不同生物质炭对酸化茶园土壤N2O和CO2排放的影响
2018-01-08何志龙张水清柳维扬
孙 贇,何志龙,林 杉*,张水清,2*,柳维扬
不同生物质炭对酸化茶园土壤N2O和CO2排放的影响
孙 贇1,何志龙1,林 杉1*,张水清1,2*,柳维扬3
(1.华中农业大学资源与环境学院/农业部长江中下游耕地保育重点实验室,武汉 430070;2.河南省农业科学院植物营养与资源环境研究所,郑州 450002;3.塔里木大学植物科学学院,新疆 阿拉尔 843300)
为了研究不同生物质炭对酸化茶园土壤温室气体排放的影响,采用原料为小麦秸秆、柳树枝、椰壳3种生物质炭,通过室内培养试验来探究不同生物质炭对茶园土壤性质及N2O、CO2排放特征的影响。试验中生物质炭添加量为20 g·kg-1,同时设置了施氮肥处理,采用尿素作为外加氮源,施氮量为100 mg·kg-1。结果表明,施加生物质炭提高了酸化茶园土壤pH值,柳树枝生物质炭处理土壤pH值最高为6.71,显著高于其他处理。不同生物质炭对土壤DOC含量的影响效果存在差异,柳树枝生物质炭使土壤DOC平均含量增加了95.6%,椰壳生物质炭使土壤DOC含量降低36.1%,小麦秸秆生物质炭则影响不显著。生物质炭通过抑制土壤硝化和反硝化作用降低土壤N2O的排放,椰壳生物质炭降低N2O排放比例达91.7%,减排效果最显著。在施氮条件下柳树枝生物质炭对土壤N2O的减排效果显著低于小麦秸秆和椰壳生物质炭。土壤CO2的排放通量与pH值、DOC含量均呈极显著正相关,生物质炭促进了土壤CO2的排放,柳树枝生物质炭处理CO2的排放显著高于其他处理。此外,外加氮源降低了土壤pH值,增加了土壤N2O的排放,但是对土壤DOC含量变化无显著影响。
生物质炭;N2O排放;CO2排放;pH;可溶性有机碳
近年来,由温室气体排放增加造成的气候变暖问题引发持续关注,在过去100多年里,全球平均气温上升了0.65~1.06℃[1]。CO2作为最主要的温室气体对全球变暖的贡献约为55%,而N2O增温潜势是CO2的296倍,并且工业化以来大气中N2O的浓度从270 nL·L-1增加到 319 nL·L-1[2]。土壤是 N2O 的主要排放来源,农业生产过程中大量施用氮肥促进了N2O的排放,据统计农业活动对大气中N2O的贡献率超过60%[3]。茶树是我国南方主要经济作物,种植面积大,但是存在管理模式不当等问题,过量施肥造成土壤酸化,降低氮肥的利用效率,同时增加土壤碳氮排放[4]。因此,需要合理的土壤改良剂来改善茶园土壤性质,减少温室气体排放。
生物质炭是生物质资源在厌氧或缺氧条件下,经热裂解炭化产生的高度芳香化结构的难溶性固态物质[5]。生物质炭呈碱性,表面含有丰富的含氧官能团可以与H+结合,能够减轻土壤酸化,可作为优异的土壤改良剂[6]。对生物质炭最初的研究是利用其较高的含碳量,以实现土壤碳封存的目的,但是在研究过程中发现生物质炭能够提高氮肥的使用效率,减少土壤中N2O的排放[7-8]。土壤温室气体的排放受到土壤pH以及有机碳、硝态氮、铵态氮含量等因素的影响[9]。研究表明,生物质炭通过影响土壤碳库与氮库特征从而影响土壤温室气体的排放[10]。
不同原料的生物质炭在结构性质上有很大的差异,并且对土壤温室气体排放的影响也不同[11]。研究中,甘蔗渣生物质炭抑制土壤碳氮的排放[12],核桃壳生物质炭对土壤N2O排放无显著影响[13],松木生物质炭没有显著减低土壤温室气体排放[14],而苹果树枝生物质炭降低了土壤增温潜势[15]。目前有关生物质炭对土壤温室气体减排的研究较多,但是针对茶园土壤的应用研究还是不够全面。因此,本试验采用原料为小麦秸秆、柳树枝、椰壳3种生物质炭,来探究不同生物质炭对茶园酸化土壤的性质及温室气体排放的影响,以期为区域茶园土壤改良及温室气体减排提供科学依据。
1 材料与方法
1.1 供试土壤
土壤采自武汉市华中农业大学茶园基地(30°28′N,114°22′E),该区域属中亚热带季风气候,温暖湿润,日照充足。茶园种植年限在20年以上,土壤母质为花岗岩。用五点采样法布点,采集土壤表层0~20 cm处的土样,剔除可见碎石、动植物残体等杂质,混匀后带回实验室,取部分鲜样储存于-4℃条件下待用,其余土壤自然风干后过2 mm筛,用于培养试验。土壤基本理化性质见表1。
1.2 生物质炭
本试验中选用的小麦秸秆是我国北方主要农业废弃物,柳树枝是木材加工的剩余枝条,椰子壳是来自南方热带地区农业副产品。3种原料均在500℃无氧裂解条件下制成生物质炭,分别用B1、B2、B3表示,经碾磨后过0.3 mm筛作为供试材料。生物质炭的基本理化性质如表2所示。
1.3 培养试验
试验设置8个处理:无外源添加物处理(CK),添加小麦秸秆生物质炭(B1)、柳树枝生物质炭(B2)、椰壳生物质炭(B3),只施氮肥处理(N)、施氮肥和小麦秸秆生物质炭(N+B1)、施氮肥和柳树枝生物质炭(N+B2)、施氮肥和椰壳生物质炭(N+B3)。培养试验的每个培养瓶中装入300 g土壤(干土),生物质炭添加量为20 g·kg-1,采用尿素作为试验外加氮源,施氮量为100 mg·kg-1。每个处理做6次重复,其中3个用来采集气体,另3个进行破坏性取样测定土壤理化指标。
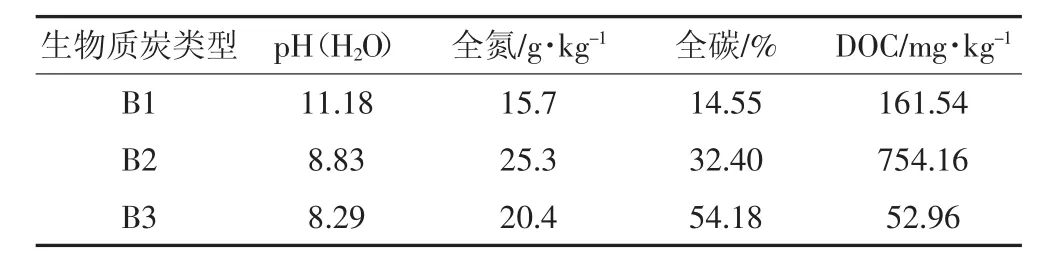
表2 生物质炭基本理化性质Table 2 Physicochemical properties of the biochars
将过筛后土壤的孔隙含水率(WFPS)调节至40%后活化7 d,消除干湿效应并激活微生物。活化结束后按照试验设计将生物质炭、尿素和土壤装入1 L的广口培养瓶中混匀,加水调节至70%WFPS,每隔1 d通过测重法保持含水量,用保鲜膜覆盖瓶口,同时在保鲜膜上留下小孔以便于气体交换,在25℃下恒温培养53 d。
1.4 样品采集及测定方法
在 试 验 第 1、2、3、4、6、8、10、12、14、16、20、25、32、39、46、53 d 采集土壤气体。采样日上午 9:30 进行气体采集,采样前保持瓶口畅通以与周围空气充分交换,之后用带有两支玻璃管的橡胶塞密封瓶口,其中一支管连接密封气球置于瓶内,用来调节采样瓶内的气压,另一支管连接导气管用来采集瓶内气体。橡胶塞完全密闭培养瓶后用夹子密封导气管,保证整个装置不漏气,同时开始计时,1 h后用带有三通阀的注射器从导气管抽取30 mL气体。在试验第1、4、8、12、16、20、25、32、39、46、53 d 采集培养瓶中土壤用于分析土壤理化指标,采样时用取样器均匀采取表面到底部的土壤以避免土层深度的影响。
采集后的气体样品用改进的气相色谱仪(Agilent 7890A)分析,N2O浓度用电子捕获检测器(ECD)测定,检测器温度为300℃,色谱柱为80/100目Porapak Q填充柱,柱箱温度为55℃,用高纯N2作为载气,流速为25 cm3·min-1。CO2浓度用氢火焰离子检测器(FID)测定,温度200℃,色谱柱为60/80目Porapak Q填充柱,柱箱温度为55℃,高纯N2作载气,载气流速为25 cm3·min-1,镍作催化剂,空气和高纯H2流速分别为 400 cm3·min-1和 40 cm3·min-1。通过标准气体和待测气体的峰面积比值来计算出样品的浓度,标准气体由国家标准物质中心提供。采用1 mol·L-1KCl浸提土壤1 h,用靛酚蓝比色法(625 nm)和紫外双波长(220 nm和275 nm)分光光度计法测定土壤NH+4-N和NO-3-N含量。土壤可溶性有机碳(DOC)含量测定:加水浸提土样2 h,水土(鲜土)质量比5∶1,之后用0.45 μm滤膜进行过滤,滤液采用德国Elementer Vario TOC仪液体模块测定。土壤全碳测定:将烘干土样过100目筛,用锡纸包裹,采用德国Ele menter Vario TOC仪固体模块测定。土壤微生物量碳(MBC)采用氯仿熏蒸法测定。pH采用电位法测定,土壤水土质量比 2.5∶1,生物质炭为 10∶1。全氮(TN)测定采用半微量凯氏法。土壤机械组成用比重计法测定。
1.5 数据统计与分析
N2O 排放通量(μg N2O-N·kg-1·h-1)和 CO2排放通量(mg CO2-C·kg-1·h-1)按照下列公式计算:
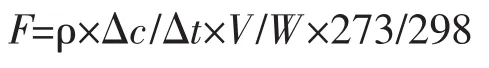
式中:F为气体排放通量;ρ为标准状态下N2O-N或CO2-C 的密度,分别为 1.258 kg·m-3和 0.535 kg·m-3;Δc/Δt为单位时间内培养瓶内气体浓度增加量,N2O和 CO2浓度单位分别为 μg·kg-1·h-1和 mg·kg-1·h-1;V为培养瓶中气体的有效空间体积,m3;W为培养瓶内干土质量,kg。
N2O和CO2累积排放量通过相邻2次采样的气体平均排放通量与排放时间的乘积累加计算得出,计算公式如下:
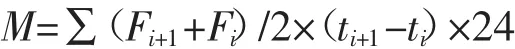
式中:M代表土壤N2O和CO2累积排放量,μg·kg-1和mg·kg-1;F 代表土壤 N2O 和 CO2通量,μg·kg-1·h-1和mg·kg-1·h-1;i代表采样次数;t代表培养时间,d。
采用Excel 2010对数据进行预处理,利用SPSS 22进行单因素方差分析(One-way ANOVA)和Duncan多重比较检验法分析处理间的差异,用Spearman相关研究法进行数据间的相关性分析,显著性水平设置为0.05。用Origin 8.5进行绘图。
2 结果与分析
2.1 土壤N2O排放变化情况
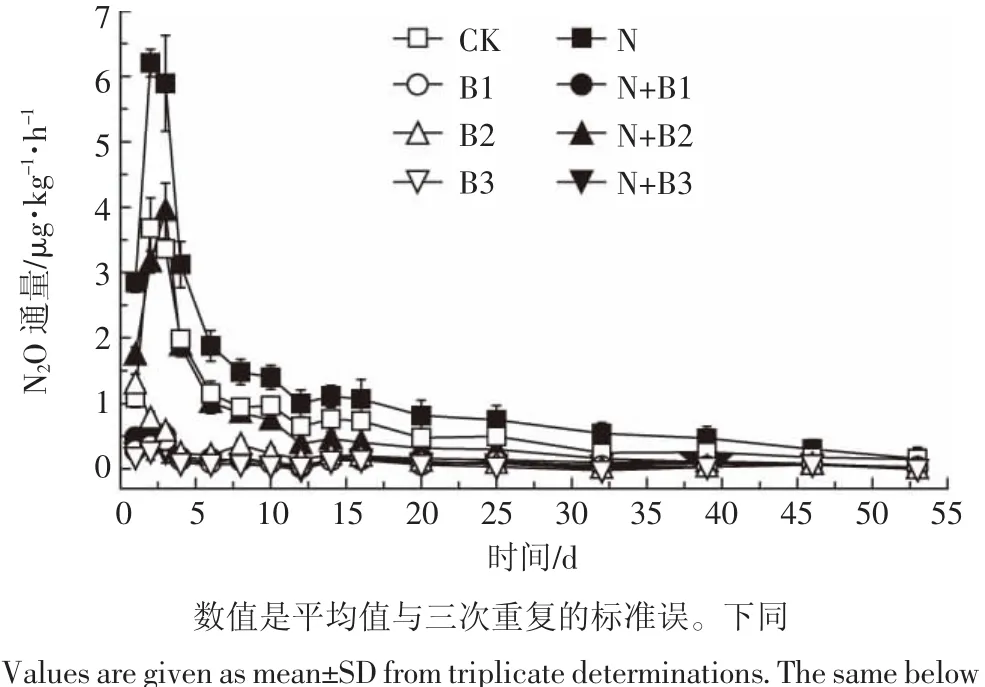
图1土壤N2O通量的动态变化Figure 1 Temporal dynamics of soil N2O flux
图1 是试验期间土壤N2O通量随时间的变化情况。培养过程中,前期N2O排放通量较高,之后逐渐下降,到培养结束时达到平稳状态。各处理之间表现出不同程度的差异,在施氮和未施氮处理中添加生物质炭都显著降低了N2O的排放峰值,秸秆和椰壳生物质炭对N2O的减排作用较为明显。从N2O排放通量变化来看,整体呈现先上升后下降的趋势,除B2处理是第1 d排放量最高外,其他处理都是在第2 d或第3 d 达到峰值,N 处理的峰值最高,为 6.20 μg·kg-1·h-1。在CK和B2处理中添加氮素,N2O的排放峰值显著提高,而对于B1和B3处理,添加氮素对N2O的排放峰值影响不显著。
从N2O累积排放通量来看(图2),处理N的N2O累积排放量最高,而B3处理排放量最低。未添加生物质炭处理中,N处理N2O排放量显著高于CK处理,表明添加氮素促进了土壤N2O的排放。未加氮处理中,添加生物质炭显著降低土壤N2O的排放,3种生物质炭间N2O累积排放量没有显著差异;在施氮处理中,添加生物质炭也显著降低土壤N2O的排放,但是3种生物质炭的减排效果出现显著差异,N+B2处理N2O累积排放量显著高于N+B1、N+B3处理,柳树枝生物质炭减排效果降低。培养试验期间,B3处理减排效果最佳,与对照相比减少了91.7%,添加氮肥后,椰壳炭同样到达最佳减排效果。
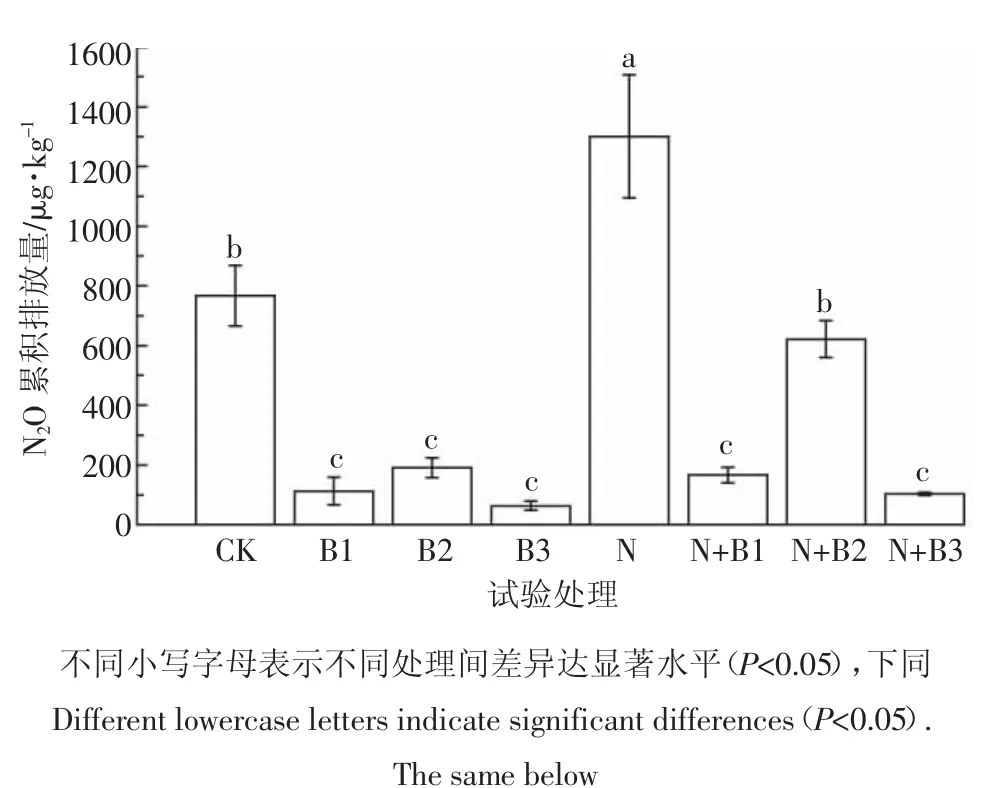
图2不同处理土壤N2O累积排放量Figure 2 Cumulative emission of soil N2O in different treatments
2.2 土壤CO2排放变化情况
图3 是试验期间CO2通量随时间的变化情况。CO2排放通量整体呈下降趋势,前期排放量高,各处理间呈现差异,后期排放量降低并达到平稳状态,处理之间差异不显著。与N2O的排放情况不同,添加生物质炭增加了土壤CO2的排放。B2和N+B2处理中CO2通量峰值显著高于其他处理,N+B2处理峰值最高为6.42 mg·kg-1·h-1。在施氮和未施氮条件下添加柳树枝和椰壳生物质炭处理CO2通量均在第1 d达到峰值,并且N+B2处理CO2与N2O排放峰值不同步,可能的原因是柳树枝生物质炭中可溶性有机碳含量高,分解迅速,而B3和N+B3处理CO2与N2O排放峰值不同步可能是由椰壳炭的吸附性能造成的。
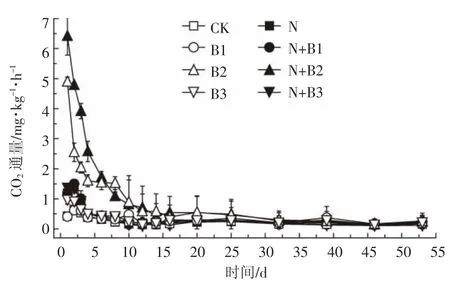
图3 土壤CO2通量动态变化Figure 3 Temporal dynamics of soil CO2flux
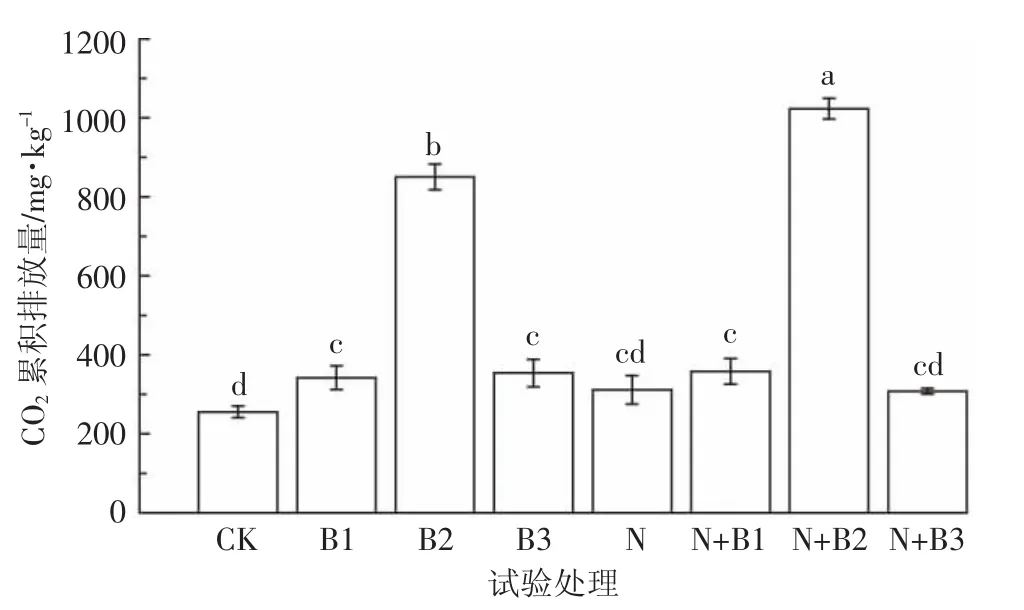
图4 不同处理土壤CO2累积排放量Figure 4 Cumulative emission of soil CO2in different treatments
从CO2累积排放量看(图4),培养期间N+B2处理CO2累积排放量最高为1 023.16 mg·kg-1,CK处理排放量最低为255.44 mg·kg-1。未加氮肥处理中,添加生物质炭显著增加土壤CO2的排放量,其中柳树枝生物质炭对土壤CO2排放的促进作用最大,B1和B3处理土壤CO2排放量也显著高于CK处理,但是两者间差异不显著。添加氮肥处理中,只有柳树枝炭显著促进了土壤CO2排放,N+B1和N+B3处理土壤CO2排放量与N处理之间没有显著性差异。
2.3 土壤pH变化情况
添加生物质炭后,土壤pH提高,柳树枝生物质炭处理pH值要显著高于其他处理,对土壤的影响最大,培养过程中B2处理pH值最高为6.71(图5)。培养初期CK处理pH值最低,N+B2处理最高,随着培养进行,各处理土壤pH值呈下降趋势,施氮肥处理pH值下降更快,在培养结束时,除B2外,施用同种生物质炭条件下加氮处理pH值要低于未加氮对照处理,N处理pH值最低,为3.93。
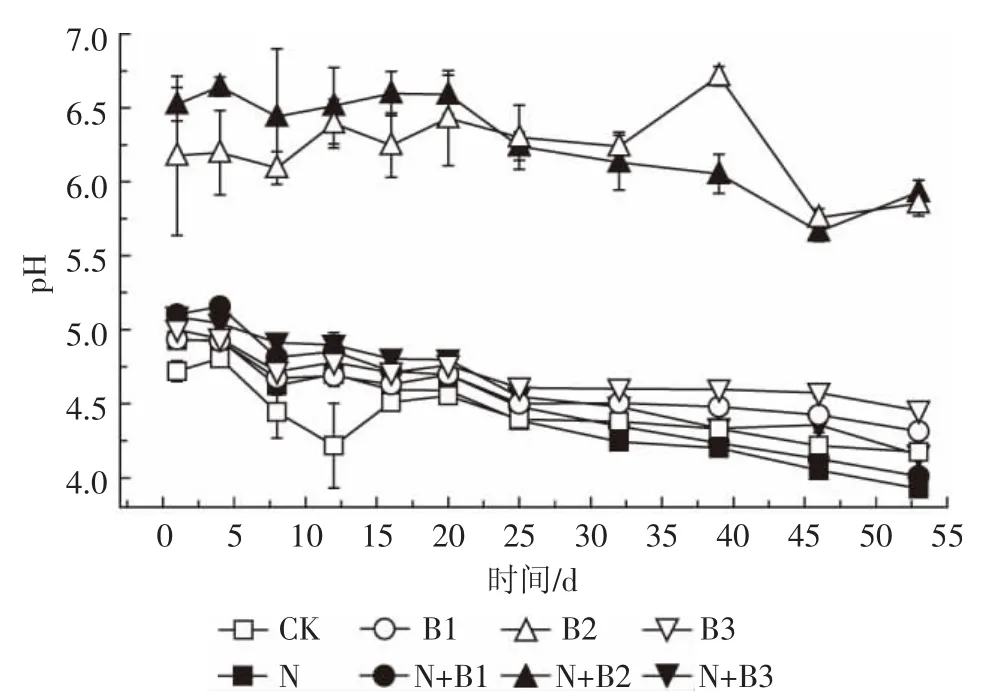
图5不同处理土壤pH的动态变化Figure 5 Temporal dynamics of soil pH value in different treatments
2.4 土壤矿质氮含量变化情况
图6 是试验期间土壤矿质氮含量随时间的变化情况。外加氮源能够显著影响土壤中硝态氮和铵态氮含量变化。未加氮处理中,土壤矿质氮主要来自原有机质矿化,没有其他氮源,土壤NH+4-N含量不高,并且培养过程中含量也在缓慢下降。在添加氮肥处理中,由于尿素分解释放大量NH+4-N,土壤NH+4-N含量急剧上升,在前期含量高于未施氮处理。随着试验的进行,矿质氮类型在发生变化,土壤NH+4-N含量逐渐下降,到培养结束,基本达到稳定状态,除N处理NH+4-N含量较高为21.6 mg·kg-1,其他处理都是在较低的水平。

图6 土壤NH+4-N和NO-3-N含量动态变化Figure 6 Temporal dynamics of soil NH+4-N and NO-3-N contents
由于土壤中矿质氮类型的转化,土壤NO-3-N含量变化趋势与NH+4-N相反呈上升状态。在培养开始时,各处理土壤NO-3-N含量基本一致,随着试验进行,NO-3-N含量不断增加,到试验结束达到平稳状态,施氮处理土壤NO-3-N含量要高于未施氮处理,其中N+B2处理NO-3-N含量最高,为194.1 mg·kg-1。
2.5 土壤DOC含量变化情况
如图7所示,土壤中的含量随着培养进行均呈现下降趋势,培养开始时,B2处理中DOC含量最高为105.1 mg·kg-1。不同生物质炭处理存在显著差异,与CK处理相比,B2处理显著增加了土壤中DOC含量,B3处理中DOC含量要低于CK处理,B1处理中DOC含量与CK处理之间无显著差异。整个培养过程中,B2处理DOC平均含量相对于CK处理增加了95.6%,而B3处理DOC则降低了36.1%。在添加相同生物质炭条件下,施氮肥与未施氮肥处理土壤DOC含量差异不显著,表明施氮肥对土壤DOC含量无影响。
2.6 土壤MBC情况

图7 土壤DOC含量动态变化Figure 7 Temporal dynamics of soil DOC contents

图8不同处理土壤MBC含量Figure 8 Soil MBC content in different treatments
图8 是培养试验末期不同处理土壤MBC含量,范围为 59.8~146.4 mg·kg-1,其中 B2 处理土壤MBC含量最高。在施氮和未施氮处理中,只有柳树枝生物质炭显著增加了土壤MBC含量,椰壳炭处理土壤MBC含量低于未添加生物质炭处理,但是差异不显著。
2.7 土壤气体排放与影响因子的关系
从表3可以得出,生物质炭类型对CO2、N2O、pH、DOC、MBC的影响有显著差异,施氮肥对CO2、N2O、pH的影响显著,对DOC、MBC的影响不显著,生物质炭类型与施氮交互作用对CO2、N2O、pH影响显著。
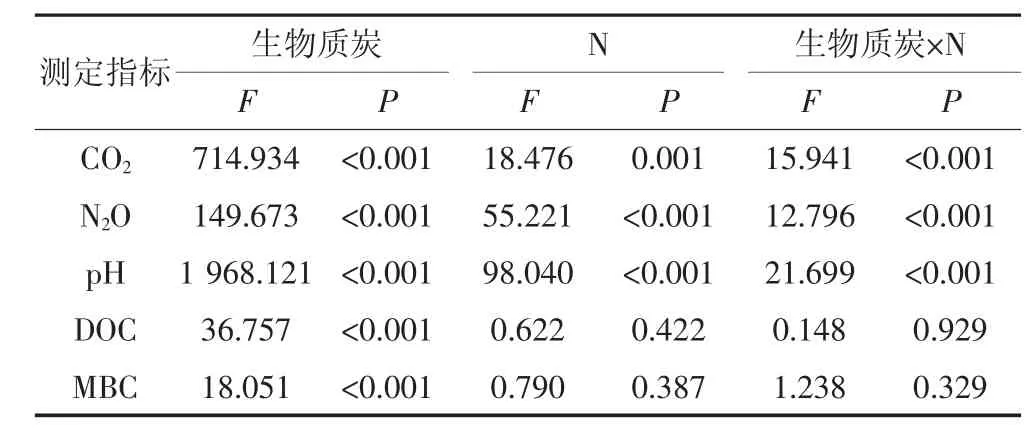
表3 各因素及其交互作用对土壤性质和气体排放影响的显著性分析Table 3 Statistical analysis for the effects of biochar type,N,and their interactions on soil properties and gas emissions
从表4可以得出,CO2排放通量与土壤DOC、pH呈极显著正相关关系,与NO-3-N含量呈极显著负相关关系,而与NH+4-N含量不相关。N2O排放通量与土壤DOC、NH+4-N呈极显著正相关关系,与NO-3-N呈极显著负相关,而与pH无显著相关关系。
3 讨论
3.1 生物质炭对土壤性质的影响
土壤有机碳含量是评价土壤肥力的关键指标,其中DOC是土壤活性有机碳的重要组成部分,能够被土壤微生物直接利用,对土壤中各元素的循环、迁移具有重要影响[16]。研究表明生物质炭能够通过两方面提高土壤DOC含量:一方面生物质炭可能导致土壤原有机碳中弱酸性官能团的去质子化,提高活性有机碳的亲水性从而增加了土壤有机碳的溶解性;另一方面生物质炭本身可以释放出大量活性物质[17-18]。Laird等[19]的研究也发现,生物质炭中含有一部分活性成分,施入土壤后可释放出各种有机分子,在很大程度上影响土壤DOC含量。本研究中柳树枝生物质炭中DOC含量高,添加到土壤后,这部分活性有机碳进入土壤,不仅提高了土壤中DOC含量,而且对土壤性质产生了很大的影响。与柳树枝炭不同,本研究中椰壳生物质炭中DOC含量低,施用后降低了土壤DOC含量,此外很多研究中证实以椰子壳作为原料制成的生物质炭吸附性能强,吸附固定了土壤有机碳中可溶解的部分,从而减少了DOC含量[20]。本试验也设置了施氮肥处理,但是添加氮素后土壤DOC含量没有显著变化。有研究表明,施用化学肥料能够对土壤DOC产生一定的影响,但是化学肥料的施用对土壤DOC的影响远小于外源有机物的添加[21]。
生物质炭可以改善土壤性质,与大多数研究结果一致,添加生物质炭增加了酸化土壤pH值[6]。一方面,生物质炭中含有大量碱基离子,使生物质炭呈碱性,可以增加酸性土壤pH值。另一方面,生物质炭表面含有丰富的-COO-(-COOH)和-O-(-OH)等含氧官能团,可以与土壤中致酸离子结合,从而改善酸性土壤的酸碱状况[22]。本试验采用茶园土壤,由于茶树特殊的生长习性,土壤中铝离子含量逐年增加,铝离子水解产生H+,使茶园土壤不断酸化[23]。由于生物质炭中有机质含量高,表面的含氧官能团可以与铝离子形成稳定的配合物或螯合物,从而提高酸化茶园土壤的pH[24]。试验中3种生物质炭处理在不同程度上提高了土壤的pH值,其中柳树枝生物质炭对土壤pH的提高效果要优于秸秆和椰壳生物质碳,可能的原因是柳树枝生物质炭中DOC含量高,有机阴离子含量更加丰富。研究表明,有机阴离子能够通过脱羧反应中和土壤中的H+,因此添加生物质炭可显著提高茶园土壤pH,此外,土壤pH的变化受到生物质炭中有机阴离子含量和解离程度的影响[25]。
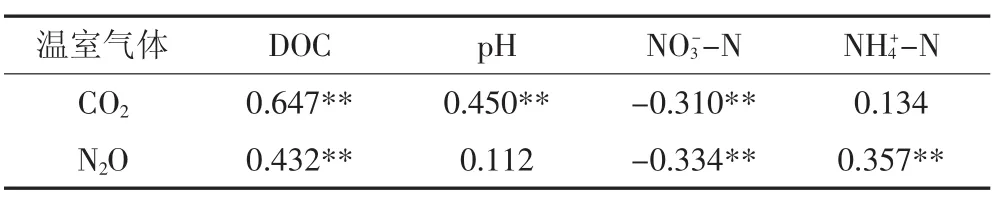
表4 土壤气体排放与土壤性质因子的相关性(n=11)Table 4 Correlation between soil gas emissions and soil properties(n=11)
3.2 生物质炭对土壤N2O排放的影响
大多数研究表明,在土壤中添加生物质炭可以减少N2O排放[8]。本研究中3种不同原料的生物质炭都显著降低了土壤N2O的排放。土壤中N2O的产生主要是受硝化和反硝化作用两种机制控制,硝化和反硝化作用的进行需要硝化菌和反硝化菌等多种相关微生物的参与[26]。反硝化作用是在无氧条件下NO-3被反硝化菌逐步还原成N2的过程,脱硝过程中会有中间产物N2O产生[27]。此次研究中土壤N2O通量与硝态氮含量呈负相关关系,硝态氮含量越高,N2O通量越低,表明添加生物质炭抑制了土壤反硝化过程产生N2O。Rogovska等[28]研究也表明,生物质炭增加土壤通气性,抑制反硝化作用的进行,从而降低土壤N2O排放。土壤反硝化作用过程中产生的NO、N2O和N2的相对量还与土壤pH、通气状况和有机质含量等有关[29]。在土壤中施入生物质炭能提高土壤的pH(图5),这会影响参与反硝化过程相关酶活性。同时,反硝化作用进行还需要微生物有足够的可利用碳源,生物质炭可以通过改变土壤DOC含量,直接影响反硝化过程[30]。
本试验中施肥采用的是酰胺态氮肥,通过土壤中矿质氮含量变化发现硝化作用强烈,并且N2O通量与铵态氮含量呈显著正相关,表明在这种土壤条件下N2O的产生主要是由硝化作用引起。硝化作用产生N2O的途径有两种:一是氨氧化成亚硝酸阶段,有副产物N2O产生;二是亚硝酸被氧化为硝酸阶段,在氧气不足的条件下发生歧化反应产生N2O[27]。此次试验添加生物质炭后土壤N2O排放显著降低。有研究也发现生物质炭能够增加土壤的通气性,提高氧气含量,通过影响土壤硝化作用减少土壤N2O的排放[31]。研究表明,土壤中参与硝化作用的氨氧化细菌(AOB)和氨氧化古菌(AOA)等微生物的活性受到土壤pH、活性有机碳含量等因素的影响[32]。生物质炭可以通过吸附作用减少微生物活动所需要的活性碳源底物,影响氨氧化菌等异养微生物的活性,从而抑制硝化作用的进行[33]。本试验中,椰壳生物质炭具有良好的吸附性能,对硝化作用的影响更大,因此椰壳生物质炭对土壤N2O的减排作用优于柳树枝和秸秆炭。此外,硝化作用同时受到底物的影响,在添加氮肥的处理中,土壤中高含量的铵态氮为硝化作用提供了充足底物,N2O的排放均有所增加。土壤硝化和反硝化作用都受到土壤活性碳源的影响,而柳树枝生物质炭处理中DOC含量高,微生物可利用的碳源充足,并且在高氮条件下硝化和反硝化底物不受限制,因此在施氮肥后,柳树枝生物质炭对N2O的抑制作用有所降低[34]。
3.3 生物质炭对土壤碳排放的影响
生物质炭含碳量高,施加到土壤中可以增加土壤有机碳含量,但是生物质炭是否促进土壤有机碳矿化一直存在争议。Jiang等[35]的研究中生物质炭抑制了土壤有机碳的分解,降低了CO2的排放。而一些研究则表明添加生物质炭可在短期内增加土壤CO2的排放[36-37]。Luo等[38]在土壤中添加350℃条件下制备的芒草生物质炭,结果表明其促进了土壤有机碳的矿化,增加CO2的排放。本研究中,添加生物质炭增加了土壤CO2的排放,但是3种不同原料的生物质炭对土壤碳排放的影响存在差异,柳树枝生物质炭对土壤CO2排放的促进作用要显著高于秸秆和椰壳炭。在施加生物质炭的土壤中,土壤排放的CO2主要来源有两部分,一部分是由土壤原有机碳分解而排放,另一部分则来自于生物质炭中活性有机碳的矿化。通过对不同处理土壤性质变化的分析发现,土壤DOC含量与CO2通量之间呈显著正相关关系,并且大量研究也表明,土壤中CO2的排放主要取决于DOC含量变化[39]。本试验中柳树枝生物质炭处理中DOC含量高于其他处理,是造成土壤CO2排放显著增加的原因。从土壤中向大气中释放的CO2来自土壤微生物对DOC的分解,土壤微生物的活性与数量是土壤有机质分解快慢的重要影响因素[40]。由于茶园土壤的酸化,可能会影响到微生物的活性,添加生物质炭,提高土壤pH,使微生物的活性增强,促进呼吸作用[41]。在培养结束时,土壤MBC含量出现差异,柳树枝生物质炭处理中MBC增加,土壤中微生物数量高于其他处理,因此,土壤CO2排放显著增加。
4 结论
(1)施加生物质炭有利于提高酸化茶园土壤pH值,柳树枝生物质炭提高土壤pH的效果要优于小麦秸秆和椰壳炭。3种不同原料生物质炭对土壤DOC含量的影响效果存在差异,柳树枝生物质炭显著提高土壤DOC含量,椰壳生物质炭降低土壤DOC含量,小麦秸秆炭则影响不显著。
(2)生物质炭降低土壤N2O的排放,其中椰壳生物质炭对土壤N2O的减排效果最佳,在施氮条件下柳树枝生物质炭对土壤N2O的减排效果显著低于小麦秸秆和椰壳生物质炭。
(3)土壤CO2排放通量与DOC含量、pH呈极显著正相关关系,生物质炭促进了土壤CO2的排放,柳树枝生物质炭处理CO2的排放显著高于其他处理。
(4)施氮肥降低了土壤pH值,增加了土壤N2O的排放,但是对土壤DOC含量变化几乎无影响。
致谢:试验所用的土壤采自华中农业大学园艺林学学院赵华老师做长期定位试验的茶园基地,对赵老师在土壤采集过程中提供的帮助,特此感谢。
[1]Stocker T F,Qin D,Plattner G-K,et al.Climate change 2013:The physical science basis:Contribution of working group I to the fifth assessment report of the Intergovernmental Panel on Climate Change[M].Cambridge University Press,2014.
[2]Intergovernmental panel on climate change(IPCC).The physical science basis[M].Cambridge University Press,2013.
[3]Pachauri R K,Allen M R,Barros V R,et al.Climate change 2014:Synthesis report.Contribution of Working GroupsⅠ,ⅡandⅢto the fifth assessment report of the Intergovernmental Panel on Climate Change[M].IPCC,2014.
[4]Qu Z,Wang J G,Almøy T,et al.Excessive use of nitrogen in Chinese agriculture results in high N2O/(N2O+N2)product ratio of denitrification,primarily due to acidification of the soils[J].Global Change Biology,2014,20(5):1685-1698.
[5]Lehmann J.A handful of carbon[J].Nature,2007,447(7141):143-144.
[6]Dai Z M,Zhang X J,Tang C,et al.Potential role of biochars in decreasing soil acidification:A critical review[J].Science of the Total Environment,2017,581/582:601-611.
[7]Case S D C,McNamara N P,Reay D S,et al.Biochar suppresses N2O emissions while maintaining N availability in a sandy loam soil[J].Soil Biology and Biochemistry,2015,81:178-185.
[8]Cayuela M L,Zwieten L V,Singh B P,et al.Biochar′s role in mitigating soil nitrous oxide emissions:A review and meta-analysis[J].Agriculture Ecosystems&Environment,2014,191:5-16.
[9]Mukherjee A,Lal R,Zimmerman A R.Effects of biochar and other amendments on the physical properties and greenhouse gas emissions of an artificially degraded soil[J].Science of the Total Environment,2014,487:26-36.
[10]肖永恒,李永夫,王战磊,等.竹叶及其生物质炭输入对板栗林土壤N2O通量的影响[J].植物营养与肥料学报,2016,22(3):697-706.
XIAO Yong-heng,LI Yong-fu,WANG Zhan-lei,et al.Effects of bamboo leaves and their biochar additions on soil N2O flux in a Chinese chestnut forest[J].Journal of Plant Nutrition and Fertilize,2016,22(3):697-706.
[11]袁 帅,赵立欣,孟海波,等.生物炭主要类型、理化性质及其研究展望[J].植物营养与肥料学报,2016,22(5):1402-1417.
YUAN Shuai,ZHAO Li-xin,MENG Hai-bo,et al.The main types of biochar and their properties and expectative researches[J].Journal of Plant Nutrition and Fertilizer,2016,22(5):1402-1417.
[12]Deng W G,Van Zwieten L M,Lin Z M,et al.Sugarcane bagasse biochars impact respiration and greenhouse gas emissions from a latosol[J].Journal of Soils and Sediments,2017,17(3):632-640.
[13]Suddick E C,Six J.An estimation of annual nitrous oxide emissions and soil quality following the amendment of high temperature walnut shell biochar and compost to a small scale vegetable crop rotation[J].Science of the Total Environment,2013,465:298-307.
[14]Angst T E,Six J,Reay D S,et al.Impact of pine chip biochar on trace greenhouse gas emissions and soil nutrient dynamics in an annual ryegrass system in California[J].Agriculture,Ecosystems&Environment,2014,191:17-26.
[15]王月玲,耿增超,王 强,等.生物炭对塿土土壤温室气体及土壤理化性质的影响[J].环境科学,2016,37(9):3634-3641.
WANG Yue-ling,GENG Zeng-chao,WANG Qiang,et al.Influence of biochar on greenhouse gases emissions and physico-chemical properties of loess soil[J].Environmental Science,2016,37(9):3634-3641.
[16]Liu H Y,Williams A P,Allen C D,et al.Rapid warming accelerates tree growth decline in semi-arid forests of Inner Asia[J].Global Change Biology,2013,19(8):2500-2510.
[17]Wit H A D,Groseth T,Mulder J.Predicting aluminum and soil organic matter solubility using the mechanistic equilibrium model WHAM[J].Soil Science Society of America Journal,2001,65(4):1089-1100.
[18]Wang D Y,Griffin D E,Parikh S J,et al.Impact of biochar amendment on soil water soluble carbon in the context of extreme hydrological events[J].Chemosphere,2016,160:287-292.
[19]Laird D A,Fleming P,Davis D D,et al.Impact of biochar amendments on the quality of a typical midwestern agricultural soil[J].Geoderma,2010,158(3/4):443-449.
[20]Wan A W A K G,Rebitanim N Z,Salleh M A M,et al.Carbon dioxide adsorption on coconut shell biochar[M]//Progress in clean energy,2015:683-693.
[21]Zhou Z C,Gan Z T,Shangguan Z P,et al.Effects of long-term repeated mineral and organic fertilizer applications on soil organic carbon and total nitrogen in a semi-arid cropland[J].European Journal of Agronomy,2013,45:20-26.
[22]袁金华,徐仁扣.生物质炭的性质及其对土壤环境功能影响的研究进展[J].生态环境学报,2011,20(4):779-785.
YUAN Jin-hua,XU Ren-kou.Progress of the research on the properties of biochar and their influence on soil environmental functions[J].Ecology and Environmental Sciences,2011,20(4):779-785.
[23]Hu X F,Chen F S,Wine M L,et al.Increasing acidity of rain in subtropical tea plantation alters aluminum and nutrient distributions at the root-soil interface and in plant tissues[J].Plant and Soil,2017,417(1/2):261-274.
[24]Paz-Ferreiro J,Lu H,Fu S,et al.Use of phytoremediation and biochar to remediate heavy metal polluted soils:A review[J].Solid Earth,2014,5(1):65-75.
[25]Wang L,Butterly C R,Wang Y,et al.Effect of crop residue biochar on soil acidity amelioration in strongly acidic tea garden soils[J].Soil Use and Management,2014,30(1):119-128.
[26]Di H J,Cameron K C,Podolyan A,et al.Effect of soil moisture status and a nitrification inhibitor,dicyandiamide,on ammonia oxidizer and denitrifier growth and nitrous oxide emissions in a grassland soil[J].Soil Biology and Biochemistry,2014,73:59-68.
[27]Wrage N,Velthof G L,Van Beusichem M L,et al.Role of nitrifier denitrification in the production of nitrous oxide[J].Soil biology and Biochemistry,2001,33(12):1723-1732.
[28]Rogovska N,Laird D,Cruse R,et al.Impact of biochar on manure carbon stabilization and greenhouse gas emissions[J].Soil Science Society of America Journal,2011,75(3):871-879.
[29]Cayuela M L,Sánchez-Monedero M A,Roig A,et al.Biochar and denitrification in soils:When,how much and why does biochar reduce N2O emissions?[J].Scientific Reports,2013,3:1732.
[30]Obia A,Cornelissen G,Mulder J,et al.Effect of soil pH increase by biochar on NO,N2O and N2production during denitrification in acid soils[J].PloS One,2015,10(9):e0138781.
[31]Clough T J,Condron L M.Biochar and the nitrogen cycle:Introduction[J].Journal of Environmental Quality,2010,39(4):1218-1223.
[32]Gannes V D,Eudoxie G,Hickey W J.Impacts of edaphic factors on communities of ammonia-oxidizing archaea,ammonia-oxidizing bacteria and nitrification in tropical soils[J].PloS One,2014,9(2):e89568.
[33]Strauss E A,Lamberti G A.Regulation of nitrification in aquatic sediments by organic carbon[J].Limnology and Oceanography,2000,45(8):1854-1859.
[34]Paul E A.Soil microbiology,ecology and biochemistry[M].Academic Press,2014.
[35]Jiang X Y,Haddix M L,Cotrufo M F.Interactions between biochar and soil organic carbon decomposition:Effects of nitrogen and low molecular weight carbon compound addition[J].Soil Biology and Biochemistry,2016,100:92-101.
[36]Smith J L,Collins H P,Bailey V L.The effect of young biochar on soil respiration[J].Soil Biology and Biochemistry,2010,42(12):2345-2347.
[37]Cheng Y,Cai Z C,Chang S X,et al.Wheat straw and its biochar have contrasting effects on inorganic N retention and N2O production in a cultivated black chernozem[J].Biology and Fertility of Soils,2012,48(8):941-946.
[38]Luo Y,Durenkamp M,De Nobili M,et al.Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH[J].Soil Biology and Biochemistry,2011,43(11):2304-2314.
[39]Fenner N,Freeman C.Drought-induced carbon loss in peatlands[J].Nature Geoscience,2011,4(12):895-900.
[40]Mueller P,Granse D,Nolte S,et al.Top-down control of carbon sequestration:Grazing affects microbial structure and function in salt marsh soils[J].Ecological Applications,2017,27(5):1435-1450.
[41]Imparato V,Hansen V,Santos S S,et al.Gasification biochar has limited effects on functional and structural diversity of soil microbial communities in a temperate agroecosystem[J].Soil Biology and Biochemistry,2016,99:128-136.
Effects of different biochars on N2O and CO2emission from acidified tea field soil
SUN Yun1,HE Zhi-long1,LIN Shan1*,ZHANG Shui-qing1,2*,LIU Wei-yang3
(1.College of Recourses and Environment,Huazhong Agricultural University/Key Laboratory of Arable Land Conservation in Middle and Lower Reaches of Yangtze River,Ministry of Agriculture,Wuhan 430070,China;2.Institute of Plant Nutrition and Environmental Resources Science,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;3.College of Plant Science and Technology,Tarim University,Alar 843300,China)
An incubation experiment was conducted to determine the effects of the addition of three kinds of biochars(wheat straw,willow branches,and coconut shell)on acidified tea field soil properties and greenhouse gas emissions.In this experiment,the amount of biochar was 20 g·kg-1,whereas urea was used as an additional nitrogen source for nitrogen fertilizer treatment at the rate of 100 mg·kg-1.The results showed that biochar addition was beneficial to improve the pH value of acidified tea field soil,and the soil pH of the willow biochar addition treatment was 6.71,which was significantly higher than that of the other treatments.Significant differences were noted between the biochar treatments for soil dissolved organic carbon(DOC)content.Compared with that of the control treatment,the soil DOC content increased by 95.6%in the willow biochar treatment and decreased by 36.1%in the coconut shell biochar treatment,whereas no significant differencein DOC was noted in wheat straw biochar(P>0.05).The reduction of soil nitrification and denitrification rate caused by biochar application might have reduced soil N2O emissions,and the application of coconut shell biochar reduced N2O emissions to 91.7%,which was the most significant reduction.When combined with nitrogen application,willow biochar treatment caused significantly higher N2O emissions than those from the other biochar treatments.Compared with N2O emissions in wheat straw and coconut shell biochar treatments,the N2O emissions in willow biochar treatment were considerably more sensitive to nitrogen addition.Biochar addition promoted CO2emission from the soil,with the highest CO2emissions from the willow biochar treatment and soil CO2fluxes having significant positive correlation with pH value and DOC contents.Moreover,nitrogen addition reduced the soil pH value and increased N2O emission,but had no significant effect on soil DOC content.
biochar;N2O emission;CO2emission;pH;dissolved organic carbon
X511
A
1672-2043(2017)12-2544-09
10.11654/jaes.2017-0845
孙 贇,何志龙,林 杉,等.不同生物质炭对酸化茶园土壤N2O和CO2排放的影响[J].农业环境科学学报,2017,36(12):2544-2552.
SUN Yun,HE Zhi-long,LIN Shan,et al.Effects of different biochars on N2O and CO2emission from acidified tea field soil[J].Journal of Agro-Environment Science,2017,36(12):2544-2552.
2017-06-13 录用日期:2017-09-01
孙 贇(1993—),男,河南南阳人,硕士研究生,主要从事农田温室气体研究。E-mail:290804185@qq.com
* 通信作者:林 杉 E-mail:linshan@mail.hzau.edu.cn;张水清 E-mail:zsq510@163.com
国家自然科学基金项目(41201255,41561068);国家重点研发计划项目(2017YFD0301103,2016YFD0200109);中央高校基本科研基金项目(2662016PY098)
Project supported:The National Natural Science Foundation of China(41201255,41561068);The National Basic Research Program of China(2017YFD0-301103,2016YFD0200109);The Fundamental Research Funds for the Central Universities(2662016PY098)
