水淹对秋华柳根茎细胞壁组分镉含量的影响
2018-01-08陈锦平陈红纯马文超
周 翠,陈锦平,2,王 婷 ,陈红纯 ,李 瑞,马文超 ,魏 虹*
水淹对秋华柳根茎细胞壁组分镉含量的影响
周 翠1,陈锦平1,2,王 婷1,陈红纯1,李 瑞1,马文超1,魏 虹1*
(1.西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,重庆 400715;2.广西农业科学院农业资源与环境研究所,南宁 530007)
为了解水淹胁迫对细胞壁镉富集能力的影响,以秋华柳(Salix variegata Franch)扦插苗为研究对象,设置镉胁迫和水淹胁迫试验,测定了不同处理组下秋华柳根、茎细胞壁不同组分的镉积累特征。结果表明:所有处理组秋华柳存活良好,表现出水淹和镉的双重耐受性;所有镉浓度处理下,秋华柳根、茎细胞壁果胶和半纤维素均具有良好的镉离子结合能力,其中果胶的镉离子结合能力最大;水淹、镉胁迫及两者的交互效应均对秋华柳根、茎细胞壁组分镉含量造成了不同程度的影响。水淹显著降低了茎细胞壁组分镉含量,但对根组分中镉含量无显著影响;水淹条件下,秋华柳根、茎细胞壁果胶和半纤维素镉含量有所降低,但果胶和半纤维素仍为细胞壁镉积累富集的主要组分。上述结果表明,水淹对秋华柳根、茎细胞壁组分中镉的分配策略没有明显改变,镉仍被固定于细胞壁中以减少重金属对植物细胞的伤害,因此秋华柳可以作为三峡库区消落带镉污染土壤修复的备选物种。
秋华柳;镉胁迫;水淹;细胞壁;果胶;半纤维素
三峡水库运行后,采用“蓄清排浑”的运作模式,从而形成了最高30 m(水位145~175 m)落差的消落带。消落带是一种水陆生态交错带,水位涨落幅度及面积变化较大,水位涨落逆反自然洪枯规律,冬蓄夏排[1]。这种特殊的水库调水节律改变了原有的生态系统结构,部分原生植被物种因不能适应消落带特殊生境而消亡,生态环境问题日益严重[2]。另一方面,三峡成库后,悬浮物、水系沉积物在库区消落带及库底沉积,造成大量的重金属积累[3]。已有研究表明,三峡库区消落带重金属污染已达警戒状态,主要污染物为镉[4],部分地区已达到中度污染(0.6~1 mg·kg-1)[5],高镉异常地区土壤镉含量达到8.5 mg·kg-1[4]。镉离子的高活性特征使其更易进入食物链,被人体摄取而危害健康[6]。利用植物修复的方法治理土壤重金属污染是近年来重金属污染治理领域研究的热点[7-8]。在对三峡库区消落带进行植被重建的同时,联合重金属植物修复将是库区消落带生态治理的有效途径。
植物遭受重金属胁迫时,最主要的应对机制之一为区室化解毒,即将重金属离子从细胞质转移至质外体(细胞壁、液泡)储存,以减少对植物体的直接毒害[9]。细胞壁对重金属的富集能力与细胞壁的多糖物质密切相关[10-12]。因此对重金属胁迫下植物细胞壁不同组分镉含量的研究,有助于进一步阐释植物对重金属的耐受解毒及积累机制。
秋华柳(Salix variegata Franch.)为杨柳科柳属多年生灌木,叶宽卵状披针形或矩圆形,生长迅速,具有较高的生物量[13]。作为三峡库区消落带的乡土物种,其分布广泛,对河流自然汛期有较好的适应能力,可用于三峡库区消落带的植被修复[14]。以往研究表明,秋华柳可耐受镉污染并有良好的镉富集和转移能力,具备修复镉污染土壤的潜力[15-17]。曾成城等[18]的研究表明在水淹生境下,秋华柳对镉污染土壤仍具有较好的修复能力。张雯[19]在秋华柳的镉解毒机制一文中认为,细胞壁的镉积累在秋华柳的镉耐性解毒中起着重要作用,但水淹胁迫是否会改变秋华柳细胞壁中不同组分对镉的结合能力和结合特征,从而影响到细胞壁的镉富集能力还有待进一步研究。根据已有研究结果,秋华柳从土壤中吸收的镉主要富集于根和茎中,故本研究以秋华柳扦插苗为材料,通过盆栽试验,测定不同处理组下不同组分镉的含量以分析水淹胁迫下秋华柳根、茎细胞壁不同组分的镉积累特征,从而揭示秋华柳细胞壁的镉富集特征和解毒机制,同时阐明水淹对秋华柳细胞壁不同组分镉积累的影响,为秋华柳在消落带的植被构建与镉污染土壤修复工作提供理论依据。
1 材料与方法
1.1 试验材料及采样地概况
试验所需秋华柳采集于嘉陵江同兴镇河岸(29°41′2″N,106°26′56″E)。受三峡水库的影响,嘉陵江水文规律相应出现3个阶段。第一阶段为水淹期(5月底—9月),属于河流型生态系统;第二阶段为蓄水期(10月—次年2月),属于湖泊型生态系统。在一、二阶段水位最高均可达到175 m。最后一个时期是泄洪期(2月底—5月初),水位降至145~165 m,属于过渡型生态系统[20]。
2015年10月于采样地173 m海拔位处,剪取长15~20 cm,茎径0.8~1 cm的秋华柳扦插条,于实验室先后用自来水、超纯水冲洗干净,扦插于花盆(上径22 cm×下径15 cm×高18 cm)中培养。每盆1株,均装入自然风干过1 mm筛的2 kg紫色土壤(采自三峡库区消落带)。土壤基本理化性质见表1。
1.2 试验设计
2016年4月27日,挑选长势基本一致且状态良好无病虫害的秋华柳扦插苗(初始株高约35 cm,基径约0.7 cm,分枝数约12个)进行随机分组。试验以镉胁迫和水淹作为胁迫因子,采用双因素完全随机试验设计,设置8组处理。根据三峡库区消落带土壤镉污染现状[3-4],共设置0、0.5、2、10 mg·kg-1(Cd2+/土壤)4个镉浓度处理水平,涉及消落带土壤轻度、中度、重度镉污染等级,分别定义为T0、T1、T2、T3。于苗木扦插前,将CdCl2·2.5H2O按浓度梯度配成水溶液后一次性浇灌于盆土中,并充分混匀土壤,保持潮湿平衡1个月。水分共设置两个处理组:对照组进行常规供水管理,水淹组将盆栽苗放入塑料盆(上径27 cm×下径20 cm×高18 cm)中实施水淹处理,试验期间水位始终维持在土壤表面以上5 cm处。
全部的盆栽苗均放置于西南大学生态园遮雨棚(四面敞开,棚顶透明)下培养,随机摆放花盆并按期交换花盆位置,花盆间保持一定的间距,避免植株间的相互干扰。试验过程中除进行常规的田间管理外,每日按时检查水淹组的水位情况并适时补充水分。培养60 d后,所有处理组秋华柳存活率为100%,叶片无明显的致病现象,苗木整体生长状况良好。取样测试时从每个处理的15株中随机抽取5株,测定的指标平均值作为1个重复,共设置3个重复。
1.3 细胞壁不同组分的提取与镉含量测定
采用分级梯度离心法提取细胞壁,分离细胞壁不同组分[21]。分别取根、茎鲜样各0.5 g,进行液氮研磨,将所得粉末置于50 mL离心管中,经75%冰乙醇冲洗 15 min 后离心 15 min(10 000 r·min-1),依次用冰丙酮、冰甲醇/氯仿混合物(1∶1,V/V)及冰甲醇冲洗后离心 15 min(10 000 r·min-1),所得沉淀即为细胞壁;向沉淀中加入0.5%的草酸铵缓冲液15 mL,在80℃水浴中振荡 30 min 后离心 15 min(10 000 r·min-1),上清液即为果胶;用去离子水冲洗沉淀,然后加入4%的NaOH溶液10 mL,在室温下振荡30 min后离心15 min(10 000 r·min-1),上清液即为半纤维素。
所有组分经微波消解仪(Leeman SW-4,Ger many)消解后用电感耦合等离子体发射光谱仪(ICPOES,Thermo Fisher Icap 6300,UK)测定不同处理下细胞壁不同组分中的镉含量。
1.4 数据分析
利用SPSS 22.0统计分析软件进行数据统计分析,采用双因素方差分析(Two-way ANOVA)分析水淹和不同镉浓度对秋华柳根、茎细胞壁不同组分镉含量的影响。用Duncan多重比较(Duncan’s multiple range test)检验相同细胞壁组分在不同镉浓度下镉含量的差异显著性,以及不同细胞壁组分在相同镉浓度下镉含量的差异显著性。利用独立样本t检验分析相同镉浓度下不同水分处理间细胞壁组分镉含量的差异显著性。采用Origin 8.5软件作图。
2 结果与分析
2.1 水淹和不同镉浓度处理对秋华柳根、茎细胞壁不同组分镉含量的影响
所有处理组秋华柳存活良好,表现出水淹和镉的双重耐受性。双因素方差分析结果表明,秋华柳根、茎细胞壁不同组分镉含量均受到水分处理、镉浓度及其交互效应的影响(表2),而且对根、茎完整细胞壁(CW)镉含量的影响相对于去果胶细胞壁(CWP)和去果胶去半纤维素细胞壁(CW-P-HC)镉含量的影响更大,各因素均表现出对CW镉含量有极显著性影响(P<0.01)。除水分处理对根CW-P及CWP-HC 镉含量无显著性影响外(P>0.05),其他根、茎CW-P及CW-P-HC镉含量均受到水分处理和镉浓度的单因素及两者交互效应的极显著性影响(P<0.01)。
2.2 正常供水下根、茎细胞壁不同组分镉含量的变化
从图1可以看出,随着镉浓度的增大,秋华柳根、茎CW、CW-P和CW-P-HC的镉含量均随之升高。在相同镉浓度下,秋华柳根、茎细胞壁镉含量均随着细胞壁组分的减少而逐渐减少,表明果胶和半纤维素在秋华柳细胞壁中均具有与镉离子结合的能力。根、茎细胞壁的镉含量在去除果胶后的下降幅度大于进一步去除半纤维素的降幅,可见果胶的镉离子结合能力大于半纤维素。
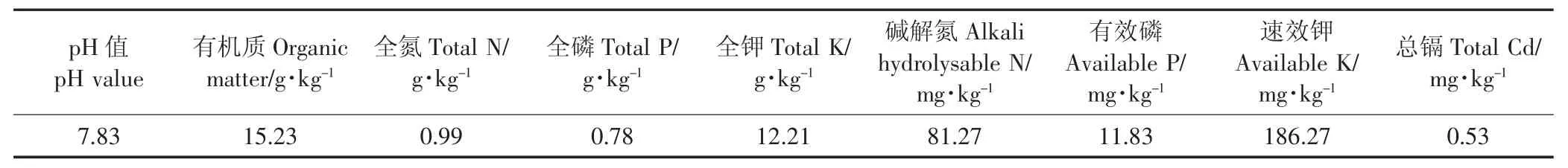
表1 土壤基本理化性质Table 1 The basic physico-chemical characteristics of soils

表2 水淹和不同镉浓度对秋华柳根、茎细胞壁不同组分镉含量的影响Table 2 Effects of flooding and different Cd concentrations on Cd contents in different cell wall components of the root and stem of S.variegata
由图1a可知,处理60 d后与CW镉含量相比,根CW-P镉含量在T2和T3镉浓度下显著下降(P<0.05),分别下降了59.23%和37.05%;T0和T1镉浓度下无显著性差异(P>0.05)。CW-P-HC镉含量与CWP相比,虽镉含量有所下降但无显著性差异(P>0.05)。图1b结果显示,秋华柳茎CW-P镉含量在T3镉浓度下相比CW显著下降(P<0.05),降幅为26.6%,与CW-P-HC镉含量间无显著性差异(P>0.05)。而T1和T2镉处理组的CW-P和CW-P-HC镉含量与CW相比均无显著性差异(P>0.05)。
2.3 水淹对秋华柳根、茎细胞壁不同组分镉含量的影响
与正常供水(图1)相比,水淹胁迫下不同镉处理组的根茎CW、CW-P和CW-P-HC镉含量都有不同程度的降低(图2),但各组分镉含量的变化趋势与正常供水下相同。随着处理镉浓度的增大,秋华柳根茎CW、CW-P和CW-P-HC的镉含量均随之升高。在相同镉浓度下,秋华柳根、茎细胞壁镉含量均随着细胞壁组分的减少而逐渐减少。根细胞壁中,除T3处理组CW和CW-P-HC间的镉含量有显著性差异(P<0.05)外,在其他相同镉处理组中CW-P-HC、CW-P及CW的镉含量间均无显著性差异(P>0.05)。茎细胞壁组分中,除T0、T1处理组中CW-P和CW-P-HC镉含量间存在显著性差异(P<0.05)外,在其他相同镉处理组中CW-P-HC、CW-P及CW的镉含量间也无显著性差异(P>0.05)。
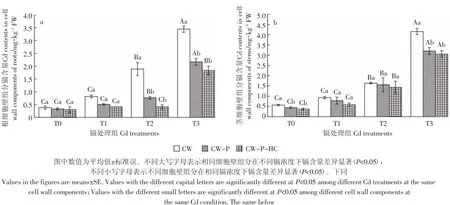
图1 正常供水条件下秋华柳不同细胞壁组分的镉含量Figure 1 Cd contents in different cell wall components of S.Variegata under normal water condition
2.4 不同水分处理下细胞壁不同组分镉含量间的对比
与正常供水(图1)相比,水淹条件下CW、CW-P和CW-P-HC的镉含量都有不同程度的降低(图2),茎器官相应组分的下降趋势更为明显,最高降幅高达74.49%(T3处理组 CW-P-HC,图 3b)。处理 60 d后,根细胞壁CW镉含量在T2、T3镉浓度组下存在正常供水和水淹间的差异显著性(P<0.05),而CW-P和CW-P-HC 的镉含量仅在镉高浓度组 T3(10 mg·kg-1Cd2+)下存在正常供水和水淹间的差异显著性(P<0.05),其他镉处理组下的细胞壁不同组分在正常供水和水淹间均无显著性差异(P>0.05,图3a)。而茎细胞壁不同组分除T1浓度下CW-P镉含量在不同水分处理间无显著性差异外(P>0.05),其他镉处理组下细胞壁不同组分在不同水分处理下均存在显著性差异(P<0.05,图 3b)。
3 讨论
细胞壁作为重金属离子跨膜进入细胞原生质体的第一道屏障,在重金属离子的吸收、固定和转运中起着重要作用。同时,细胞壁也是植物响应重金属胁迫的功能信号分子和代谢所在位点,细胞壁与植物重金属耐性间具有重要的关联性[22-23]。植物细胞壁是由果胶、纤维素、半纤维素、木质素、蛋白质等多种组分构成的一种复杂结构[24]。已有研究表明,在结合重金属离子时,细胞壁多糖物质起到主要作用,同时细胞壁结构蛋白、木质素等酚类物质也参与其中共同完成细胞壁对重金属的吸收和富集[25-27]。本试验结果表明,在正常供水和水淹胁迫下,秋华柳根、茎细胞壁镉含量去除果胶后均有所下降;去除半纤维素后,镉含量进一步降低。由此可见,秋华柳根、茎细胞壁果胶和半纤维素均具有一定的镉离子结合能力。
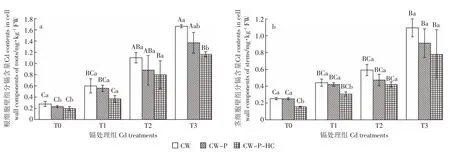
图2 水淹条件下秋华柳不同细胞壁组分的镉含量Figure 2 Cd contents in different cell wall components of S.variegata under flooding
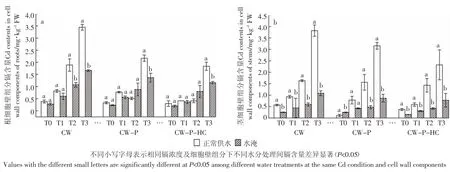
图3 不同水分处理下秋华柳不同细胞壁组分的镉含量Figure 3 Cd contents in different cell wall components of S.variegata in different water treatment
细胞壁结合重金属离子能力的大小主要取决于细胞壁中不同组分提供的负电配位基团,如-COOH、-OH、-CHO、-NH2、-CHO、-SH 等的多少[28-29]。这些负电配位基团通过与重金属阳离子发生反应而将其固定于细胞壁中,完成区室化,阻止重金属离子进入细胞原生质体对植物造成毒害[30],其中多糖中-COOH的多寡将直接决定细胞壁结合重金属离子能力的大小,而果胶是-COOH的主要来源[31]。有些植物在重金属胁迫下可通过增加细胞壁中的果胶含量,提供众多的重金属离子结合位点,以富集更多的金属离子[32]。此外,有研究发现果胶在普通条件下便能与Ca2+形成一种“egg-box”结构(俗称蛋盒结构),当植物生长在重金属污染区域时,Ca2+便可与 Cd、Cu、Al、Zn、Pb 等金属阳离子进行置换,从而在重金属区室化上扮演着重要角色[10,33]。本试验结果也发现,果胶在秋华柳根、茎细胞壁镉积累上同样起到重要作用。处理60 d后,T2(2 mg·kg-1Cd2+)和 T3(10 mg·kg-1Cd2+)处理组中,去除果胶后的根细胞壁镉含量显著下降,降幅分别达到了59.23%和37.05%,茎细胞壁中,去除果胶后的细胞壁镉含量在T3处理组中也显著下降。由此可见,秋华柳根、茎细胞壁果胶结合了大量的镉离子且在中、高镉浓度(2 mg·kg-1,10 mg·kg-1Cd2+)下发挥的作用更大,可能因为高浓度的镉离子可诱导细胞壁中果胶的合成,从而提供更多的负电配位基团。与茎相比,果胶在根细胞壁的镉富集中作用更显著,可能由于根部镉离子浓度较大,更容易被根吸收进入细胞,同时与根际酸碱度的变化及根部分泌的有机酸等因素有关[34-35],使根成为镉富集的最主要器官。除果胶外,组成细胞壁的另一主要多糖物质为半纤维素,因含有大量的-OH,在细胞壁的重金属富集中也发挥着一定的作用。陈世宝等[36]研究发现芥菜、生菜、小白菜等多种植物根系在进一步去除半纤维素后,细胞壁中锌的含量显著下降。本研究得到了相似的结果,与只去除果胶组分的细胞壁镉含量相比,秋华柳根、茎细胞壁在去除果胶及半纤维后镉含量有所下降,但两者间无显著差异,由此可见秋华柳根、茎细胞壁半纤维素同样具有镉离子结合能力,但结合能力远小于果胶。这一结果证实了多糖中-COOH的多寡可直接决定细胞壁结合重金属离子能力大小的说法。
根、茎细胞壁在去除果胶及半纤维素后镉含量仍很高,说明一部分镉离子被细胞壁的残余组分固定,即纤维素、木质素和结构蛋白。纤维素主要存在于细胞壁的初生壁和次生壁中,构成细胞壁的骨架[22]。木质素则存在于次生壁中,主要在矿物质的运输中起作用[37]。已有研究表明,植物面临重金属胁迫时,体内木质素相关合成酶活性提高,组织中的木质素含量明显增加[38]。细胞壁蛋白基因也会发生高表达,产生相关细胞壁蛋白,在重金属离子的固定中发挥重要作用[39]。因此,秋华柳茎细胞壁纤维素、木质素、结构蛋白可能是结合镉离子的另一主要组分,有待进一步验证。
有研究表明,细胞壁对重金属的富集特征不是一成不变的,外源因素可通过影响细胞壁多糖的合成,从而改变细胞壁的镉富集能力[40]以及重金属在细胞壁不同组分中的分布,甚至改变植物对重金属的耐受和富集能力。周丽珍等[41]发现,外源添加NaCl造成苋菜根、茎、叶细胞壁中的镉含量总体显著下降。然而,也有相关研究表明其他外源因素可促进细胞壁对重金属的富集。高超等[42]、Qiu等[43]的研究发现,磷的添加提高了细胞壁对镉的富集能力,显著增加了水稻、卷心菜细胞壁中的镉含量。本试验中,水淹及水淹与镉处理间的交互效应对秋华柳根、茎细胞壁果胶和半纤维素的镉富集能力均造成了一定程度的影响。从独立样本t检验的结果来看,与正常供水相比,水淹条件下的秋华柳根茎完整细胞壁、去果胶细胞壁和去果胶去半纤维素细胞壁的镉含量都有不同程度的降低。可能是由于水淹改变了土壤中重金属的化学形态,生物有效性降低[18,44-45],细胞壁中固定的重金属离子量减少,果胶对重金属的结合也相应减少,也有可能是水淹影响了细胞壁果胶和半纤维素等多糖组分的合成,从而减少了细胞壁对镉的固定能力。与根相比,水淹条件下茎细胞壁相应组分的镉含量下降趋势更为明显。这可能是因为水淹条件下秋华柳的形态和代谢途径都发生了变化[14],从而影响了植株地上部的镉含量以及根-枝镉转移能力,最终降低了茎细胞壁中的镉含量。本试验的处理时间处于植物春夏季生长旺季,研究结果证明秋华柳根、茎细胞壁组分在生长季水淹期间,表现出了良好的镉积累能力,水淹胁迫未对其造成明显的影响。但面对三峡库区消落带冬季植物非生长季水淹,秋华柳是否会表现出相同的镉积累特征?不同季节的水淹是否会影响秋华柳细胞壁的镉积累特征?这将是后续研究需要关注的问题,以期通过更全面的研究为秋华柳在消落带的植被构建与镉污染土壤修复工作提供更充足的理论依据。
4 结论
(1)果胶和半纤维素在秋华柳根、茎细胞壁中均具有一定的镉离子结合能力,果胶对镉的结合能力大于半纤维素。
(2)水淹条件下,秋华柳根、茎细胞壁果胶和半纤维素中的镉含量虽有一定程度的降低,但仍为细胞壁镉离子的主要结合组分。
(3)水淹未对秋华柳根、茎细胞壁组分中镉的分配策略造成明显影响,秋华柳可作为三峡库区消落带镉污染土壤修复的一个备选物种。
[1]谭淑端,王 勇,张全发.三峡水库消落带生态环境问题及综合防治[J].长江流域资源与环境,2008,17(增刊1):101-105.
TAN Shu-duan,WANG Yong,ZHANG Quan-fa.Environment challenges and countermeasures of the water-lever-fluctuation zone(WLFZ)of the Three Gorges Reservoir[J].Resources and Environment in the Yangtze Basin,2008,17(Suppl1):101-105.
[2]Zhang Q,Lou Z.The environmental changes and mitigation actions in the Three Gorges Reservoir region,China[J].Environmental Science&Policy,2011,14(8):1132-1138.
[3]Singh S,Eapen S,D’Souza S F.Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant,Bacopa monnieri L.[J].Chemosphere,2006,62(2):233-246.
[4]刘意章,肖唐付,宁增平,等.三峡库区巫山建坪地区土壤镉等重金属分布特征及来源研究[J].环境科学,2013,34(6):2390-2398.
LIU Yi-Zhang,XIAO Tang-fu,NING Zeng-ping,et al.Cadmium and selected heavy metals in soils of Jianping area in Wushan county,the Three Gorges region:Distribution and source recognition[J].Environmental Science,2013,34(6):2390-2398.
[5]唐 将.三峡库区镉等重金属元素迁移富集及转化规律[D].成都:成都理工大学,2005.
TANG Jiang.Study on the regularity of move,enrichment,and translation of cadmium and other heavy metals in the district of the Three Gorges Reservoir[D].Chengdu:Chengdu University of Technology,2005.
[6]孙惠莉,吕金印,贾少磊.硫对镉胁迫下小白菜叶片AsA—GSH循环和植物络合素含量的影响[J].农业环境科学学报,2013,32(7):1294-1301.
SUN Hui-li,LÜ Jin-yin,JIA Shao-lei.Effects of sulfur on ascorbateglutathione cycle and the content of phytochelatins in the leaves of pakchoi(Brassica chinensis L.)under cadmium stress[J].Journal of Agro-Environment Science,2013,32(7):1294-1301.
[7]Zhang X,Lin L,Chen M,et al.A nonpathogenic Fusarium oxysporum strain enhances phytoextraction of heavy metal by the hyperaccumulator Sedum alfredii Hance[J].Journal of Hazardous Materials,2012,229/230(3):361-370.
[8]曾 鹏,曹 霞,郭朝晖,等.Cd污染土壤景观修复植物筛选研究[J].农业环境科学学报,2016,35(4):691-698.
ZENG Peng,CAO Xia,GUO Zhao-hui,et al.Potential of ornamental plants for remediating soil polluted with cadmium[J].Journal of Agro-Environment Science,2016,35(4):691-698.
[9]Vollenweider P,Cosio C,Günthardt-Goerg M S,et al.Localization and effects of cadmium in leaves of a cadmium-tolerant willow(Salix viminalis L.)PartⅡ:Microlocalization and cellular effects of cadmium[J].Environmental and Experimental Botany,2006,58(1-3):25-40.
[10]Krzesłowska M.The cell wall in plant cell response to trace metals:Polysaccharide remodeling and its role in defense strategy[J].Acta-Physiologiae Plantarum,2011,33(1):35-51.
[11]Bouazizi H,Jouili H,Geitmann A,et al.Structural changes of cell wall and lignifying enzymes modulations in bean roots in response to copper stress[J].Biological Trace Element Research,2010,136(2):232-240.
[12]Zhang X H,Lin A J,Gao Y L,et al.Arbuscular mycorrhizal colonisation increases copper binding capacity of root cell walls of Oryza sativa L.and reduces copper uptake[J].Soil Biology&Biochemistry,2009,41(5):930-935.
[13]李 娅,曾 波,叶小齐,等.水淹对三峡库区岸生植物秋华柳(Salix variegata Franch.)存活和恢复生长的影响[J].生态学报,2008,28(5):1923-1930.
LI Ya,ZENG Bo,YE Xiao-qi,et al.The effect of flooding on survival and recovery growth of the riparian plant Salix variegate Franch.in Three Gorges Reservoir region[J].Acta Ecologica Sinica,2008,28(5):1923-1930.
[14]张艳红,曾 波,付天飞,等.长期水淹对秋华柳根部非结构性碳水化合物含量的影响[J].西南师范大学学报:自然科学版,2006,31(3):153-156.
ZHANG Yan-hong,ZENG Bo,FU Tian-fei,et al.Effects of long-term flooding on non-structural carbohydrates content in roots of Salix variegata Franch[J].Journal of Southwest China Normal University(Natural Science),2006,31(3):153-156.
[15]孙晓灿,魏 虹,谢小红,等.水培条件下秋华柳对重金属Cd的富集特性及光合响应[J].环境科学研究,2012,25(2):220-225.
SUN Xiao-can,WEI Hong,XIE Xiao-hong,et al.Bioaccumulation and photosynthesis response of Salix variegate to cadmium under hydroponic culture[J].Research of Environmental Sciences,2012,25(2):220-225.
[16]贾中民,魏 虹,孙晓灿,等.秋华柳和枫杨幼苗对镉的积累和耐受性[J].生态学报,2011,31(1):107-114.
JIA Zhong-min,WEI Hong,SUN Xiao-can,et al.Accumulation and tolerance of Salix variegate and Pterocarya stenoptera seedlings to cadmium[J].Acta Ecologica Sinica,2011,31(1):107-114.
[17]刘 媛,马文超,张 雯,等.镉胁迫对秋华柳根系活力及其Ca、Mg、Mn、Zn、Fe 积累的影响[J].应用生态学报,2016,27(4):1109-1115.
LIU Yuan,MA Wen-chao,ZHANG Wen,et al.Effect of cadmium stress on root vigor and accumulation of elements Ca,Mg,Mn,Zn,Fe in Salix variegate[J].Chinese Journal of Applied Ecology,2016,27(4):1109-1115.
[18]曾成城,陈锦平,马文超,等.水淹生境下秋华柳对镉污染土壤研究修复能力[J].生态学报,2016,36(13):3978-3986.
ZENG Cheng-cheng,CHEN Jin-ping,MA Wen-chao,et al.The remedial capability of Salix variegate for Cd-contaminated soil under flooding environments[J].Acta Ecologica Sinica,2016,36(13):3978-3986.
[19]张 雯.秋华柳(Salix variegata Franch)的Cd富集特性及解毒机制研究[D].重庆:西南大学,2014.
ZHANG Wen.Research on accumulation characteristics and tolerance mechanismstocadmiumofSalixvariegataFranch[D].Chongqing:Southwest University,2014.
[20]Nie Y,Zhang Z,Wang M,et al.Seasonal variations of carbonic anhydrase activity in Chongqing urban section of Jialing River and its influencing factors[J].Chemosphere,2017,179:202-212.
[21]Zhong H L,Lauchli A.Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J].Journal of Experimental Botany,1993,44(261):773-778.
[22]Chen G,Liu Y,Wang R,et al.Cadmium adsorption by willow root:The role of cell walls and their subfractions[J].Environmental Science&Pollution Research International,2013,20(8):5665-5672.
[23]刘清泉,陈亚华,沈振国,等.细胞壁在植物重金属耐性中的作用[J].植物生理学报,2014,50(5):605-611.
LIU Qing-quan,CHEN Ya-fei,SHEN Zhen-guo,et al.Roles of cell wall in plant heavy metal tolerance[J].Plant Physiology Journal,2014,50(5):605-611.
[24]Carpita N C,Defernez M,Findlay K,et al.Cell wall architecture of the elongating maize coleoptile[J].Plant Physiology,2001,127(2):551-565.
[25]Davis T A,Llanes F,Volesky B,et al.Metal selectivity of Sargassum spp.and their alginates in relation to their α-l-guluronic acid content and conformation[J].Environmental Science&Technology,2003,37(2):261-267.
[26]Konno H,Nakato T,Nakashima S,et al.Lygodium japonicum fern accumulates copper in the cell wall pectin[J].Journal of Experimental Botany,2005,56(417):1923-1931.
[27]Konno H,Nakashima S,Katoh K.Metal-tolerant moss Scopelophila cataractae accumulates copper in the cell wall pectin of the protonema[J].Journal of Plant Physiology,2010,167(5):358-364.
[28]Pelloux J,Rusterucci C,Mellerowicz E J.New insights into pectin methylesterase structure and function[J].Trends in Plant Science,2007,12(6):267-277.
[29]Davis T A,Volesky B,Mucci A.A review of the biochemistry of heavy metal biosorption by brown algae[J].Water Research,2003,37(18):4311-4330.
[30]张旭红,高艳玲,林爱军,等.植物根系细胞壁在提高植物抵抗金属离子毒性中的作用[J].生态毒理学报,2008,3(1):9-14.
ZHANG Xu-hong,GAO Yan-ling,LIN Ai-jun,et al.A review on the effects of cell wall on the resistance of plants to metal stress[J].Asian Journal of Ecotoxicology,2008,3(1):9-14.
[31]Dronnet V M,Renard C,Axelos M A V,et al.Heavy metals binding by pectins:Selectivity,quantification and characterisation[J].Progress in Biotechnology,1996,14(96):535-540.
[32]Astier C,Gloaguen V,Faugeron C.Phytoremediation of cadmium-contaminated soils by young Douglas fir trees:Effects of cadmium exposure on cell wall composition[J].International Journal of Phytoremediation,2014,16(7/8):790-803.
[33]Caffall K H,Mohnen D.The structure,function,and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydrate Research,2009,344(14):1879-1900.
[34]Stoltz E,Greger M.Accumulation properties of As,Cd,Cu,Pb and Zn by four wetland plant species growing on submerged mine tailings[J].Environmental&Experimental Botany,2002,47(3):271-280.
[35]Dahmani-Muller H,Oort F V,Gélie B,et al.Strategies of heavy metal uptake by three plant species growing near a metal smelter[J].Environmental Pollution,2000,109(2):231-238.
[36]陈世宝,孙 聪,魏 威,等.根细胞壁及其组分差异对植物吸附、转运Zn的影响[J].中国环境科学,2012(9):1670-1676.
CHEN Shi-bao,SUN Cong,WEI Wei,et al.Difference in cell wall components of roots and its effect on the transfer factor of Zn by plant species[J].China Environmental Science,2012(9):1670-1676.
[37]Ithal N,Recknor J,Nettleton D,et al.Developmental transcript profiling of cyst nematode feeding cells in soybean roots[J].Molecular Plant-Microbe Interactions,2007,20(5):510-525.
[38]Yang Y J,Cheng L M,Liu Z H.Rapid effect of cadmium on lignin biosynthesis in soybean roots[J].Plant Science,2007,172(3):632-639.
[39]Pan W H,Shou J X,Zhou X R,et al.Al-induced cell wall hydroxyproline-rich glycoprotein accumulation is involved in alleviating Al toxicity in rice[J].Acta Physiologiae Plantarum,2011,33(2):601-608.
[40]Zhu X F,Wang Z W,Dong F,et al.Exogenous auxin alleviates cadmium toxicity in Arabidopsis thaliana by stimulating synthesis of hemicellulose 1 and increasing the cadmium fixation capacity of root cell walls[J].Journal of Hazardous Materials,2013,263(2):398-403.
[41]周丽珍,罗 璇,何宝燕,等.NaCl胁迫下苋菜中镉的亚细胞分布及转运研究[J].生态环境学报,2015,24(1):139-145.
ZHOU Li-Zhen,LUO Xuan,HE Bao-yan,et al.Subcellular distribution and translocation of Cd in amaranth under salinity stress[J].Ecology and Environmental Sciences,2015,24(1):139-145.
[42]高 超,聂洪光,聂 帅.磷对镉胁迫下水稻亚细胞分布的影响[J].农业科技与装备,2014(8):5-6.
GAO Chao,NIE Hong-guang,NIE Shuai.Effects of different phosphorus on subcellular distribution under Cd stress[J].Agricultural Science&Technology and Equipment,2014(8):5-6.
[43]Qiu Q,Wang Y T,Yang Z Y,et al.Effects of phosphorus supplied in soil on subcellular distribution and chemical forms of cadmium in two Chinese flowering cabbage(Brassica parachinensis L.)cultivars differing in cadmium accumulation[J].Food and Chemical Toxicology,2011,49(9):2260-2267.
[44]Vodyanitskii Y N,Plekhanova I O.Biogeochemistry of heavy metals in contaminated excessively moistened soils:Analytical review[J].Eurasian Soil Science,2014,47(3):153-161.
[45]甲卡拉铁,喻 华,冯文强,等.淹水条件下不同氮磷钾肥对土壤pH和镉有效性的影响研究[J].环境科学,2009,30(11):3414-3421.
JIA Ka-la-tie,YU Hua,FENG Wen-qiang,et al.Effect of different N,P and K fertilizers on soil pH and available Cd under waterlogged conditions[J].Environmental Science,2009,30(11):3414-3421.
Effect of flooding on cadmium content in different cell wall components of the root and stem of Salix variegata Franch
ZHOU Cui1,CHEN Jin-ping1,2,WANG Ting1,CHEN Hong-chun1,LI Rui1,MA Wen-chao1,WEI Hong1*
(1.Key Laboratory of Eco-environments in Three Gorges Reservoir Region(Ministry of Education),Chongqing Key Laboratory of Plant Ecology and Resources Research in Three Gorges Reservoir Region,School of Life Sciences,Southwest University,Chongqing 400715,China;2.Agricultural Resources and Environment Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007,China)
The altered water regime in the Three Gorges Reservoir in the Yangtze River,China,has induced the formation of a hydro-fluctuation zone that has caused many serious environmental problems.Among them,the two main problems are high cadmium concentration in the sediment and anti-seasonal,long-term flooding.Revegetation has become one of the most important means of ecological restoration in the hydro-fluctuation zone of the Three Gorges Reservoir.Previous research has shown that Salix variegata,a native species in the Three Gorges Reservoir,can tolerate both flooding and cadmium stress,and thus is a promising candidate species for revegetation in the hydrofluctuation zone of the Three Gorges Reservoir.However,the ability of S.variegata to tolerate and accumulate cadmium under flooding is still unclear.In order to investigate the effect of flooding on cadmium content in different cell wall components of the root and stem of S.var-iegata,cutting seedlings under two water regimes as control group(CK)and flooding group(FL)and four cadmium concentrations(0,0.5,2,and 10 mg·kg-1,achieved by adding CdCl2·2.5H2O to the soil)were studied via pot experiments.Sampling was carried out after 60 d of treatment,and the cadmium accumulation characteristics of different cell wall components of the root and stem of S.variegata under different cultivation were analyzed.The results showed as the following:The survival rate of S.variegata for all treatments was high,which indicated high tolerance of this species to flooding and cadmium stresses;In all cadmium treatments,the pectin and hemicellulose of cell wall in the root and stem of S.variegata had good binding capacities to cadmium,and pectin had the highest binding capacity for cadmium;Water regime,cadmium concentration,and the interactions between these two factors had different impacts on the cadmium contents in different cell wall components of the root and stem of S.variegata.Flooding significantly reduced the cadmium content in stem cell wall components,but there was no significant effect by flooding on cadmium content in the root cell wall;The contents of pectin and hemicellulose cadmium in the root and stem cell wall of S.variegata decreased under flooding conditions,but pectin and hemicellulose were still the main cell wall components enriched with cadmium.These results indicated that there was no significant change in the distribution of cadmium in the components of the root and stem cell wall of S.variegata under flooding,as cadmium could still be fixed in the cell wall,to alleviate the harmful effects of cadmium stress on plants.Hence,S.variegata should be considered for phytoremediation of cadmium in the hydro-fluctuation zone of the Three Gorges Reservoir.
Salix variegata;cadmium stress;flooding;cell wall;pectin;hemicellulose
X503.23
A
1672-2043(2017)12-2421-08
10.11654/jaes.2017-0655
周 翠,陈锦平,王 婷,等.水淹对秋华柳根茎细胞壁组分镉含量的影响[J].农业环境科学学报,2017,36(12):2421-2428.
ZHOU Cui,CHEN Jin-ping,WANG Ting,et al.Effect of flooding on cadmium content in different cell wall components of the root and stem of Salix variegata Franch[J].Journal of Agro-Environment Science,2017,36(12):2421-2428.
2017-05-05 录用日期:2017-07-07
周 翠(1992—),女,安徽宿州人,硕士研究生,主要从事应用生态学研究。E-mail:1320801522@qq.com
*通信作者:魏 虹 E-mail:weihong@swu.edu.cn
国家国际科技合作专项(2015DFA90900);中央财政林业科技推广示范资金项目(20170183);中央财政林业科技推广示范资金项目(渝林科研2016-8);三峡后续工作库区生态与生物多样性保护专项项目(5000002013BB5200002);中央高校基本科研业务费专项资金资助(XDJK2017D104)
Project supported:The International Sci-Tech Cooperation Project of Ministry of Science and Technology(2015DFA90900);The Forestry Extension Project of China Central Finance(20170183);The Forestry Extension Project of China Central Finance(Yulinkeyan 2016-8);Follow-up Work of Ecological Biodiversity Conservation Project in the Three Gorges Reservoir Area(5000002013BB5200002);Fundamental Research Funds for the Central Universities(XDJK2017D104)
