壬基酚溶液暴露对秀丽隐杆线虫的毒性研究
2018-01-08潘立刚张秀彤靳欣欣
李 安 ,潘立刚 *,张秀彤 ,梁 刚 ,满 燕 ,靳欣欣
壬基酚溶液暴露对秀丽隐杆线虫的毒性研究
李 安1,2,潘立刚1,2*,张秀彤1,2,梁 刚1,2,满 燕1,2,靳欣欣1,2
(1.北京农业质量标准与检测技术研究中心,北京 100097;2.农业部农产品质量安全风险评估实验室(北京),北京 100097)
为探究壬基酚溶液暴露对秀丽隐杆线虫的急性致死毒性和非致死毒性效应,将同期化后的秀丽隐杆线虫暴露于壬基酚溶液24 h,考察壬基酚对秀丽隐杆线虫的半致死浓度、性腺臂发育、子代数目、虫体长度和身体弯曲频率等毒性指标的影响。结果表明,以L4期野生型秀丽隐杆线虫为受试生物,对壬基酚溶液24 h的半数致死浓度即LC50值为8.09 mg·L-1。壬基酚暴露干扰了秀丽隐杆线虫性腺臂的正常发育,与对照组相比,0.081 mg·L-1和0.162 mg·L-1染毒组对秀丽隐杆线虫的子代数目和虫体长度均有显著性影响(P<0.05);低剂量染毒组身体弯曲频率与对照组相比没有统计学差异(P>0.05),而高剂量组与对照组有显著性差异(P<0.05)。毒性试验研究表明,模式动物秀丽隐杆线虫对壬基酚的毒性响应比较敏感,在环境激素的生态毒理学研究中具有潜在的应用价值。
壬基酚;秀丽隐杆线虫;生态毒理
壬基酚(NP,Nonylphenol)是非离子表面活性剂壬基酚聚氧乙烯醚(NPEs,Nonylphenol ethoxylates)合成过程中的重要化工中间体。由于NPEs具有良好的渗透性、乳化性、润湿性和分散性,其在化工、纺织、造纸、农药等多个行业得到了广泛应用[1]。NPEs进入环境后降解成性质比较稳定的小分子化合物壬基酚,并在土壤[2]、水体[3]、食品[4]等各种介质中累积而对生态环境和人类健康构成潜在的威胁。环境水体中的壬基酚污染及其对水生生物的累积风险已引起人们的广泛关注,王平等[5]研究发现黄河兰州段浮游植物、浮游动物和鱼类等各级生物体内的壬基酚含量范围为0.127~45.89 mg·kg-1,比水体中高 103~105 倍。由于壬基酚的高疏水性,水体中的壬基酚容易在土壤中富集,如太原市小店区污灌渠水体中壬基酚平均含量为5.92 μg·L-1[6],而该区域农田土壤的壬基酚平均含量达0.188 mg·kg-1[7]。土壤中的壬基酚残留可经根系吸收向农作物迁移,并在农产品中富集而增加了消费者的膳食安全风险[8]。
壬基酚是一种典型的类雌激素类物质,能够引起鱼类[9]、蛙类[10]、大鼠[11]等动物的内分泌干扰效应,同时还可能对生物的生长发育、生殖系统、免疫系统和神经系统产生不良作用。秀丽隐杆线虫是从土壤中分离出来的无脊椎动物,由于具有易培养、繁殖周期短、遗传基因与哺乳动物同源性高等特点[12],近年来逐渐应用在农药[13]、环境激素[14]、重金属[15]等污染物毒理机制研究,线虫的致死性和非致死性毒性评价指标也被应用在水体[16]和土壤[17]等环境介质安全性评估中。目前国内外将秀丽隐杆线虫应用在壬基酚的毒性评价研究报道较少,且仅集中于壬基酚对秀丽隐杆线虫的生殖毒性方面研究[18],探究更多的以线虫为模式生物的壬基酚毒性指标,对于筛选更为适当和敏感的毒性评价指标和完善基于线虫的类雌激素化合物毒理评价体系具有积极意义。
本文以秀丽隐杆线虫为模式生物,通过短期急性暴露实验探究壬基酚对秀丽隐杆线虫的致死、生殖、发育和运动神经毒性效应,探讨以秀丽隐杆线虫为模型进行类雌激素化合物毒理评价的可行性,为其在环境类雌激素物质的生态毒理评估应用提供参考依据。
1 材料与方法
1.1 材料
N2野生型秀丽隐杆线虫(Caenorhabditis elegans)和大肠杆菌(Escherchia coli)OP50均由美国线虫遗传中心(CGC,Caenorhabditis Genetics Center)馈赠。4-壬基酚(纯度>99%)购自中国上海Aladdin公司。
1.2 主要仪器
Acquilty UPLC Xevo TQ超高效液相色谱串联质谱仪(美国Waters公司)、SMG800体视显微镜(北京同舟同德仪器仪表有限公司)、LW300-38LT数码成像倒置显微镜(上海测维光电技术有限公司)、KT53恒温培养箱(德国Binder公司)、5427R高速冷冻离心机(德国Eppendorf公司)
1.3 暴露溶液中壬基酚浓度检测方法
以无水乙醇为溶剂配制 20 000 mg·L-1溶液,利用M9缓冲溶液稀释成浓度为100 mg·L-1的壬基酚溶液,该溶液中乙醇体积分数为0.5%,样品充分振荡溶解后,吸取适量溶液并利用甲醇稀释200倍,过0.22 μm微孔滤膜后进行UPLC-MS/MS测定。
色谱条件:BEH C18色谱柱(100 mm×2.1 mm×1.7 μm),柱温为40℃,以甲醇(A)和0.05%氨水(B)为流动相,梯度洗脱程序为:0~1 min,20%A;1~3.5 min,20%A;3.5~4.5 min,95%A;4.5~5 min,20%A;5~6 min,20%A;流速为 0.3 mL·min-1;进样量为 5 μL。
质谱条件:采用电喷雾离子源负离子模式(ESI-),离子源温度为150℃;去溶剂温度为400℃;去溶剂气流速为 800 L·h-1;毛细管电压为 3.5 kV;碰撞气体为高纯氩气;监测模式为MRM,定量监测离子对为 m/z 219.4→m/z 133.1。
1.4 秀丽隐杆线虫的培养及同期化
1.4.1 秀丽隐杆线虫的培养
秀丽隐杆线虫在含有大肠杆菌OP50的线虫生长培养基(NGM,Nematode growth medium)上培养。
1 L NGM培养基溶液配制方法为:氯化钠3 g·L-1,蛋白胨 2.5 g·L-1,胆固醇 5 mg·L-1,1 mmol·L-1氯化钙,1 mmol·L-1硫酸镁,25 mmol·L-1磷酸氢钾缓冲液,18 g营养琼脂粉,调节pH至6.0。线虫以大肠杆菌OP50为食物,在20±1℃恒温培养箱中培养。
1.4.2 秀丽隐杆线虫的同期化方法
为了保证受试生物处于同一生长水平,采用次氯酸钠漂白法进行同期化获得L4期生长同步的秀丽隐杆线虫。
5 mL漂白液的配制方法为:0.5 mL次氯酸钠溶液;0.5 mL 5 mol·L-1氢氧化钠溶液;4 mL 无菌水。1 L M9缓冲液配制方法为:3 g磷酸二氢钾;6 g磷酸氢二钠;5 g氯化钠;0.12 g硫酸镁。
具体同期化步骤为:①将正处于产卵期的雌雄同体线虫用1 mL已灭菌的M9缓冲液从NGM培养板中洗下,4000 r·min-1离心 2 min,弃去上清液;②向管中加入750 μL新配的同期化漂白液,室温下剧烈振荡 3~5 min,4000 r·min-1离心 2 min,弃去上清液,收集底部沉淀;③沉淀用灭菌的M9缓冲液反复清洗2~3次,再次离心后弃上清液时留约0.2 mL溶液,摇匀;④将含有线虫虫卵的M9溶液转移到涂有OP50的NGM培养板中孵化并培养,获得同期化线虫。
1.5 暴露方法
1.5.1 壬基酚急性致死试验暴露方法
利用M9缓冲溶液将壬基酚母液梯度稀释制成0.8、0.6、0.4、0.2、0.1、0.05 倍不同浓度的壬基酚溶液(含0.5%乙醇助溶剂),以M9缓冲溶液为空白对照组,以含0.5%乙醇的M9缓冲溶液为助溶剂对照组,将30条同期化的L4期秀丽隐杆线虫转入溶液中暴露24 h,暴露环境温度为20℃。
1.5.2 壬基酚急性非致死试验暴露方法
利用M9缓冲溶液分别配制LC50的1/50倍和1/100倍的壬基酚溶液(含优化后的助溶剂),以M9缓冲溶液为空白对照组,以含0.5%乙醇的M9缓冲溶液为助溶剂对照组,将20条同期化的L4期秀丽隐杆线虫转入溶液中暴露24 h,暴露环境温度为20℃。
1.6 毒性指标测定方法
1.6.1 致死率
将暴露后的秀丽隐杆线虫在体视显微镜下观察并利用接种针触碰线虫,若无反应即为死亡,记录每个处理组中秀丽隐杆线虫的存活和死亡数目。
1.6.2 子代数目
将暴露后的秀丽隐杆线虫置于正常的NGM培养基上培养,每间隔12 h移一次盘,并记录72 h内孵化出的所有后代数目,每组重复10次。
1.6.3 虫体长度
将暴露后的秀丽隐杆线虫置于没有食物的NGM培养基上,在体视显微镜下观察,结合图像分析系统测定线虫身体的长度,每组重复20次。
1.6.4 性腺臂观察
将暴露后的秀丽隐杆线虫置于滴有M9缓冲溶液的载玻片上,轻轻盖上盖玻片,使用倒置显微镜观察秀丽隐杆线虫的性腺臂并拍摄图像。
1.6.5 身体弯曲频率
将暴露后的秀丽隐杆线虫置于没有食物的NGM培养基上,待其自由运动1 min后,测试20 s内身体弯曲的次数。一次弯曲定义为秀丽隐杆线虫相对于虫体长轴方向上的一个波长的移动,每组重复20次。
1.7 数据处理
采用统计学软件SPSS 22.0进行统计分析,参照熊浩明等[19]报道方法,利用SPSS软件中的概率单位(Probit)回归计算LC50值。多组比较采用方差齐性检验和单因素方差分析(One-way ANOVA)。
2 结果与讨论
2.1 急性毒性效应
2.1.1 暴露溶液中壬基酚浓度的确定
由于壬基酚微溶于水,20℃时的溶解度仅为5.43 mg·L-1[20],在配制暴露溶液时通常会加入助溶剂以提高壬基酚的溶解性。本文以毒性相对较低的0.5%乙醇为助溶剂制备暴露溶液,样品充分混匀后仍可观察到表面漂浮有一定量的未溶解壬基酚。对暴露溶液中的壬基酚进行测定,结果表明配制的100 mg·L-1的壬基酚溶液,实测浓度值为53.2 mg·L-1。图1为标准品与样品中壬基酚MRM负离子扫描色谱图。壬基酚标准品以甲醇为溶剂,而壬基酚暴露溶液为以0.5%乙醇助溶的水溶液,暴露溶液中实测的壬基酚浓度要明显低于标准品。
2.1.2 急性致死毒性
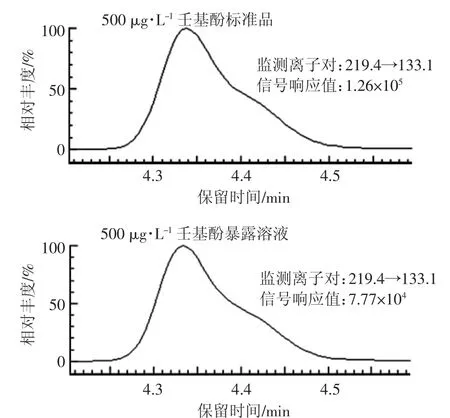
图1 壬基酚标准品与暴露溶液的MRM扫描色谱图Figure 1 The MRM scan chromatogram of nonylphenol standard and exposure solution
在确定的母液浓度基础上,梯度稀释母液,制成实际浓度为 0.012~0.242 mg·L-1的壬基酚暴露溶液,并通过补加无水乙醇保证稀释液中的乙醇体积分数均为0.5%。壬基酚暴露剂量与线虫的致死率关系曲线见图2所示。基于回归分析计算壬基酚对秀丽隐杆线虫的半数致死剂量(LC50)。概率单位模型方程为Probit(p)=3.22x-2.92,Pearson模型拟合优度检验p=0.678,表明模型拟合良好。壬基酚对秀丽隐杆线虫的LC50为 8.09 mg·L-1,95%置信区间为 7.17~9.05 mg·L-1。
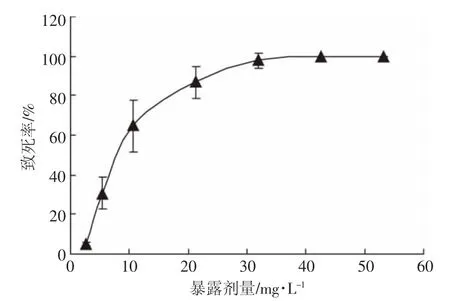
图2 壬基酚暴露剂量与秀丽隐杆线虫致死率关系曲线Figure 2 Relation curve between exposure doses of nonylphenol and lethality of C.elegans
目前关于壬基酚在水生生物的半数致死浓度报道较多,对不同生物由于敏感性不同而LC50-24h值不一,如对泥鳅[21]和大型溞[22]的24 h LC50值分别为12.8、0.3 mg·L-1,可见秀丽隐杆线虫对壬基酚的急性毒性响应要略高于泥鳅,但比大型溞的敏感性要低。杨栋等[18]研究发现,0~100 mg·L-1壬基酚浓度范围暴露的秀丽隐杆线虫死亡数之间没有统计学差异,因此认为壬基酚对线虫的LC50远高于100 mg·L-1。本实验中线虫染毒条件与杨栋等人设计明显不同,本实验以添加了助溶剂的壬基酚水溶液为暴露环境,而杨栋等将壬基酚溶于NGM固体培养基中作为线虫的暴露环境。实验中NGM培养基具有一定厚度,且线虫在NGM培养基中通常只在琼脂表面活动,与壬基酚的接触量和接触频率远比在液体环境中要低,因此在培养基中的线虫实际染毒量要比设计染毒剂量低得多。这可能是造成本实验中线虫的LC50值与杨栋等人的研究结论差异较大的原因。
2.2 非致死毒性效应
急性致死实验所需的暴露剂量相对较高,而非致死毒性效应反映了污染物低剂量暴露对动物正常代谢和生理机能的影响。性腺臂是秀丽隐杆线虫重要的生殖器官,其功能与哺乳动物的卵巢类似,主要是形成卵母细胞的场所。如图3所示,在同等放大比例下,空白对照组和助溶剂对照组的秀丽隐杆线虫性腺臂呈明显的U型弯曲状,且外观粗壮,而0.081 mg·L-1壬基酚溶液暴露组的线虫性腺臂表现出退化的迹象,其长度有所缩短,宽度也变窄;0.162 mg·L-1壬基酚溶液暴露组的线虫性腺臂则表现出明显的退化萎缩,长度进一步缩短,宽度也进一步变窄。由此证实,壬基酚暴露会导致线虫生殖系统发育缺陷。据Wolke等[23]报道,秀丽隐杆线虫性腺臂内的细胞流承担了卵母细胞发育所需营养物质的运输功能。本研究中壬基酚暴露组的秀丽隐杆线虫性腺臂发育存在缺陷,细胞流之间的营养物质传输通道受到影响,导致卵母细胞无法得到正常的营养供给,因此卵母细胞营养供给通道受阻可能是壬基酚引发生殖毒性效应的作用途径之一。

图3壬基酚溶液暴露对秀丽隐杆线虫性腺臂发育的影响Figure 3 Effect of nonylphenol solution on the gonad arm development of C.elegans
图4 表示不同浓度壬基酚暴露对秀丽隐杆线虫子代数目、身体弯曲频率和虫体长度的影响。与空白对照组相比,助溶剂对照组的子代数目略有减少,但方差分析表明两者差异不显著(P>0.05)。由此说明,助溶剂乙醇对秀丽隐杆线虫的生殖能力有一定损伤,但0.5%的剂量对生殖能力损伤效果不明显,与前人报道的研究结论基本一致[24]。与助溶剂对照组相比,暴露在 0.081 mg·L-1和 0.162 mg·L-1的壬基酚溶液中的秀丽隐杆线虫子代数目分别降低了14.7%和31.5%,并具有显著的统计学差异(P<0.05)。壬基酚被认为是一种内分泌干扰物,进入动物体内后通过改变体内性激素水平而表现出生殖毒性。据文献报道,壬基酚对大鼠[25]、斑马鱼[26]、大型溞[27]均表现出明显的生殖系统损伤能力,且存在多种作用途径。Trong等[28]以鳕鱼为受试生物研究发现,壬基酚暴露后干扰了StAR蛋白和P450scc基因的表达,改变了体内性激素水平,进而影响了鱼类卵巢激素的合成。壬基酚暴露后线虫精子激活率低也可能是子代数目减少的因素之一。研究发现,壬基酚暴露浓度与斑马鱼[26]和日本青鳉[29]的精子激活率呈现显著负相关的剂量-效应关系。如前所述,壬基酚暴露后性腺臂发育不良,进而影响了卵母细胞营养供给途径不畅,导致线虫怀卵质量降低。这也可能是引起子代数量减少等生殖毒性的原因之一。本研究以秀丽隐杆线虫为受试生物进一步证实了壬基酚具有较强的生殖毒性。
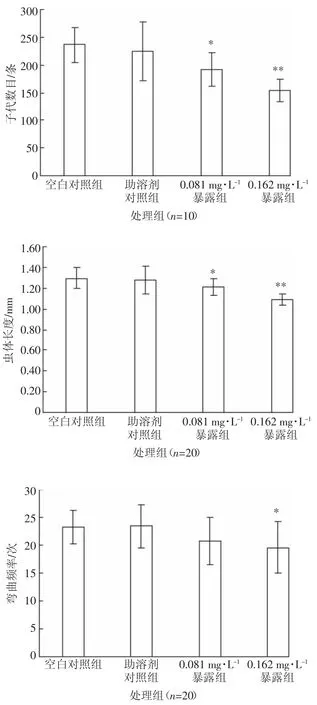
图4 壬基酚溶液暴露对秀丽隐杆线虫非致死毒性指标的影响Figure 4 Effect of nonylphenol solution on the non-lethal toxicities of C.elegans
由图4可知,当暴露在壬基酚溶液中时,秀丽隐杆线虫的发育表现出一定的生长迟缓现象。0.081 mg·L-1壬基酚暴露的秀丽隐杆线虫体长显著低于对照组(P<0.05),而 0.162 mg·L-1壬基酚溶液暴露的秀丽隐杆线虫平均体长与对照组相比具有极显著差异(P<0.01),壬基酚的发育毒性呈现一定的浓度依赖性。关于壬基酚对动物的生长发育的影响,目前还存有一定的争议,如Robert等[30]将斑马鱼幼苗暴露于0.01~0.1 mg·L-1壬基酚的水体,60 d 后仍未发现壬基酚处理组与对照组的斑马鱼幼苗体长和体质量有显著性差异;而Arsenault等[31]研究发现,暴露于0.02 mg·L-1壬基酚的大西洋鲑鱼幼苗的体质量相对降低,且血液中胰岛素生长因子(IGF-I)明显减少,因此认为壬基酚是通过干扰生长激素/胰岛素生长因子轴而影响幼苗的生长发育;郑晓晶等[32]发现 0.01 mg·L-1和0.1 mg·L-1的壬基酚染毒可以滞后蝌蚪的变态时间,降低蝌蚪变态后幼蛙的体质量。本实验通过线虫体长的表观毒理证实了低浓度(0.1 mg·L-1以下)壬基酚对线虫的发育毒性,但是否经由内分泌干扰途径影响线虫个体的发育还有待研究进一步证实。
壬基酚暴露后的秀丽隐杆线虫身体弯曲频率分别如图4所示。低浓度壬基酚暴露对秀丽隐杆线虫身体弯曲频率具有一定的影响,而暴露于相对高浓度的秀丽隐杆线虫,表现出显著的身体弯曲频率缺陷(P<0.05)。秀丽隐杆线虫的神经元与运动肌肉细胞相连后,在信号蛋白的参与下形成突触,进而发挥运动神经功能[33]。壬基酚暴露后的秀丽隐杆线虫运动行为受到影响,表明壬基酚可能干扰信号蛋白的正常合成与代谢,进而导致突触功能与运动神经肌肉细胞无法发挥正常作用。也有学者认为,线虫神经系统中超过三分之一的细胞会分泌乙酰胆碱,因此染毒组线虫的胆碱能系统可能受到扰乱而表现出运动行为毒性[34]。研究报道,长时间的饥饿条件下,也会影响秀丽隐杆线虫的运动行为[35],因此在食物匮乏情况下研究线虫的神经行为毒性,可能会对实验结果造成一定的干扰。
3 结论
(1)通过对L4期秀丽隐杆线虫的24 h急性暴露试验,明确了壬基酚对线虫的LC50值为8.09 mg·L-1。
(2)壬基酚对秀丽隐杆线虫具有明显的生殖毒性,壬基酚溶液暴露(0.162 mg·L-1和 0.081 mg·L-1)后显著减少了秀丽隐杆线虫的子代数目,且导致秀丽隐杆线虫性腺臂出现退化萎缩迹象。壬基酚对秀丽隐杆线虫的发育毒性和神经行为毒性具有一定的影响。
(3)秀丽隐杆线虫的多个评价指标对壬基酚毒性作用敏感,是优秀的壬基酚毒性评价模式生物。本文关于壬基酚暴露对线虫的表观毒性研究结果,对于进一步探究壬基酚的毒理机制提供了科学依据。
[1]黄振军,张希功,冯勤勇.壬基酚的发展趋势[J].精细与专用化学品,2002,10(14):7-8.
HUANG Zhen-jun,ZHANG Xi-gong,FENG Qin-yong.Development tendency of nonylphenol[J].Fine and Specialty Chemicals,2002,10(14):7-8.
[2]Chen F,Ying G G,Kong L X,et al.Distribution and accumulation of endocrine-disrupting chemicals and pharmaceuticals in wastewater irrigated soils in Hebei,China[J].Environmental Pollution,2011,159(6):1490-1498.
[3]陈益欧.苏州市主要水体、饮用水及餐饮用具壬基酚污染状况调查及其去除方法研究[D].苏州:苏州大学,2013.
CHEN Yi-ou.Investigation on pollution of nonylphenol in major water bodies,drinking water and dining ustensils in Suzhou and removal efficiency of some water treatment techniques[D].Suzhou:Soochow University,2013.
[4]谢明勇,刘晓珍,陈泱杰.壬基酚在食品中的污染现状及其生物毒性概述[J].食品科学技术学报,2014,32(1):1-7.
XIE Ming-yong,LIU Xiao-zhen,CHEN Yang-jie.Review on exposure level of nonylphenol in food and related biological toxicity profile[J].Journal of Food Science and Technology,2014,32(1):1-7.
[5]王 平,徐 建,王 平,等.黄河(兰州段)水生生态系统中壬基酚的分布研究[J].城市环境与城市生态,2006,19(2):20-22.
WANG Ping,XU Jian,WANG Ping,et al.Distribution of nonylphenol in the aquatic ecosystem of Lanzhou Reach of Yellow River[J].Urban Environment&Urban Ecology,2006,19(2):20-22.
[6]刘 敏,张彩香,廖小平,等.污灌区地表水中辛基酚、壬基酚及其前体的分布特征[J].环境化学,2014,33(7):1101-1106.
LIU Min,ZHANG Cai-xiang,LIAO Xiao-ping,et al.Distribution characteristics of octylphenol,nonylphenol and nonylphenol polyethoxylates in surface water of sewage irrigation area[J].Environmental Chemistry,2014,33(7):1101-1106.
[7]刘 媛,张彩香,廖小平,等.太原小店污灌区土壤壬基酚的分布特征[J].中国环境科学,2015,35(1):165-170.
LIU Yuan,ZHANG Cai-xiang,LIAO Xiao-ping,et al.Distribution characteristics of nonylphenol in Taiyuan Xiaodian sewage-irrigated soil[J].China Environmental Science,2015,35(1):165-170.
[8]Cai Q Y,Huang H J,Lv H,et al.Occurrence of nonylphenol and nonylphenol monoethoxylate in soil and vegetables from vegetable farms in the Pearl River Delta,South China[J].Archives of Environmental Contamination and Toxicology,2012,63(1):22-28.
[9]刘晓丽,汪 奇,贾林芝,等.壬基酚对斑马鱼精巢组织及性激素合成酶基因表达的影响[J].环境科学学报,2011,31(11):2523-2529.
LIU Xiao-li,WANG Qi,JIA Lin-zhi,et al.Alterations in testicular histology and the mRNAs of enzymes reponsible for sex steroid synthesis in the zebrafish Danio rerio exposed to nonyphenol[J].Acta Scientiae Circumstantiae,2011,31(11):2523-2529.
[10]吕 玥,张迎梅,杨 峰,等.壬基酚对中华大蟾蜍蝌蚪的毒性效应[J].农业环境科学学报,2010,29(6):1086-1090.
LÜ Yue,ZHANG Ying-mei,YANG Feng,et al.Toxic effect of exposure to nonylphenol on Bufo bufogargarizans tadpoles[J].Journal of A-gro-Environment Science,2010,29(6):1086-1090.
[11]Chapin R E,Delaney J,Wang Y,et al.The effects of 4-nonylphenol in rats:A multigeneration reproduction study[J].Toxicological Sciences,1999,52(1):80-91.
[12]Leung M C K,Williams P L,Alexandre B,et al.Caenorhabditis elegans:An emerging model in biomedical and environmental toxicology[J].Toxicological Sciences,2008,106(1):5-28.
[13]田 雨,汝少国,王 蔚,等.久效磷对秀丽隐杆线虫运动、学习和觅食行为的影响[J].环境科学研究,2015,28(2):275-282.
TIAN Yu,RU Shao-guo,WANG Wei,et al.Effects of monocrotophos on the locomotion,learning and foraging behavior of Caenorhabditis elegans[J].Research of Environmental Sciences,2015,28(2):275-282.
[14]Kohra S,Kuwahara K,Takao Y,et al.Effect of Bisphenol A on the feeding behavior of Caenorhabditis elegans[J].Journal of Health Science,2002,48(1):93-95.
[15]Peredney C L,Williams P L.Utility of Caenorhabditis elegans,for assessing heavy metal contamination in artificial soil[J].Archives of Environmental Contamination&Toxicology,2000,39(1):113-118.
[16]王晓祎,王大勇,李爱民,等.农药废水对秀丽隐杆线虫毒性效应及其主要有毒组分[J].农业环境科学学报,2009,28(7):1392-1396.
WANG Xiao-wei,WANG Da-yong,LI Ai-min,et al.Toxicity of a pesticide wastewater on Caneorhabditis elegans[J].Journal of Agro-Environment Science,2009,28(7):1392-1396.
[17]Höss S,Jänsch S,Moser T,et al.Assessing the toxicity of contaminated soils using the nematode Caenorhabditis elegans as test organism[J].Ecotoxicology&Environmental Safety,2009,72(7):1811-1818.
[18]杨 栋,刘 冉,董自平,等.壬基酚对秀丽隐杆线虫的生殖毒性[J].环境与健康杂志,2014,31(6):473-476.
YANG Dong,LIU Ran,DONG Zi-ping,et al.Reproductive toxicity of nonylphenoltoCaenorhabditiselegans[J].JournalofEnvironmentHealth,2014,31(6):473-476.
[19]熊浩明,魏柏青,魏荣杰,等.用SPSS软件计算鼠疫菌半数致死量(LD50)[J].中国人兽共患病学报,2013,29(11):1127-1130.
XIONG Hao-ming,WEI Bai-qing,WEI Rong-jie,et al.Calculation of median lethal dose(LD50)for Yersinia pestis by SPSS package[J].Chinese Journal of Zoonoses,2013,29(11):1127-1130.
[20]陈慰双.我国水环境中壬基酚的污染现状及生态风险评估[D].青岛:中国海洋大学,2013.
CHEN Wei-shuang.The current pollution status and ecological risk assessment of nonylphenol in domestic water environment[D].Qingdao:Ocean University of China,2013.
[21]雷 忻,田鹏飞,唐丁丁,等.壬基酚胁迫对泥鳅的急性毒性效应[J].江苏农业科学,2014,42(5):306-307.
LEI Xin,TIAN Peng-fei,TANG Ding-ding,et al.Acute toxicity of loach exposed to nonylpehnol[J].Jiangsu Agricultural Sciences,2014,42(5):306-307.
[22]Comber M H I,Williams T D,Stewart K M.The effects of nonylphenol on Daphnia magna[J].Water Research,1993,27(2):273-276.
[23]Wolke U,Jezuit E A,Priess J R.Actin-dependent cytoplasmic streaming in C.elegans oogenesis[J].Development,2007,134(12):2227-2236.
[24]李乃鹏,梁琼麟,罗国安,等.长期酒精暴露对秀丽隐杆线虫生殖能力的损伤作用研究[J].中国当代医药,2013,20(9):13-15.
LI Nai-peng,LIANG Qiong-lin,LUO Guo-an,et al.Study of the reproductive injury of Caenorhabditis elegans induced by alcohol with a long-term exposure[J].China Modern Medicine,2013,20(9):13-15.
[25]邓茂先,吴德生,张立实,等.壬基酚对雌性SD大鼠早期性发育的影响[J].中国公共卫生,2002,18(2):147-148.
DENG Mao-xian,WU De-sheng,ZHANG Li-shi,et al.Effects of p-Nonylphenol on early sexual development in femals SD rat[J].China Public Health,2002,18(2):147-148.
[26]夏继刚,牛翠娟,高 颖,等.壬基酚长期暴露对斑马鱼雄鱼第二性征、精子活力的影响[J].生态毒理学报,2010,5(1):44-49.
XIA Ji-gang,NIU Cui-juan,GAO Ying,et al.Effects of long-term exposure to nonylphenol on secondary sexual characteristics and sperm motility of male zebrafish(Brachydanio rerio)[J].Asian Journal of Ecotoxicology,2010,5(1):44-49.
[27]Zhang L,Gibble R,Baer K N.The effects of 4-nonylphenol and ethanol on acute toxicity,embryo development,and reproduction in Daphniamagna[J].Ecotoxicology&EnvironmentalSafety,2003,55(3):330-337.
[28]Kortner T M,Arukwe A.The xenoestrogen,4-nonylphenol,impaired steroidogenesis in previtellogenic oocyte culture of Atlantic cod(Gadus morhua)by targeting the StAR protein and P450scc expressions[J].General and Comparative Endocrinology,2007,150(3):419-429.
[29]Hara Y,Strüssmann C A,Hashimoto S.Assessment of short-term exposure to nonylphenol in Japanese medaka using sperm velocity and frequency of motile spermp[J].Archives of Environmental Contamination and Toxicology,2007,53(3):406-410.
[30]Jr R H,Janz D M.Developmental estrogenic exposure in zebrafish(Danio rerio):I.Effects on sex ratio and breeding success[J].Aquatic Toxicology,2003,63(4):417-429.
[31]Arsenault J T,Fairchild W L,Maclatchy D L,et al.Effects of waterborne 4-nonylphenol and 17beta-estradiol exposures during parrsmolt transformation on growth and plasma IGF-I of Atlantic salmon(Salmo salar L.)[J].Aquatic Toxicology,2004,66(3):255-265.
[32]郑晓晶,张育辉.壬基酚对中国林蛙蝌蚪生长发育的毒性效应[J].生态学杂志,2008,27(8):1332-1336.
ZHENG Xiao-jing,ZHANG Yu-hui.Toxicity effects of nonylphenol on tadpoles Rana chensinensis growth and development[J].Chinese Journal of Ecology,2008,27(8):1332-1336.
[33]Loria P M,Hodgkin J,Hobert O.A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience,2004,24(9):2191-2201.
[34]Opperman C H,Chang S.Nematode acetylcholinesterases:Molecular forms and their potential role in nematode behavior[J].Parasitology Today,1992,8(12):406-411.
[35]Boyd W A,Cole R D,Anderson G L,et al.The effects of metals and food availability on the behavior of Caenorhabditis elegans[J].Environmental Toxicology&Chemistry,2003,22(12):3049-3055.
Study of toxicity of Caenorhabditis elegans exposed to nonylphenol solution
LI An1,2,PAN Li-gang1,2*,ZHANG Xiu-tong1,2,LIANG Gang1,2,MAN Yan1,2,JIN Xin-xin1,2
(1.Beijing Research Center for Agricultural Standards and Testing,Beijing 100097,China;2.Risk Assessment Lab of Agri-products Quality and Safety of Ministry of Agriculture(Beijing),Beijing 100097,China)
To better understand the effect of acute lethal toxicity and non-lethal toxicity on Caenorhabditis elegans exposed to nonylphenol solution,C.elegans were exposed to nonylphenol solution for 24 h and then toxicity indicators such as lethal concentration,development of a gonad arm,number of offspring,body length,and body bending frequency were investigated.Results showed that the median lethal concentration LC50for 24 h acute exposure was 8.09 mg·L-1when using L4 wild-type C.elegans as the testing animal.Nonylphenol can interfere with the normal development of the gonad arm of C.elegans.Compared with the control,both the 0.081 mg·L-1and 0.162 mg·L-1of nonylphenol treatment had significant effects on the number of offspring in C.elegans and the body length of the worm(P<0.05).The body bending frequency of C.elegans exposed to low doses of nonylphenol showed no statistical difference compared with the control(P>0.05),whereas high dose treatment showed significant difference(P<0.05).The results of the toxicity experiments indicate that the model animal C.elegans has certain sensitivity to nonylphenol.Thus,using C.elegans as a model animal has potential application value in the ecological toxicology of environmental hormones.
nonylphenol;Caenorhabditis elegans;ecological toxicology
2017-05-23 录用日期:2017-07-24
李 安(1985—),男,江西吉安人,助理研究员,从事风险评估与生化毒理研究。E-mail:lia@brcast.org.cn
*通信作者:潘立刚 E-mail:panlg@brcast.org.cn
北京市农林科学院科技创新能力建设专项(KJCX20150408)
Project supported:Special Projects of Construction of Science and Technology Innovation Ability of Beijing Academy of Agriculture and Forestry Sciences(KJCX20150408)
X503.22
A
1672-2043(2017)12-2414-07
10.11654/jaes.2017-0739
李 安,潘立刚,张秀彤,等.壬基酚溶液暴露对秀丽隐杆线虫的毒性研究[J].农业环境科学学报,2017,36(12):2414-2420.
LI An,PAN Li-gang,ZHANG Xiu-tong,et al.Study of toxicity of Caenorhabditis elegans exposed to nonylphenol solution[J].Journal of Agro-Environment Science,2017,36(12):2414-2420.
