与小麦三雌蕊基因(Pis1)连锁的SRAP标记研究
2018-01-08胡召杉杨在君彭正松
胡召杉,杨在君*,彭正松
(1.西华师范大学西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.西昌学院 农业科学学院,四川 西昌 615013)
与小麦三雌蕊基因(Pis1)连锁的SRAP标记研究
胡召杉1,杨在君1*,彭正松2
(1.西华师范大学西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.西昌学院 农业科学学院,四川 西昌 615013)
【目的】为了寻找与小麦三雌蕊基因Pis1连锁的分子标记。【方法】利用川麦28(CM28)与其三雌蕊近等基因系CM28TP杂交的F2群体为研究材料,采用SRAP分子标记技术,结合分组混合分析法(BSA)筛选与Pis1基因连锁的分子标记。【结果】①1936个SRAP引物组合在两亲本CM28和CM28TP中具有多态性的引物组合为224对,多态性引物比例为11.57 %;②利用三雌蕊池和正常池进一步筛选得到m2e36和m16e26 2个与Pis1基因连锁的SRAP标记;③利用218个F2分离群体检测,算出m2e36与Pis1基因的图距为18.22 cM,m16e26与Pis1基因的距离为22.63 cM,这2个分子标记分别位于Pis1 的两侧。【结论】该结果为进一步利用SRAP标记进行小麦基因定位奠定了基础。
小麦;三雌蕊性状;Pis1基因;SRAP标记
【研究意义】小麦是典型的复穗状花絮,其麦穗由多个小穗排列在主穗轴的两侧构成,而小穗又是由着生于小穗轴上的3~5朵小花组成。正常情况下,小花由2个稃片、2个浆片、3个雄蕊和1个雌蕊组成,每朵小花结一粒种子。陈济世先生最先在小麦中发现一朵小花结3粒种子的突变体,并将其命名为“三粒小麦”,但其亲本无法确定[1]。“三粒小麦”又称“多子房小麦”,它具有较多的可以在杂交小麦制种中利用的优良性状,如:穗粒数多,稃片开张,角度大等。彭正松教授等对“三粒小麦”进行了多年的田间选育,最后培育出“三雌蕊品系(Three pistils,TP)”。TP性状是由显性核基因Pis1控制,与细胞质遗传无关[2-3]。因此,TP与Murai等人[4]发现的雄蕊雌蕊化品系的遗传机制不同,且TP具有3个正常的雄蕊和3个可育的雌蕊,一朵小花能结3粒种子,显著增加了小麦的穗粒数,因而具有较高的育种学价值。利用微卫星标记(SSR)已将Pis1基因定位于2D染色体的长臂上(2DL),位于SSR标记Xgwm539和Xgwm349之间。但Pis1基因距离SSR标记Xgwm539和Xgwm349均较远,分别为:17.6和19.5 cM[5]。虽然TP的遗传基础基本清楚,但控制三雌蕊性状发生的Pis1基因的DNA序列信息尚不清楚。要准确克隆Pis1基因,最有效的方法就是图位克隆,而实施图位克隆的首要任务是找到与Pis1基因紧密连锁的分子标记。目前用于小麦基因定位的分子标记主要是SSR标记,但SSR标记在小麦基因组中数量有限无法满足基因的精细定位要求,因此必须在小麦中开发新的分子标记。【前人研究进展】SRAP(sequence-related amplified polymorphism)标记是Li等[6]开发的一种基于PCR技术的分子标记。SRAP标记具备RFLP、RAPD、SSR和AFLP 等分子标记的优点,同时也克服了上述分子标记的缺点,该分子标记不仅有效和可靠,且使用成本较低。SRAP标记在设计引物时正反引物分别针对DNA序列相对保守的外显子与变异较大的内含子、启动子与间隔序列,因此,多数SRAP标记在基因组中的分布是均匀的[7]。目前,SRAP标记已广范应用于遗传多样性研究[8-11],遗传图谱的构建[12-13]和基因克隆[14]等方面。然而,与小麦功能基因连锁的SRAP标记研究尚未见报道。【本研究切入点】本研究拟筛选与小麦三雌蕊基因Pis1连锁的SRAP标记。【拟解决的关键问题】为Pis1基因的克隆奠定基础,同时也为其它功能基因的定位提供新的更为有效的分子标记。
1 材料与方法
1.1 供试材料
本研究所用材料为小麦三雌蕊近等基因系CM28TP和其轮回亲本川麦28(CM28),以及CM28与CM28TP杂交后的F2群体。
1.2 试验方法
1.2.1 F2群体的构建 分别以CM28为母本和以CM28TP为父本配置杂交组合得到F1代种子。F1种植后套袋自交获得F2群体。亲本及F2群体的218个单株于2014年11月种植于西华师范大学生命科学学院实验田中,行距20 cm,株距10 cm,统一水肥管理。
1.2.2 性状调查 性状统计在小麦成熟期进行,若一朵小花能够结2粒或3粒种子则记为三雌蕊性状,若一朵小花只结1粒种子则记为正常雌蕊。
1.2.3 总DNA提取 采集亲本及F2群体单株的幼嫩叶片,用植物多糖多酚植物DNA提取试剂盒(LABGENE,瑞士)提取其总DNA。
1.2.4 构建BSA池 选取群体中的三雌蕊性状单株和正常雌蕊性状单株各10株,分别等量混合各株DNA,建立DNA三雌蕊池(P)和正常雌蕊池(N)。
1.2.5 SRAP标记分析 采用Li等[6]发表的引物,包括44条SRAP正向引物和44条SRAP反向引物,共1936对引物组合(表1)。引物由生工生物工程(上海)有限公司合成。PCR反应体系、程序、聚丙烯酰胺凝胶电泳及银染参照杨在君等[10]的方法。
1.2.6 数据统计 数据的统计以条带的有无作为区别不同基因型的标志,并根据标记在两亲本中的表现进行归类,将三雌蕊性状中出现的带型记为“a”,正常雌蕊中出现的带型记为“b”,缺失数据记为“-”。标记的命名采用引物组合的方式,如m16e26表示引物组合为Me16和Em26。
1.2.7 连锁分析 利用Mapmaker3.0,设置LOD≥3.0,对标记进行连锁分析,采用Kosambi函数将重组率转化为遗传距离。利用Mapdraw绘制连锁图[15]。
2 结果与分析
2.1 小麦三雌蕊性状的遗传分析
2.2 亲本间多态性标记的筛选
利用1936个SRAP引物组合(表1)对2个亲本CM28和CM28TP进行筛选。结果发现1936对引物组合中有1926对引物组合(99.5 %)在两亲本中能扩增出清晰的条带,条带主要分布在50~1000 bp之间。每对引物组合扩增出的条带数目不等,扩增最少的引物组合仅出现1个条带,如Me19-Em37;最多的扩增出21个条带,如Me22-Em2。大部分引物组合能扩增出3~9个条带。在1926对引物组合中有224对的扩增产物具有多态性,占所用引物的11.63 %。这224对引物组合共扩增出371个差异性条带。其中Me5-Em23产生的差异性条带最多为7条,大部分引物组合产生1~2条差异性条带。
2.3 Pis1基因定位
利用筛选出的224对在亲本间具有多态性的引物组合对三雌蕊池和正常池进行分析,其中引物组合Me2-Em36在三雌蕊DNA池中产生1条特异性条带(记为m2e36),Me16-Em26在正常雌蕊DNA池中产生1特异性条带(记为m16e26)。用建库的20个单株对2个标记进行验证,结果2个引物组合特异性明显,Me2-Em36引物组合在10个三雌蕊单株中,8株扩增出100 bp左右的特征条带;在10个正常雌蕊单株中,6株无该条带,4株有条带(图1)。Me16-Em26引物组合在10个正常雌蕊植株中,9株扩能增出1条约80 bp的特征条带,1株无条带;在10个三雌蕊单株中,9株无条带,1株有条带(图1)。利用Me2-Em36和Me16-Em26引物组合对F2群体218个单株进行PCR扩增,利用Mapmaker3.0计算遗传距离,Mapdraw绘制连锁图,结果表明m2e36与Pis1的遗传距离为18.22 cM,m16e26与Pis1的连锁距离为22.63 cM。这2个分子标记分别位于Pis1基因的两侧(图2)。

表1 正向和反向SRAP引物序列
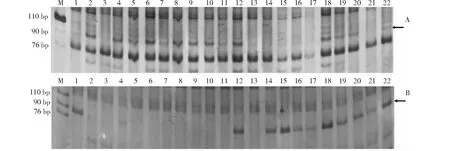
A:Em2-Me36扩增结果;B:Em2-Me36扩增结果;1:正常雌蕊DNA池;2:三雌蕊DNA池;3~12:三雌蕊单株;13~22:正常雌蕊单株A:The PCR results with primer Em2-Me36;B:The PCR results with primer Em2-Me36;1:Normal pistils DNA pools;2:Three pistils DNA pools;3-12:Three pistils plants;13-22:Normal pistils plants图1 Em2-Me36和Em16-Me26在三雌蕊池和正常雌蕊池及建池三雌蕊、正常雌蕊单株间的扩增结果Fig.1 PCR results of three pistils and normal pistils DNA pools, 10 three pistils plants and 10 normal pistils plants with primer Em2-Me36 and Em16-Me26
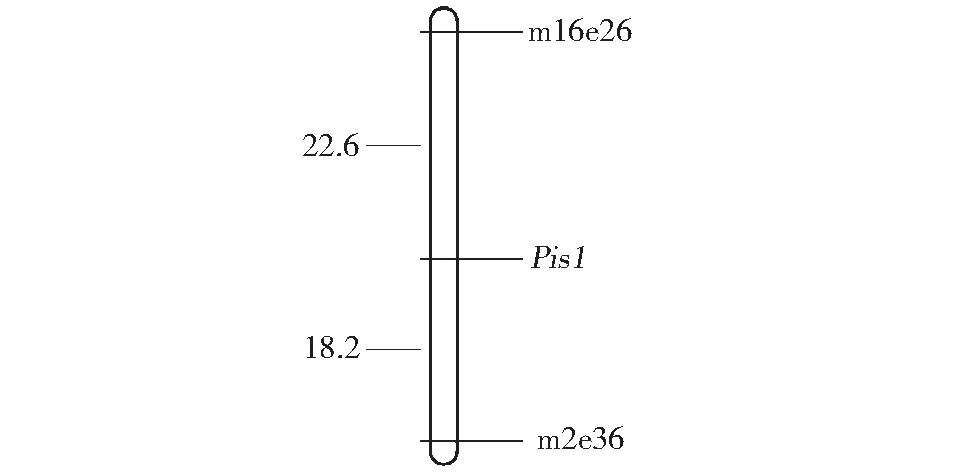
图2 Pis1基因与SRAP标记的连锁图谱Fig.2 A linkage map of Pis1 gene base on SRAP markers
3 讨论与结论
正常情况下,小麦一朵小花只结一粒种子,自陈济世先生发现“三粒小麦”(多子房)以来,由于其具有穗粒数多、稃片开张、角度大等特点,引起了众多学者的重视。沈光华等[16]利用小麦中国春单体和双端体定位分析后认为小麦多子房性状受2个同效异位隐性基因控制,且这2个基因分别位于5DS和6BS染色体上。武军等[17]认为,小麦的多子房性状是在三粒小麦细胞质存在的前提下,由1对显性核基因控制。马守才等对不同来源的多子房小麦材料研究后发现多子房性状既有显性基因,也有隐性基因控制,而且这些基因均位于6B染色体上[18-19]。彭正松教授等对“三粒小麦”进行了多年的田间选育,最后培育出“TP品系”。TP是由一对显性核基因控制,与细胞质遗传无关[2-3]。利用SSR分子标记已将控制三雌蕊性状的Pis1基因定位于2D染色体的长臂上,位于SSR标记Xgwm539和Xgwm349之间,距离Xgwm539 17.6 cM,距离Xgwm349 19.5 cM[5]。
由于小麦中SSR标记数量有限,很难利用SSR标记进行精细定位,因此必须在小麦中开发新的分子标记。SRAP标记是Li等[6]人开发的一种新型的分子标记,他曾利用SRAP标记在油菜(BrassicacampestrisL.)中发现了一个与恢复基因连锁的SRAP标记。王瑜等人[20]筛选到了一个与苜蓿(MedicagostivaL.)褐斑病(GLS)抗性基因连锁的SRAP标记。张媛等人[21]从苹果(MalusdomesticaB.)砧木中筛选出4个与苹果砧木的耐盐基因连锁的SRPA标记。王帅等[22]从亚洲百合(LiliumasiaticaHybrida)中筛选出一个与无粉性状连锁的SRAP标记。迄今为止国内外关于SRAP标记用于小麦功能基因定位的报道较少。本研究从1936个SRAP引物组合中筛选出224个多态性引物组合,多态性引物比例为11.57 %。这比黄瓜的多态性引物比例(34.9 %)低[23],这主要是由于本实验用于构建F2群体的亲本是一对小麦三雌蕊近等基因系CM28TP及其轮回亲本CM28。用三雌蕊池和正常池进一步筛选,得到m2e36和m16e26与Pis1基因连锁的SRAP标记。然后利用218个F2分离群体检测,算出m2e36与Pis1基因的图距为18.22 cM,m16e26与Pis1基因的距离为22.63 cM。
本研究虽然找到了2个与Pis1基因连锁的SRAP标记,但这2个标记距离Pis1基因仍较远。使用更多的SRAP引物组合和开发AFLP、SNP等标记,正在本实验继续进行,以寻找与Pis1基因紧密连锁的分子标记,达到把Pis1基因精细定位与图位克隆的目的。本研究虽然未能进一步精细定位Pis1基因,但开发出了与Pis1基因连锁的SRAP标记,并在染色体上标定出了SRAP标记的位置,这为进一步利用SRAP标记进行小麦的基因定位奠定了基础。
[1]陈济世,张岭华,吴秉礼.“三雌蕊小麦”的发现及选育初报[J].作物学报,1983,9(1):69-72.
[2]Peng Z S.A new mutation in wheat producing three pistils in a floret[J].Journal of Agronomy and Crop Science, 2003, 189: 270-272.
[3]Peng Z S, Yang J, Wei S H, et al.Characterization of common wheat (TriticumaestivumL.) mutation line producing three pistils in a floret[J].Hereditas, 2004, 141: 15-18.
[4]Murai K, Takumi S, Koga H, et al.Pistillody, homeotic transformation of stames into pistil-like structures, caused by nuclear-cytoplasm interaction in wheat[J].Plant Journal, 2002, 29: 169-182.
[5]Peng Z S,Martinek P, Kosuge K,et al.Genetic mapping of a mutant gene producing three pistils per floret in common wheat[J].Journal of Applied Genetics, 2008, 49: 135-139.
[6]Li G, Quiros C F.Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J].Theoretical and Applied Genetics, 2001, 103: 455-461.
[7]李巧燕,林瑞庆,朱兴全.SRAP分子标记及其应用概述[J].热带医学杂志,2006,6(4):467-469.
[8]Ferriol M, Picó B, Nuez F.Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP marker[J].Theoretical and Applied Genetics, 2003, 107(2): 271-282.
[9]Budak H, Shearman R C, Parmaksiz I, et al.Molecular characterization of buffalograss germplasm using sequence-related amplified polymorphism markers[J].Theoretical and Applied Genetics, 2004, 108: 328-334.
[10]杨在君,彭正松,周永红,等.利用SRAP分子标记评价小麦三雌蕊近等基因系的遗传背景[J].核农学报, 2012,26(1):22-27.
[11]黄如葵,黄熊娟,梁家作,等.利用辐射诱变及分子标记辅助筛选进行苦瓜种质创新[J].南方农业学报,2015,46(3):376-380.
[12]李媛媛,沈金雄,王同华,等.利用SRAP、SSR和AFLP标记构建甘蓝型油菜遗传连锁图谱[J].中国农业科学, 2007, 40(6):1118-1126.
[13]梁小玉,季 杨,白史且,等.基于SRAP分子标记构建的菊苣遗传连锁图谱[J].草业学报,2015,24(5):153-158.
[14]Li G, Quiros C F.Genetic analysis, expression and molecular characterization of BoGSL-ELONG, a major gene involved in the aliphatic glucosinolate pathway ofBrassicaspecies[J].Genetics, 2002, 162: 1937-1943.
[15]刘仁虎, 孟金陵.MapDraw,在Excel种绘制遗传连锁图的宏[J].遗传,2003,25(3):317-321.
[16]沈光华,童一中,沈革志.普通小麦多子房基因单体分析的染色体定位及双端体分析的染色体臂定位[J].遗传学报, 1992,19(6):513-516.
[17]武 军,李邦琴,赵继新.三雌蕊小麦多子房性状的遗传分析[J].西北农业大学学报,2000,28(6):58-60.
[18]马守才, 张改生.多子房性状应用于杂种小麦的研究Ⅰ多子房性状基因和细胞质效应[J].西北植物学报,2000,20(6):949-953.
[19]马守才,张改生,李红茹,等.小麦品系多Ⅱ多子房性状的遗传分析[J].麦类作物学报, 2006, 26(1):35-37.
[20]王 瑜,袁庆华,李向林,等.与苜蓿褐斑病(GLS)抗性基因连锁的SRAP标记研究[J].中国农业科学,2010,43(2):438-442.
[21]张 媛,孙叶红,李中勇,等.苹果砧木SRAP-PCR 反应体系的优化及耐盐性标记的筛选[J].分子植物育种,2016,14(1):210-215.
[22]王 帅,辛昊阳,甄 艳,等.一个与亚洲百合无花粉性状紧密连锁的SRAP标记[J].分子植物育种,2015,13(10): 2299-2304.
[23]邓思立,潘俊松,何欢乐,等.黄瓜M基因连锁的SRAP分子标记[J].上海交通大学学报(农业科学版),2006, 24(3): 240-244.
AnalysisofSRAPMarkersAssociatedwithThreePistilsGene(Pis1)inWheat
HU Zhao-shan1,YANG Zai-jun1*,PENG Zheng-song2
(1.Key Laboratory of Southwest China Resource Conservation (Ministry of Education), China West Normal University, Sichuan Nanchong 637009, China;2.College of Agricultural Sciences, Xichang College, Sichuan Xichang 615013, China )
【Objective】This paper aimed to identify the molecular markers linked to three pistils gene (Pis1) in wheat.【Method】The F2population produced by from the crossed of Chuanmai 28 (CM28) and its near isogentic line for three pistils CM28TP were used as materials. The molecular marker associated withPis1 was screened by bulked sergeant analysis (BSA) method and SRAP technology. 【Result】(i)224 pairs showed polymorphism among 1936 pairs of primer, the polymorphic percentage was 11.57 %; (ii) Two specific SRAP marker, m2e36 and m16e26 were found link toPis1 gene in three pistils and normal pistils DNA pool; (iii) After further analysis the 218 F2individuals foundPis1 gene located between the SRAP marker m2e36 and m16e26, 18.22cM distant from m2e36 and 22.63cM distant from m16e26. 【Conclusion】The results could offer the references for further mapping of wheat genes using SRAP markers.
Wheat; Three pistils character;Pis1 gene; SRAP markers
1001-4829(2017)12-2629-05
10.16213/j.cnki.scjas.2017.12.003
2017-01-20
国家自然科学基金项目(31760425);西华师范大学英才基金项目(17YC355)
胡召杉(1989-),女,在读硕士研究生,主要从事小麦遗传育种研究,E-mail: hzs20151209@163.com;*为通讯作者:杨在君,男,副教授,主要从事小麦遗传育种研究,E-mail: yangzaijun1@126.com。
S331
A
(责任编辑陈 虹)
