长链非编码RNA CASC19在结直肠癌中的表达及功能
2018-01-08王健君李晓敏钟树志彭彦霄
王健君,李晓敏,何 雷,钟树志,彭彦霄,季 娜
皖南医学院 1组织学与胚胎学教研室 2病理学教研室 3附属弋矶山医院病理科,安徽芜湖 241002
·论著·
长链非编码RNA CASC19在结直肠癌中的表达及功能
王健君1,李晓敏2,何 雷3,钟树志1,彭彦霄1,季 娜1
皖南医学院1组织学与胚胎学教研室2病理学教研室3附属弋矶山医院病理科,安徽芜湖 241002
目的探讨长链非编码RNA CASC19在结直肠癌中的表达、功能及临床意义。方法应用实时荧光定量PCR检测40对结直肠癌及相应癌旁正常组织中CASC19的表达,分析其表达与临床病理参数的关系;检测CASC19在5株结直肠癌细胞中的表达,应用小干扰RNA下调结直肠癌细胞中CASC19的表达,应用Transwell实验研究CASC19对结直肠癌细胞体外迁移的影响。结果CASC19在结直肠癌组织中的表达明显高于相对应的癌旁组织,差异具有统计学意义(t=5.527,P<0.000 1),其高表达与肿瘤的转移相关(P=0.044);下调CASC19的表达能够抑制体外培养的结直肠癌细胞的迁移能力。结论结直肠癌组织中CASC19的表达水平显著高于相应癌旁正常组织,CASC19的表达与患者的年龄、性别和肿瘤的部位、分化无相关性,而与肿瘤的大小、淋巴结转移及远处转移显著相关,提示CASC19的高表达可能促进结直肠癌的转移。
CASC19;结直肠癌;迁移;长链非编码RNA
结直肠癌是消化系统的常见肿瘤,其发病率和死亡率逐年上升,患者死亡的主要原因是肿瘤的转移。因此,阐明结直肠癌转移的分子机制,开发针对转移的靶向药物,对于提高结直肠癌患者的治愈率至关重要。然而,目前对结直肠癌转移的具体分子机制仍不完全清楚。已知在这一过程中涉及到多基因的异常表达,如BRAF基因的突变[1]、激活癌基因Ras[2]、抑癌基因P53的失活[3]等,这些基因都是编码蛋白的基因。近年来,通过基因芯片及二代测序技术发现在结直肠癌发生及转移过程中伴有非编码基因的异常表达。这些非编码基因包括小RNA、长链非编码RNA(long non-coding RNAs,lnc-RNAs)、环状RNA等,其中,lncRNAs是转录本长度超过200 bp的RNA分子,其能够在表观遗传、转录及转录后水平发挥作用[4],参与肿瘤的增殖、凋亡、分化、浸润和转移等过程,发挥癌基因或抑癌基因的作用。目前,大部分结直肠癌中异常表达的lncRNAs在大肠癌侵袭及转移过程中的功能和作用机制仍属未知。CASC19是新发现的长链非编码RNA,关于其功能研究报道较少。本研究探讨CASC19在结直肠癌中的表达、功能及其临床意义,以进一步揭示结直肠癌转移的分子机制。
材料和方法
标本收集皖南医学院附属弋矶山医院结直肠癌手术切除标本共40例,包括肿瘤组织和配对的癌旁组织。所有病例均为2015年7月至2016年3月由普通外科收治的结直肠癌患者,患者术前均未接受放、化疗,术后病理均证实为腺癌,且无其他肿瘤性疾病。
细胞株人结直肠癌细胞株LOVO、CACO2、DLD1、HCT8、RKO及永生化的正常结肠黏膜上皮细胞FHC均购自美国American type culture collection(ATCC)公司。用含10%胎牛血清的RPMI 1640培养基培养,置于37℃ 5%CO2孵箱内,当细胞生长的融合度为70%~80%时,取生长状态好的细胞用于实验。
RNA提取及逆转录使用TRIzol试剂提取结直肠癌组织总RNA,使用RNAisoTMPlus(Takara公司)提取细胞RNA,使用primeScriptTMRT Reagent Kit with gDNA Eraser(Takara公司)将RNA逆转录为cDNA。
实时荧光定量PCR使用BestarTMRealtime PCR Master Mix(SYBR Green法)(DBI公司)进行实时荧光定量PCR(real-time quantitative PCR,qRT-PCR),所用引物:CASC19:上游5’-CTCAGCATTTGCCATACTACAT- 3’,下游5’-TTCTAACCCAGGCACTCCAA- 3’;内参GAPDH:上游5’-GGAGCGAGATCCCTCCAAAAT- 3’,下游5’- GGCTGTTGTCATACTTCTCATGG- 3’;引物由北京睿博兴科生物技术有限公司合成。qRT-PCR反应程序为:95℃预变性2 min,95℃变性15 s,60℃退火、延伸34 s,40个循环,检测各样品的循环阈值(cycle threshold,Ct)。所有实验均重复3次,计算每个样本的平均ΔCt,ΔCt= CtCASC19-CtGAPDH。
Transwell体外迁移实验选取结直肠癌细胞株RKO和CACO2进行体外功能实验,应用小干扰RNA下调CASC19,小干扰RNA序列:正义链5’-AGAGA-TAACACTAACAAAG- 3’,反义链5’- CTTTGTTAGTGTTATCTCT- 3’,小干扰RNA由苏州吉玛公司设计合成,应用lipo2000转染细胞,转染后48 h提取细胞总RNA,逆转录进行实时荧光定量PCR证实干扰效率。转染后24 h以1×105/室接种细胞,72 h取出小室,应用吉姆萨染液染色后镜检穿出小室的细胞数。
统计学处理采用SPSS 23.0 统计软件(IBM)进行统计分析。癌组织与配对癌旁组织中CASC19的表达差异采用独立样本t检验比较;各细胞中CASC19的表达量分别用独立样本t检验与FHC细胞株中的表达量进行比较;癌组织中CASC19的表达水平与患者临床资料之间的关系采用χ2检验或Fisher精确概率法统计(CASC19的表达水平通过中位数分为高表达20例及低表达20例);Transwell 实验采用两个独立样本t检验分析;计量资料用均数±标准差表示,P<0.05为差异有统计学意义。
结 果
结直肠癌及相应癌旁正常组织CASC19的表达qRT-PCR结果显示40对结直肠癌组织中CASC19的表达水平显著高于相应癌旁正常组织(t=5.527,P<0.000 1)(图1)。
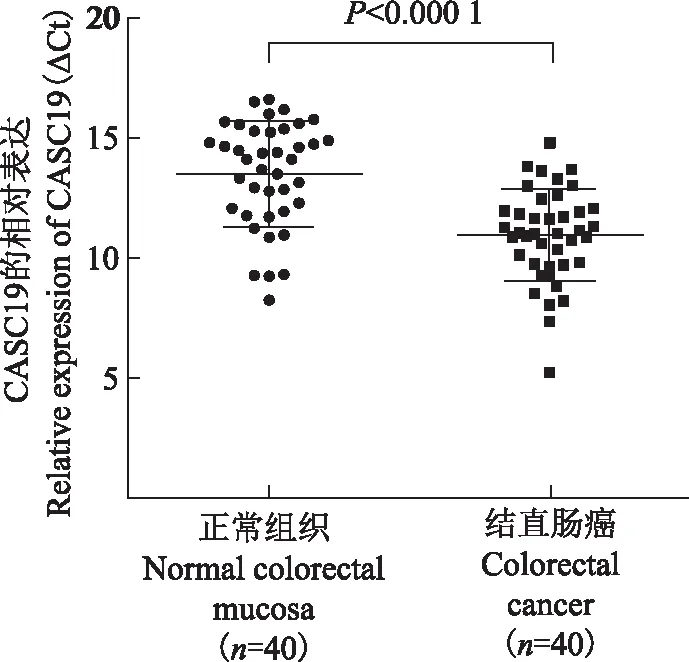
图1结直肠癌及相应癌旁正常组织CASC19的表达
Fig1CASC19 expressions at the mRNA level in colorectal cancer and paired normal colorectal mucosa
CASC19在结直肠癌组织中的表达水平与临床病理参数的关系统计分析显示,CASC19的表达水平与患者的年龄、性别和肿瘤的部位、分化无相关性
(P均>0.05);而与肿瘤的大小(χ2=5.013,P=0.025)、淋巴结转移(χ2=8.286,P=0.004)以及远处转移(χ2=5.625,P=0.044)呈正相关(表1);40例结直肠癌中8例伴有远处转移,其中1例为肺转移、1例为髂窝转移、6例伴肝转移,7例高表达CASC19,这7例中5例原发癌位于直肠、2例位于结肠。
CASC19在体外培养的结直肠癌细胞株中的表达qRT-PCR结果显示CASC19的表达在CACO2、RKO、LOVO、HCT8、DLD1和FHC细胞中逐渐降低,以FHC细胞为参照,两两比较结果显示,CASC19在5种结直肠癌细胞株LOVO(t=10.770,P=0.004 0)、CACO2(t=7.589,P=0.001 6)、DLD1(t=9.432,P=0.000 7)、HCT8(t=18.840,P<0.000 1)、RKO(t=8.140,P=0.001 2)中的表达均高于FHC细胞中的表达(图2)。
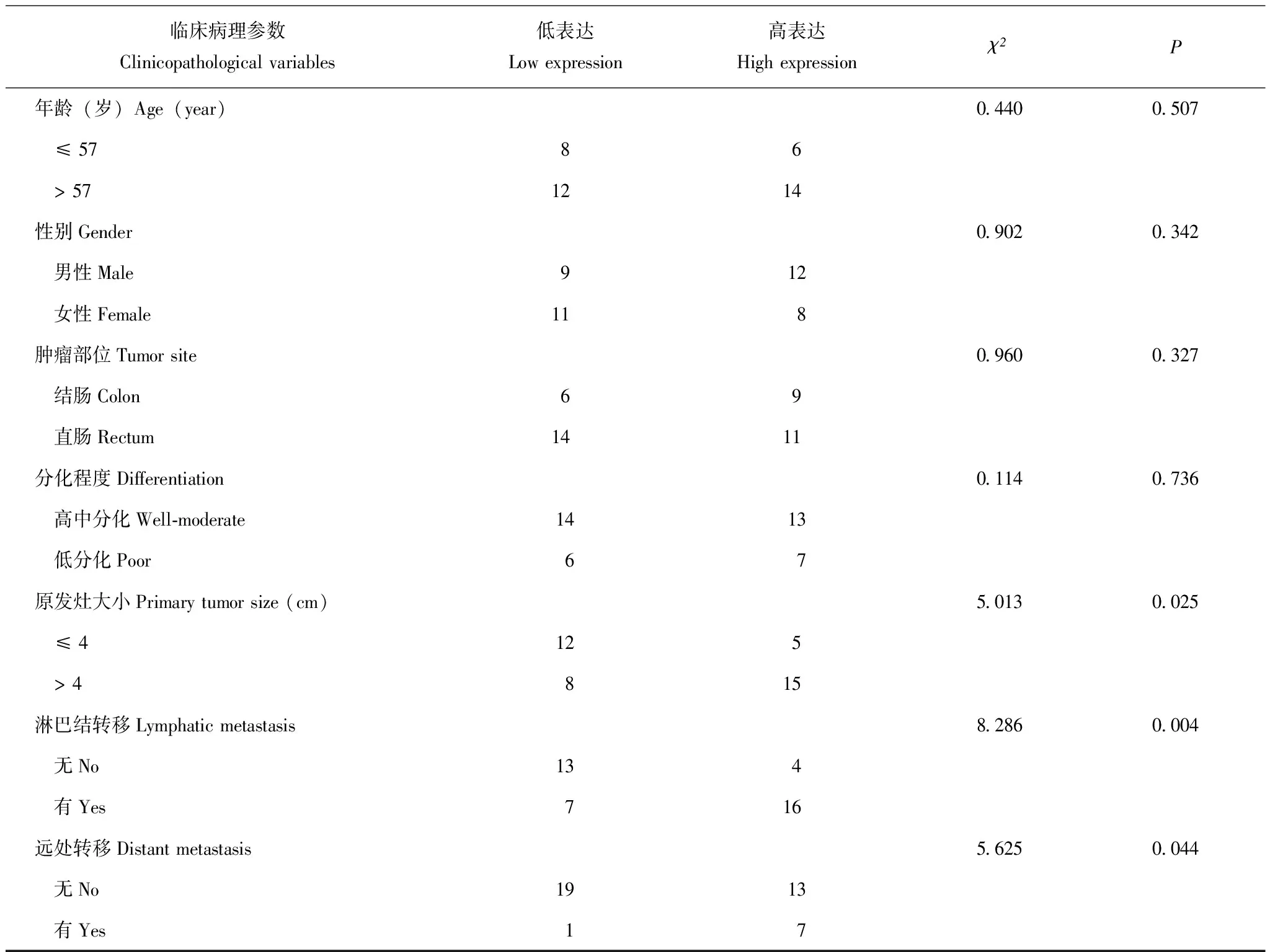
表 1 结直肠癌组织中CASC19的表达与各临床病理参数的相关性(n)Table 1 Correlations of clinicopathological features with CASC19 expression in colorectal cancer tissues(n)
CASC19促进结直肠癌细胞迁移根据CASC19在5种结直肠癌细胞株的表达水平,选取RKO及CACO2细胞,应用小干扰RNA下调CASC19的表达,应用qRT-PCR检测CASC19的表达,结果显示干扰后RKO(t=56.230,P< 0.000 1)和CACO2(t=22.200,P<0.000 1)细胞中CASC19的表达显著降低(图3)。通过Transwell体外迁移实验检测CASC19干扰后细胞迁移能力的改变,结果与对照组相比,CASC19表达下调后,RKO(t=8.782,P=0.000 9)和CACO2(t=14.900,P=0.000 1)的迁移能力明显下降(图4)。
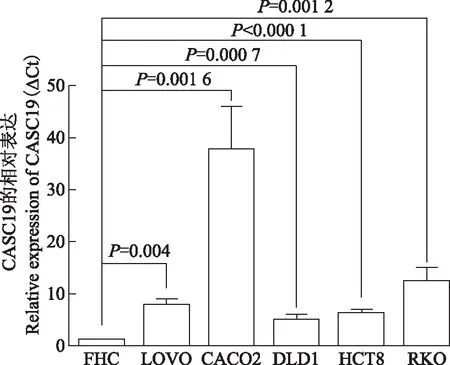
图2CASC19在结直肠癌细胞和正常结肠黏膜上皮细胞FHC中的表达
Fig2CASC19 expressions in colorectal cancer cell lines compared with the normal colorectal epithelium cell line FHC
讨 论
现代生物学研究显示,基因组中存在大量非编码RNA[5],其中许多在肿瘤发生发展中发挥重要作用[6]。其中lncRNAs是转录本长度超过200 bp的非编码RNA,由于其能够在表观遗传水平及转录前、转录后等多水平调控基因的剪接、表达、入核、基因的稳定性等,参与肿瘤的增殖、迁移、凋亡等过程,近几年备受关注。
由于二代测序技术及芯片技术的发展,越来越多的lncRNAs被发现,有研究表明在结直肠癌中也存在lncRNAs的异常表达,这些异常表达的lncRNAs的功能和机制大部分是未知的,仅有少数几个被研究。例如,转移相关性肺腺癌转录因子1在结直肠癌中高表达,其通过3’端的功能域促进结直肠癌的增殖、迁移及浸润,加速结直肠癌的发展及转移[7];HOX转录反义RNA通过促进结直肠癌上皮间质转化促进结直肠癌的浸润及转移,其高表达与结肠癌患者肿瘤的浸润深度、淋巴结转移、远处转移、分化、肿瘤分期呈正相关,可作为结直肠癌的预后指标[8];H19具有双重作用,在结直肠癌中能被c-Myc激活,参与c-Myc下游基因的调控,促进结直肠癌的发展[9],又能发挥抑癌基因的角色,在小鼠结肠癌肿瘤模型中敲除H19基因后,肿瘤生长、浸润及转移能力降低[10]。
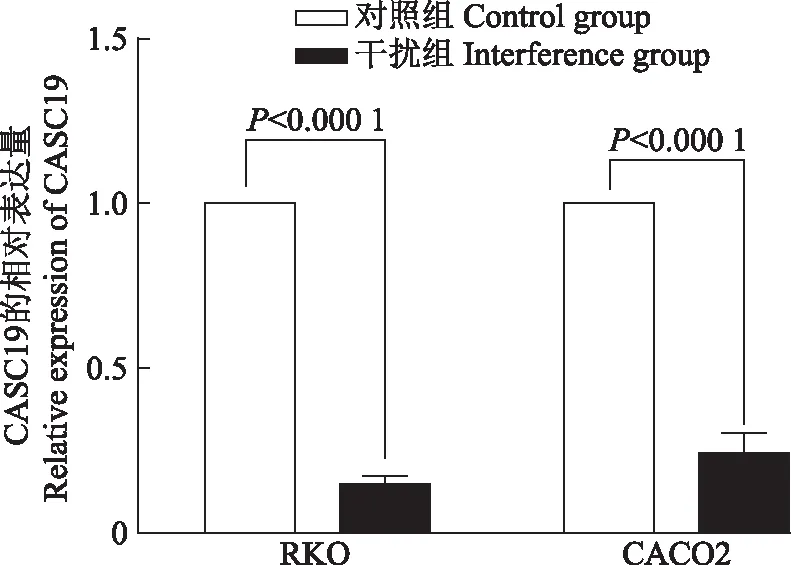
图3CASC19 小干扰RNA下调RKO和CACO2细胞中CASC19的表达
Fig3CASC19 expression was down-regulated by CASC19 small interfering RNA in RKO and CACO2 cells
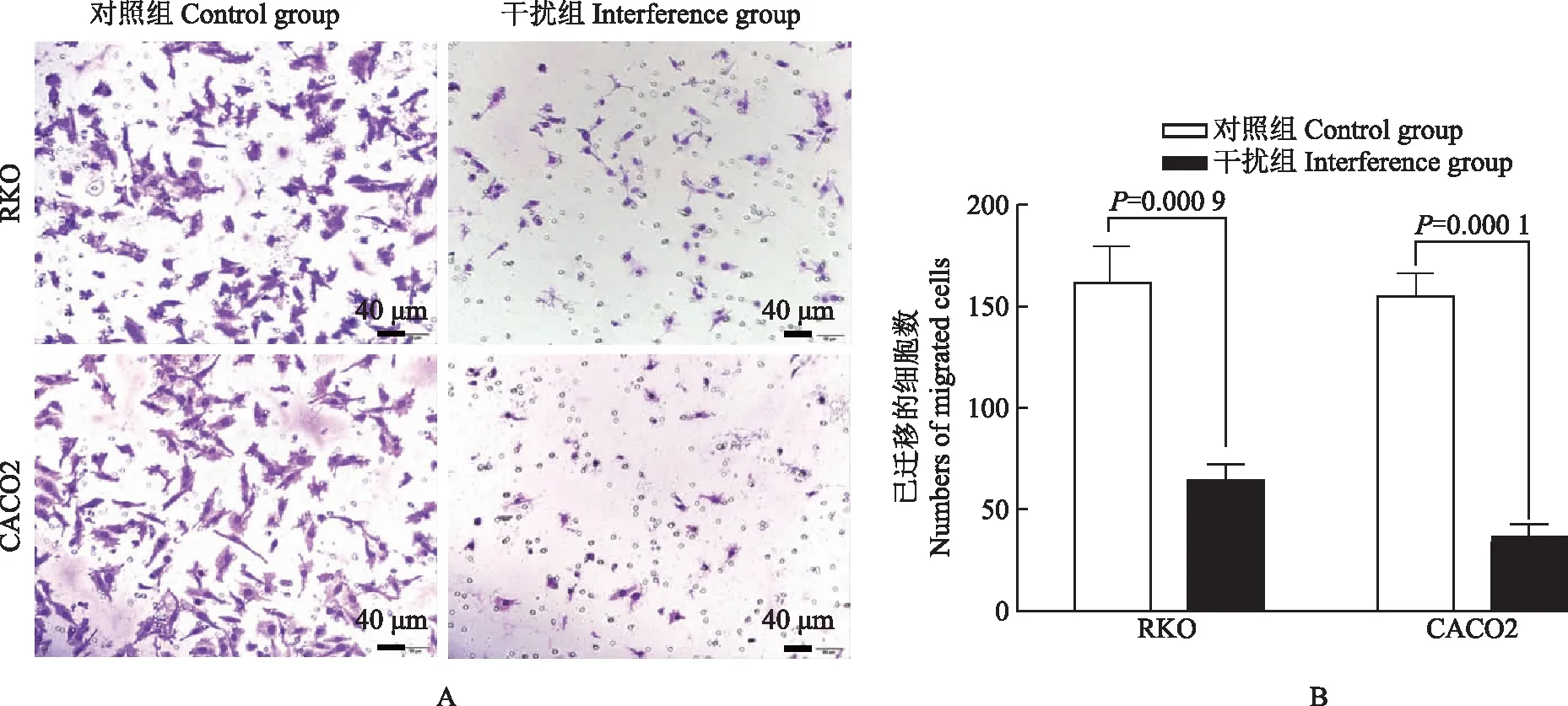
A.在RKO及CACO2细胞中沉默CASC19能够抑制细胞的迁移(吉姆萨染色);B. RKO及CACO2细胞已迁移的细胞数
A. representative photographs of CASC19-silence inhibit cell migration in RKO and CACO2 cells (Giemsa staining); B. the migration numbers of RKO and CACO2 cells
图4Transwell实验检测CASC19对结直肠癌细胞体外迁移的影响
Fig4Effect of CASC19 on colorectal cancer cell migrationinvitroby Transwell invasion assay
CASC19是新发现的一种lncRNAs,位于染色体8q24 区。有报道lncRNA作用机制依赖于他们的基因组位置,可以影响其附近基因的表达[11]。染色体8q24区有一重要的蛋白c-Myc,这一区域分布着很多lncRNAs,有研究表明这一区域的lncRNAs可以通过c-Myc促进肿瘤的发生发展[12]。例如,CCAT1可以被c-Myc 激活进而促进结肠癌增殖和浸润[13],CCAT2通过调控c-Myc转录和激活WNT通路促进结直肠癌、肺癌的浸润和转移[14- 15]。CCAT1-L调控c-Myc促进结直肠癌的浸润[16]。通过GEO数据分析显示结直肠癌CASC19存在异常表达。
本研究显示CASC19的表达水平在结直肠癌组织中显著高于相应癌旁正常组织,并且CASC19在结直肠癌组织中的表达与肿瘤的大小、淋巴结转移以及远处转移呈正相关。CASC19在5种结直肠癌细胞中的表达均高于正常结肠黏膜上皮细胞FHC中的表达,Transwell结果证实下调CASC19表达后可以抑制结直肠癌细胞的体外迁移能力,表明CASC19发挥促进结直肠癌生长和转移的作用,能够发挥癌基因的功能。对于CASC19的具体分子机制有待进一步实验揭示。
综上,lncRNA CASC19在结直肠癌增殖及转移中发挥重要作用,可为结直肠癌的靶向治疗提供新的思路。
[1] Cremolini C, Di Maio M, Petrelli F, et al. BRAF-mutated metastatic colorectal cancer between past and future [J]. Br J Cancer, 2015, 113(11): 1634-1635. doi: 10. 1038/bjc. 2015. 316.
[2] Luo F, Poulogiannis G, Ye H, et al. Wild-type K-ras has a tumour suppressor effect on carcinogen-induced murine colorectal adenoma formation[J]. Int J Exp Pathol, 2014, 95(1): 8- 15. doi: 10. 1111/iep. 12064.
[3] Bradner JE. Cancer: an essential passenger with p53[J]. Nature, 2015, 520(7549): 626- 627. doi: 10. 1038/nature14390.
[4] Zhang J, Zhang A, Wang Y, et al. New insights into the roles of ncRNA in the STAT3 pathway[J]. Future Oncol, 2012, 8(6): 723- 730. doi: 10. 2217/fon. 12. 52.
[5] Guttman M, Amit I, Garber M, et al. Chromatin signature reveals over a thousand highly conserved large non-coding RNAs in mammals[J]. Nature, 2009, 458(7235): 223- 227. doi: 10. 1038/nature07672.
[6] Prensner JR, Chinnaiyan AM. The emergence of lncRNAs in cancer biology[J]. Cancer Discovery, 2011, 1(5): 391- 407. doi: 10. 1158/2159- 8290. CD- 11- 0209.
[7] Xu C, Yang M, Tian J, et al. MALAT- 1: a long non-coding RNA and its important 3’ end functional motif in colorectal cancer metastasis[J]. Int J Oncol, 2011, 39(1): 169- 175. doi: 10. 3892/ijo. 2011. 1007.
[8] Wu ZH, Wang XL, Tang HM, et al. Long non-coding RNA HOTAIR is a powerful predictor of metastasis and poor prognosis and is associated with epithelial-mesenchymal transition in colon cancer[J]. Oncol Rep, 2014, 32(1): 395- 402. doi: 10. 3892/or. 2014. 3186.
[9] Barsyte-Lovejoy D, Lau SK, Boutros PC, et al. The c-Myc oncogene directly induces the H19 noncoding RNA by allele-specific binding to potentiate tumorigenesis[J].Cancer Res, 2006, 66(10): 5330- 5337. doi: 10. 1158/0008- 5472. CAN- 06- 0037.
[10] Yoshimizu T, Miroglio A, Ripoche MA, et al. The H19 locus actsinvivoas a tumor suppressor[J]. Proc Natl Acad Sci USA, 2008, 105(34): 12417- 12422. doi: 10. 1073/pnas. 0801540105.
[11] Loayza-Puch F, Agami R. Lncing protein translation to metastasis[J]. EMBO J, 2013, 32 (20): 2657- 2658. doi: 10. 1038/emboj. 2013. 210.
[12] Huppi K, Pitt JJ, Wahlberg BM, et al. The 8q24 gene desert: an oasis of non-coding transcriptional activity[J].Front Genet, 2012, 3: 69. doi: 10. 3389/fgene. 2012. 00069.
[13] He X, Tan X, Wang X, et a1. C-Myc-activated long non-coding RNA CCATl promotes colon cancer cell proliferation and invasion[J]. Tumour Biol, 2014, 35(12):1218l- 12188. doi: 10. 1007/s13277- 014- 2526- 4.
[14] Ling H, Spizzo R, Atlasi Y, et al. CCAT2, a novel noncoding RNA mapping to 8q24, underlies metastatic progression and chromosomal instability in colon cancer[J]. Genome Res, 2013, 23(9): 1446- 1461. doi: 10. 1101/gr. 152942. 112.
[15] Qiu M, Xu Y, Yang X, et al. CCAT2 is a lung adenocarcinoma-specific long non-coding RNA and promotes invasion of non-small cell lung cancer[J]. Tumour Biol, 2014, 35(6): 5375- 5380. doi: 10. 1007/s13277- 014- 1700-z.
[16] Xiang JF, Yin QF, Chen T, et al. Human colorectal cancer-specific CCAT1-L lncRNA regulates long-range chromatin interactions at the MYC locus[J]. Cell Res, 2014, 24(5): 513- 531. doi: 10. 1038/cr. 2014. 35.
ExpressionandFunctionofLongNon-codingRNACASC19inColorectalCancer
WANG Jianjun1,LI Xiaomin2,HE Lei3,ZHONG Shuzhi1,PENG Yanxiao1,JI Na11Department of Histology and Embryology,2Department of Pathology,3Department of Pathology,
Yijishan Hospital of Wannan Medical College,Wannan Medical College,Wuhu,Anhui 241002,China
LI Xiaomin Tel:0553- 3932468,E-mail:lxm1980326@sina.com
ObjectiveTo investigate the expression, function and significance of long non-coding RNA (lncRNA) CASC19 in colorectal cancer (CRC).MethodsReal-time quantitative polymerase chain reaction was employed to determine the expression of CASC19 in 40 paired samples from CRC surgical specimens and 5 CRC cell lines. The correlations of CASC19 expression with clinicopathologic parameters were analyzed. Transwell assay was applied to detect the migration ability of CRC cells after the CASC19 expression was knocked down by small interfering RNA.ResultsThe expression of CASC19 in colorectal cancer was significantly higher than those in adjacent normal mucosa tissues (t=5.527,P<0.000 1) and was associated with metastasis (P=0.044). Knockdown of CASC19 expression in CRC inhibited the migration ability of CRCinvitro.ConclusionsThe expression of CASC19 increases in CRC. CASC19 expression is not associated with age, gender, or tumor site/differentiation but with tumor size, lymph node metastasis, and distant metastasis, suggesting high CASC19 expression may promote CRC metastasis.
CASC19;colorectal cancer;migration;long non-coding RNA
ActaAcadMedSin,2017,39(6):756-761
李晓敏 电话:0553- 3932468,电子邮件:lxm1980326@sina.com
皖南医学院重点科研项目培育基金(WK2016Z01)、皖南医学院中青年科研基金自然科学类(WK201619)和安徽省高校自然科学基金 (KJ2017A250) Supported by the Wannan Medical College Key Research Projects (WK2016Z01),the Natural Sciences Youth Foundation of Wannan Medical College (WK201619),and the Natural Science Foundation of the Anhui Provincial High-Education Institutions(KJ2017A250)
R735.3
A
1000- 503X(2017)06- 0756- 06
10.3881/j.issn.1000- 503X.2017.06.004
2016- 12- 09)
