肝细胞肝癌组织精氨酸酶2和诱导型一氧化氮合酶的表达及与肿瘤血管形成的相关性
2018-01-08顾春燕邵建国陈丽燕
肖 锋, 顾春燕*, 邵建国, 钱 铮, 陈丽燕, 孙 艳
1. 南通市第三人民医院病理科,南通 226006 2. 南通市第三人民医院消化内科,南通 226006
·短篇论著·
肝细胞肝癌组织精氨酸酶2和诱导型一氧化氮合酶的表达及与肿瘤血管形成的相关性
肖 锋1, 顾春燕1*, 邵建国2, 钱 铮1, 陈丽燕1, 孙 艳1
1. 南通市第三人民医院病理科,南通 226006 2. 南通市第三人民医院消化内科,南通 226006
目的探讨精氨酸酶2(arginase-2, Arg-2)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)在肝细胞肝癌(hepatocellular carcinoma, HCC)中的表达及其与肿瘤血管形成的相关性。方法采用免疫组化方法检测158例HCC患者手术切除标本中Arg-2、iNOS的表达,抗CD34单克隆抗体显示血管内皮细胞。采用Image-Pro plus 6.2.1图像分析软件测定肿瘤微血管密度(microvessel density, MVD)。结果158例HCC中,Arg-2、iNOS的阳性表达率分别为73.4%(116/158)、83.5%(132/158)。Arg-2和iNOS在HCC组织中的表达正相关(r=0.474,P=0.000)。116例Arg-2阳性HCC组织的MVD为(283.92±130.69)/0.702 mm2,42例Arg-2阴性HCC组织的MVD为(129.25±51.00)/0.702 mm2,差异有统计学意义(P=0.000);132例iNOS阳性组织的MVD为(267±131.49)/0.702 mm2,26例iNOS阴性HCC组织的MVD为(116±41.85)/0.702 mm2,差异有统计学意义(P=0.000)。结论Arg-2与iNOS在HCC组织中的表达正相关,且与MVD相关,提示Arg-2与iNOS可能参与调节HCC中微血管的形成。
精氨酸酶2;诱导型一氧化氮合酶;肝细胞肝癌;微血管密度
精氨酸酶2(arginase-2, Arg-2)与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)均以精氨酸作为底物,高表达Arg-2能竞争性水解更多精氨酸,间接导致iNOS催化合成一氧化氮(nitric oxide, NO)减少[1]。NO能调节肿瘤血管生成,而肿瘤血管形成是肿瘤生长、转移的基础。Arg-2及iNOS蛋白的异常表达在多种恶性肿瘤中均有报道。本课题组前期研究[2-3]发现,Arg-2、iNOS在HCC组织中表达明显升高。但HCC中Arg-2与iNOS异常表达的相关性尚未明确;虽然iNOS活性的增高与肿瘤血管形成关系密切[4],但Arg-2是否与HCC肿瘤血管形成相关还未明确。因此,本研究探讨了Arg-2、iNOS在HCC中表达的相关性,以及两者与HCC形成肿瘤新生血管之间的关系。
1 资料与方法
1.1 一般资料 筛选我院2005年1月至2011年12月经手术切除的158例HCC患者。其中,男性133例,女性25例;年龄19~81岁,平均年龄(52.9±10.2)岁。158例患者有详细的临床资料,包括血清甲胎蛋白(AFP)水平、乙肝表面抗原(HBsAg)检测结果和病理检查结果。所有患者术前均未接受相关治疗,均经术后病理检查证实为HCC。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 主要试剂 兔抗人单克隆Arg-2抗体购自Santa Cruz公司,小鼠抗人单克隆iNOS抗体购自Abcam公司,CD34兔抗人单克隆抗体购自北京中杉金桥生物技术有限公司,二抗工作液及免疫组化显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学检测及结果判定 所有标本经4%中性甲醛固定,常规组织脱水、透明及浸蜡处理,以4 μm厚连续切片,具体步骤参照试剂盒说明书进行。免疫组化染色结果由两位高年资病理科医师在双盲条件下进行评定,实验均设阳性和阴性对照。染色结果以阳性细胞染色强度和阳性细胞所占百分比表示。在显微镜低倍镜(×40)下观察免疫组化染色情况;然后在高倍镜(×400)下观察,每例标本挑选5个视野,每高倍视野计数200个瘤细胞。按阳性细胞所占的百分比分为5个等级:小于5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;按阳性染色强度分为4个等级:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两组评分先相乘再相加后取平均值,综合评分分为:0~1分,阴性(-);2~4分,弱阳性(+);5~8分,中度阳性();9~12分,强阳性()4个等级。
1.4 微血管密度(microvessel density, MVD)测定 参考Bernardo等[5]报道的方法,在显微镜低倍镜(×100)下观察肿瘤结节内CD34免疫染色情况,选定CD34免疫染色最强的区域(热点区);根据肿瘤结节大小,选取2~5个视野,用Olympus BX-51显微镜(安装显微镜摄像头MD30)在200倍放大视野下采集大小为0.702 mm2的图像。采用Image-Pro plus 6.2.1软件分析MVD,以“免疫染色阳性区域计数/图像面积”作为MVD值,每例取平均值。
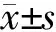
2 结 果
2.1 HCC组织中Arg-2和iNOS的表达情况及相关性 免疫组化染色显示: Arg-2阳性染色定位于HCC细胞的胞质,呈不均匀的颗粒状,部分病例高表达(图1A),部分低表达(图1B);iNOS阳性染色亦定位于HCC细胞的胞质,呈均匀的片状分布,部分病例高表达(图1C),部分低表达(图1D)。Spearman秩相关分析(表1)显示:Arg-2与iNOS表达正相关(r=0.474,P=0.000)。
2.2 HCC组织中Arg-2和iNOS的表达与MVD的相关性 免疫组化染色结果显示:微血管位于HCC癌细胞巢之间,呈纤细的分支状结构,部分病例MVD高(图1E),部分病例MVD低(图1F)。结果(表2)显示:Arg-2与iNOS表达阴性组MVD均明显低于阳性组,差异有统计学意义(P=0.000)。
3 讨 论
肿瘤血管形成是肿瘤生长、转移的基础。HCC血供丰富,故探讨HCC中微血管形成机制对进一步研究HCC生长、侵袭以及抗血管生成靶向治疗等方面的意义重大。
NO由iNOS催化底物精氨酸降解生成,在肿瘤血管形成中发挥重要的调节作用;这种调节作用与肿瘤组织局部产生NO的浓度大小以及肿瘤细胞自身对NO的敏感性有关[6]。在HCC等实体肿瘤中,肿瘤细胞、血管内皮细胞均能产生内源性NO,NO通过扩张肿瘤组织中的血管和促进肿瘤血管形成,进而保证肿瘤血供,维持肿瘤生长[7]。
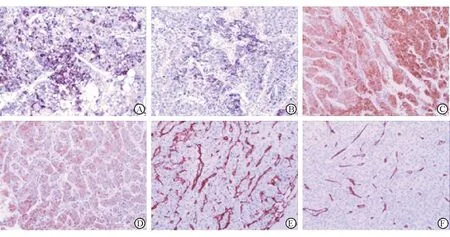
图1 免疫组织化学染色结果
A, B:Arg-2在HCC组织中的表达,高表达(A)、低表达(B);C, D:iNOS在HCC组织中的表达,高表达(C)、低表达(D);E, F:CD34在HCC组织中的表达,显示微血管密度,密度高(E)、密度低(F).Original magnification: ×200
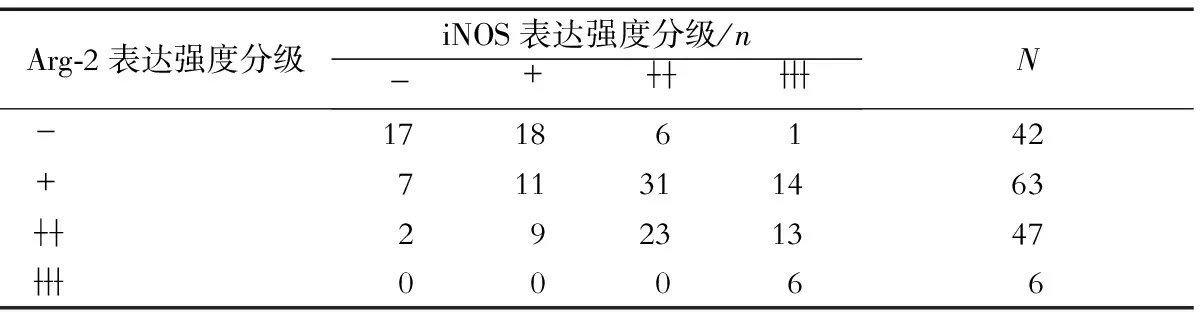
表1 HCC组织中Arg-2与iNOS蛋白表达相关性

表2 HCC组织中Arg-2、iNOS的表达与MVD的相关性
*P=0.000与同指标(-)相比
Arg是一种双核含锰的金属酶,其催化L-精氨酸水解成L-鸟氨酸和尿素,在生物体的新陈代谢中起重要作用。目前认为Arg存在两种形式的同工酶:Arg-1型和Arg-2型。两者大约有60%的氨基酸序列一致,主要区别在于各自的表达部位、染色体定位以及免疫反应性不同[8]。Arg-1也称为“肝型Arg”,在肝脏中有较高的生物学活性,能水解L-精氨酸,生成尿素和L-鸟氨酸,即尿素循环。Arg-1除参与尿素循环外,还参与催化合成精胺和亚精胺等多种细胞生长必需的代谢分子,影响细胞代谢水平和生长状态。Arg-2也称为“肝外Arg”,广泛分布于其他组织,如在肾脏、脑、小肠、前列腺、乳腺以及巨噬细胞中表达,不参与尿素循环,主要调控细胞内精氨酸的浓度,从而调控生物体内NO、脯氨酸、多胺等物质的合成[9-10]。
目前,Arg-1已常规应用于肝癌的临床诊断及鉴别诊断中[11-12]。而有关Arg-2与肝癌的研究目前国内外相对较少。本研究小组前期的研究[2]发现,Arg-2在正常肝组织及癌旁肝组织中均不表达,在HCC组织中表达明显升高,且与HCC组织学分级相关。
Arg-2与iNOS共用底物精氨酸。作为重要的代谢酶,Arg-2及iNOS蛋白在人类多种恶性肿瘤中均可被检测到。本研究发现,Arg-2的表达与iNOS的表达正相关,表明两者可能在HCC生物学进程中发挥协同作用,且在HCC中协同性低表达或高表达。在低表达模式下,底物精氨酸水解减少,精氨酸在HCC组织中蓄积,NO生成减少。高浓度的精氨酸可为肿瘤细胞增殖提供营养,促进肿瘤生长,而低浓度NO可调节肿瘤血管生成。在高表达模式下,Arg-2和iNOS竞争性作用于底物精氨酸,高表达的Arg-2同时消耗了底物精氨酸,使iNOS催化产生的NO减少,NO浓度降低[1]。由于高浓度NO不仅能对肿瘤细胞产生细胞毒作用,导致细胞凋亡,而且能阻断肿瘤新生血管的形成,抑制肿瘤细胞的生长[6],故Arg-2对于iNOS的这种竞争性抑制作用可能对HCC肿瘤细胞起到保护作用。iNOS与肿瘤微血管形成的相关性已有文献[4]报道。本研究结果显示:Arg-2表达阴性组MVD明显低于阳性组(P=0.000),表明Arg-2可能参与调节HCC微血管形成等过程。结果显示Arg-2可能通过间接调节NO浓度影响微血管形成,有待进一步研究。
综上所述,本研究明确了Arg-2与iNOS在HCC组织中表达的相关性,且Arg-2表达与MVD相关。与Arg-1影响肝细胞代谢和生长不同,Arg-2可能参与调节HCC中微血管的形成。肿瘤发生及进展是一个精确调控的过程,Arg-2与iNOS在HCC中表达对于微血管形成可能起到调控作用,具体机制仍有待进一步研究。
[ 1 ] SOUSA M S, LATINI F R, MONTEIRO H P, et al. Arginase 2 and nitric oxide synthase: Pathways associated with the pathogenesis of thyroid tumors[J]. Free Radic Biol Med, 2010, 49(6):997-1007.
[ 2 ] 肖 锋, 邵建国, 钱 铮, 等. 精氨酸酶2在肝细胞癌组织中的表达及临床意义[J].第二军医大学学报, 2013, 34(2):155-159.
[ 3 ] 许桐林, 肖 锋, 钱 铮, 等.诱导型一氧化氮合酶在肝细胞癌组织中的表达及临床意义[J]. 南通大学学报(医学版), 2016, 36(6): 521-524.
[ 4 ] MAYO J N, CHEN C H, LIAO F F, et al. Homocysteine disrupts outgrowth of microvascular endothelium by an iNOS-dependent mechanism[J]. Microcirculation, 2014, 21(6):541-550.
[ 5 ] BERNARDO V, LOURENCO S Q, CRUZ R, et al. Reproducibility of immunostaining quantification and description of a new digital image processing procedure for quantitative evaluation of immunohistochemistry in pathology[J]. Microsc Microanal, 2009, 15(4):353-365.
[ 6 ] VANNINI F, KASHFI K, NATH N. The dual role of iNOS in cancer[J]. Redox Biol, 2015, 6:334-343.
[ 7 ] MARROGI A J, TRAVIS W D, WELSH J A, et al. Nitricoxidesynthase, cyclooxygenase 2, and vascular endothelial growth factor in the angiogenesis of non-small cell lung carcinoma[J]. Clin Cancer Res, 2000, 6(12): 4739-4744.
[ 8 ] MUNDER M. Arginase: an emerging key player in the mammalian immune system[J]. Br J Pharmacol, 2009, 158(3): 638-651.
[ 9 ] ZHANG X, ZHANG J, ZHANG R, et al. Structural, enzymatic and biochemical studies on Helicobacter pylori arginase[J].Int J Biochem Cell Biol, 2013, 45(5):995-1002.
[10] CHOI S, PARK C, AHN M, et al. Immunohistochemical study of arginase 1and 2 in various tissues of rats[J]. Acta Histochem, 2012, 114(5):487-494.
[11] 顾春燕, 肖 锋, 钱 铮, 等. 精氨酸酶-1和磷脂酰肌醇蛋白聚糖-3联合检测在肝细胞癌鉴别诊断中的应用[J].中华消化杂志, 2014, 34(5): 321-324.
[12] 顾春燕, 肖 锋, 钱 铮, 等. 精氨酸酶-1在肝细胞癌中的低表达及其临床意义[J]. 中国癌症杂志, 2014, 24(6): 438-445.
Expressions of arginase-2 and inducible nitric oxide synthase in hepatocellular carcinoma and the relations to angiogenesis
XIAO Feng1, GU Chun-yan1*, SHAO Jian-guo2, QIAN Zheng1, CHEN Li-yan1, SUN Yan1
1. Department of Pathology, The Third People’ s Hospital of Nantong, Nantong 226006, Jiangsu, China 2. Department of Gastroenterology, The Third People’ s Hospital of Nantong, Nantong 226006, Jiangsu, China
Objective: To analyze the expressions of arginase-2 (Arg-2) and inducible nitric oxide synthase (iNOS) protein in hepatocellular carcinoma (HCC) and the relations to angiogenesis.MethodsThe expressions of Arg-2 and iNOS in tumor specimens from 158 postoperative patients with HCC were detected by using immunohistochemistry. The endothelial cells were immunostained with anti-CD34 antibody. The microvessel density (MVD) was quantified by Image-Pro plus 6.2.1 image analysis software.ResultsIn 158 HCC patients, the positive rates of Arg-2 and iNOS were 73.4% (116/158) and 83.5% (132/116), respectively. The expressions of Arg-2 and iNOS in HCC were positively correlated (r=0.474,P=0.000). The MVD was (283.92±130.69)/0.702 mm2in 116 HCC specimens with positive expression of Arg-2, and (129.25±51.00)/0.702 mm2in 42 HCC specimens with negative expression of Arg-2, and the difference was statistically significant (P=0.000). The MVD was (267±131.49)/0.702 mm2in 132 HCC specimens with positive expression of iNOS, and (116±41.85)/0.702 mm2in 26 HCC specimens with negative expression of iNOS, and the difference was statistically significant(P=0.000).ConclusionsThe expressions of Arg-2 and iNOS are positively correlated in HCC tissues, which are both related to MVD. These results suggest that Arg-2 and iNOS may be involved in regulating microvascular angiogenesis in HCC.
arginase-2; inducible nitric oxide synthase; hepatocellular carcinoma; microvascular density
2017-06-14接受日期2017-10-18
南通市前沿与关键技术创新项目(MS22015087),南通市卫计委青年科研基金(WQ2015034,WQ2016016). Supported by Nantong Frontier and Key Technology Innovation Project (MS22015087) and Youth Research Foundation of Nantong Health and Family Planning Commission (WQ2015034, WQ2016016).
肖 锋,硕士,主治医师. E-mail:xfeng_1981@163.com
*通信作者(Corresponding author). Tel: 0513-89093913, E-mail: guchunyan143@aliyun.com
10.12025/j.issn.1008-6358.2017.20170512
R 735.7
A
[本文编辑] 姬静芳
