CYP2C18基因多态性对瓣膜置换术后服用华法林剂量的影响研究*
2018-01-05刘寅强欧阳培刚张学玉张桂敏
刘寅强,欧阳培刚,罗 康,张学玉,张桂敏
(昆明医科大学第一附属医院心脏大血管外科 650032)
论著·临床研究
CYP2C18基因多态性对瓣膜置换术后服用华法林剂量的影响研究*
刘寅强,欧阳培刚,罗 康,张学玉,张桂敏
(昆明医科大学第一附属医院心脏大血管外科 650032)
目的探讨云贵高原汉族人群细胞色素P450(CYP)2C18、维生素K环氧化物还原酶复合体亚单位1(VKORC1)、CYP2C9的基因型分布情况及其基因多态性与华法林稳定剂量的相关性。方法以2011年1月至2014年1月在该院行瓣膜置换术后持续服用华法林抗凝治疗的云贵高原汉族患者176例为研究对象,采集静脉血检测各位点基因型,分析基因型及等位基因频率分布,以及基因多态性与华法林稳定剂量的相关性。结果各位点基因型及等位基因频率分布均符合Hardy-Winberg遗传平衡(P>0.05);CYP2C18(rs7896133)、VKORC1(rs9923231)、CYP2C9(rs1057910)、CYP2C9(rs4086116)基因位点的基因多态性与华法林稳定剂量相关(P<0.05)。结论云贵高原汉族患者CYP2C18(rs7896133)、VKORC1(rs9923231)、CYP2C9(rs1057910)、CYP2C9(rs4086116)基因多态性可能是华法林稳定剂量个体差异的影响因素。
多态性,单核苷酸;华法林;瓣膜置换术;CYP2C18
华法林是治疗许多心血管疾病的一线抗凝药物,特别对于瓣膜置换患者而言,目前仍然是首选的瓣膜术后长期口服抗凝药物。但华法林的药效存在明显的个体差异,服药中会出现抗凝过量出血或抗凝不足致血栓形成等严重并发症[1-2]。近年的研究认为,某些相关基因的多态性是决定其药效个体差异的主要原因[3-4]。国内外研究表明,维生素K环氧化物还原酶复合体亚单位1(VKORC1)、细胞色素P450(CYP)2C9基因多态性与华法林用药剂量的个体差异密切相关[5-8],但对于云贵高原地区的汉族人群,CYP2C18基因多态性的相关研究则较少。为了解CYP2C18等位基因及基因型在高原汉族人群中的分布频率,以及其基因多态性对华法林稳定剂量的影响,笔者对中国云贵高原汉族人群上述各位点基因多态性进行分析,现报道如下。
1 资料与方法
1.1一般资料 以176例云贵高原地区汉族患者为研究对象,患者均于2011年1月至2014年1月在本院心脏大血管外科行瓣膜置换术,其中双瓣置换术60例、主动脉瓣置换术52例、二尖瓣置换术64例,术后均以华法林作为口服抗凝药持续治疗3个月以上。患者平均身高(1.64±0.71)m,平均年龄(44.44±12.33)岁,平均体质量(59.19±11.03)kg,其中男82例、女94例。以国际标准比值(INR)1.5~2.5作为抗凝强度标准,所有患者随访3~24个月;两次复查INR值达到预定抗凝标准,记录华法林日维持剂量、凝血酶原时间(PT)、INR值等指标。入选患者均未服用影响华法林疗效指标的药物,肝肾功能指标均无异常[2,4]。本研究通过昆明医科大学伦理委员会审核,并取得患者知情同意。
1.2方法
1.2.1样品采集与DNA提取 采集患者静脉血3 mL,置于枸橼酸钠抗凝管中,全血3 000 r/min离心10 min,弃上层血浆,沉淀细胞,分装,基因组试剂盒提取DNA,-20 ℃保存。
1.2.2Snapshot技术基因测序 明确基因位点,设计引物扩增位点片段,引物由上海捷瑞公司合成。PCR仪型号为:东胜·龙(EDC-810);taq酶、DNTP为Fermentas公司产品。多重PCR反应体系含1 μL模板DNA,1.5 μL 25 mmol/L氯化镁(MgCl2),1.5 μL 10×缓冲液,0.3 μL DNTP,0.3 μL Taq聚合酶,0.15 μL引物混合,补水至15 μL。扩增条件:95 ℃ 3 min,94 ℃ 15 s,60 ℃ 15 s ,-0.5 ℃,11个循环;72 ℃ 30 s,94 ℃ 15 s,54 ℃ 15 s,72 ℃ 30 s,72 ℃ 3 min,24个循环,扩增后取3 μL PCR产物用ExoI和Sap纯化,主要去除反应产物中的引物及DNTP。37 ℃ 45 min,80 ℃ 15 min,纯化后进行延伸反应,预先混入延伸引物。延伸反应体系:Snapshot Mix试剂1 μL,PCR产物2 μL,延伸引物混合2 μL,补水至6 μL,96 ℃ 1 min,96 ℃ 10 s,52 ℃ 5 s,30个循环。取1 μL延伸产物,加8 μL上样,95 ℃变性3 min,立即冰水浴[2,4]。研究随机抽取10%样品进行重复检验。测序仪型号为ABI 3730XL。
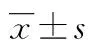
2 结 果
2.1等位基因和基因型分布频率 患者等位基因频率和基因型频率分布符合Hardy-Weinberg平衡(P>0.05),见表1。

表1 瓣膜置换术患者基因型与等位基因频率 [n=176,n(%)]
2.2基因多态性与华法林稳定剂量的相关性 VKORC1(rs9923231)、CYP2C9(rs1057910)、CYP2C9(rs4086116)、CYP2C18(rs7896133)相同基因位点不同基因型华法林稳定剂量比较,差异均有统计学意义(P<0.05),见表2。华法林稳定剂量与VKORC1(rs9923231)、CYP2C9(rs1057910)、CYP2C9(rs4086116)、CYP2C18(rs7896133)基因位点相关(P<0.05),见表3。
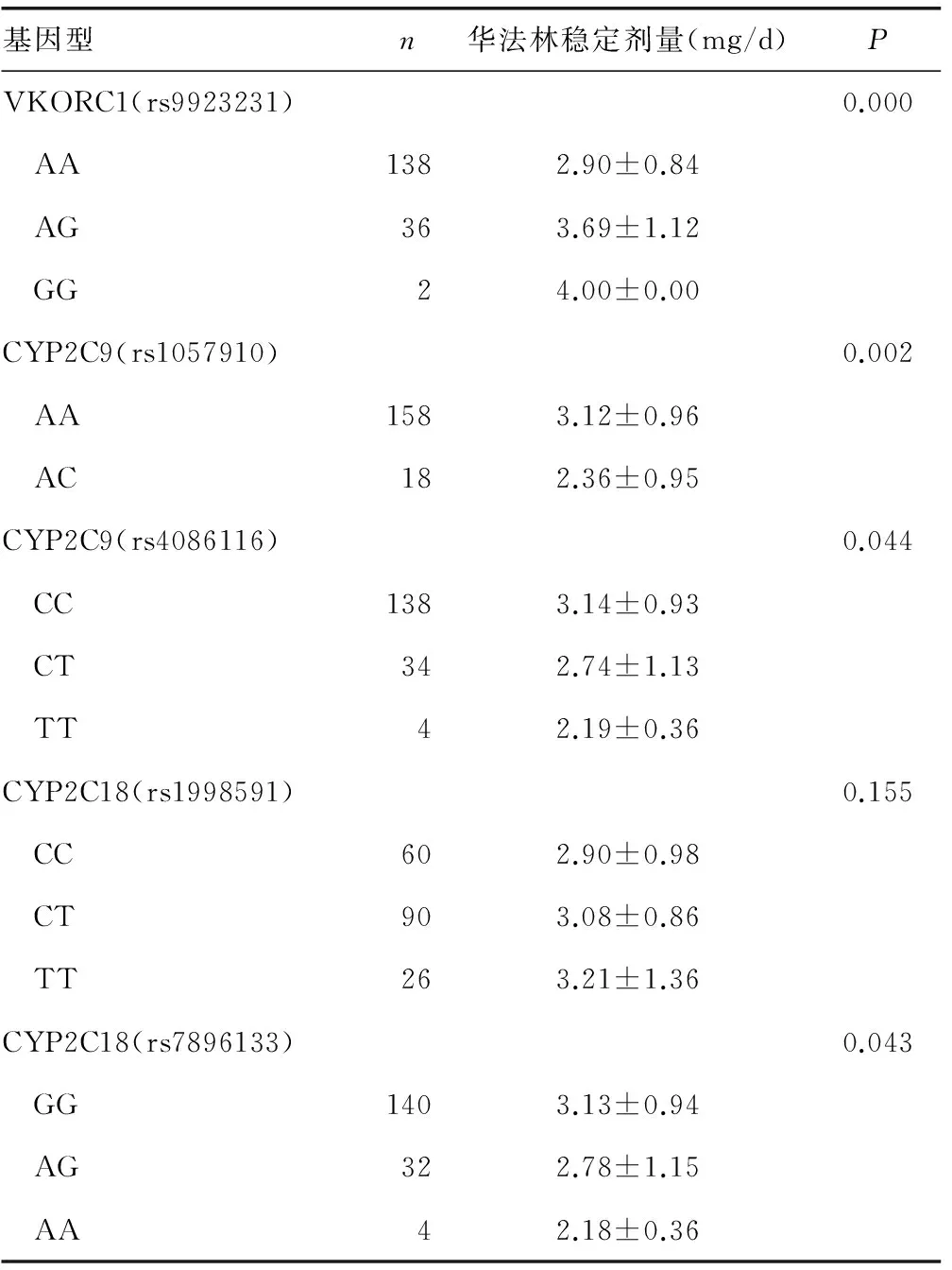
基因型n华法林稳定剂量(mg/d)PVKORC1(rs9923231)0.000 AA1382.90±0.84 AG363.69±1.12 GG24.00±0.00CYP2C9(rs1057910)0.002 AA1583.12±0.96 AC182.36±0.95CYP2C9(rs4086116)0.044 CC1383.14±0.93 CT342.74±1.13 TT42.19±0.36CYP2C18(rs1998591)0.155 CC602.90±0.98 CT903.08±0.86 TT263.21±1.36CYP2C18(rs7896133)0.043 GG1403.13±0.94 AG322.78±1.15 AA42.18±0.36
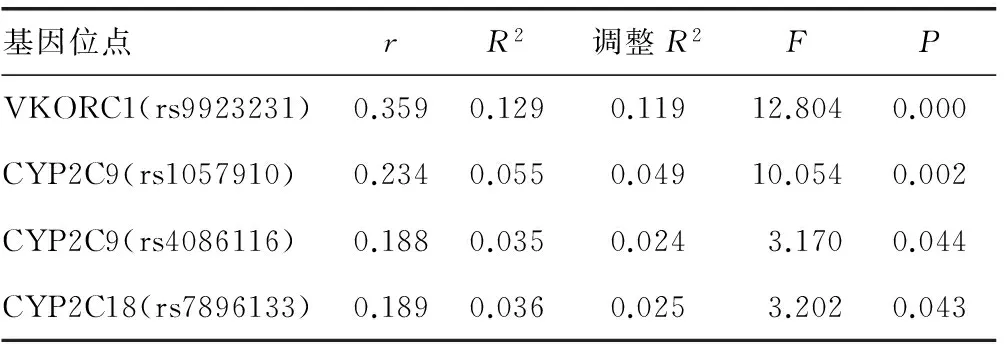
表3 基因多态性与华法林稳定剂量的单因素相关性分析
3 讨 论
机械瓣膜置换患者术后需要终生口服华法林进行抗凝治疗,但华法林治疗窗窄,个体用药差异大,容易导致出血栓塞等严重并发症。近年来国内外研究表明,基因多态性与华法林剂量有重要的相关性[3-4]。目前,国内研究主要集中在VKORC1和CYP2C9两个基因位点,对云贵高原汉族人群CYP2C18的相关研究较少。
本研究对云贵高原汉族人群CYP2C18(rs7896133)、CYP2C18(rs1998591)、VKORC1(rs9923231)、CYP2C9(rs4086116)、CYP2C9(rs1057910)各基因位点的多态性,及其与华法林稳定剂量的相关性进行分析。结果显示,等位基因频率和基因型分布符合Hardy-Weinberg平衡(P>0.05)。其中VKORC1、CYP2C9基因型及其分布频率国内外已有大量研究,亚裔人群中其基因型及基因分布频率与本次研究结果基本一致[9-11],证实云贵高原汉族人群上述基因位点基因多态性无特殊变异。其中CYP2C18(rs7896133) AA、AG、GG各基因型频率分别为2.3%、18.2%、79.5%,G和A等位基因频率分别为88.6%、11.4%,A为次要等位基因,其次要等位基因频率高于文献[12]报道的欧美人群CYP2C18(rs7896133)次要等位基因频率(5.6%),以及文献[13]报道的中国台湾地区人群该基因位点次要等位基因频率(7.1%)。其中,云贵高原地区汉族人群与欧美人群基因变异的差异性大于与中国台湾地区人群比较,表明高原地区汉族人群的基因变异可能既与种族差异有关,也与海拔高度、环境因素及生活方式等因素相关,影响因素越多,其差异性可能越大。本研究结果还显示,CYP2C18(rs1998591) TT、CT、CC基因型分布频率分别为14.8%、51.1%、34.1%,C和T等位基因频率分别为59.7%、40.3%,T为次要等位基因。目前,对CYP2C18(rs1998591)基因多态性的研究国内外均较少,本研究以云贵高原汉族人群为研究对象探讨该基因位点多态性,补充了该基因位点多态性研究在云贵高原汉族人群的资料。
VKORC1、CYP2C9等基因国内外已经有大量研究,其基因多态性与华法林日维持剂量相关[9-11],与本研究结果基本一致。经过基因测序发现,CYP2C18(rs1998591)的基因多态性与华法林稳定剂量无明显相关性(P>0.05)。而CYP2C18(rs7896133)基因位点GG、AG、AA基因型华法林稳定剂量分别为(3.13±0.94)、(2.78±1.15)、(2.18±0.36)mg/d,其中AA基因型华法林日稳定剂量低于AG及GG基因型,GG基因型华法林日稳定剂量最高,差异有统计学意义(P<0.05),CYP2C18(rs7896133)基因多态性与华法林日稳定剂量相关(P<0.05),该位点可以解释3.6%的华法林剂量差异,G基因突变与华法林高剂量相关,A基因突变与华法林低剂量相关。Wadelius等[12]报道,单因素分析显示在欧美人群中该位点可解释7.4%的华法林剂量差异(P<0.01),可以看出欧美人群CYP2C18(rs7896133)位点对华法林稳定剂量可能有更大的影响,这可能与种族差异相关。Lee等[13]对中国台湾人群研究显示,A基因型突变与华法林低剂量相关,而G基因型突变与华法林高剂量相关,与本研究云贵高原地区汉族人群具有一致性,亦表明CYP2C18(rs7896133)基因多态性是导致华法林稳定剂量差异的影响因素,并且在平原与高原地区亚裔人群均存在。对CYP2C18(rs1998591)基因测序发现,云贵高原汉族人群该位点基因多态性对华法林稳定剂量无明显影响。
CYP2C18源自于CYP2家族,CYP2参与华法林的体内代谢活动,其活性降低可以减缓华法林的体内代谢,导致华法林在体内的有效血药浓度升高,从而增强其抗凝效果[5-6,14]。本研究初步得出云贵高原汉族人群CYP2C18(rs7896133)、VKORC1(rs9923231)、CYP2C9(rs4086116)、CYP2C9(rs1057910)基因多态性与华法林稳定剂量的差异相关,可能是导致个体间华法林稳定剂量差异的重要因素。但由于本研究观察时间有限且样本量较小,还需要扩大样本量并延长观察时间,以进一步明确研究结果。
[1]Holbrook A,Schulman S,Witt DM,et al.Evidence-based management of anticoagulant therapy:antithrombotic therapy and prevention of thrombosis,9th ed:American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J].Chest,2012,141(2 Suppl):S152-184.
[2]刘寅强,杨百晖,夏建明,等.GGCX(rs6738645)基因多态性与华法林稳定剂量的关系[J].重庆医学,2014,43(10):1184-1186.
[3]Danese E,Montagnana M,Johnson JA,et al.Impact of the CYP4F2 p.V433M polymorphism on coumarin dose requirement:systematic review and meta-analysis[J].Clin Pharmacol Ther,2012,92(6):746-756.
[4]刘寅强,杨百晖,夏建明,等.钙腔蛋白(rs2290228)基因多态性与华法林稳定剂量的关系[J].天津医药,2013,41(4):304-306.
[5]Qiu JX,Zhou ZW,He ZX,et al.Estimation of the binding modes with important human cytochrome P450 enzymes,drug interaction potential,pharmacokinetics,and hepatotoxicity of ginger components using molecular docking,computational,and pharmacokinetic modeling studies[J].Drug Des Devel Ther,2015,9:841-866.
[6]Yang Y,Peter I,Scott SA.Pharmacogenetics in Jewish populations[J].Drug Metabol Drug Interact,2014,29(4):221-233.
[7]Lund K,Gaffney D,Spooner R,et al.Polymorphisms in VKORC1 have more impact than CYP2C9 polymorphisms on early warfarin International Normalized Ratio control and bleeding rates[J].Br J Haematol,2012,158(2):256-261.
[8]Huang SW,Xiang DK,Huang L,et al.Influence of GGCX genotype on warfarin dose requirements in Chinese patients[J].Thromb Res,2011,127(2):131-134.
[9]刘建兴,李文慧,陈智豫,等.云南汉族人群VKORCI 3730A/G基因多态性与华法林抗凝治疗维持剂量的相关性[J].广东医学,2012,33(20):3073-3076.
[10]胡静,朱君荣,于锋.华法林抗凝个体化治疗研究进展[J].中国临床药理学与治疗学,2014,19(3):591-595.
[11]孟彦宏,贾政,赵磊.VKORCI基因多态性的检测及其与华法林稳定剂量的相关性[J].陕西医学杂志,2014,43(12):1576-1578.
[12]Wadelius M,Chen LY,Eriksson N,et al.Association of warfarin dose with genes involved in its action and metabolism[J].Hum Genet,2007,121(1):23-34.
[13]Lee MT,Chen CH,Chou CH,et al.Genetic determinants of warfarin dosing in the Han-Chinese population[J].Pharmacogenomics,2009,10(12):1905-1913.
[14]Kim SY,Kang JY,Hartman JH,et al.Metabolism of R- and S-warfarin by CYP2C19 into four hydroxywarfarins[J].Drug Metab Lett,2012,6(3):157-164.
ResearchoninfluencingofCYP2C18genepolymorphismonwarfarindoseaftervalvereplacementsurgery*
LiuYinqiang,OuyangPeigang,LuoKang,ZhangXueyu,ZhangGuimin
(DepartmentofCardiacVascularSurgery,FirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming,Yunnan650032,China)
ObjectiveTo investigate the CYP2C18,VKORC1 and CYP2C9 genotype distribution situation and the correlation between their polymorphism with warfarin stable dose.MethodsA total of 176 Yungui plateau Han patients with continuously warfarin anticoagulation therapy after valve replacement in this hospital from January 2011 to January 2014 served as the research subjects.The venous blood was collected for detecting genotypes at various loci.The genotype and allele frequency distribution were analyzed,and the correlation between the gene polymorphism with warfarin stable dose was analyzed.ResultsThe genotypes and allele frequencies at various loci conformed to the Hardy-Winberg genetic balance (P>0.05).The polymorphisms of CYP2C18(rs7896133),VKORC1 (rs9923231),CYP2C9(rs1057910) and CYP2C9(rs4086116) gene loci were correlated with warfarin stable dose (P>0.05).ConclusionThe gene polymorphism of CYP2C18(rs7896133),VKORC1 (rs9923231),CYP2C9(rs1057910) and CYP2C9(rs4086116) in Yungui plateau Han patients may be the influence factors which contribute to warfarin stable dose personalized difference.
polymorphism,single nucleotide;warfarin;valve replacement surgery;CYP2C18
10.3969/j.issn.1671-8348.2017.35.024
云南省科技厅-昆明医科大学应用基础研究联合专项资金项目(201501UH00141)。
刘寅强(1980-),副主任医师,博士,主要从事胸心外科疾病抗凝研究。
R654.2
A
1671-8348(2017)35-4974-03
2017-06-18
2017-09-11)
