含精氨酰-甘氨酰-天冬氨酰环两亲性肽自组装凝胶与骨髓间充质干细胞相容性研究*
2018-01-05肖仁顺蒋星海王晓梅宋玉林
肖仁顺,阮 宏,蒋星海,吴 凯,王晓梅,宋玉林
(南昌大学第二附属医院骨科,南昌 330006)
论著·基础研究
含精氨酰-甘氨酰-天冬氨酰环两亲性肽自组装凝胶与骨髓间充质干细胞相容性研究*
肖仁顺,阮 宏,蒋星海,吴 凯,王晓梅,宋玉林△
(南昌大学第二附属医院骨科,南昌 330006)
目的分析骨髓间充质干细胞(BMSCs)与两亲性肽三维凝胶的相容性。方法取3周龄SD健康大鼠3只,分离股骨、胫骨获取BMSCs,采用流式细胞术检测BMSCs表面抗原;将10 mg/mL含精氨酰-甘氨酰-天冬氨酰(RGD)环两亲性肽溶液加入等体积 DMEM/F12培养基数秒后自组装成三维凝胶,透射电镜显微镜(TEM)下观察三维凝胶结构;1×106cells/mL BMSCs悬液与RGD环两性亲肽混合形成三维培养体系,1×106cells/mL BMSCs悬液与多聚赖氨酸混合形成二维培养体系,无血清培养;CCK-8法观察细胞生长情况,钙黄绿素乙酰氧基甲酯/碘化丙啶(PI)双标染色,荧光显微镜观察RGD环两性亲肽对BMSCs增殖的影响。结果分离培养的细胞高表达CD29、CD90,不表达或低表达CD34、CD45;TEM显示凝胶由多空纳米纤维构成,纳米纤维直径2~5 nm,长度100~1 000 nm;质谱测得合成多肽相对分子质量为1 256.37,与理论值一致;高效液相色谱分析两性亲肽纯度为95.88%;钙黄绿素乙酰氧基甲酯/PI双标染色显示,三维培养体系中,30 min后少数BMSCs出现死亡,12 h后细胞开始增殖,增殖较二维培养活跃,差异有统计学意义(P<0.05);CCK-8细胞计数显示,三维培养体系细胞增殖活力高于二维培养体系,差异有统计学意义(P<0.05)。结论RGD两性亲肽与BMSCs有良好的生物相容性,可能成为组织工程支架材料。
精氨酰-甘氨酰-天冬氨酰;间质干细胞;两亲性肽;细胞相容性
材料的生物相容性和细胞亲和性可以通过固定的某些生物活性分子在聚合物或生物材料表面改进,为种子细胞黏附、增殖、扩展和分化提供良好的界面,促进细胞外基质的生产,是构建组织工程产品的重要措施。组织工程的快速发展,给神经组织修复和再生带来新的希望。组织工程的三要素为支架材料、种子细胞和细胞因子,其中神经支架材料用以恢复神经的三维结构,利于细胞的黏附、生长、分化、增殖,并提供足够大的表面积和容积,从而达到对神经细胞的支持、营养作用,最终有利于血管的生成。支架最佳生长模型具有很高的生物相容性和生物降解性,易于细胞附着、生长,以及及时地摄入营养和排出废物[1]。自组装肽纳米纤维支架高度模拟细胞外基质并支撑细胞生长,同时具有良好的生物相容性,已成为神经组织工程材料的首要选择[2]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有多向分化的潜能、低免疫原性等优点,成为神经组织工程理想的种子细胞[3]。本实验通过设计与合成精氨酰-甘氨酰-天冬氨酰(Arg-Gly-Asp,RGD)环两性亲肽,自组装形成多孔三维两性亲肽凝胶支架,研究SD大鼠BMSCs与含RGD环两性亲肽的相容性。
1 材料与方法
1.1材料
1.1.1实验动物 健康3周龄SD大鼠3只,由南昌大学医学院动物中心提供。
1.1.2主要仪器与试剂 RGD环两性亲肽结构分子式为C16H31OA3G4D2RGD,委托上海波肽公司合成,用高效液相色谱仪和质谱仪进行纯化和分析,相对分子质量为1 256.37,纯度为95.88%。DMEM/F12培养基(美国Gibco公司),碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、B27(美国Gibco-BRL公司),碘化丙啶(PI),钙黄绿素乙酰氧基甲酯(美国Invitrogen 公司),CCK-8细胞计数试剂盒(日本DOjindo公司)。0.1 mol/L氢氧化钠(NaOH)、0.1 mol/L盐酸(HCl,国药集团化学试剂有限公司),兔抗大鼠CD29、CD45、CD90多克隆抗体(英国Abcam公司)。倒置相差显微镜、荧光倒置显微镜(日本Olymous公司),JEM-1230型透射电子显微镜(日本JEOL公司),流式细胞仪(美国BD公司),细胞培养孵培养箱、多功能酶标仪(美国Thermo公司)。
1.2方法
1.2.1BMSCs分离获取 腹腔注射麻醉后脊髓脱臼处死大鼠,放入75%乙醇浸泡30 min,无菌环境下去除股骨、胫骨上的肌肉组织,取出股骨及胫骨,用磷酸盐缓冲液(PBS)冲洗2次,剪刀剪去股骨及胫骨两端骨骺,用5 mL注射器吸入含20 μg/L bFGF、20 μg/L EGF、 2% B27的无血清DMEM/F12培养基冲洗骨髓腔,直到骨髓腔变白,将冲洗液移入25 cm2细胞培养瓶中,置于37 ℃、5%二氧化氮(CO2)细胞培养箱中培养。48 h后仅将瓶子中培养液倒出更换新鲜培养液,不用PBS清洗瓶底。之后每隔2天更换新鲜培养液,待细胞铺满培养瓶底90%以上,加入胰蛋白酶消化,传代培养,细胞第3代进行细胞流式分析。
1.2.2BMSCs表面抗原流式鉴定 取培养至第3代的BMSCs,用0.25%胰蛋白酶消化后加入等体积含胎牛血清培养基终止消化,1 000 r/min离心5 min后去除培养基。加入少量PBS 后用移液管均匀吹打,将细胞水平调整至 1×109cells/L。取1 mL 1×109cells/L细胞悬液分别移入4支流式管中,PBS清洗细胞悬浮液2遍,再加入缓冲液重悬。每管分别加入藻红蛋白(PE)标记的单克隆抗体5 μL,同型非特异性IgG-PE为阴性对照,避光室温反应30 min。流式细胞仪上检测。
1.2.3RGD环两性亲肽自组装制备 取10 mg RGD环两性亲肽放入2 mL小管,加入0.1 mol/L NaOH溶液400 μL充分振荡混匀溶解,加入400 μL无菌双蒸水,再以每次滴加0.1 mol/L HCl 10 μL的方式缓慢调节多肽溶液至pH 8,继续滴入无菌双蒸水至体积为1 ml,此时多肽浓度为10 mg/mL,多肽溶液呈黏稠状态。取200 μL黏稠状多肽溶液滴入等体积含钙离子(Ca2+)等二价阳离子无酚红的DMEM/F12自组装成凝胶。取10 μL两性亲肽凝胶滴入金属网格中,脱水,晾干,磷钨酸染色,进行透射电镜显微镜(TEM)观察。
1.2.4RGD环两性亲肽凝胶与BMSCs的复合性培养 将盖玻片放入24孔板内,取10 mg/mL RGD两性亲肽溶液200 μL滴加到盖玻片,包被盖玻片,将培养至第3代密度为 1×106cells/mL的BMSCs等体积接种于RGD环两性亲肽包被的盖玻片上,数秒后形成三维凝胶细胞体系;凝胶内部pH值为7.35,将凝胶细胞培养体系置于37 ℃ 5% CO2孵箱中无血清培养,取200 μL密度为1×106cells/mL的BMSCs悬液滴在多聚赖氨酸包被的盖玻片上,37 ℃ 5% CO2孵箱中无血清培养(二维培养体系)。培养6、12、24 h的盖玻片以PBS清洗3次,在盖玻片上滴入配好的终浓度为2 μmol/L的钙黄绿素乙酰氧基甲酯,终浓度为4 μmol/L的PI,37 ℃孵育15 min,荧光显微镜下观察黄绿色的活细胞,红色的死细胞。
1.2.5RGD环肽对BMSCs增殖/毒性的作用 取96孔板,将1×105cells/mL BMSCs悬液100 μL接种于96孔板中,10 mg/mL环肽溶液100 μL加入40孔(三维细胞培养体系),每组8孔;10 mg/mL环肽溶液100 μL加入余下的40孔(二维细胞培养体系),每组8孔,每天分别向三维细胞培养体系1组8孔和二维细胞培养体系1组8孔中加入10 μL CCK-8试剂,避光置于37 ℃、5% CO2孵箱2 h,调整到460 nm上机测量吸光度值(A值),连续测量5 d。计算每天每组A值的平均数,以时间为横轴,A值为纵轴绘制BMSCs的生长曲线。
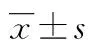
2 结 果
2.1倒置显微镜观察原代BMSCs形态及生长情况 冲洗骨髓腔出来的细胞,在第2、3天BMSCs开始贴壁,细胞两端成梭形,细胞核成卵圆形,细胞生长呈克隆式,细胞呈大小不一放射状的集落,开始生长较慢,2周左右细胞铺满培养瓶90%以上,细胞呈漩涡式、鱼状排列,胰酶消化后细胞贴壁均匀生长,形态为长梭形,传代后3 d左右细胞铺满培养瓶,见图1。

A:原代第6天BMSCs;B:第2代BMSCs;C:第3代BMSCs
图1 BMSCs原代及传代培养的细胞(×100)
A:CD29;B:CD34;C:CD45;D:CD90
图2 BMSCs流式细胞检测
2.2BMSCs流式细胞鉴定 选取第3代BMSCs与CD29、CD34、CD45、CD90抗体结合后上机检测,结果显示BMSCs高表达CD29(阳性率为99.88%)、CD90(阳性率为99.88%),不表达或低表达CD34(阳性率为1.64%)、CD45(阳性率为1.59%),证明所培养的细胞为BMSCs,见图2。
2.3两性亲肽RGD环肽自组装成凝胶纳米支架 10 mg RGD环两性亲肽溶于400 μL 0.1 mol/L NAOH,加入400 μL双蒸水,用0.1 mol/L HCl调节至pH 8,继续加入双蒸水至1 mL,此时肽溶液为黏稠状态,加入等体积的无酚红DEME/F12,数秒后成凝胶状态,TEM观察凝胶由纳米纤维构成,纳米纤维直径 2~5 nm,长度 100~1 000 nm,纳米纤维相互交织成三维网络结构,见图3。

A:2 mL小管瓶口倒置,凝胶紧贴瓶底,凝胶有较强的黏附力;B:TEM下观察凝胶由纳米纤维交叉编织,纳米纤维之间存在间隙
图3两性亲肽RGD环肽自组装成凝胶纳米支架
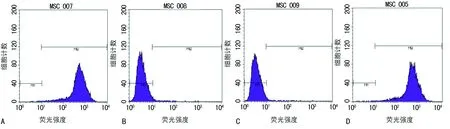
2.4RGD环两性亲肽的检测结果 质谱结果显示,RGD环两性亲肽相对分子质量为1256.0,与目标肽相对分子质量的理论设计一致(图4A);高效液相色谱分析显示,合成的RGD环两性亲肽纯度为95.88%(图4B、C),表明合成的RGD环两性亲肽是本研究的目标肽。
A:质谱检测合成目标肽相对分子质量为1256.0;B、C:高效液相色谱检测合成目标肽的纯度为95.88%,已达到目标肽浓度
图4 RGD环两性亲肽的检测结果
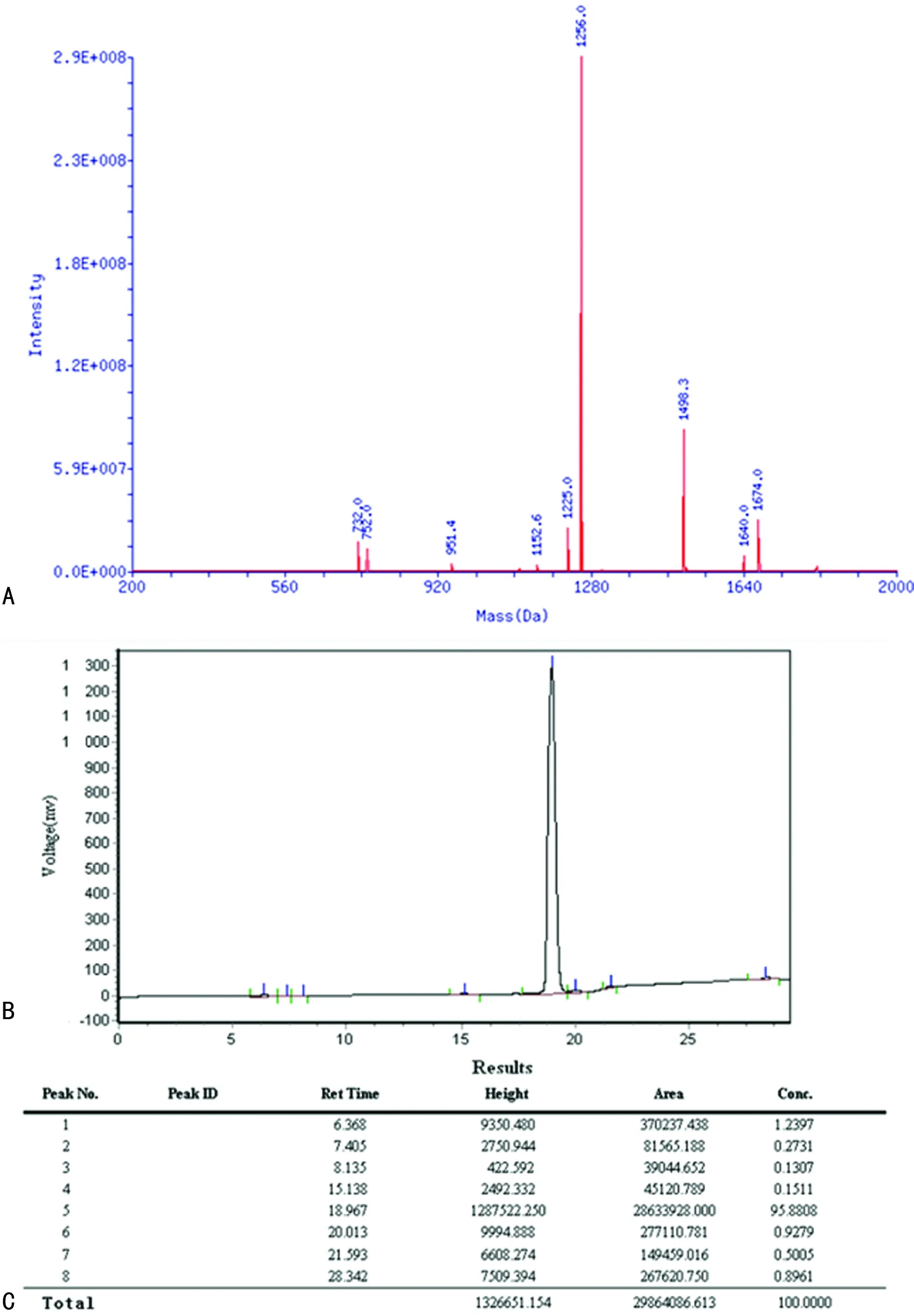
2.5RGD环两性亲肽纳米凝胶与BMSCs复合性培养结果 细胞分别在二维培养体系与三维细胞培养体系中培养6、12、24 h后分别进行钙黄绿素乙酰氧基甲酯和PI染色,细胞点计数活细胞与死细胞,随着细胞培养时间增加三维细胞培养体系活细胞数明显比二维细胞培养体系中多,差异有统计学意义(P<0.05),三维细胞培养体系中6、12、24 h活细胞数,见图5A、B、C;二维细胞培养体系中6、12、24 h活细胞数,见图5D、E、F;三维细胞培养体系死细胞(图6A、B、C)与二维细胞培养体系死细胞(图6D、E、F)未见增多。
2.6CCK-8测量两性肽对BMSCs增殖的影响 BMSCs在三维细胞培养体系中增殖曲线与在二维细胞培养体系中增殖曲线见图7,在三维细胞培养体系中BMSCs增殖速度比在二维细胞培养体系中BMSCs增殖速度快,差异有统计学意义(P<0.05)。
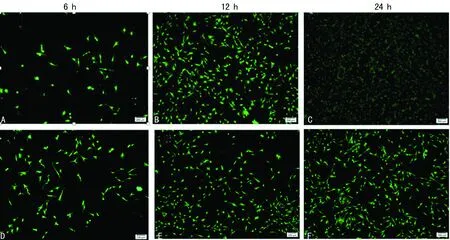
A、B、C:三维细胞培养体系; D、E、F:二维细胞培养体系
图5三维与二维细胞培养体系活细胞
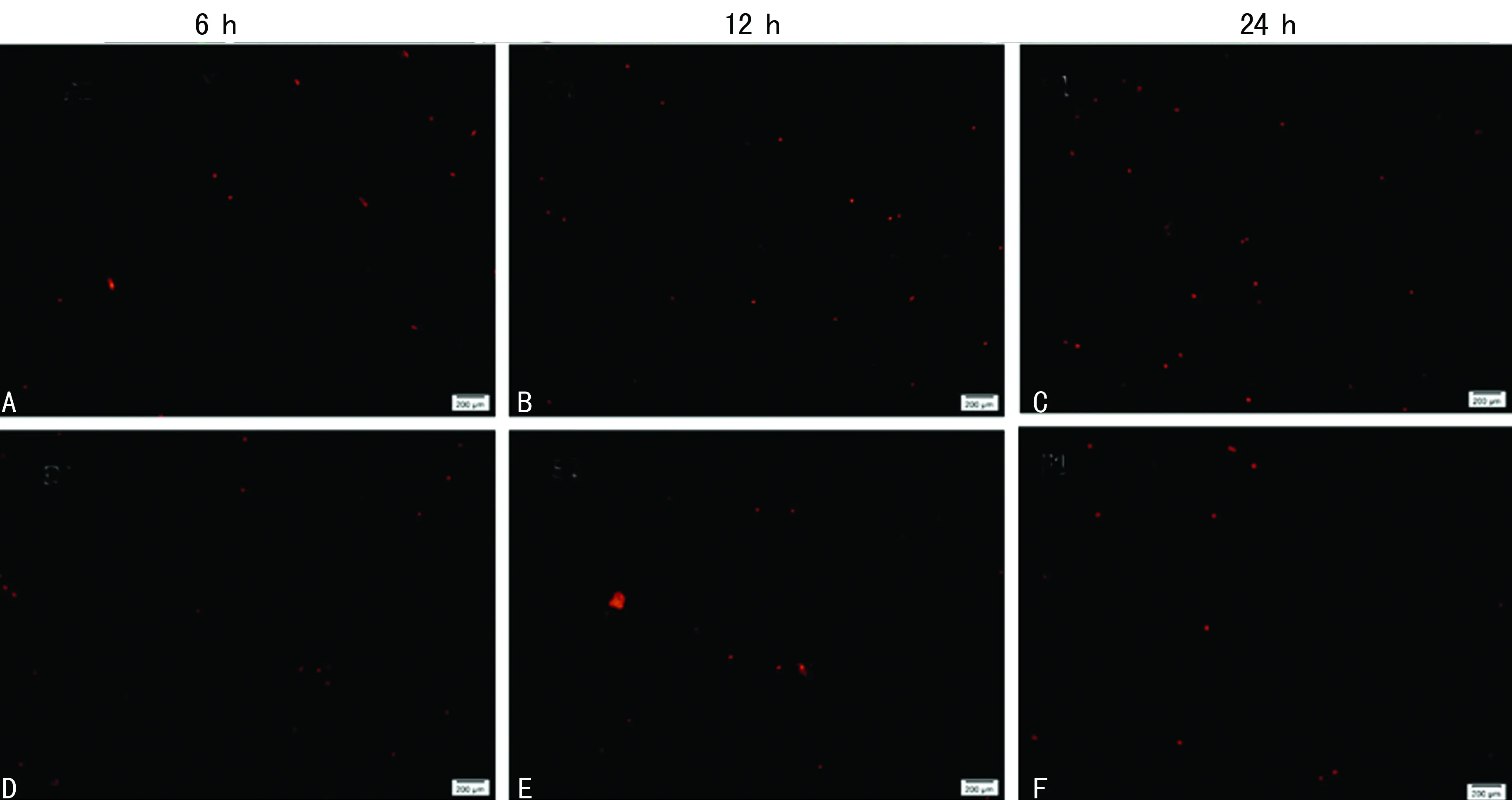
A、B、C:三维细胞培养体系; D、E、F:二维细胞培养体系
图6三维与二维细胞培养体系死细胞

图7 两性肽对BMSCs增殖的影响
3 讨 论
脊髓损伤主要为机械直接对脊髓造成的伤害,通常导致完全或不完全的神经功能丧失,如运动功能和感觉功能丧失[4]。脊髓损伤给患者带来心理和生理伤害,造成家庭巨大的经济负担,因此,迫切需要寻求一种有效的治疗脊髓损伤的方法。目前,神经组织工程是治疗脊髓损伤的有效方法。
生物材料包括有机材料、无机材料、金属材料三大类。由于无机材料及金属材料具有硬度大、韧性低、弹性差、可塑性差等特点,不适合用于神经组织工程;有机高分子材料具有在体内不易降解,或降解产物不能被机体利用且难以清除,以及其生物相容性差等缺点,也不宜作为神经组织工程的支架材料。利用两亲性肽自组装构建神经组织工程支架是较好的方法,其基本原理:肽分子在酸或细胞培养液(含钙、镁或氢等离子)作用下,通过分子内非共价键(氢键、疏水键、范德华力)等,自组装为三维多孔纳米纤维凝胶,形成纳米纤维直径较小,凝胶黏弹性可调控到与脊髓黏弹性一致,生物相容性好,降解产物为氨基酸可被细胞利用。这种肽在细胞培养液促发下可自组装为纳米纤维凝胶,反应温和,条件简单,与其他材料相比具有明显优势,是构建神经组织工程较好的基质支架材料。
目前许多研究者通过改变氨基酸序列,设计出具有特定功能的肽链[5],可模拟培养细胞所需要的生存环境,通过改变肽链的长短序列及带电性质,在pH 7.35~7.45发生自组装成多肽纳米凝胶结构,此纳米凝胶与细胞外基质相类似。由于多肽凝胶含水量较高且存在着间隙,为营养物质及细胞排泄物的运送提供了通道。多肽由天然的氨基酸合成,在体内不会进行排斥反应和炎性反应,凝胶在体内酶的作用下降解,给细胞提供生存养料。RGD环肽序列为C16H31OA3G4D2RGD,环肽具有的特性为:(1)C16H31O序列提高对酸的敏感度,同时烷基尾可以调节纳米纤维之间的间隙[6-7];(2)A3G4(AAAGGGG)与C16H31O烷基尾有协同作用[8],同时能让活性RGD环表位暴露出来;(3)D2(DD)具有调节带电离子作用,当RGD环肽在自组装成凝胶时,凝胶的pH范围在7.35~7.45之间,正好适合细胞生长、增殖、分化[8];(4)RGD序列能促进细胞对凝胶的黏附、生长及分化[1]。
本研究通过用高效液相色谱仪和质谱仪进行纯化和分析,结果证明所合成的RGD环肽为所需的目的肽。用0.1 mol/L NaOH溶液、0.1 mol/L HCl溶液及无菌双蒸水将多肽调整浓度为10 mg/mL,此时的多肽溶液呈黏稠状态,加入等体积含Ca2+等二价阳离子无酚红的DMEM/F12,数秒钟后多肽成凝胶状态,小管瓶口倒置,凝胶紧贴瓶底,有较强的黏附力,经电子显微镜观察凝胶发现凝胶由直径2~5 nm,长度100~1 000 nm的纳米纤维构成,纳米纤维相互交织成三维网络结构。此类似凝胶含水量95.0%,对细胞有良好的骨架支持作用;营养物质、氧气及细胞所需要的活性因子可通过凝胶间隙到达细胞内,细胞内排泄物可通过间隙排出凝胶外。本实验采用全骨髓细胞差异贴壁法获取大鼠骨髓间充质干细胞[9],通过细胞形态学观察,流式细胞仪检测细胞表面抗原,培养2周后的细胞呈漩涡式、鱼状排列,细胞表面CD29、CD90高表达,而CD34、CD45不表达,验证所取的细胞为骨髓间充质干细胞。
BMSCs有许多优点,包括来源丰富、高活性、低免疫原性、分化潜能和分泌养分,在移植研究中已得到广泛的应用[10]。BMSCs可以分泌多种趋化因子、免疫调节因子和生长因子,这些因子可以进一步聚集其他细胞(包括炎性细胞),调节免疫应答,参与组织修复,影响病理进展[11]。因此,BMSCs为组织工程修复神经损伤较理想的种子细胞。
RGD环两性亲肽纳米凝胶与BMSCs混合形成三维细胞培养体系,凝胶的三维结构具有良好的骨架结构,为细胞的生长提供支持作用;同时RGD环活性表位促进细胞对凝胶的黏附、生长及分化。本研究CCK-8结果显示,在三维细胞培养体系中BMSCs增殖速度比在二维细胞培养体系中快。由钙黄绿素乙酰氧基甲酯和PI构成的DEAD/LIVE试剂可通过荧光显微镜显色,观察细胞在二维及三维细胞培养体系的活力和增殖情况,活细胞染成绿色,死细胞染成红色[12]。本研究结果显示,随着培养时间的增加,三维细胞培养体系中的活细胞数较二维细胞培养体系中多。
综上所述,RGD环肽与BMSCs具有很好的细胞相容性,可为以后在仿生材料涉及的神经组织工程中进行转基因改造奠定基础。
[1]Breymann C,Schmidt D,Hoerstrup SP.Umbilical cord cells as a source of cardiovascular tissue engineering[J].Stem Cell Rev,2006,2(2):87-92.
[2]元亮亮,梁鹏.自组装多肽纳米纤维支架的结构特点及应用优势[J].中国组织工程研究,2013,17(29):5379-5386.
[3]陈睿,宋玉林,汪文玉,等.大鼠骨髓间充质干细胞与树枝状两亲性多肽自组装凝胶支架的生物相容性[J].西安交通大学学报(医学版),2016,37(6):803-809.
[4]Yip PK,Malaspina A.Spinal cord trauma and the molecular point of no return[J].Mol Neurodegener,2012,7:6.
[5]Ruan L,Zhang H,Luo H,et al.Designed amphiphilic peptide forms stable nanoweb,slowly releases encapsulated hydrophobic drug,and accelerates animal hemostasis[J].Proc Natl Acad Sci U S A,2009,106(13):5105-5110.
[6]Sargeant TD,Guler MO,Oppenheimer SM,et al.Hybrid bone implants:self-assembly of peptide amphiphilic nanofibers within porous titanium[J].Biomaterials,2008,29(2):161-171.
[7]Hartgerink JD,Beniash E,Stupp SI.Self-assembly and mineralization of peptide-amphiphile nanofibers[J].Science,2001,294(5547):1684-1688.
[8]宋玉林,郑启新,郑剑锋,等.两亲性肽自组装凝胶与神经干细胞相容性研究[J].组织工程与重建外科杂志,2008,4(4):192-195.
[9]李双月,戚媛,陈若琳,等.全骨髓贴壁法分离培养大鼠骨髓间充质干细胞的生物学特性及优势[J].中国组织工程研究,2014,18(10):1484-1489.
[10]Hu J,Deng G,Tian Y,et al.An in vitro investigation into the role of bone marrowderived mesenchymal stem cells in the control of disc degeneration[J].Mol Med Rep,2015,12(4):5701-5708.
[11]Han X,Yang Q,Lin L,et al.Interleukin-17 enhances immunosuppression by mesenchymal stem cells[J].Cell Death Differ,2014,21(11):1758-1768.
[12]桑江玮,王素雅,张杰,等.猪小肠黏膜下层细胞外基质促进肝细胞活力和功能基因表达的研究[J].中国修复重建外科杂志,2017,31(5):607-613.
Studyoncompatibilityofself-assembledgelcontainingRGDamphipathicpeptidewithbonemarrowmesenchymalstemcells*
XiaoRenshun,RuanHong,JiangXinghai,WuKai,WangXiaomei,SongYulin△
(DepartmentofOrthopedics,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
ObjectiveTo analyze the compatibility of bone marrow mesenchymal stem cells (BMSCs) with amphiphilic peptide three-dimensional gel.MethodsThree healthy 3-week-old SD rats were taken for separating femur and tibia to obtain BMSCs,the BMSCs surface antigen was detected by flow cytometry;the 10 mg/mL RGD-cyclic amphiphilic peptide solution was added into the same volume of DMEM/F12 culture medium,after a few seconds,which was self assemble into three-dimensional gel.Three dimensional gel structure was observed by transmission electron microscope (TEM).1×106cells/mL BMSCs suspension and RGD-cyclic amphiphilic peptide were mixed to form a 3D culture system,1×106cells/mL BMSCs suspension was mixed with polylysine to form a 2D culture system,the serum-free culture was conducted;the CCK-8 method was used to observe the cell growth situation,calcein acetoxy methyl ester/propidium iodide (PI) double standard staining was performed.The effect of RGD-cyclic amphiphilic peptide on the proliferation of BMSCs was observed by fluorescence microscopy.ResultsThe separated and cultured BMSCs highly expressed CD29 and CD90,but lowly expressed or did not express CD34 and CD45;TEM showed that the gel was composed of multiple empty nanofibers with the nanofiber diameter of 2-5 nm and length of 100-1 000 nm;the molecular weight of synthetic peptides detected by mass spectrometry (MS) was 1 256.37,which was consistent with the theoretical value;the HPLC analysis showed that RGD-amphiphilic peptide purity was 95.88%;the calcein acetoxyl methyl ester/PI double staining showed that in the 3D culture system,a few BMSCs died after 30 min and the cells began to proliferate after 12 h,the proliferation was more active than that of 2D culture,and the difference was statistically significant (P<0.05);CCK-8 cell count showed that the proliferation activity of 3D culture system was higher than that of 2D culture system,and the difference was statistically significant (P<0.05).ConclusionRGD amphiphilic peptide has a good biocompatibility with BMSCs,and may become the tissue engineering scaffold material.
Arg-Gly-Asp;mesenchymal stem cells;amphiphilic peptide;cytocompatibility
10.3969/j.issn.1671-8348.2017.35.005
国家自然科学基金资助项目(81360271,30801158);江西省教育厅课题(GJJ14054);江西省自然科学基金计划项目(20151BAB205051);南昌大学研究生创新专项基金(CX2016326)。
肖仁顺(1991-),住院医师,硕士,主要从事脊髓损伤、两性肽组织模块方面的研究。△
,E-mail:songyulin2001@163.com。
R318
A
1671-8348(2017)35-4912-05
2017-07-12
2017-09-15)
