经后增殖方含药血清对超排卵大鼠卵巢COCs及CCs中GDF9与Bim表达的影响*
2018-01-05郭新宇刘佳子邓伟民张金玉
杨 贞,郭新宇,刘佳子,邓伟民,张金玉
(1.广州军区广州总医院生殖医学中心,广州 510010;2.广州中医药大学研究生院,广州 510405;3.汕头大学医学院附属第一医院康复科,广东汕头 515041)
论著·基础研究
经后增殖方含药血清对超排卵大鼠卵巢COCs及CCs中GDF9与Bim表达的影响*
杨 贞1,2,郭新宇1△,刘佳子3,邓伟民1,张金玉1
(1.广州军区广州总医院生殖医学中心,广州 510010;2.广州中医药大学研究生院,广州 510405;3.汕头大学医学院附属第一医院康复科,广东汕头 515041)
目的观察经后增殖方含药血清对超排卵大鼠卵巢的卵丘-卵母细胞复合体(COCs)及卵丘细胞(CCs)中生长分化因子9(GDF9)及Bim表达的影响,探讨其治疗效果及作用机制。方法制备大鼠超排卵卵巢模型,收集COCs和CCs,分别与雌性SD超排卵大鼠空白血清和经后增殖方药物血清在体外共同培养,各分3组:空白血清组(空白组)、含药血清组(对照组)、含药血清+GDF9受体阻断剂组(实验组),共6组。24 h后收集COCs和CCs,实时荧光定量PCR检测GDF9和Bim mRNA表达水平,蛋白质印迹法检测GDF9蛋白表达水平。结果(1)对照组COCs中GDF9 mRNA表达水平明显高于空白组和实验组(P<0.05);对照组和实验组COCs中Bim mRNA表达水平均明显低于空白组(P<0.05);对照组COCs中GDF9蛋白表达水平明显高于空白组(P<0.05),亦高于实验组,但差异无统计学意义(P>0.05)。(2)CCs中GDF9 mRNA表达水平在3组间的差异性比较结果与COCs中一致;对照组和实验组CCs中Bim mRNA表达水平均明显低于空白组(P<0.05);对照组CCs中Bim mRNA表达水平明显低于实验组(P<0.05);对照组CCs中GDF9蛋白表达水平明显高于空白组和实验组(P<0.05)。(3)对照组COCs中GDF9 mRNA表达水平明显高于CCs中(P<0.05),其余组内COSs和CCs比较差异无统计学意义(P>0.05)。结论经后增殖方含药血清能提高COCs和CCs中GDF9的表达水平,维持COCs和CCs中Bim的低水平表达,抑制细胞凋亡,促进卵泡发育;COCs较剔除卵母细胞的CCs更有利于GDF9 mRNA的表达。
经后增殖方;超排卵;卵丘-卵母细胞复合体;卵丘细胞;生长分化因子9;Bim
控制性超排卵(controlled ovarian hyperstimulation,COH)是体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)周期中的重要环节,常用方案为先使用促性腺激素释放激素激动剂进行垂体降调节,然后用促性腺激素刺激卵巢,使多个卵泡同时发育,从而同时获取多个卵子进行体外受精,有别于自然周期的单卵排卵。已有研究证实超排卵可能损伤卵细胞染色体的结构和功能,影响胚胎的基因表达,从而降低胚胎的着床潜能[1],导致胚胎着床率和妊娠率显著下降[2]。中医药介入IVF-ET周期收效显著,本课题组前期研究证实益气血补肝肾中药能提高胚胎移植成功率和妊娠率[3]。本研究提取COH大鼠卵巢中卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs)和卵丘细胞(cumulus cells,CCs),加入经后增殖方含药血清进行体外培养,检测COCs和CCs中生长分化因子9(growth differentiation factor 9,GDF9)和Bim的表达水平,探讨益气血中药对提高IVF-ET周期卵泡质量的效果及可能的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 无特定病原体(SPF)级SD雌性大鼠42只,鼠龄6~8周,体质量180~220 g,由广州军区广州总医院动物实验中心提供(合格证号:44007200031374,44002100009700)。适应性饲养1周后进入实验阶段,自然光照,自由取水和摄食,以阴道脱落细胞涂片检查动情周期。
1.1.2实验药品 醋酸曲普瑞林(GnRHa,瑞士辉凌公司,商品:名达必佳,批号:K18565B);孕马血清促性腺激素(PMSG,美国Sigma公司,批号:SLBP4544V);人绒毛膜促性腺激素(HCG,丽珠药业有限公司,批号:160201);经后增殖方(颗粒剂,每袋10 g,广东一方制药有限公司,批号:Q1511004),每袋相当于生药:党参15 g,白术12 g,茯苓12 g,甘草6 g,熟地黄12 g,白芍12 g,当归6 g,川芎6 g,菟丝子15 g,鹿角霜20 g,杜仲15 g,山萸肉10 g,川椒3 g。
1.1.3主要仪器与试剂 反转录试剂盒(德国DBI公司,批号:DBI-2220),荧光定量PCR检测试剂盒(美国Genecopoeia公司,批号:AOPR-1200),二喹啉甲酸(BCA)蛋白定量试剂盒(杭州弗德生物,批号:FD2001),山羊抗大鼠GDF-9抗体(美国Santa公司,批号:sc-12244),小鼠抗大鼠β-actin抗体(北京博奥森,批号:Bsm-33036M),荧光定量PCR仪(美国ABI公司,型号:7500)。
1.2方法
1.2.1含药血清的制备及灭活 12只雌性大鼠连续观察2个动情周期均正常,随机分为含药血清组和空白血清组,每组6只。阴道涂片为动情后期(动情周期第3天),两组大鼠均于每日上午9时腹腔注射GnRHa 2.0 μg/100 g,连续7 d,第7天同时注射PMSG 40 IU/100 g,48 h后注射HCG 100 IU/100 g。从第1天注射GnRHa开始,同时含药血清组大鼠每日上午9时给予经后增殖方4.5 g/kg(相当于3倍临床等效剂量),空白血清组大鼠给予等体积生理盐水灌胃,每日1次,至注射HCG日,共9 d。第9天灌胃及注射HCG后1.5 h,腹腔注射10%水合氯醛4.0 mL/kg,深入麻醉大鼠后腹主动脉取血。将各组血液置于4 ℃放置2 h,3 000 r/min离心20 min,取上清液,56 ℃ 30 min灭活,用0.22 μm微孔过滤器过滤除菌,同组血清混匀分装,-20 ℃保存备用。
1.2.2COCs和CCs的制备 30只雌性大鼠连续观察2个动情周期均正常。阴道涂片为动情后期(动情周期第3天),于每日上午9时腹腔注射GnRHa 2.0 μg/100 g,连续7 d,第7天同时注射PMSG 40 IU/100 g,48 h后注射HCG 100 IU/100 g,2 h后颈椎脱臼处死,无菌条件下快速取出小鼠双侧卵巢,37 ℃ 5%二氧化碳(CO2)过夜预热的M199培养液中洗3次,37 ℃恒温板上,立体显微镜下,10 mL注射器吸取大卵泡中的COCs,选取形态良好的COCs。(1)取一半COCs置于M199培养液(美国Hyclone公司)中,37 ℃ 5% CO2孵箱暂存备用。(2)另一半COCs置于0.1%透明质酸酶(美国Sigma公司)中,用一次性注射针头刺破卵泡,使CCs释放入培养液中,并轻轻吹打,使其分散成单个细胞,加入M199培养液终止消化,200目一次性细胞筛过滤。将含CCs的培养液收集在离心管中,以1 000 r/min离心5 min收集细胞,培养液洗2次后,加一定量的培养液重悬细胞,台盼蓝染色,血细胞计数板计数活细胞数,细胞存活数大于85%,M199培养液将CCs悬液调整为1×106cells/mL的单细胞悬液备用。
1.2.3COCs和CCs的培养 将COCs和CCs分别随机种入已用0.05% L-多聚赖氨酸涂布的6孔培养板中,COCs和CCs各随机分为3组,每组3个复孔,加入大鼠血清及青链霉素双抗(美国Gibco公司),形成含10%大鼠血清[各组分别加入空白血清(空白组),含药血清(对照组),含药血清+GDF9受体阻断剂(实验组,GDF9受体阻断剂为美国R&D公司产品)]、1%双抗的M199培养液。培养24 h后,收集各组细胞待测。
1.2.4实时荧光定量PCR法检测GDF9 mRNA和Bim mRNA的表达 实时荧光定量PCR操作按试剂盒说明书进行。GDF9上游引物序列:5′-GCA GAT TCC TGT TGG GGG TT-3′,下游引物序列:5′-TAC AGG CAA CAG CAA GGA CC-3′,扩增长度100 bp;Bim上游引物序列:5′-AGA GAT ACG GAT CGC ACA GG-3′,下游引物序列:5′-GTC TTC CGC CTC TCG GTA AT-3′,扩增长度100 bp;内参β-actin上游引物序列:5′-AGT TCA ACG GCA CAG TCA AG-3′,下游引物序列:5′-TAC TCA GCA CCA GCA TCA CC-3′,扩增长度118 bp。引物由上海捷瑞生物工程有限公司合成。PCR反应条件:95 ℃ 10 min预变性;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 35 s,退火、变性、延伸,40个循环。根据各组样品的Ct值(Ct值为荧光信号达到设定阈值时所经过的循环数),以β-actin进行参照,折算出各样品起始模板数的相对数量关系。计算公式:目的基因的相对量以2-ΔΔCt值表示,ΔΔCt=[Ct(待测样品目的基因)-Ct(待测样品内参基因)]-[Ct(对照组样品目的基因)-Ct(对照组样品内参基因)]。
1.2.5蛋白质印迹法(Western blot)检测GDF9蛋白的表达 提取大鼠COCs和CCs总蛋白液。用BCA蛋白定量试剂盒测定蛋白水平后,各组样品分别取60 μg蛋白,加适量5×蛋白上样缓冲液,沸水浴5 min,配置10%的分离胶和5%的浓缩胶,上样,浓缩胶电压75 V,分离胶电压120 V,电泳至溴酚蓝刚跑出即终止电泳,将蛋白质转移至聚偏氟乙烯(PVDF)膜上。将转好的膜于室温下脱色摇床上用5%脱脂奶粉(含0.5% TBST)封闭1 h。加入用TBST溶解的5%脱脂牛奶稀释的一抗(山羊抗大鼠GDF-9抗体1∶500,小鼠抗大鼠β-actin抗体1∶2 000),4 ℃过夜;用TBST在室温下洗3次,每次5 min;加入用TBST溶解的5%脱脂牛奶稀释的二抗[辣根过氧化物酶(HRP)-兔抗山羊IgG抗体1∶1 000,HRP-山羊抗小鼠IgG抗体1∶5 000),室温下孵育30 min后,用TBST室温下洗3次,每次5 min。采用电化学发光(ECL)法显影曝光。X线片曝光显影。采用Image J软件处理系统分析目标带的吸光度值(A值)。以GDF9/β-actin的相对A值表示结果。
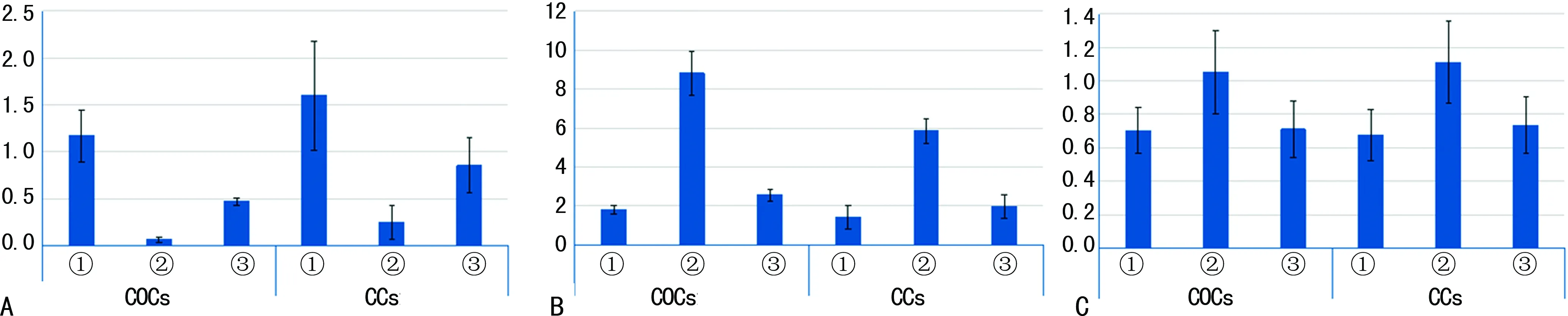
A:Bim mRNA;B:GDF9 mRNA;C:GDF9蛋白;①:空白组;②:对照组;③:实验组
图1 COCs和CCs中Bim mRNA、GDF9 mRNA和GDF9蛋白相对表达水平表1 COCs和CCs中Bim mRNA、GDF9 mRNA及GDF9蛋白相对表达水平比较
*:P<0.05,与空白组COCs比较;#:P<0.05,与空白组CCs比较;△:P<0.05,与实验组COCs组比较;▽:P<0.05,与实验组CCs比较;▲:P<0.05,与同组COCs比较
2 结 果
2.1COCs和CCs中Bim mRNA相对表达水平 熔解曲线均呈单峰分布,无基因组DNA的非特异扩增。(1)COCs中:对照组和实验组Bim mRNA相对表达水平均明显低于空白组(P<0.05),对照组Bim mRNA相对表达水平低于实验组,但差异无统计学意义(P>0.05);(2)CCs中:对照组和实验组Bim mRNA相对表达水平均明显低于空白组(P<0.05),对照组Bim mRNA相对表达水平明显低于实验组(P<0.05);(3)各组COCs中Bim mRNA相对表达水平均低于相对应各组CCs中Bim mRNA相对表达水平,但差异均无统计学意义(P>0.05),见图1A、表1。
2.2COCs和CCs中GDF9 mRNA相对表达水平 熔解曲线均呈单峰分布,无基因组DNA的非特异扩增。(1)COCs中:对照组GDF9 mRNA相对表达水平明显高于空白组和实验组(P<0.05);(2)CCs中:对照组GDF9 mRNA相对表达水平明显高于空白组和实验组(P<0.05);(3)各组COCs中GDF9 mRNA相对表达水平均高于相对应各组CCs中,其中对照组COCs和CCs中GDF9 mRNA相对表达水平比较,差异有统计学意义(P<0.05),空白组、实验组差异均无统计学意义(P>0.05),见图1B、表1。
2.3COCs和CCs中GDF9蛋白相对表达水平比较 (1)COCs中:对照组GDF9蛋白相对表达水平明显高于空白组(P<0.05),亦高于实验组,但差异无统计学意义(P>0.05);(2)CCs中:对照组GDF9蛋白相对表达水平明显高于空白组和实验组(P<0.05);(3)各组COCs中GDF9蛋白相对表达水平与相对应各组CCs中比较,差异均无统计学意义(P>0.05),见图1C、图2、表1。
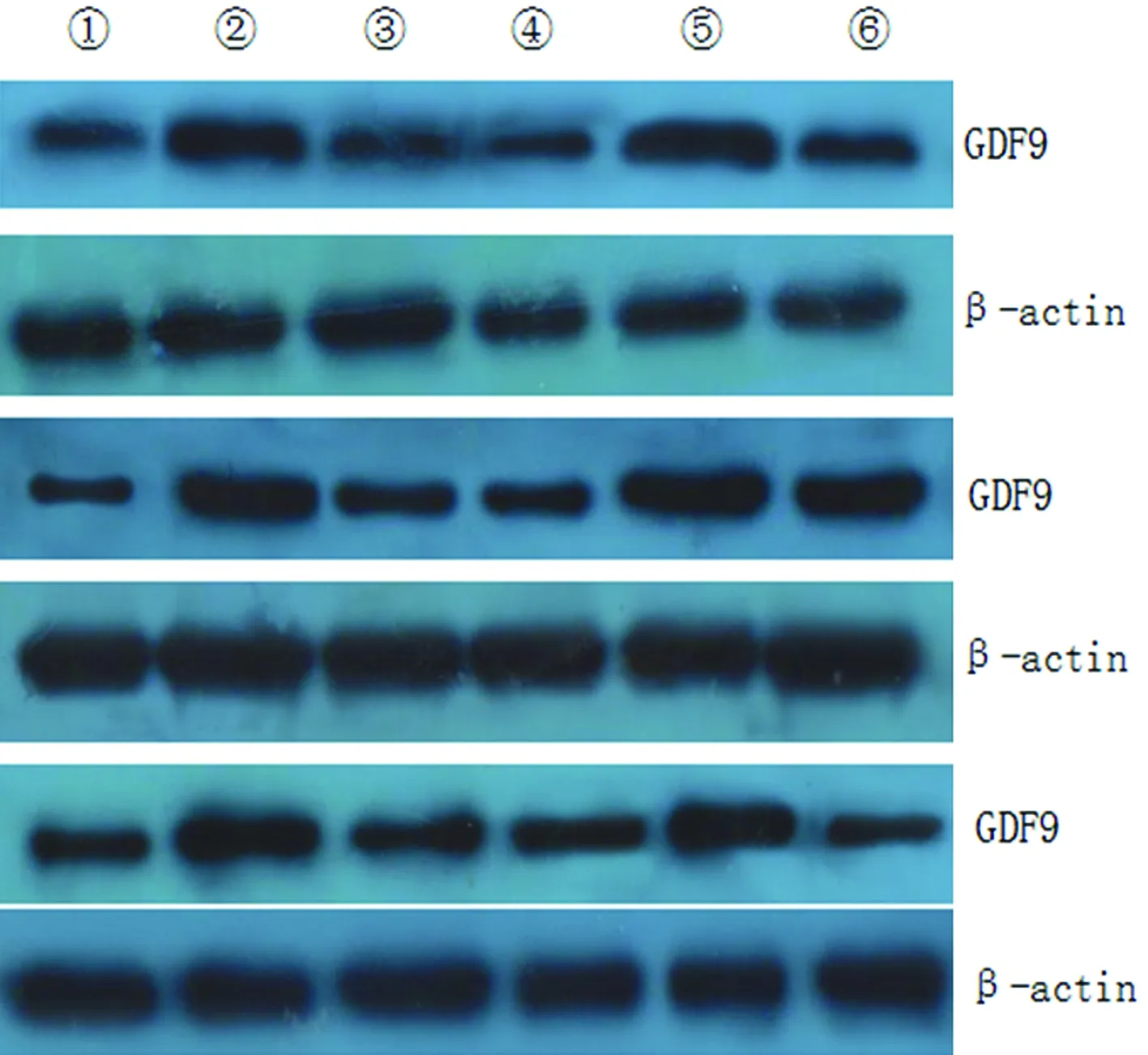
①:空白组CCs;②:对照组CCs;③:实验组CCs;④:空白组COCs;⑤:对照组COCs;⑥:实验组COCs
图2 COCs和CCs中GDF9蛋白表达电泳图
3 讨 论
COCs是哺乳动物卵巢的基本功能单位,包括一个卵母细胞和围绕其周围的CCs。CCs与卵母细胞关系密切,CCs直接影响卵母细胞的发育、成熟,进而影响胚胎的质量,而卵母细胞也可以通过分泌卵细胞分泌因子(oocyte secreted factors,OSFs)来调节CCs的生长分化,在卵母细胞的成熟过程中,二者相互影响,缺一不可[4]。近年来通过卵母细胞与颗粒细胞重建卵泡的研究提示,卵母细胞在调控卵泡发育中起主导作用,OSFs通过旁分泌作用促进卵泡的形成,卵丘扩张及某些代谢过程,同时OSFs被证实具有维持CCs低凋亡率的作用,而CCs保持良好生物学活性是卵细胞质量的保证[5-6]。
作为其中一种OSFs,GDF9是转化生长因子β超家族成员,其表达可见于早期初级卵泡阶段,对颗粒细胞的增殖、分化、排卵及黄素化起调控作用,与卵泡的生长和发育关系密切,是卵泡发育的重要因子,并可能与胚胎发育有关,卵泡液中的GDF9水平高低可以预测卵母细胞及胚胎质量[7-10]。因此,最近的一些研究已经把GDF9列为评价卵母细胞质量及其发育潜能的重要指标[11-12]。颗粒细胞的凋亡促进卵泡闭锁,使卵泡无法回到正常的发育轨道[13]。目前已经阐明有两条凋亡信号传导途径:(1)外源性死亡受体途径,由Fas/TNF2A通路激发;(2)内源性线粒体途径,由Bcl-2基因家族激发[14]。Bim是Bcl-2家族中BH3-only亚家族的成员,在机体多种组织包括生殖细胞中有不同程度的表达[15],在凋亡的启动和调节上具有重要的作用。不同的Bim异构体可通过直接激活Bax蛋白,或通过抑制Bcl-2的抗凋亡活性间接激活Bax/Bak引起线粒体途径的细胞凋亡。因此其表达上调可促进细胞凋亡,是一种重要的凋亡调节蛋白[16]。因此,本研究选取GDF9和Bim作为检测指标,观察具有益气血作用的经后增殖方对卵泡发育的作用机制。
中医学的“肾气-天癸-冲任”生殖轴与西医学的“下丘脑-垂体-卵巢”性腺轴相对应。中医认为,受孕的机理在于肾气充,天癸至,冲任调和,精血津液充沛。不孕主要与肾气不足,冲任气血亏虚有关。因此在治疗上通常以补肾、益气、养血为主。本研究所用经后增殖方由《太平惠民和剂局方》之八珍汤加减演化而来,方中四君子汤(党参、白术、茯苓、甘草)健脾益气;四物汤(熟地黄、当归、白芍、川芎)补血活血;另加补肾精血之山萸肉,阴阳并补之菟丝子,两药同用有养精种子之效;鹿角霜、杜仲、川椒温阳暖宫。全方使气血双补,气生血长,又得肾阳温煦,胎孕易成。笔者早前的临床观察表明该方在卵泡期可能通过增强“下丘脑-垂体-卵巢”性腺轴的调理功能,改善卵母细胞质量,促进卵泡发育,增强胚胎着床潜能,提高胚胎的种植率[3]。
本研究结果显示,对照组COCs和CCs中GDF9 mRNA和蛋白表达水平均明显高于空白组(P<0.05),说明经后增殖方含药血清能显著提高GDF9 mRNA和蛋白的表达水平,从而对抗细胞凋亡,促进卵泡发育;加入GDF9受体阻断剂能阻断含药血清对GDF9表达的影响(P<0.05)。而对照组COCs中GDF9 mRNA表达水平明显高于CCs中(P<0.05),说明经后增殖方含药血清有助于卵母细胞和CCs之间的相互影响,促进卵母细胞分泌GDF9 mRNA,二者相互依存,相互促进。剔除了卵母细胞,GDF9 mRNA的表达显著下降,CCs的功能将受到明显影响。经后增殖方含药血清能明显抑制COCs和CCs中Bim基因的表达(P<0.05),而在加入含药血清的同时加入了GDF9受体阻断剂,COCs和CCs中Bim基因的表达水平仍然受到明显抑制(P<0.05),说明GDF9受体阻断剂能特异性阻断GDF9受体的作用,但对Bim并无直接影响,因此经后增殖方含药血清仍能发挥对Bim表达的抑制作用。然而该水平仍高于未加入GDF9受体阻断剂的含药血清组(P<0.05),说明加入GDF9受体阻断剂,GDF9的表达明显降低,能间接影响经后增殖方含药血清对Bim基因表达的抑制作用,从而无法维持Bim表达的低水平。
综上所述,具有益气血作用的经后增殖方能通过促进GDF9的分泌,维持超排卵大鼠CCs和卵母细胞的功能及其相互之间的促进作用,有利于卵泡的发育,提高卵泡质量;GDF9具有维持CCs中Bim低水平表达的作用。而经后增殖方提高GDF9表达水平的具体作用通路有待进一步研究。
[1]Meng QX,Gao HJ,Xu CM,et al.Reduced expression and function of aquaporin-3 in mouse metaphase-II oocytes induced by controlled ovarian hyperstimulation were associated with subsequent low fertilization rate[J].Cell Physiol Biochem,2008,21(1/2/3):123-128.
[2]李培旭,李尚为,彭芝兰,等.超排卵对小鼠胚胎着床潜能的影响[J].实用妇产科杂志,2007,23(4):232-234.
[3]邓伟民,邵玉,张金玉,等.中药益气血补肝肾法对辅助生育胚胎种植率的影响[J].广州中医药大学学报,2008,25(2):106-109.
[4]Eppig JJ,Wigglesworth K,Pendola FL.The mammalian oocyte orchestrates the rate of ovarian follicular development[J].Proc Natl Acad Sci U S A,2002,99(5):2890-2894.
[5]Su YQ,Sugiura K,Wigglesworth K,et al.Oocyte regulation of metabolic cooperativity between mouse cumulus cells and oocytes:BMP15 and GDF9 control cholesterol biosynthesis in cumulus cells[J].Development,2008,135(1):111-121.
[6]Hussein TS,Froiland DA,Amato F,et al.Oocytes prevent cumulus cell apoptosis by maintaining a morphogenic paracrine gradient of bone morphogenetic proteins[J].J Cell Sci,2005,118(Pt 22):5257-5268.
[7]Gilchrist RB,Lane M,Thompson JG.Oocyte-secreted factors:regulators of cumulus cell function and oocyte quality[J].Hum Reprod Update,2008,14(2):159-177.
[8]Regassa A,Rings F,Hoelker M,et al.Transcriptome dynamics and molecular cross-talk between bovine oocyte and its companion cumulus cells[J].BMC Genomics,2011,12:57.
[9]Assou S,Haouzi D,De Vos J,et al.Human cumulus cells as biomarkers for embryo and pregnancy outcomes[J].Mol Hum Reprod,2010,16(8):531-538.
[10]Yeo CX,Gilchrist RB,Thompson JG.Exogenous growth differentiation factor 9 in oocyte maturation media enhances subsequent embryo development and fetal viability in mice[J].Human Reproduction,2008,23(1):67-73.
[11]Yang JL,Zhang CP,Li L,et al.Testosterone induces redistribution of forkhead Box-3a and Down-Regulation of growth and differentiation factor 9 messenger ribonucleic acid expression at early stage of mouse folliculogenesis[J].Endocrinology,2010,151(2):774-782.
[12]Sanchez F,Adriaenssens T,Romero S,et al.Quantification of oocyte-specific transcripts in follicle-enclosed oocytes during antral development and maturation in vitro[J].Mol Hum Reprod,2009,15(9):539-550.
[13]金艳梅.颗粒细胞对卵泡发育的影响[J].中国畜牧兽医,2010,37(8):69-72.
[14]Riedl SJ,Shi Y.Molecular mechanisms of caspase regulation during apoptosis[J].Nat Rev Mol Cell Biol,2004,5(11):897-907.
[15]Sionov RV,Vlahopoulos SA,Granot Z.Regulation of bim in health and disease[J].Oncotarget,2015,6(27):23058-23134.
[16]Puthalakath H,Strasser A.Keeping killers on a tight leash:transcriptional and post-translational control of the pro-apoptotic activity of BH3-only proteins[J].Cell Death Differ,2002,9(5):505-512.
EffectofserumcontainingJinghouZengzhiRecipeonexpressionofGDF9andBiminovarianCOCsandCCsincontrolledovarianhyperstimulationrats*
YangZhen1,2,GuoXinyu1△,LiuJiazi3,DengWeimin1,ZhangJinyu1
(1.ReproductiveMedicineCenter,GeneralHospitalofGuangzhouMilitaryRegion,Guangzhou,Guangdong510010,China;2.GraduateSchool,GuangzhouUniversityofChineseMedicine,Guangzhou,Guangdong510405,China;3.DepartmentofRehabilitation,FirstAffiliatedHospital,MedicalCollegeofShantouUniversity,Shantou,Guangdong515041,China)
ObjectiveTo observe the effects of serum containing Jinghou Zengzhi Recipe (JHZZ) on the expression of growth differentiation factor 9 (GDF9) and Bim in cumulus-oocyte complexes (COCs) and cumulus cells (CCs) of controlled ovarian hyperstimulation (COH) rats,and to investigate its curative effect and mechanism.MethodsThe rat COH ovarian model was prepared for collecting COCs and CCs,which were respectively co-cultured in vitro with the blank serum of female COH SD rat and serum containing JHZZ,and the each group was divided into 3 subgroups:the blank serum group (blank group),serum containing JHZZ group (control group) and serum containing JHZZ plus GDF9 receptor blocker group (experimental group),total 6 subgroups.COCs and CCs were collected after 24 h.The expression levels of GDF9 and Bim mRNA were detected by real-time quantitative PCR.The GDF9 protein expression levels were detected by Western blot.Results(1) The expression level of GDF9 mRNA in control group COCs was obviously higher than that in the control group and experiment group COCs (P<0.05);the Bim mRNA expression level in COCs of control group and experiment group was significantly lower than that in COCs of blank group (P<0.05);the GDF9 protein expression level in the control group COCs was significantly higher than that in the blank group COCs (P<0.05),and also higher than that in the experiment group COCs,but the difference was not statistically significant (P>0.05).(2)The comparison results of GDF9 mRNA expression level in CCs among 3 groups were consistent with those in COCs;the Bim mRNA expression level in CCs of control group and experimental group was significantly lower than that in the blank group (P<0.05);the Bim mRNA expression level in the control group CCs was significantly lower than that in the experimental group CCs(P<0.05);the GDF9 protein expression level in the control group CCs was significantly higher than that in the blank group and experimental group CCs (P<0.05).(3)The GDF9 mRNA expression level in the control group COCs was significantly higher than that in CCs (P<0.05),and the other inter-group comparisons between COSs and CCs had no statistical difference (P>0.05).ConclusionSerum containing JHZZ can increase the GDF9 expression level in COCs and CCs,maintain the low expression of Bim in COCs and CCs,inhibit the ovarian cells apoptosis and promote the follicular development;COCs is more conducive to the expression of GDF9 mRNA compared with CCs eliminating oocyte.
Jinghou Zengzhi Recipe;superovulation;cumulus-oocyte complexes;cumulus cells;growth differentiation factor 9;Bim
10.3969/j.issn.1671-8348.2017.35.004
国家自然科学基金资助项目(81403249)。
杨贞(1988-),在读博士,主要从事妇科生殖医学方面研究。△
,E-mail:iris92@126.com。
R285.5
A
1671-8348(2017)35-4908-04
2017-06-25
2017-09-21)
