玉米中伏马毒素产生菌的分离鉴定及其产毒条件的研究
2018-01-05郭文博沈源源杨俊花赵志辉
郭文博,沈源源,杨俊花,范 楷,赵志辉,韩 铮
(上海市农业科学院农产品质量标准与检测技术研究所,上海市设施园艺技术重点实验室,上海市农产品质量安全评价技术服务平台,上海农产品质量安全工程技术研究中心,上海 201403)
玉米中伏马毒素产生菌的分离鉴定及其产毒条件的研究
郭文博,沈源源,杨俊花,范 楷,赵志辉,韩 铮*
(上海市农业科学院农产品质量标准与检测技术研究所,上海市设施园艺技术重点实验室,上海市农产品质量安全评价技术服务平台,上海农产品质量安全工程技术研究中心,上海 201403)
从发霉的玉米中分离鉴定产生伏马毒素B1(Fumonisin B1,FB1)和伏马毒素B2(Fumonisin B2,FB2)的真菌菌株并对其产毒条件(培养基、温度、时间、水分含量)进行考察,揭示伏马毒素的发生规律。将发霉玉米的提取液接种至PDA培养基,利用平板划线法分离获得产毒菌株,通过形态学观察和rDNA-ITS序列分析分别进行真菌形态学和种属鉴定;将产毒菌株接种在不同培养基上并选择不同条件(温度、时间、水分含量)培养,利用高效液相色谱-串联质谱法(HPLC-MS/MS)对不同培养条件下各种培养基中FB1、FB2进行定量检测。BLAST结果表明,分离得到的菌株DNA序列与NCBI数据库中登录号为KC709665.1、KR020684.1和KR052812.1的拟轮生镰孢菌(Fusarium verticillioides)序列同源性均为100%,证明分离得到的产毒菌株为F.verticillioides。接种试验表明,F.verticillioides的最佳产毒条件为玉米培养基,40%水分含量,28℃黑暗条件下培养28 d,FB1、FB2产量分别达到821.08 mg/kg、339.50 mg/kg。本研究玉米中伏马毒素产毒菌株主要为F.verticillioides,且伏马毒素的产生与培养基、温度、时间和水分含量等环境因素密切相关。
伏马毒素;拟轮生镰孢菌;分离;产毒条件;玉米
伏马毒素主要是由拟轮生镰孢菌(Fusarium verticillioides)、层生镰孢菌(F.proliferatum)和硫色镰孢菌(F.sulphureum)在一定温度和湿度条件下产生的一组水溶性次级代谢产物[1-2],主要污染玉米及其制品,在世界范围内特别是玉米产区广泛分布[3]。常见的伏马毒素主要为伏马毒素B1(Fumonisin B1,FB1)和伏马毒素B2(Fumonisin B2,FB2),是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物,其结构与人和动物体内的神经鞘氨醇极为相似,在神经鞘脂代谢过程中可竞争性地结合神经鞘氨醇N-2酰基转移酶,从而抑制神经鞘氨醇的生物合成、阻碍鞘脂类代谢,引发各种疾病[4],如马的大脑白质软化症(Equine leucoencephalomalacia,ELEM)[5]、猪肺水肿综合征(Porcine pulmonary edema,PPE)[6]、啮齿类动物的肝脏和肾脏损伤等[7]。此外,伏马毒素还具有很强的细胞毒性[8]和免疫毒性[9],与人类食道癌的发生密切相关[10-12]。
伏马毒素的产生与镰刀菌种属及其生长的环境条件密切相关,不同种属的镰刀菌在不同的条件下产生伏马毒素的种类和能力均存在差异[13-14]。其中,温度、水分含量、培养时间、基质等是影响伏马毒素产量的主要因素。目前,国内对伏马毒素发生规律的报道主要集中在马铃薯葡萄糖培养基(PD)、马铃薯蔗糖培养基(PS)、察氏培养基(Czapek)和理查德培养基(Richard)等常规培养基。研究结果表明,在马铃薯葡萄糖培养基中F.verticillioides的最佳产毒条件为pH 9、12 h光暗交替、25℃、培养10 d[15];在Richard培养基的最佳产毒条件为25℃、pH 5、培养10 d[16]。但对玉米、大米等实际高产毒培养基的产毒条件如温度、水分含量等影响因素缺乏系统的考察,限制了伏马毒素标准品的研制及动物毒理学的研究和发展。
本研究首先从发霉的玉米中分离鉴定获得伏马毒素的主要产毒菌株,将其分别接种在马铃薯葡萄糖琼脂培养基(PDA)和马铃薯葡萄糖培养基(PD)、玉米和大米四种培养基质上,采用LC-MS/MS技术分析不同培养基、培养温度、培养时间和水分含量下伏马毒素的产生量,构建不同培养基中伏马毒素的产生量与温度、时间和水分含量的非线性回归模型,旨在揭示伏马毒素的发生规律,对防控伏马毒素污染、保证农产品质量安全具有重要意义。
1 材料与方法
1.1 试验材料与培养基
优质玉米、大米、土豆,均购自上海某超市,发霉玉米(10份)收集于上海某农贸市场。
马铃薯葡萄糖琼脂培养基(PDA)和马铃薯葡萄糖培养基(PD)[17]。大米培养基:称取50 g优质大米至250mL三角瓶,加入20 mL蒸馏水混匀,用透气封口膜密封瓶口,浸泡过夜,121℃灭菌30min,冷却后将大米摇散待用。玉米培养基:称取50 g优质玉米至250 mL三角瓶,加入20 mL蒸馏水混匀,用透气封口膜密封瓶口,浸泡过夜,121℃灭菌30 min,冷却后将玉米摇散待用。
1.2 试剂与仪器
FB1、FB2标准品(德国Sigma公司);葡萄糖、琼脂(上海源叶生物科技有限公司);甲醇、乙腈(色谱纯,美国Merck公司);甲酸(色谱纯,中国Aladdin公司)。真菌基因组DNA小量制备试剂盒、DNA凝胶回收试剂盒(美国AXYGEN公司);Taq DNA聚合酶(上海桑尼生物科技有限公司);DNA marker[Takara,宝生物工程(大连)有限公司]。
液相色谱-串联质谱:TSQ Quant配 Surveyor液相操作系统(美国 Thermo Fisher Scientific公司);Eppendorf 5804R离心机(德国Eppendorf公司);Applied Biosystems 2720 PCR仪、Applied Biosystems 3730-XL测序仪(美国Applied Biosystems公司);Tanon 2500凝胶成像系统(上海天能科技有限公司);Thermo Scientific Heraguard ECO超净台(美国Thermo Fisher Scientific公司);霉菌培养箱(上海精宏实验设备有限公司);SX-500高压灭菌锅(日本TOMY公司)。
1.3 方法
1.3.1 菌株分离方法
称取10 g伏马毒素含量超标的发霉玉米,加入100 mL无菌水震荡提取30 min,分别取10-1、10-2、10-3的稀释液200μL涂布于PDA培养基平板上,28℃培养,48 h后利用平板划线法逐步分离得到单菌落,将分离得到的单一菌落接种于PDA培养基上28℃黑暗培养7 d,备用。
1.3.2 产毒菌株的分子生物学鉴定
对于大多数真核生物来说,核糖体内转录间隔区(ITS)序列分析被广泛应用于真菌物种的分子鉴定以及属内物种间或种内差异较明显的菌群间的系统发育关系分析。本试验利用特异性的引物进行PCR扩增,确定产毒菌的种类。引物由上海派森诺生物科技股份有限公司合成,序列如下:ITS1:TCCGTAGGTGAACCTGCGC,ITS4:TCCTCCGCTTATTGATATGC。PCR扩增反应体系包括:DNA(20 ng/μL)1.0μL,10×Buffer(含2.5×10-3mol/LMg2+)5μL,Taq聚合酶(5 U/μL)1.0μL,dNTP(1×10-5mol/L)1.0μL,ITS1引物(1×10-5mol/L)1.5μL,ITS4引物(1×10-5mol/L)1.5μL,ddH2O 39.0μL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,58℃退火30 s,72℃延伸1 min,共35个循环;最后72℃延伸7 min。反应完成后,PCR产物进行1%琼脂糖凝胶电泳检测,确认PCR扩增片段。PCR产物经胶回收后用ABI3730-XL测序仪进行碱基序列测定,将拼接后的序列与NCBI核酸数据库进行比对,得到待测菌株的菌种信息。
1.3.3 培养条件与方法
将分离获得的产毒菌株接种于PDA培养基,28℃黑暗条件下培养7 d后,备用。用无菌打孔器从PDA培养基上取直径为0.5 cm的菌丝块,分别将菌丝块接种至PDA、PD、玉米、大米培养基中,每份接种3块菌丝块,用无菌透气封口膜密封,摇匀,28℃黑暗条件下培养4周。接种第1周,每天振荡三角瓶1次,使菌丝与培养基充分接触,避免玉米、大米培养基凝结成块,培养结束后,40℃烘干,待用。
1.3.4 产毒条件优化
①不同培养基:将分离获得的产毒菌株分别接种于PDA、PD、玉米、大米培养基,28℃、40%水分含量条件下培养28 d,每7 d重复取样3份;②培养时间:将分离获得的产毒菌株接种于玉米培养基,28℃、40%水分含量条件下培养35 d,每7 d重复取样3份;③培养温度:将分离获得的产毒菌株接种于玉米培养基,20℃、25℃、28℃、30℃、35℃,40%水分含量培养28 d,每7 d重复取样3份;④水分含量:在250 mL的三角瓶中装入50 g玉米,然后分别加入10 mL、15 mL、20 mL、25 mL、30 mL水,即调节水分含量为20%、30%、40%、50%、60%,接种分离得到的产毒菌株,28℃培养28 d,每7 d重复取样3份。
1.3.5 样品处理
液体培养基:PD培养液涡旋振荡5 min,取2 mL于10 mL离心管中加入2.0 mL乙腈,涡旋混合1 min,超声1 h,4 000 r/min离心10min,取上清液过0.22μm滤膜后用乙腈-水(50∶50,v/v)稀释100倍后上机测定。
固体培养基:将3种固体培养基粉碎混匀后准确称取(1.00±0.01)g样品于10 mL离心管中,加入5.0 mL乙腈-水(50∶50,v/v)提取,涡旋混合1min,超声1 h,4 000 r/min离心10min,取上清液过0.22μm滤膜后用乙腈-水(50∶50,v/v)稀释104倍后上机测定。
1.3.6 LC-MS/MS检测条件
Thermo C18色谱柱(2.1 mm×100 mm,5μm);流动相A为甲醇,流动相B为0.1%甲酸水;线性梯度洗脱程序:0 mim(40%A),1 min(60%A),7 min(100%A),8 min(100%A),8.2 min(40%A),9.0 min(40%A);流速为300μL/min;进样量5μL;柱温30℃。
采用正离子模式的电喷雾(ESI+)离子源,多反应监测模式(MRM)采集;FB1和FB2的母离子、子离子、碰撞能量等参数见表1;喷雾电压为3.5 kV;碎裂电压为1.5 V;毛细管温度为350℃;雾化气压力3 500 Pa;辅助气压 15 Pa;鞘气压 45 Pa。

表1 伏马毒素B1、B2质谱条件参数Table 1 M ass spectrometry parameters for FB1 and FB2
2 结果与分析
2.1 伏马毒素含量测定
本试验利用HPLC-MS/MS技术,采用多反应监测模式(MRM),建立测定玉米培养基中FB1和FB2含量的分析方法。试验结果表明:玉米培养基样品中FB1和FB2在1—200μg/kg之间线性关系良好,相关系数(R2)均大于0.999,定量限为0.3μg/kg,检出限为0.1μg/kg;采用空白基质加标的方法,考察方法的回收率和精密度,得到低、中、高浓度加标回收率为88.6%—95.3%,精密度(RSD%)范围是2.9%—6.8%。通过方法学考察,表明采用的方法灵敏、准确、可靠,满足本试验中对PDA、PD、玉米和大米中FB1和FB2的准确定量。标准溶液和玉米产毒培养基中FB1、FB2色谱图如图1。

图1 伏马毒素B1、B2色谱图Fig.1 Chromatograms of FB1 and FB2 in standard solution(A)and maizemedium(B)
2.2 伏马毒素产生菌的鉴定
利用微生物稀释分离法和平板划线法,将分离得到的产伏马毒素的菌株接种于PDA培养基,28℃黑暗条件下培养7 d,由图2可见:菌落为棉絮状平铺PDA培养基中,气生菌丝为白色,基内菌丝为浅粉色,培养基反面呈淡黄色;在显微镜下观察到大型分生孢子呈镰刀形,数量较少,而小型分生孢子呈椭圆形,数量较多且多为棒形、无分隔。根据《真菌鉴定手册》《常见镰孢霉鉴定手册》《中国真菌志》等工具书,初步鉴定为镰刀菌[18-20]。
提取菌株DNA后,用IST1和IST4引物进行PCR扩增,得到550 bp左右的目的条带(图2),对纯化后的PCR产物进行序列测定后,与NCBI数据库中已知菌株信息比对,结果表明:试验菌株与数据库中登录号为KC709665.1、KR020684.1和KR052812.1的F.verticillioides序列同源性均为100%。最终,本试验经过形态学鉴定和rDNA-ITS序列分析,共获得8株产伏马毒素的F.verticillioides,并利用Fum-1进行最佳产毒条件的优化。
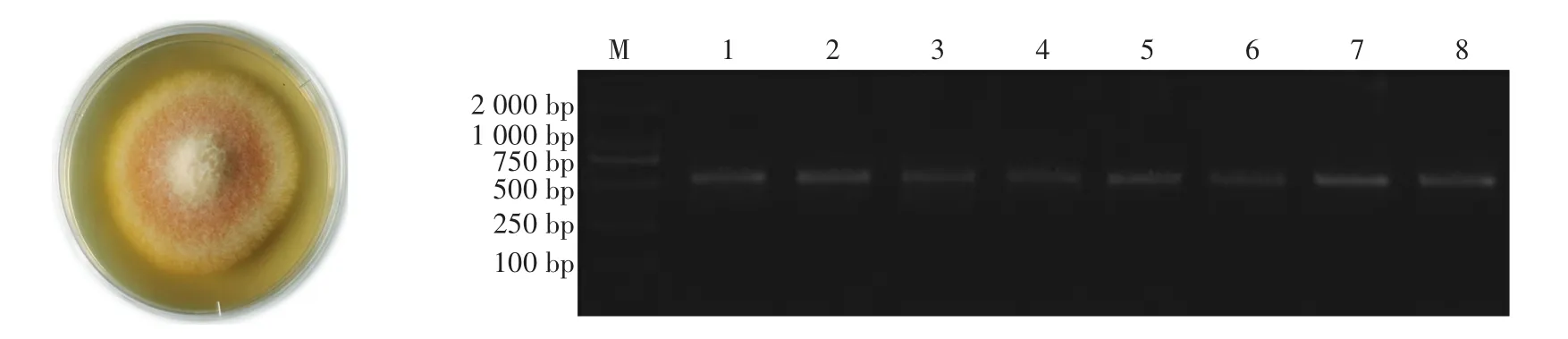
图2 分离菌株的形态特征及PCR鉴定结果Fig.2 Morphological characteristics and PCR identification of isolates
2.3 培养时间对F.verticillioides产毒量的影响
由图3可见,F.verticillioides在不同培养基上产毒量随时间的延长呈动态变化,本试验将PDA、PD、玉米和大米培养基培养时间设为35 d。在0—7 d,PDA和PD培养基中FB1、FB2含量逐渐升高,在第14天达到最大;在0—28 d,玉米和大米培养基中FB1、FB2含量逐渐增加,在第28天达到最大。当培养基中伏马毒素含量达到最大后,随着培养时间的继续增加,4种培养基中FB1、FB2含量均略微下降。
不同研究表明,F.verticillioides的产毒能力与培养基密切相关[15-16,21]。本试验中4种培养基均能产生伏马毒素,但产毒量存在明显差异。PDA与PD培养基中FB1、FB2含量极低,大米培养基中FB1、FB2含量分别为598.03 mg/kg、284.01mg/kg,玉米培养基中FB1、FB2含量分别为821.08mg/kg、339.50mg/kg,均远远高于PDA与PD。
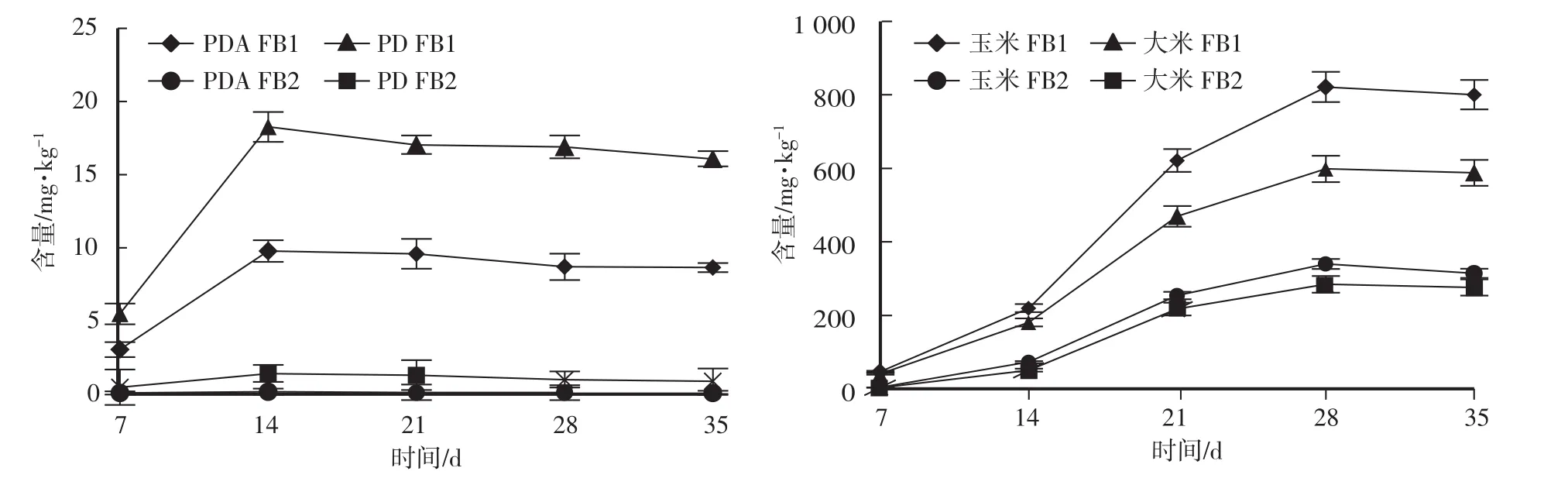
图3 培养时间对拟轮生镰孢菌产毒的影响Fig.3 Effect of incubation time on toxin-producing ability of F.verticillioides
2.4 培养温度对F.verticillioides产毒量的影响
将接种F.verticillioides的玉米培养基分别在20℃、25℃、28℃、30℃、35℃,40%水分含量条件下培养28 d,结果见图4。结果表明:当培养温度低于28℃时,伏马毒素产量随温度的增加而增加;当培养温度高于28℃时,伏马毒素产量随温度的增加而降低。本试验中28℃条件下玉米中FB1和FB2含量最高,分别达到817.08 mg/kg、329.01 mg/kg。因此,本试验最终选择28℃作为最佳培养温度。
2.5 水分含量对F.verticillioides产毒量的影响
将F.verticillioides分别接种在水分含量在20%、30%、40%、50%、60%的玉米培养基,28℃培养28 d,结果见图5。结果表明:水分含量从20%到40%,FB1和FB2产量不断增加,水分含量为40%时,伏马毒素含量达到最大,分别为808.21 mg/kg、321.15 mg/kg,当水分含量超过40%时,伏马毒素含量逐渐下降。因此,最终将培养基水分含量定为40%。

图4 培养温度对拟轮生镰孢菌产毒的影响Fig.4 Effect of incubation tem perature on toxin-producing ability of F.verticillioides
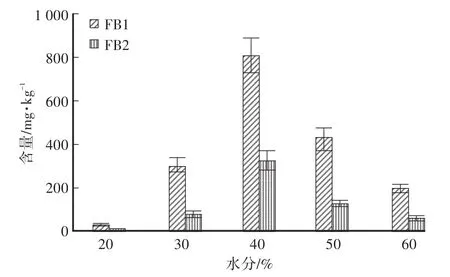
图5 水分含量对拟轮生镰孢菌产毒的影响Fig.5 Effect of water content on toxin-producing ability of F.verticillioides
3 讨论
F.verticillioides是一类世界性分布的真菌,它不仅可以存在于土壤及动植物体内,还可侵染多种重要经济作物,引起苗枯、根腐、茎腐和穗腐等病害[22],其生长产毒与地域环境、耕作制度、气候条件等有关,不同国家和地区分布存在明显差异。关于玉米致病菌群的研究表明,北美洲以F.verticillioides和禾谷镰孢菌(F.graminearum)为优势菌株[23],南美洲则以 F.proliferatum为优势菌菌[24];我国北方玉米中,F.graminearum为主要致病菌,F.verticillioides较少[25]。本研究从发霉玉米中共分离得到14株镰孢菌,经过形态学和分子生物学鉴定,伏马毒素产生菌主要为F.verticillioides,占54%,与其他关于玉米中真菌污染的调查分析结果一致[22,26-27],均表明F.verticillioides能够引起玉米霉变并产生伏马毒素的污染。
F.verticillioides产毒量与培养基种类、培养温度、培养时间、水分含量等因素密切相关。本试验结果表明F.verticillioides的最佳产毒条件为玉米培养基,40%水分含量,28℃黑暗条件下培养28 d。随着培养时间的延长,四种培养基中伏马毒素产量均呈先增加后下降趋势,此结果与李俊霞等[16]研究结果一致,由此表明F.verticillioides产毒量与菌丝的旺盛生长期相关,随着培养时间延长,菌丝逐渐老化,溶氧量降低,同时其他抑制性作用代谢产物增加,造成毒素总量下降。另外,伏马毒素降解及本身作为碳源被F.verticillioides利用也可能是伏马毒素含量下降的原因[28]。当培养温度为20—28℃时,F.verticillioides生长迅速,伏马毒素产量逐渐增加;当培养温度高于30℃时,F.verticillioides生长变缓慢,产毒量逐渐降低,说明较高的培养温度能够抑制F.verticillioides产毒,与师雯等[29]研究结果一致。水分含量也是影响微生物生长的重要因素,当水分含量为20%时,由于培养基表面干化,F.verticillioides生长缓慢,造成培养基利用率不高,伏马毒素产量较低;当培养基水分含量为40%,玉米培养基中菌丝生长迅速,伏马毒素产量最高;而当水分含量大于40%时,培养基结块成团,使培养基溶氧量不足,从而造成菌丝生长不良,不利于F.verticillioides产毒,伏马毒素的产生量降低。
4 结论
伏马毒素在世界范围内广泛分布,不仅严重影响农作物品质,还对人和动物健康造成潜在的危害。本研究在已有报道的基础上[30-31],从发霉玉米中分离鉴定产伏马毒素的F.verticillioides,系统地研究了其在不同培养基、温度、时间、水分含量条件下产生伏马毒素的量,揭示了伏马毒素的产生规律,对F.verticillioides和伏马毒素污染防控具有重要意义。
[1]FREUDENSCHUSSM,JAUNECKER G,KRSKA R.Fumonisin B1-isolation and analytical characterisation for the application as reference material[J].Mycotoxin Research,2003,19(2):194-197.
[2]VISENTIN I,TAMIETTIG,VALENTINO D,et al.The ITS region as a taxonomic discriminator between Fusarium verticillioides and Fusarium proliferatum[J].Mycological Research,2009,113(10):1137-1145.
[3]郭聪聪,朱维芳,付萌,等.甘肃省玉米籽粒中镰孢菌分离频率及伏马毒素含量监测[J].植物保护学报,2015,42(6):942-948.
[4]GELINEAU-VANW J,STARR L,MADDOX J,et al.Maternal fumonisin exposure and risk for neural tube defects:mechanisms in an in vivo mousemodel[J].Birth Defects Research Part A:Clinical and Molecular Teratology,2005,73(7):487-497.
[5]GIANNITTIF,DIAB SS,PACIN A M,et al.Equine leukoencephalomalacia(ELEM)due to fumonisins B1 and B2 in Argentina[J].Pesquisa Veterinária Brasileira,2011,31(5):407-412.
[6]HASCHEKW M,GUMPRECHT L A,SMITH G,et al.Fumonisin toxicosis in swine:an overview of porcine pulmonary edema and current perspectives[J].Environmental Health Perspectives,2001,109(Suppl2):251-257.
[7]MATHUR S,CONSTABLE P D,EPPLEY R M,et al.Fumonisin B1 is hepatotoxic and nephrotoxic in milk-fed calves[J].Toxicological Sciences,2001,60(2):385-396.
[8]GARCIAJC D R,RAMOSM C,PINTON P,et al.Evaluation of the cytotoxicity of aflatoxin and fumonisin in swine intestinal cells[J].Revista Iberoamericana de Micologia,2007,24(2):136-141.
[9]FERNANDES F T,INGBERMANM,CARON L F.Naturally contaminated feed with low levels of fumonisinswith anti-mycotoxin additive and its impact in the immune cells and blood variables in broiler chickens[J].Journal of Toxicology and Environmental Health Sciences,2014,6(10):203-211.
[10]邱茂锋,刘秀梅.某食管癌高发区人群伏刀菌素摄入量及尿二氢神经鞘氨醇/神经鞘氨醇比值的调查[J].卫生研究,2001,30(6):365-367.
[11]邹小农,鲁凤珠,张思维,等.中国1990年—1992年食管癌死亡分布特征分析[J].中国肿瘤,2002,11(8):446-449.
[12]曾甜甜,卢小东,陈路芳,等.伏马霉素通过上调 TGFβ信号通路促进 HepG2细胞增殖[J].江苏大学学报(医学版),2014,24(2):115-121.
[13]RAHAYU D,RAHAYUW P,LIOE H N,et al.The effect of temperature and humidity on the growth of Fusarium verticillioides BIO 957 and fumonisin B1 productions[J].Agritech,2015,35(2):156-163.
[14]SEWRAM V,MSHICILELIN,SHEPHARD G S,et al.Production of fumonisin B and C analogues by several Fusarium species[J].Journal of Agricultural and Food Chemistry,2005,53(12):4861-4866.
[15]田雪亮,陈锡岭,王洪亮.串珠镰刀菌产生毒素条件研究[J].微生物学杂志,2007,26(6):45-47.
[16]李俊霞,廖大国.四川玉米串珠镰刀菌产毒素条件的研究[J].粮食储藏,2011,40(2):44-46.
[17]曲远航,王琦,姚彦坡,等.马铃薯晚疫病生防木霉菌的筛选及鉴定[J].菌物学报,2014,33(6):1231-1241.
[18]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[19]BOOTH C.The genus fusarium[M].UK:Commonwealth Mycological Institute,1971.
[20]裴冬丽,刘春元,吴建宇,等.河南省玉米穗粒腐病病原串珠镰刀菌鉴定[J].玉米科学,2011,19(1):136-138.
[21]BAILLY JD,QUERIN D,TARDIEU D,etal.Production and purification of fumonisins from a highly toxigenic Fusarium verticilloides strain[J].Revue De Medecine Veterinaire,2005,156(11):547-554.
[22]史晓榕,白丽.不同类型玉米群体穗粒腐病病原菌的调查研究[J].植物保护,1992,18(5):28-29.
[23]WHITE D G.Compendium of corn diseases[M].USA:American Phytopathological Society,1999.
[24]CHULZE SN,RAMIREZM L,TORRESA,et al.Geneticvariation in Fusarium section Liseola from no-tillmaize in Argentina[J].Applied and Environmental Microbiology,2000,66(12):5312-5315.
[25]白金铠,尹志,胡吉成.东北玉米茎腐病病原的研究[J].植物保护学报,1988,15(2):93-98.
[26]张超冲,贤振华,韦继光,等.玉米青枯病菌的侵染及发病规律研究[J].广西农学院学报,1983(1):53-62.
[27]黄思良,卢维宏,陶爱丽,等.南阳市玉米穗腐病致病镰刀菌种群结构分析[J].南阳师范学院学报,2012(3):54-57.
[28]代喆,王雅玲,孙力军,等.利用 Fusarium poae制备 T-2毒素的培养条件和提取方法[J].微生物学杂志,2012,31(5):40-44.
[29]师雯,韩铮,武爱波,等.温度和 pH对不同镰刀菌生长及产毒的影响[J].食品工业科技,2015,36(18):117-122.
[30]PRADEEP F,BEGAM M,PALANISWAMY M,et al.Influence of culture media on growth and pigment production by Fusarium moniliforme KUMBF1201 isolated from paddy field soil[J].World Applied Sciences Journal,2013,22(1):70-77.
[31]刘秀梅,王晓英,邱茂锋,等.串珠镰刀菌伏马菌素产毒基因及毒力的测定[J].中华预防医学杂志,2005,39(4):249-252.
Isolation and identification of fumonisin-producing strains from maize and research on their toxin-producing conditions
GUOWen-bo,SHEN Yuan-yuan,YANG Jun-hua,FAN Kai,ZHAO Zhi-hui,HAN Zheng*
(Institute of Agro-Food Quality Standards and Testing Technology,Shanghai Key Laboratory of Protected Horticultural Technology,Shanghai Service Platform of Agro-Products Quality and Safety Evaluation Technology,Shanghai Engineering Research Center of Agro-Products Quality and Safety,Shanghai Academy of Agricultural Sciences,Shanghai201403,China)
To isolate and identify the fungi producing fumonisins B1 and B2(FB1 and FB1)from moldy maize and investigate the conditions(medium,temperature,incubation time and water content)for the fungi to produce fumonisins,the extract ofmoldy maize were inoculated on PDA medium,and the toxigenic strains were isolated by plate streak approach.The species of the strains were identified respectively by morphologic observation and rDNA-ITS analysis,then the strains were inoculated on different media and cultured under different temperatures,incubation times and water contents,and finally the FB1 and FB2 were quantitatively determined by high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS).The BLAST showed that the isolated strains and the Fusarium verticillioides KC709665.1,KR020684.1 and KR052812.1 in the NCBIwere 100%in DNA sequence homology,demonstrating the isolated strain to be F.verticillioides.The inoculation experiment showed that the optimal conditions for fumonisins production were 40%water content and maizemedium at28℃ in dark for 4 weeks,and the FB1 and FB2 yields could be up to 821.08 mg/kg and 339.50 mg/kg respectively.The fumonisin-producing strains in the testedmaizeweremainly F.verticillioides,and the fumonisins production was closely related to such environmental factors as culturemedium,temperature,time and water content.
Fumonisin;Fusarium verticillioides;Isolation;Toxin-producing conditions;Maize
Q93-331
A
1000-3924(2017)06-078-07
2016-09-08
上海市科技兴农重点攻关项目[沪农科攻字(2015)第6-3-2号]
郭文博(1988—),男,硕士,研究实习员,研究方向:农产品质量安全。E-mail:guo1103bo@126.com,Tel:021-67131637
*通信作者:韩铮(1983—),男,博士,研究员,研究方向:农产品质量安全。E-mail:hanzheng_ok@163.com,Tel:021-37196975
程智强)
