来源于盐惰菌属Halopiger xanaduensis的木聚糖酶基因在毕赤酵母中诱导表达及其酶学性质的研究
2018-01-05于成野韩红娟付晓燕游双红朱恒文彭日荷姚泉洪
于成野,韩红娟,付晓燕,游双红,孙 淼,朱恒文,彭日荷,姚泉洪*
(1上海市农业科学院生物技术研究所,上海 201106;2上海海洋大学食品学院,上海 201306)
来源于盐惰菌属Halopiger xanaduensis的木聚糖酶基因在毕赤酵母中诱导表达及其酶学性质的研究
于成野1,2,韩红娟1,付晓燕1,游双红1,孙 淼1,朱恒文1,2,彭日荷1,姚泉洪1*
(1上海市农业科学院生物技术研究所,上海 201106;2上海海洋大学食品学院,上海 201306)
根据毕赤酵母的密码子偏爱性和木聚糖酶的蛋白序列设计并合成了木聚糖酶基因片段,与表达载体pYPX88连接,构建成分泌表达载体;构建的分泌表达载体经BglⅡ酶切后电击转化到毕赤酵母GS115中,筛选得到阳性克隆。研究了重组木聚糖酶的最适pH、pH稳定性、最适温度、温度稳定性以及部分金属离子、十二烷基硫酸钠(SDS)和二硫苏糖醇(DTT)对该酶性质的影响。结果表明:重组木聚糖酶最适pH为6.0,在pH 4.5—8.0时酶学性质稳定;最适温度为60℃,在20—65℃时酶学性质稳定;金属离子Mn2+与Cu2+对该酶有抑制作用,化合物DTT对该酶有明显促进作用。
木聚糖酶;毕赤酵母;酶学性质
木聚糖是半纤维素的主要成分,主链由多个D-木糖残基通过β-1,4糖苷键连接而成[1],在自然界中占植物生物量的20%—40%[2-3]。木聚糖酶作用于木聚糖使其水解为低聚木糖以及木糖[4]。广义的木聚糖酶主要由 β-1,4-木聚糖内切酶、β-1,4-木聚糖酶和β-1,4-木聚糖外切酶组成[5]。随着酶产业的发展,木聚糖酶大量用于日常工业生产,在造纸、医疗、酿酒、果蔬加工等行业应用明显增加[6-7]。传统工业中如造纸行业的纸浆漂白需大量的化学试剂处理,对环境的危害程度很大且回收利用率低,而木聚糖酶等酶的利用可减少化学试剂的大量使用,进而减少对环境的危害。
自然界中存在多种野生型木聚糖酶产生菌,但大多数木聚糖酶产生菌产率不高,较高的在45 IU/mL左右[8],且多数酶活很低。本试验研究的木聚糖酶基因来源于耐盐菌株Halopiger xanaduensis,该菌是古菌域广古菌门惰盐菌属的原核生物。此类菌株本身利用葡萄糖、半乳糖以及木糖的能力很低,但在其体内却发现了40余种糖基水解酶以及5种多糖裂解酶。其中木聚糖酶基因就是众多糖基水解酶基因的一种,但该基因在该物种中的利用率极低,造成了基因的浪费。近年来,有关来源于盐惰菌属的木聚糖酶基因的研究未见报道。本试验拟采用人工合成的方法,根据木聚糖酶的蛋白序列以及毕赤酵母的密码子偏爱性合成木聚糖酶基因片段,并构建表达载体,在常用外源蛋白表达菌种毕赤酵母[9-10]中表达,研究木聚糖酶蛋白的酶学特性,以期对工业生产有所助益。
1 材料与方法
1.1 菌株、载体、试剂以及主要试验器材
用于基因表达的毕赤酵母菌株GS115生产于美国Invitrogen公司。表达载体pYPX88(GenBank编号:AY178045)由本实验室自行设计。克隆载体PGEM-t购于Promega公司,限制性内切酶、DNA连接酶、TaqDNA聚合酶购于Takara公司,底物木聚糖由上海生工生物工程有限公司提供,目的蛋白提纯所用镍柱由Sigma公司提供,其他药品均为分析纯级。
1.2 木聚糖酶基因的合成与基因扩增
本研究中木聚糖酶基因来源于菌株Halopiger xanaduensis(GenBank编号:wp_013881271)。根据木聚糖酶的蛋白序列和毕赤酵母的密码子偏爱性,采用两步PCR的方法(PTDS法)合成目的基因[11]。首先通过NCBI上公布的Halopiger xanaduensis木聚糖酶基因片段构建多段60 bp左右具有重叠序列的引物,引物由上海生工生物工程有限公司合成。利用该引物合成480 bp左右的中长度片段,再利用中长度片段合成全长目的基因。在其3’端和5’端分别引入Bam HⅠ和Sac lⅠ切点,将合成的基因片段克隆到克隆载体PGEM-t中转化后测序,将Bam HⅠ和Sac1Ⅰ双酶切后的质粒通过凝胶电泳回收目的基因片段,把回收的基因片段克隆到表达载体pYPX88中。由于电击到酵母细胞中需要的质粒浓度较高,所以将连接产物转化到大肠杆菌DH5α中富集,在含150μg/mL的卡那霉素LB固体培养基中培养过夜,挑取单菌落于含150μg/mL的卡那霉素LB液体培养基中培养过夜,抽提质粒并用BglⅡ进行酶切鉴定。
1.3 重组质粒的转化和筛选
通过电击转化的方法把重组载体转化到毕赤酵母菌株GS115中,转化后的毕赤酵母菌株涂布于SD-山梨醇培养基上[K2HPO4·3H2O 6.6 g/L、KH2PO427 g/L、(NH4)2SO420 g/L、MgSO4·7H2O 2 g/L、NaCl 0.4 g/L、CaCl20.3 g/L、硼酸 0.1 g/L、FeCl30.04 g/L、山梨醇 0.5 g/L]28℃培养 72 h。挑取单菌落,划线于SD培养基中,28℃培养48 h。取pH为5.3的柠檬酸缓冲液、体积浓度为1%的木聚糖溶液、甲醇浓度为1%的BMMY培养基(SD培养基50%,双蒸水50%)各50μL混合,将预混样注入40孔板,挑取划线培养基中单克隆菌落于40孔板中,28℃摇床培养24 h。取出培养液,8 000 r/min离心1 min,取上清,用DNS显色法进行显色[12],上清液与DNS混合,100℃煮沸10 min,混合液显红色即为转化成功的阳性克隆;双蒸水50μL,木聚糖底物100μL,60℃反应10 min后加入150μL的DNS溶液,100℃显色15 min做为空白对照。
1.4 转化后阳性克隆的诱导表达
挑取酵母阳性克隆转化子于50 mL BMGY培养基中(甘油浓度为1%),28℃培养24 h,4℃、8 000 r/min离心8 min,取沉淀用100 mL去离子水重悬,8 000 r/min离心8 min,取沉淀,在100 mL BMMY(甲醇浓度为1%)培养基中诱导72 h,每24 h补充一次甲醇,使甲醇浓度始终为1%。取50 mL诱导液于4℃、8 000 r/min离心15 min,上清即为诱导酶液。
1.5 诱导酶液的去糖基化与纯化
糖基化现象在毕赤酵母表达体系中比较常见,酶蛋白分子糖基化会造成SDS-PAGE电泳结果与理论推算酶蛋白分子量值不符且所得蛋白分子量偏大的现象,为了验证所得蛋白分子量为试验木聚糖酶蛋白,用去糖基化酶处理酵母诱导表达的酶液。聚丙烯酰氨凝胶电泳(SDS-PAGE)验证去糖基化与未去糖基化酶液样本,如有糖基化现象的存在,去糖基化酶处理样本条带应低于未处理样本,电泳过后的凝胶用考马斯亮蓝R-250进行过夜染色(Sangon)。取用SDS-PAGE验证过的粗酶液,用琼脂镍柱(Ni-NTA)进行纯化。
1.6 酶活以及酶学特性的测定
木聚糖酶酶活的测定采用DNS显色法。150μL的反应体系包括50μL酶液和100μL底物(底物为质量浓度为1%的木聚糖溶液),60℃反应10 min后加入150μL DNS溶液,100℃显色15 min,酶标仪540 nm处测量其OD值,酶活测定方法参考文献[13-14]。
测定最适 pH与 pH稳定性的缓冲液为:柠檬酸-磷酸缓冲液(pH 2.0—7.0),Tirs-HCl缓冲液(pH 7.0—9.0),甘氨酸-NaOH缓冲液(pH 9.0—10.0)。测定的 pH分别为 2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0。pH稳定性的测定是将酶液在相应的 pH溶液中常温处理2 h。最适温度与温度稳定性的测定选用的温度为20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃、75℃、80℃、85℃、90℃。温度稳定性的测定是在相应的温度条件下处理酶液2 h,并在最适pH溶液中测定其酶活。
金属离子及化合物SDS、DTT对酶活性的影响试验在最适温度与最适pH的环境下进行。毕赤酵母诱导表达纯化后酶液在对应离子溶液中处理12 h,在SDS与DTT溶液中处理12 h。利用处理后酶液与木聚糖底物反应,进行相应酶活测定。测定的金属离子为 Zn2+、Mg2+、Mn2+、Fe2+、Fe3+、Al3+、Pb2+、Ca2+、K+、Ni2+、Na+、Cr2+、Cu2+、NH4+、Co2+。溶液中金属离子浓度均为10 mmol/L。将金属离子溶液置换成水作为对照。
2 结果与分析
2.1 载体构建
根据毕赤酵母密码子的偏爱性以及Halopiger xanaduensis基因的特点构建木聚糖酶基因序列,连接到克隆载体上。结果表明:目的基因序列正确,经酶切得到的基因片段与表达载体pYPX88连接得到重组质粒;重组质粒经BglⅡ酶切后,电泳所得基因片段长度与预期相符。
2.2 重组质粒阳性克隆的筛选与表达
重组质粒与毕赤酵母感受态细胞电击转化后72 h即在SD-山梨醇平板上长出单菌落,利用40孔板法筛选出阳性克隆,用含1%甘油的BMGY培养基富集菌体,利用甲醇在BMMY培养基中诱导表达,DNS显色为红色,说明转化子成功分泌并表达了木聚糖酶蛋白。空白对照未出现显色反应。试验成功筛选出8个阳性克隆转化子,选取红色最深的单克隆诱导表达木聚糖酶。
2.3 木聚糖酶酶液的SDS-PAGE电泳
取1.4中所述步骤得到的酶液1 mL,利用去糖基化酶对其进行去糖基化,分别取16μL原酶液和去糖基化酶液与4μL Loading Buffer混合,SDS-PAGE电泳2 h,考马斯亮蓝过夜染色,脱色液脱色6 h。酶液经去糖基化酶处理后,蛋白的分子量在45 kD左右(图1)。
2.4 酶学特性
木聚糖酶最大反应速率为219μmol/(min·mg),纯化后酶液浓度为200μg/mL。酶液的Km值为2.2 mol/L。重组木聚糖酶最适pH为6.0,在pH为5.0—8.0时相对酶活达到50%以上,当pH小于3.5或者大于8.5时,酶活较低,且酶活降低速率较快(图2)。在pH为4.5—8.0的缓冲液中处理酶液2 h后,其残余酶活仍在85%及以上,说明重组的木聚糖酶具有较好的pH稳定性(图3)。重组木聚糖酶的最适温度为60℃(图4),当温度低于30℃或者高于80℃时酶活较低。在温度稳定性方面,酶液在20—65℃处理后,相对残余酶活为60%以上(图5)。金属离子以及部分化合物对酶液的影响中(图6),大部分离子,如 Zn2+、Mg2+、Ca2+、K+、Fe2+、Ni2+、Cr2+、Na+、NH4+,能够增强重组木聚糖酶的酶活性,而Mn2+、Cu2+对酶有抑制作用,DTT能明显增强酶活性。
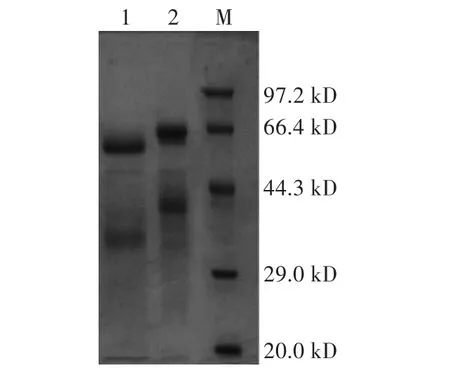
图1 SDS-PAGE检测重组木聚糖酶蛋白Fig.1 Detection of recombinant xylanase protein by SDS-PAGE
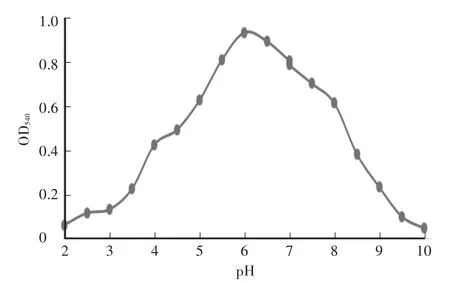
图2 重组木聚糖酶的最适pHFig.2 The optimum pH of recombinant xylanase

图3 重组木聚糖酶的pH稳定性Fig.3 The pH stability of recombinant xylanase
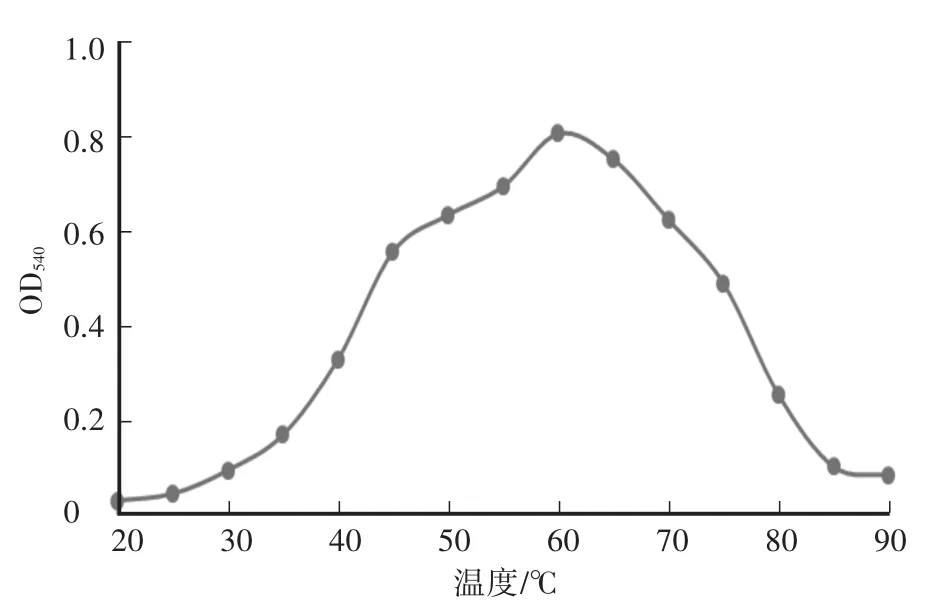
图4 重组木聚糖酶的最适温度Fig.4 The optimum tem perature of recombinant
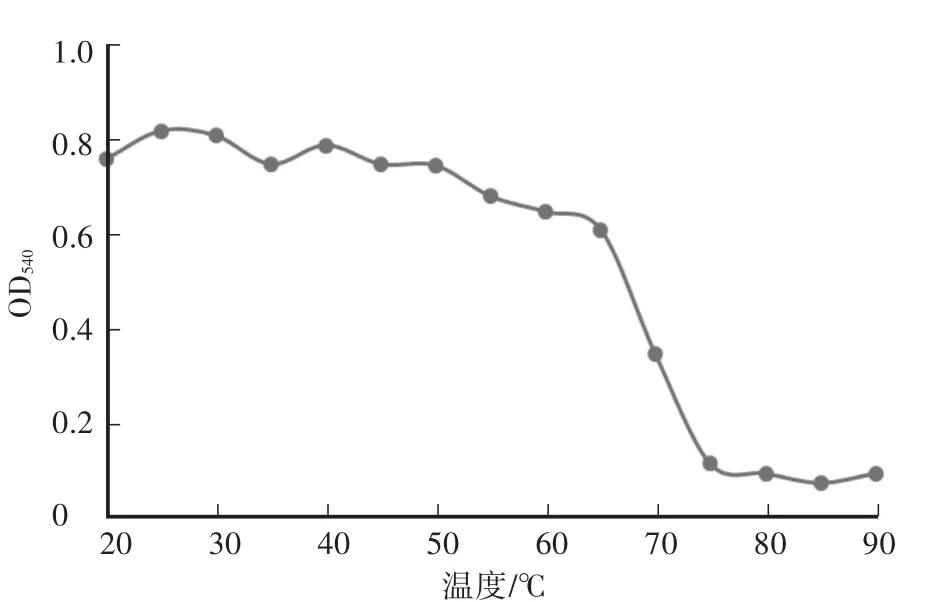
图5 重组木聚糖酶的温度稳定性Fig.5 The tem perature stability of recombinant xylanase

图6 金属离子及SDS、DTT对重组木聚糖酶活性的影响Fig.6 Effects ofmetal ions and SDS,DTT on the activity of recombinant xylanase
3 结论与讨论
自然界中木聚糖酶的来源十分丰富,每种木聚糖酶的酶学性质也不完全相同,不同的行业对其酶学特性也有其特殊的要求。在木聚糖酶的工业应用过程中,高的酶活和水解能力是十分重要的,因此,寻找野生型高产菌株以及通过基因突变等生物技术手段改造木聚糖酶基因越来越受到科研工作者的重视。在产木聚糖酶菌株方面,此前曾有报道在耐热与低温菌中寻找到的产木聚糖酶菌株[15-16],也分别对其酶学特性做了研究,表明木聚糖酶的耐热与耐低温多与其来源菌株所处环境相关。
木聚糖酶的活性发挥受到很多金属离子的影响。本研究表明,Mn2+、Cu2+对该酶有抑制作用,这与Cu2+等离子与酶的反应底物木聚糖发生络合反应形成络合物从而使有效底物浓度降低有一定关联,而多数金属离子如Cr2+等对酶有促进作用。巯基化合物DTT对该酶有明显的促进作用,与未添加DTT的反应体系比较,其酶活增强了2.5倍左右。
目前,木聚糖酶作为动物饲料添加剂与食品添加剂主要存在2个方面的问题,即木聚糖酶温度的稳定性和pH最适范围。本研究中Halopiger xanaduensis来源的木聚糖酶基因与其他来源的木聚糖酶基因比较有一定优势。首先,温度的稳定性较好,在20—65℃均有较高酶活,很好地解决了饲料生产过程中因造粒而产生的高温影响酶活性的问题。其次,在pH稳定性方面跨度较大,可以适应pH 4.5—9.0的范围。
[1]王秋影,廖美德.木聚糖酶的研究进展[J].饲料博览,2013(6):8-12.
[2]孙超,陈卫平.微生物木聚糖酶及其应用研究进展[J].中国酿造,2013,32(4):24-29.
[3]NOKUTHULA PM,SUREN S,KUGEN P.Expression of an alkalo-tolerant fungal xylanase enhance by directed evolution in Pichia pastoris and Escherichia coli[J].Journal of Biotechnology,2009,141:26-30.
[4]李思佳.木聚糖酶1YNA及其突变体在毕赤酵母中的表达和酶特性鉴定[D].武汉:中南民族大学,2013.
[5]王丹丹.木聚糖酶基因克隆和表达的研究进展[J].中国生物制品学,2013,26(8):1193-1196.
[6]马文静,张美云,房桂干.木聚糖酶的应用研究进展[J].江苏造纸,2008(1):20-24.
[7]阮同琦,赵祥颖,刘建军.木聚糖酶及其应用研究进展[J].山东食品发酵,2008(1):42-46.
[8]郭清吉.木聚糖酶产生菌的筛选、酶学性质及宏基因组文库的构建与筛选[D].青岛:青岛科技大学,2008.
[9]SUEM P,MARIANA L F,BRIAN M,et al.Heter-Ologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22:249-270.
[10]MCHUNU N P,SINGH S,PERMAUL K.Expression of an alkalotolerant fungal xylanase enhanced by directed evolution in Pichia pastoris and Escherichia coli[J].JBiotechnol,2009,141(1/2):26-30.
[11]XIONG A S,YAO Q H,PENG R H,et al.A simple,rapid,high fidelity and cost-effective PCR based two-step DNA synthesis(PTDS)method for long gene sequences[J].Nucleic Acids Research,2004,32(12):e98.
[12]陈红歌,朱静,梁改琴,等.黑曲霉木聚糖酶的纯化与性质[J].菌物系统,2000,19(1):111-116.
[13]林俊芳,刘志明,陈晓阳,等.真菌漆酶的酶活测定方法评价[J].生物加工过程,2009,7(4):1-8.
[14]SUN J,PENG R H,XIONG A S,et al.Secretory expression and characterization of a soluble laccase from the ganoderma lucidum strain 7071-9 in pichia pastoris[J].Molecular Biology Reports,2012,39(4):3807-3814.
[15]张慧敏,李剑芳,邬敏辰,等.耐热木聚糖酶基因在毕赤酵母中的表达及酶学性质[J]食品与生物技术学报,2013,32(2):124-128.
[16]李秀婷.嗜热真菌Thermomyces lanuginosus耐热木聚糖酶性质及应用研究[D].北京:中国农业大学,2004.
Induced expression of xylanase gene from Halopiger xanaduensis in Pichia pastoris and its enzymatic properties
YU Cheng-ye1,2,HAN Hong-juan1,FU Xiao-yan1,YOU Shuang-hong1,SUN Miao1,ZHU Heng-wen1,2,PENG Ri-he1,YAO Quan-hong1*
(1Biotechnology Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai201106,China;2College of Food Science and Technology,Shanghai Ocean University,Shanghai201306,China)
The xylanase gene was designed and synthesized according to the codon preference of Pichia pastoris and xylanase protein sequence,which was connected with expression vector pYPX88 and constructed into secretory expression vector.The secretory expression vector was transformed into Pichia pastoris GS115 by electroporation after Bgl IIdigestion,and the positive clones were screened out.The optimum pH,pH stability,optimum temperature and temperature stability of the recombinant xylanase,and the effects of somemetal ions,sodium dodecyl sulfate(SDS),dithiothreitol(DTT)on the properties of the recombinant xylanase were studied.The results showed that the optimum pH of the recombinant xylanase was 6,and the enzyme properties were stable at pH 4.5—8.0;the optimum temperature was 60℃,and the enzyme properties were stable at 20—65℃;the metal ion Mn2+and Cu2+could inhibite the enzyme activity,and DTT coud promote the enzyme activity obviously.
Xylanase;Pichia pastoris;Enzymatic properties
2016-03-28
上海市农业委员会重点项目(No.2011-1-8;2013D-8)
于成野(1991—),男,在读硕士,研究方向:生物化学与分子生物学。E-mail:yuchengye163@163.com
*通信作者,E-mail:yaoquanhong777@163.com,Tel:021-62203180
Q78
A
1000-3924(2017)06-001-05
闫其涛)
