吸烟、F2RL3基因甲基化与稳定性冠状动脉粥样硬化性心脏病预后的关系
2018-01-05刘访遥雷长城唐娟
刘访遥,雷长城,唐娟
(南华大学附属第二医院 心血管内科,湖南 衡阳 421001)
吸烟、F2RL3基因甲基化与稳定性冠状动脉粥样硬化性心脏病预后的关系
刘访遥,雷长城,唐娟
(南华大学附属第二医院 心血管内科,湖南 衡阳 421001)
目的探讨F2RL3基因甲基化与稳定性冠状动脉粥样硬化性心脏病(简称冠心病)继发心血管事件、死亡率的相关性,及F2RL3基因甲基化与吸烟导致稳定性冠心病患者有害作用的关系。方法募集南华大学附属第二医院121例经历过急性冠状动脉综合征、心肌梗死或冠状动脉介入治疗后接受心血管康复计划的住院患者。随访超过8年。F2RL3基因位点甲基化特点采用Sequenom基质辅助激光解吸电离时间飞行质谱分析。F2RL3基因甲基化、吸烟与继发性心血管事件、特因和全因死亡率之间的相关性由估计混杂因素控制危险比的多变量Cox回归模型分析。结果随访期间,5例患者发生非致死性心肌梗死,4例患者发生非致死性脑卒中,6例患者发生心血管疾病死亡,5例患者因为其他原因死亡。调整已知预后因素后,Cox模型分析显示F2RL3基因甲基化与死亡率密切相关。与F2RL3基因甲基化四分位数最高的稳定性冠心病患者相比,四分位最低的患者死于心血管疾病、非心血管疾病或其他任何原因的校正危险比(95%CI)分别为2.32(0.97,5.58)、5.16(1.81,14.7)和3.19(1.64,6.21)。两组患者继发性心血管事件无相关性。将F2RL3纳入回归模型后,吸烟与所有预后结果的相关性减弱。结论F2RL3甲基化是吸烟有害影响的潜在介导者,并与稳定性冠心病死亡率密切相关。
稳定型冠状动脉粥样硬化性心脏病;甲基化;F2RL3
吸烟相关发病率和死亡率已成为世界性公共卫生系统的关键挑战[1]。控制吸烟仍然是主要措施,但许多吸烟者戒烟过程中遇到很大困难[2-3]。这种情况下,对与吸烟相关疾病的潜在发病机制进行深入研究和对吸烟潜在影响进行更深入理解,从而制定针对吸烟继发性疾病的有效预防措施具有重要临床意义。其中一个机制是表观遗传修饰,例如基因组DNA序列CpG位点甲基化。
最近有研究表明[4-5]未吸烟者和当前吸烟者间甲基化程度和特异性明显存在差异。尤其是F2RL3基因的CpG位点,其在吸烟者中显示出低甲基化水平。F2RL3基因编码蛋白酶活化受体4,参与血液凝固等生理过程,也是潜在的药物靶点[6-7]。因此,了解F2RL3甲基化的个体差异具有重要临床意义。
本研究报道检测了最近发现的F2RL3基因的CpG位点的甲基化程度与已建立的稳定性冠状动脉粥样硬化性心脏病(简称冠心病)高发人群的心血管标志物之间的相关性。此外,本文旨在确定这一位点的甲基化是否与继发性心血管疾病事件和死亡率相关,并且可能是吸烟导致的有害影响的潜在介导者。
1 资料与方法
1.1 研究对象
本前瞻性队列研究纳入2005~2007年121例由于近期急性心血管事件或心血管手术(急性冠状动脉综合征、心肌梗死或冠状动脉介入)而接受心血管康复治疗的住院患者,年龄30~70岁。患者接受定期随访至2015年12月,生存时间是指纳入研究开始至研究结束或在研究期间因任何原因死亡。
1.2 数据和样品采集
住院康复开始和结束时通过标准化调查问卷获得与健康相关数据。住院康复阶段结束时,采集空腹血标本并对血液进行离心分离,冷却,并储存在-80℃冰箱备用检测。而标准常规临床参数(γ谷氨酰转移酶、肌酐、空腹血糖、高密度脂蛋白、总胆固醇和三酰甘油的血清水平)从住院检查资料获得。康复出院后第1、3、4、5、6和8年,通过电子邮件方式联系受试者,非死亡性心脑血管事件(心肌梗死和脑卒中)信息通过标准化的问卷调查获得。
1.3 甲基化评估
基线时,提取受试者全血DNA。检测F2RL3基因Cg03636183位点CpG甲基化,研究已经证实该位点与吸烟行为相关,并采用Sequenom基质辅助激光解吸电离时间飞行质谱检测。样品首先使用EZ-96 DNA甲基化金试剂盒进行亚硫酸氢盐转化。随后,利用先前特定亚硫酸氢盐的引物对包含cg03636183扩增子和邻近6个外加CpG位点进行扩增。碱性磷酸酶(SAP)处理后,用Rnase A进行切割,树脂清洗,PCR产物片段被转移到384 SpectroCHIPs并与通过美国Sequenom公司质谱系统连同SpectroACQUIRE v3.3.1.3和MassARRAY EpiTyper V1.0软件相结合进行测定。DNA甲基化的标准(0%、20%、40%、60%、80%和100%)被用来作为控PCR扩增偏差的对照。
1.4 统计学方法
采用SPSS 19.0统计学软件处理数据,非正态计量资料以中位数(Q1~Q3)表示,比较采用秩和检验,相关分析采用Spearman法,Kaplan -Meier法绘制生存曲线,比较采用log-rank检验,P<0.05为差异有统计学意义,影响因素的分析采用Cox回归模型。
2 结果
2.1 一般结果
共121例患者纳入本次研究,随访期间,5例患者发生非致死性心肌梗死,4例患者发生致死性卒中,6例患者发生心血管疾病的死亡,5例患者死于其他原因。受试者重要基线特征见表1。半数以上的受试者年龄在60岁以上,男性占主导地位。大约70%的受试者目前或曾经吸烟。
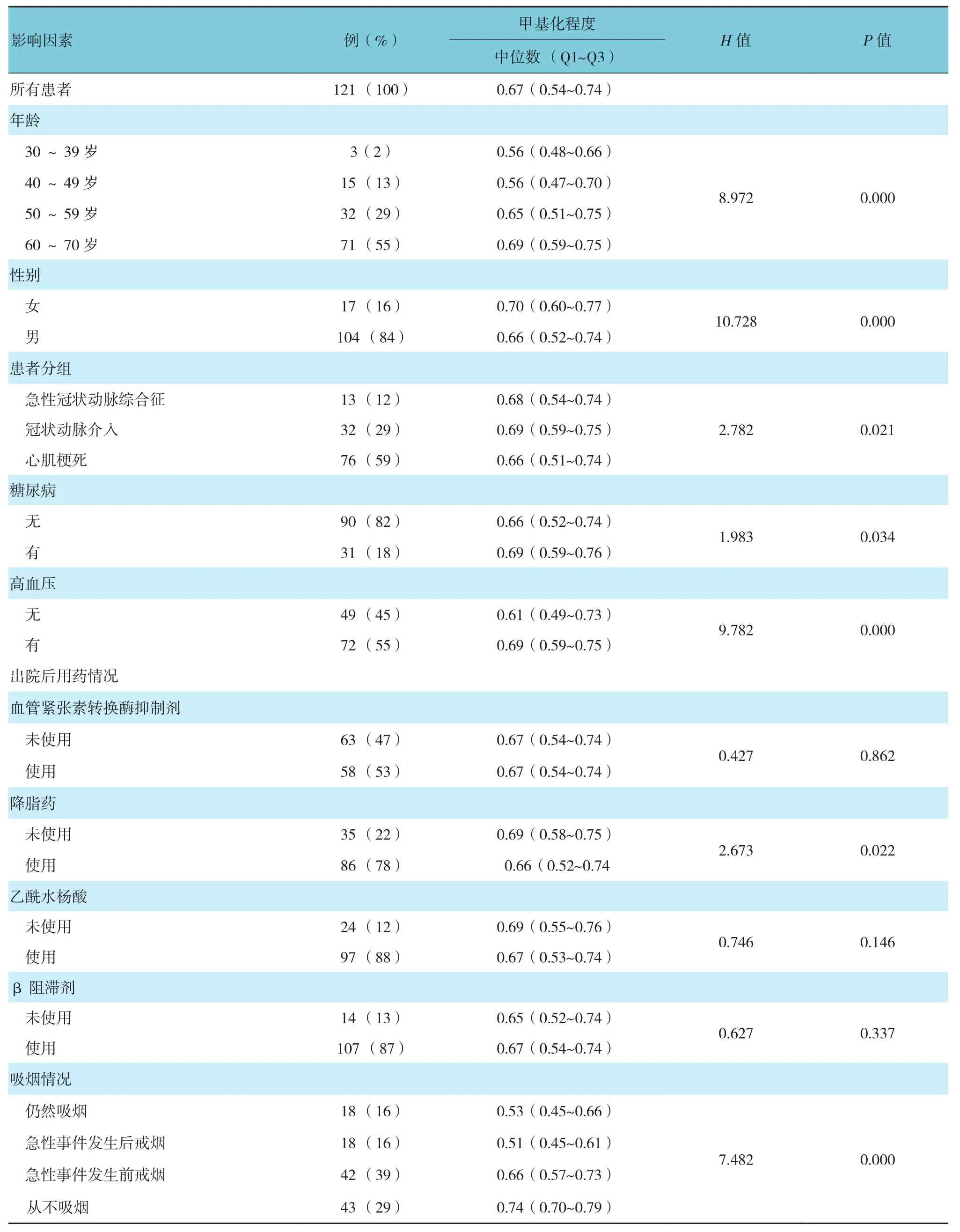
表1 稳定冠心病患者不同影响因素F2RL3甲基化基线情况 (CpG-4)
2.2 F2RL3甲基化程度与心血管危险标志物的相关性
F2RL3基因甲基化程度与年龄呈正相关,与性别也具有相关性。高血压患者表现出较高的甲基化水平。从不吸烟受试者、目前仍然吸烟受试者及心血管急性事件发生后戒烟受试者的F2RL3基因甲基化水平明显不同。调整年龄、性别、吸烟后,持续心血管疾病风险指标相关性发现,F2RL3基因甲基化程度与血清白蛋白Spearman相关系数>0.10,与N末端原B-利尿钠肽、高敏C反应蛋白和白细胞介素6 Spearman相关系数<-0.10。见表2。
2.3 F2RL3甲基化程度与患者预后相关性
根据F2RL3甲基化程度四分位数分层后,Kaplan-Meier曲线分析4组患者生存事件差异(见附图)。与F2RL3甲基化最低的两组患者相比,F2RL3甲基化四分位数最高的两组患者预后更好。随访期后期,F2RL3甲基化四分位数最低组患者全因死亡率增加。控制潜在混杂变量后,各组患者估计危险比见表3。甲基化四分位数最低组患者全因死亡率风险比甲基化四分位数最高组患者的3倍。调整F2RL3甲基化后,持续吸烟者的危害比明显下降。见表4、5。
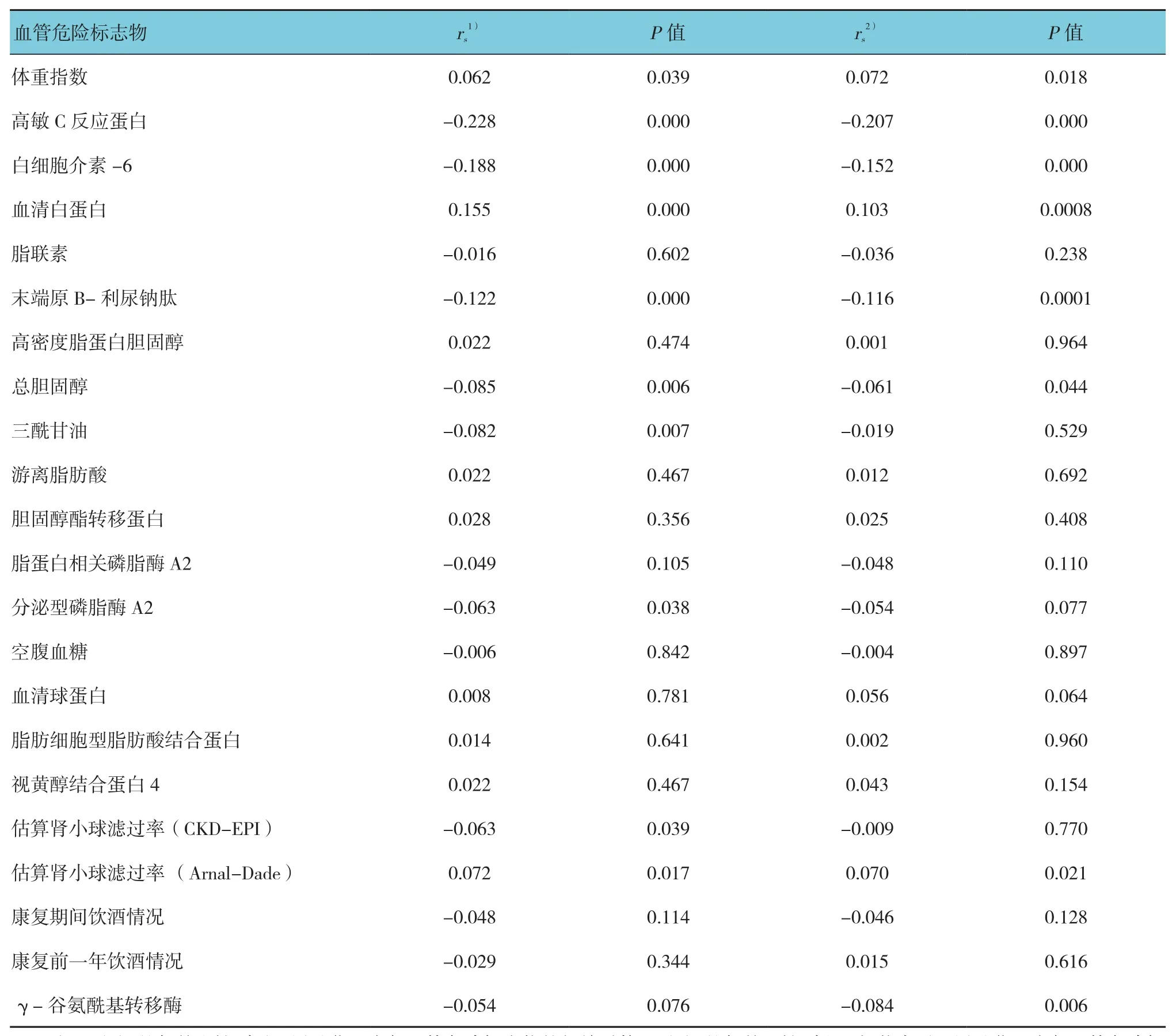
表2 F2RL3甲基化程度与血管危险标志物的相关性分析
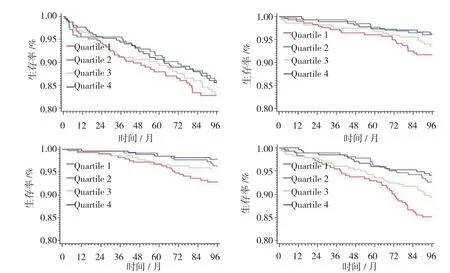
附图 4种结局的生存曲线分析

表3 F2RL3甲基化程度和稳定性冠心病患者预后的Cox回归模型分析
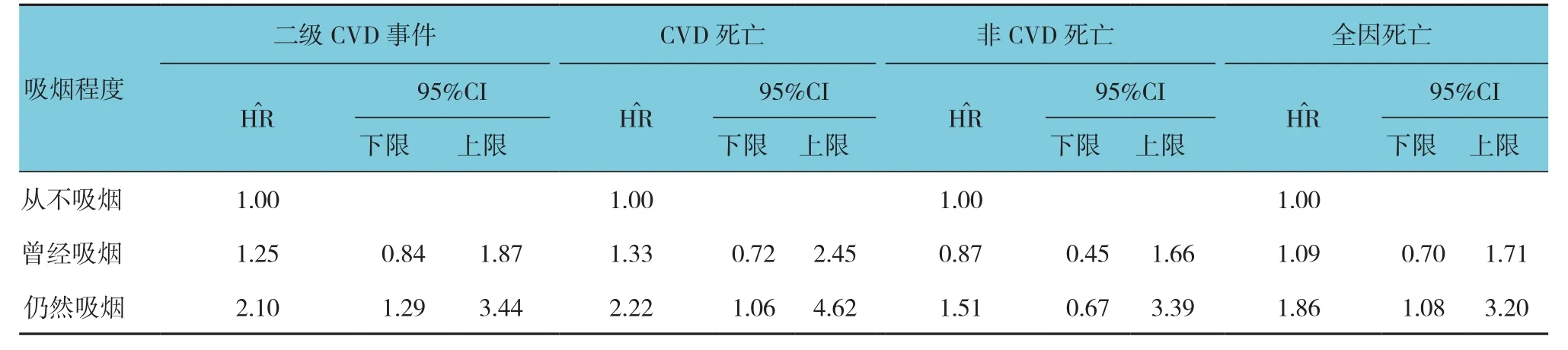
表4 经年龄和性别调整后,吸烟和和稳定性冠心病患者预后的COX回归模型分析
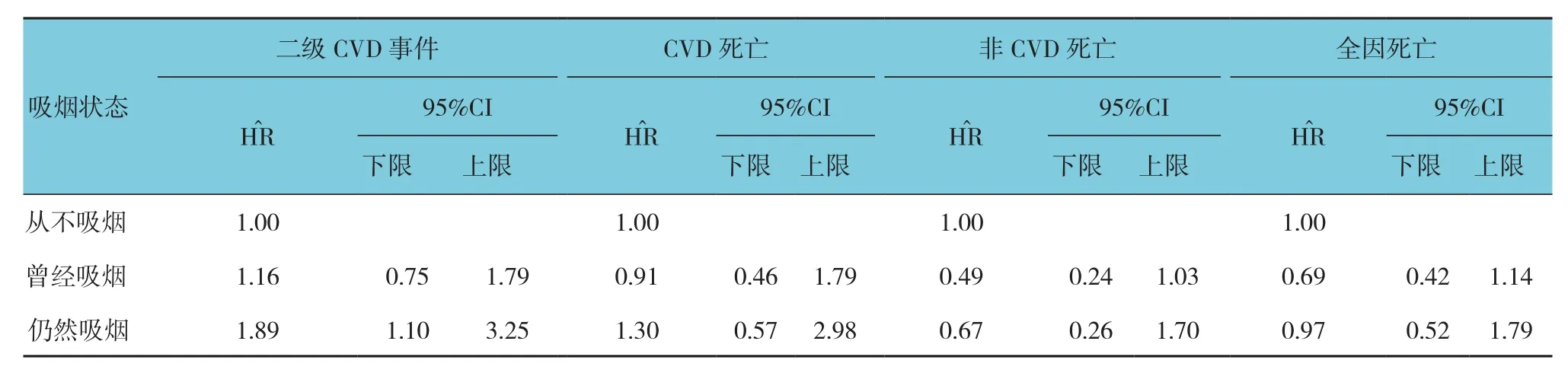
表5 经年龄、F2RL3甲基化和性别调整后,吸烟和和稳定性冠心病患者预后的COX回归模型分析
3 讨论
本研究结果表明稳定性冠心病患者F2RL3基因低甲基化程度与死亡率相关。甲基化水平仅与几种目前一致心血管风险标志物相关,并且与预后关联性很大程度上独立于潜在混杂因素。
F2RL3基因甲基化近来发现与吸烟行为、心血管发病率和全因死亡率的发生风险有关,但对于甲基化程度差异的功能效应还没有证据显现[8]。鉴于F2RL3基因产物在血小板活化,内膜增生和炎症过程发挥作用[9],因此F2RL3基因甲基化与心血管患者预后相关并不令人感到意外。这一相关性类似于其他风险预测标志物如炎症标志物和肥胖相关变量与心血管患者预后的相关性,并且还能延伸至非心血管死亡率。非致死性和致死性心血管事件之间的关联性的不同解释仍然需要进一步探索。
基于单学科知识,鉴别出独立、有效且与已知疾病途径和标志物无内在联系的风险预测物非常困难[10]。近来研究发现F2RL3甲基化与吸烟相关。尽管在Cox多元回归分析中,F2RL3甲基化作为验证吸烟行为的标志物进行调整,但在本组心血管基本患者中F2RL3甲基化仍然与预后相关。除N末端原B-利尿钠肽和C-反应蛋白2种特别建立,且高度变异变量等危险因子外,本组其他危险因素均与患者预后无相关性。C反应蛋白是F2RL3编码蛋白酶活化受体4的下游生理分子,小鼠模型中,C反应蛋白活化导致炎症反应[11]。人类和动物研究发现C-反应蛋白至少与冠心脏病的因果关系被排除[12],F2RL3甲基化改变血小板生物学和凝血功能的作用更能解释F2RL3甲基化与心血管疾病死亡的相关性[13]。
多学科研究方法探讨F2RL3甲基化与心血管疾病死亡的相关性十分重要。任何情况下,对F2RL3甲基进行校正后,持续吸烟与各种死亡结果的相关性减弱,提示F2RL3甲基化是吸烟有害影响的潜在介导者。无论对何种因果关系进行考察,F2RL3甲基化都是与吸烟有关的风险预测标志物,临床结果显示,与已验证的吸烟行为标志物相比,F2RL3甲基化表现出更为紧密的相关性。这可能是由于F2RL3甲基化更接近于病理生理进程,或者是由于F2RL3甲基化能够准确反映过去和现在的吸烟暴露强度,或者是这2种机制的组合。
总之,本研究结果支持F2RL3 CpG位点甲基化差异与临床的相关性。F2RL3甲基化是吸烟有害影响的潜在介导者,并与稳定性冠心病死亡率密切相关。
[1]PIRIE K, PETO R, REEVES G K, et al. The 21st century hazards of smoking and benefits of stopping: a prospective study of one million women in the UK[J]. The Lancet, 2013, 381(9861): 133-141.
[2]石荟, 徐浩, 白冲, 等. 2010-2011年上海市医院工作人员吸烟及控烟状况调查[J]. 中华结核和呼吸杂志, 2013, 36(6): 420-424.
[3]张梅, 李镒冲, 姜勇. 我国居民对烟草危害及控烟问题的认知情况[J]. 中国健康教育, 2012, 28(2): 101-103.
[4]ZEILINGER S, KÜHNEL B, KLOPP N, et al. Tobacco smoking leads to extensive genome-wide changes in DNA methylation[J].PloS one, 2013, 8(5): e63812.
[5]SHENKER N S, UELAND P M, POLIDORO S, et al. DNA methylation as a long-term biomarker of exposure to tobacco smoke[J]. Epidemiology, 2013, 24(5): 712-716.
[6]ZHANG Y, SCHÖTTKER B, ORDÓÑEZ-MENA J, et al. F2RL3 methylation, lung cancer incidence and mortality[J]. International Journal of Cancer, 2015, 137(7): 1739-1748.
[7]ZHANG Y, YANG R, BURWINKEL B, et al. F2RL3 methylation in blood DNA is a strong predictor of mortality[J]. International Journal of Epidemiology, 2014, 43(4): 1215-1225.
[8]BREITLING L P, YANG R, KORN B, et al. Tobacco-smokingrelated differential DNA methylation: 27K discovery and replication[J]. The American Journal of Human Genetics, 2011,88(4): 450-457.
[9]LEGER A J, COVIC L, KULIOPULOS A. Protease-activated receptors in cardiovascular diseases[J]. Circulation, 2006, 114(10):1070-1077.
[10]O’DONOGHUE M, MORROW D A. The future of biomarkers in the management of patients with acute coronary syndromes[J].Current Opinion in Cardiology, 2008, 23(4): 309-314.
[11]MCDOUGALL J J, ZHANG C, CELLARS L, et al. Triggering of proteinase-activated receptor 4 leads to joint pain and inflammation in mice[J]. Arthritis & Rheumatism, 2009, 60(3):728-737.
[12]TRION A, DE MAAT M P M, JUKEMA J W, et al. No effect of C-reactive protein on early atherosclerosis development in apolipoprotein E*3 – leiden / human C-reactive protein transgenic mice[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2005, 25(8): 1635-1640.
[13]BORISSOFF J I, SPRONK H M H, ten CATE H. The hemostatic system as a modulator of atherosclerosis[J]. New England Journal of Medicine, 2011, 364(18): 1746-1760.
Correlations of smoking andF2RL3gene methylation with prognosis of stable coronary heart disease
Fang-yao Liu, Chang-cheng Lei, Juan Tang
(Department of Cardiology, the Second Aff i liated Hospital, University of South China,Hengyang, Hunan 421001, China)
ObjectiveTo determine whether methylation ofF2RL3gene is associated with secondary cardiovascular events and mortality of stable coronary heart disease and with the harmful effect of smoking.MethodsA total of 121 inpatients participating cardiovascular rehabilitation programmes after experiencing acute coronary syndrome, myocardial infarction or coronary intervention were recruited in our hospital. Active followup was conducted over 8 years. Methylation ofF2RL3gene was characterized by Sequenom matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Associations of methylation ofF2RL3gene and smoking with secondary cardiovascular events, and speci fi c-cause and all-cause mortality were examined by multiple Cox’s regression model through estimating confounder-controlled hazard ratios.ResultsDuring the follow-up, 5 patients suffered from non-fatal myocardial infarction, 4 had non-fatal strokes, 6 died of cardiovascular diseases, and 5 died due to other causes. After controlling established prognostic factors, Cox’s regression analysis revealedF2RL3methylation was closely associated with mortality. Adjusted hazard ratios (95% CI) for death from cardiovascular, non-cardiovascular, and any other cause were 2.32 (0.97, 5.58), 5.16 (1.81, 14.7), and 3.19 (1.64, 6.21) in the subjects with the lowest quartile of methylation ofF2RL3gene in comparison to those with the highest quartile.There was no association between the secondary cardiovascular event outcomes of the two groups. The strong associations of smoking with all outcomes were markedly weakened whenF2RL3was included in the regression models.ConclusionsThe results seem to indicate methylation ofF2RL3is a potential mediator of the detrimental impact of smoking and is strongly related to mortality of patients with stable coronary heart disease.
stable coronary heart disease; epigenetic methylation;F2RL3
10.3969/j.issn.1005-8982.2018.01.018
1005-8982(2018)01-0092-07
2017-03-20
R541.4
A
(张西倩 编辑)
