硫化氢对大鼠局灶性脑缺血再灌注损伤的保护效果研究*
2018-01-05陈昆邱华峰从静张卉
陈昆,邱华峰,从静,张卉
(黄淮学院护理学系,河南 驻马店 463000)
硫化氢对大鼠局灶性脑缺血再灌注损伤的保护效果研究*
陈昆,邱华峰,从静,张卉
(黄淮学院护理学系,河南 驻马店 463000)
目的探讨硫化氢(H2S)干预处理对大脑中动脉栓塞局灶性脑缺血性再灌注损伤(CIRI)模型大鼠脑及神经功能的保护作用及其机制。方法选取48只成年雄性SD大鼠,采用随机数字表法分为假手术组、模型组和实验组,每组16只(复制模型过程中如死亡则补足),假手术组和实验组采用线栓法结扎大鼠左侧大脑中动脉复制模型,实验组于栓线后10 min腹腔注射25μmol/kg硫氢化钠NaHS生理盐水,假手术组和模型组仅给予等体积生理盐水。结果实验组大鼠的死亡率为23.81%,低于模型组的44.83%,两组比较,差异有统计学意义(P<0.05);3组大鼠的脑梗死体积百分比比较,差异有统计学意义(P<0.05)。模型组和实验组大鼠的脑梗死体积百分比高于假手术组;实验组的脑梗死体积百分比低于模型组;3组大鼠的海马CA1区的PI3K、p-Akt、Caspase蛋白水平比较,差异有统计学意义(P<0.05),模型组大鼠海马CA1区的p-Akt、Caspase蛋白高于假手术组,实验组大鼠海马CA1区的Caspase蛋白低于于模型组,实验组大鼠海马CA1区的PI3K、p-Akt蛋白高于假手术组和模型组。结论H2S干预处理对大脑中动脉栓塞局灶性脑缺血再灌注损伤模型大鼠有脑脊神经缺损功能保护作用,其作用机制可能与激活PI3K、p-Akt通路,抑制凋亡相关蛋白Caspase有关。
硫化氢;栓塞;局灶性脑缺血;再灌注损伤;神经功能
脑缺血性疾病的发病率逐年攀升,造成脑血管堵塞或脑血血供不足[1],诱发脑缺血性再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)。CIRI 能够直接造成脑神经元细胞坏死或凋亡,形成一系列的严重继发症,具有较高的病死率和致残率[2]。因此,通过研究CIRI的产生机制,寻找到一种优秀神经保护剂,从而有效预防其发生及恶化。
硫化氢H2S作为医学界中常见的气体信号分子,具有优秀的抗氧化、缓解机体损伤和消除大脑毒性的作用[3]。H2S能够保护脑缺血性损伤,其机制可能与血管平滑肌及促血管细胞炎症因子相关[4],但具体过程仍需进一步研究。笔者选择局灶性CIRI模型大鼠作为研究对象,旨在探讨H2S对模型大鼠脑及神经功能的保护作用,并较深入分析其作用机制,现报道如下。
1 材料与方法
1.1 实验动物
选取48只成年雄性SD大鼠(SPF级),体重220~250 g,平均(240±15)g,购自安徽医科大学动物实验研究中心,动物合格证号:皖医实动准字第01号。动物喂养条件:自由进食进水、光照12 h、室温23~25℃、相对湿度40%~60%,实验前禁食8 ~ 12 h[5]。
1.2 实验药品与仪器
兔抗鼠Caspase-3、PI3K、p-Akt多克隆抗体购自上海索莱宝生物科技有限公司,抗热休克蛋白70(heat shock protein 70,HSP70)多克隆抗体购自武汉云克隆科技股份有限公司,抗β-actin单克隆抗体购自北京康为世纪生物科技有限公司,硫氢化钠NaHS水合物购自上海容创生物技术有限公司,CM1800Leica冷冻切片机和RM2135Leica石蜡切片机购自德国Leica公司。
1.3 模型的复制
大鼠腹腔注射350 mg/kg 10%水合氯醛全身麻醉后,平放于手术台上,取颈正中切口,逐渐分离双侧颈总动脉,结扎左侧颈外动脉主干,再结扎颈总动脉近心端,微动脉夹夹闭颈内动脉。近颈外动脉起始处剪开颈总动脉,于颈内动脉端插入尼龙线栓头,后缓慢上推撤出微动脉夹,逐层缝合。将处于麻醉状态大鼠固定放入鼠笼,至其自然苏醒后提起颈部双侧总动脉,用无创动脉夹夹闭形成全脑缺血。待大鼠无翻正反射,呼吸频率加快、毛竖立、眼发白和瞳孔放大,则代表模型复制成功。在模型复制过程中需仔细操作,避免造成模型鼠的死亡。
1.4 实验方法
将57只大鼠随机分为3组:①假手术组,全部大鼠行假手术,将其双侧颈总动脉及翼小孔分别暴露,无缺血处理;②模型组,大鼠腹腔注射350 mg/kg 10%水合氯醛全身麻醉后,手术分离其双侧颈总动脉,结扎左侧颈外动脉主干,再结扎颈总动脉近心端,微动脉夹夹闭颈内动脉。近颈外动脉起始处剪开颈总动脉,于颈内动脉端插入尼龙线栓头,缓慢上推撤出微动脉夹,逐层缝合。将处于麻醉状态大鼠固定放入鼠笼,自然苏醒后提起颈部双侧总动脉后用无创动脉夹夹闭形成全脑缺血;③实验组:大鼠模型复制方式与模型组一致,模型复制成功后腹腔注射NaHS水合物48μmol/kg,双侧颈总动脉闭塞30 min。假手术组和模型组仅给予等体积生理盐水。模型复制过程中,每组16只成功,3只死亡。
1.5 观察指标及检测方法
1.5.1 死亡率 采用Longa 5分制对大鼠的神经缺陷程度进行评价,0分表示无神经功能缺陷;1分表示轻度局灶性神经功能缺陷,不能完全伸展对侧前肢;2分为中度局灶性神经功能缺陷,大鼠存在向对侧转圈的情况;3分表示重度局灶性神经功能缺陷,大鼠向对侧倾倒;4分表示大鼠不能独立行走、意识减低。比较3组大鼠脑梗死体积的差异和脑梗死体积百分率。
1.5.2 大脑海马CA1区相关蛋白 比较3组大鼠PI3K、p-Akt、Caspase的表达差异。
1.6 脑梗死体积测量
3组大鼠腹腔注射0.50 ml/100 mg 10%水合氯醛全身麻醉,离断鼠头开颅取脑,将脑置入冰水冲洗干净,-20℃下静置20 min后取出,从前往后取冠状切片,厚2.0 mm,切5片。置于1% TTC磷酸缓冲液内,37℃避光孵育30 min,脑正常组织染成红色,梗死组织则为白色。对脑切片拍照后,将图片数据传输至计算机,使用Image-pro plus软件进行图像分析,计算脑梗死容积,脑梗死容积=脑切片坏死区面积×切片厚度,将全部大鼠脑切片梗死容积相加得到全脑总梗死容积,梗死体积百分比=梗死体积/鼠大脑体积×100%。
1.7 免疫组织化学法
SABC免疫组织化学法染色测定3组大鼠大脑海马CA1区的PI3K、p-Akt、Caspase的表达,取测定梗死面积的切片37℃下复温1 h,切片置于PBS液,洗3次,5 min/次。于3%过氧化氢与甲醇体积比1∶10混合液内,37℃水浴40 min。置于PBS液,洗3次,5 min/次。切片于高压煮沸的柠檬酸缓冲液瓷缸内煮5 min,取出瓷缸自然冷却至室温。取冷却后的切片置于PBS液,洗3次,5 min/次。取出切片脱水、指甲油包裹、10%山羊血清封闭,室温下静置2 h,滴入一抗(PI3K、p-Akt、Caspase抗体和PBS按1∶100稀疏),室温孵育1 h,4℃冰箱过夜孵育。取出切片室温复温1 h,置于PBS液,洗3次,5 min/次,清除切片水分。DAB显色,各蛋白呈现红褐色阳性染色结果,用水冲洗30 min。切片梯度酒精脱水、中性树胶封片后,通风处晾干,显微镜下观察并拍照。
1.8 统计学方法
采用SPSS 16.0软件数据进行分析,所有计量资料满足正态分布、方差齐性,以均数±标准差(x±s)表示,3组间比较用单因素方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠的死亡率及神经功能缺陷评分比较
模型组共用29只大鼠、死亡13只,实验组共用大鼠19只、死亡3只,假手术组无大鼠死亡,实验组大鼠的死亡率为23.81%,低于模型组的44.83%,两组比较,差异有统计学意义(χ2=4.356,P=0.037)。假手术组、模型组及实验组大鼠神经功能缺陷评分分别 为(0.00±0.00)、(3.31±0.57) 和(2.26±0.66)分,经方差分析,差异有统计学意义(F=49.084,P=0.000);进一步两两比较,模型组和实验组大鼠神经功能缺陷评分较假手术组高(P<0.05),实验组大鼠神经功能缺陷评分较模型组高(P<0.05)。
2.2 3组大鼠的脑梗死体积百分比比较
假手术组、模型组及实验组大鼠的脑梗死体积百分比分别为(0.00±0.00)%、(36.35±3.89)%和(21.74±3.72)%,经方差分析,差异有统计学意义(F=28.627,P=0.000);进一步两两比较,模型组和实验组大鼠的脑梗死体积百分比高于假手术组(P<0.05),实验组大鼠的脑梗死体积百分比低于模型组(P<0.05)。见图 1。
2.3 3组 大鼠 海 马 CA1区 的 PI3K、p-Akt、Caspase蛋白表达比较
3组大鼠海马CA1区的PI3K、p-Akt、Caspase蛋白表达水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,模型组大鼠海马CA1区的 p-Akt、Caspase蛋白高于假手术组(P<0.05),实验组大鼠海马CA1区的Caspase蛋白低于模型组(P<0.05),实验组大鼠海马CA1区的PI3K、p-Akt蛋白高于假手术组和模型组(P<0.05)。见附表和图2。
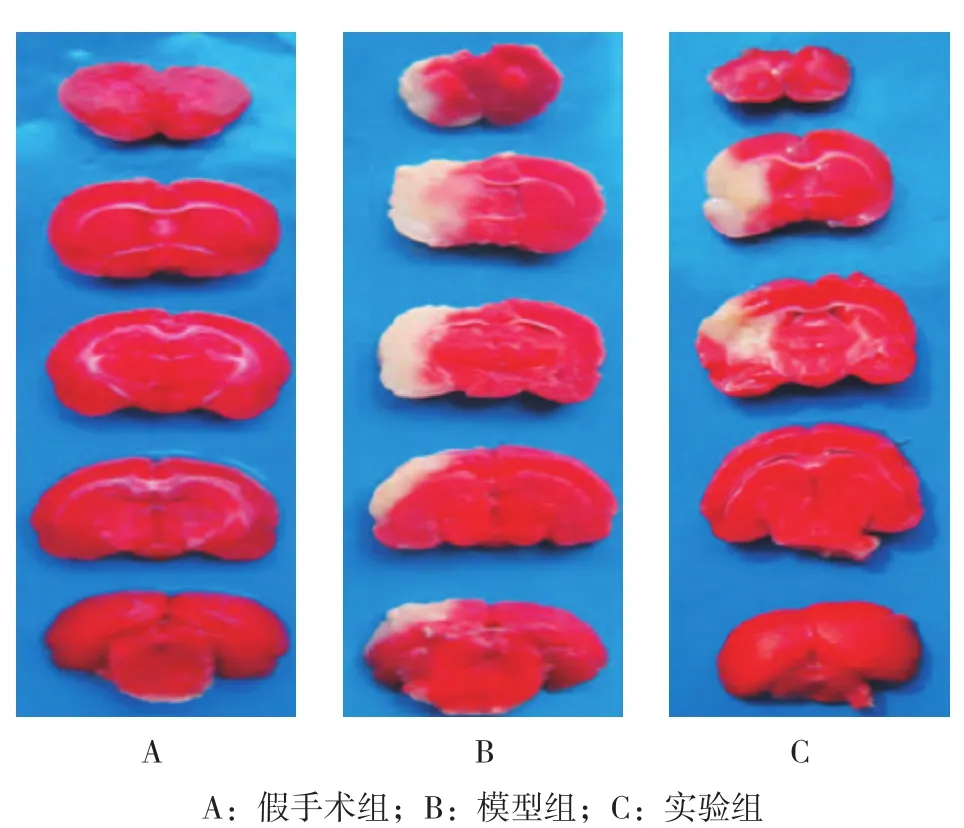
图1 3组大鼠的脑梗死组织
附表 大鼠海马CA1区的PI3K、p-Akt、Caspase蛋白表达比较 (n =16,±s)

附表 大鼠海马CA1区的PI3K、p-Akt、Caspase蛋白表达比较 (n =16,±s)
注:1)与假手术组比较;P <0.05;2)与模型组比较,P <0.05
假手术组 0.167±0.032 0.204±0.051 0.249±0.094模型组 0.163±0.029 0.245±0.0491) 0.571±0.1261)实验组 0.286±0.0411)2) 0.357±0.0561)2) 0.336±0.1111)2)F值 22.761 19.864 31.863

图2 3组大鼠海马CA1区的PI3K、p-Akt、Caspase蛋白表达 (免疫组织化学法×400)
3 讨论
CIRI可致脑组织损伤,并累及脑中枢神经,形成继发性神经细胞坏死或凋亡,造成患者死亡或残疾[6]。这是因为常规状态下,人体内活性氧自由基(reactive oxygen species,ROS)生成和代谢清除保持动态平衡状态[7]。当人体处于CIRI病理状态时,其抗氧化功能出现障碍,造成ROS无法被清除而蓄积,从而攻击脑组织等机体组织,即形成氧化应激反应,其能直接促使脑组织或神经组织细胞坏死[8],并可经线粒体通路、DNA修复酶及转录因子,诱发连锁式的成批细胞凋亡,故笔者认为通过探讨CIRI的最佳防治手段具有十分重要的医学研究价值。
CIRI的产生机制较复杂,其中脑缺血可引发自由基过表达,从而严重氧化损害脑组织细胞,属于诱发CIRI主要因素之一[9]。而脑缺血诱发脑组织损伤,造成炎症因子表达上升,产生大量毒性物质,侵蚀神经组织,造成神经细胞坏死及星形细胞水肿,也可形成CIRI[10]。因此,笔者认为预防CIRI产生及恶化的首要手段应是选择合适外源性保护因子,降低脑缺血患者机体内氧自由基或炎症因子表达水平。在本实验中,笔者选择H2S作为抵抗CIRI的气体保护分子,这是因为其能够调控海马磷酸化环腺苷酸反应元件结合蛋白和海马神经元脑源性神经营养因子mRNA表达上调[11],从而使得生物体脑缺血程度得到缓解,间接减轻CIRI对脑组织的损伤程度。有研究显示,H2S能够增强CIRI模型大鼠脑组织内超氧化物酶活性,并降低脂质过氧化产物的产生[12],有效降低自由基表达,保证细胞膜免受氧化反应侵害。本实验选择线栓法复制CIRI大鼠模型,并使用H2S对实验组大鼠进干预,结果显示该组死亡率低于模型组,这表明H2S还可有效降低CIRI大鼠死亡率,笔者推断H2S可能通过抑制氧自由基表达,缓解CIRI大鼠脑组织损伤,从而降低大鼠死亡率。
既往文献显示[13],CIRI可致大鼠大脑皮质缺血,从而造成其侧前肢出现明显的运动功能障碍,而缺血性低灌注脑梗死体积越大,CIRI大鼠的运动功能障碍越严重。在本实验中,笔者测得模型组和实验组大鼠的脑梗死体积百分比高于假手术组,而实验组的脑梗死体积百分比低于模型组;这表明H2S能够缩小CIRI大鼠脑梗死体积,缓解缺血性脑神经损伤,从而侧面证明H2S可能对预防CIRI所引起肢体功能障碍或甚至残疾具有积极意义。
在本实验中,笔者对CIRI诱发脑组织细胞及神经组织细胞凋亡机制进行评估。细胞凋亡受到多种凋亡因子调控,而这些因子也是在和相关信号通路结合后被激活,造成中性粒细胞聚集、大量氧自由基合成及增加线粒体钙超载度等诱细胞凋亡因素。通过分析,笔者选择PI3K-Akt信号通路作为实验中评估指标之一,这是因为该信号通路参与调控细胞增殖、分化及凋亡,并由多靶点组成,并和磷酸化Akt基因相互作用,对转录因子表达和促凋亡蛋白活性水平产生影响,间接影响脑组织及神经细胞等多种细胞活性、发育、分化、增殖和凋亡。文献显示[14],PI3K/P-Akt越高,细胞存活率越高,细胞凋亡则反之,而在脑缺血早期给患者提供外源性PI3K及p-Akt,能够减轻缺血性脑组织损伤,同时促使p-Akt蛋白表达下调。在本实验中,实验组PI3K和p-Akt蛋白高于假手术组和模型组,这表明H2S可使实验组大鼠机体PI3K和p-Akt蛋白表达增高,从而缓解脑组织及神经组织细胞凋亡,减轻CIRI。
有研究表明[15],Caspase-3能够影响脑缺血后神经元损伤,并可直接促使神经元凋亡;而高活性Caspase-3能够造成多种蛋白质底物失活,造成其促修复、复制和转录DNA和mRNA的功能障碍;同时磷酸化Akt能降低Caspase-3活性。本实验结果显示,CIRI确实可致大鼠Caspase-3蛋白表达上升,而H2S预处理能够使得CIRI大鼠Caspase-3蛋白降低,从而对CIRI大鼠脑损伤进行缓解和保护。
笔者在既往研究基础上,证明通过H2S干预可使CIRI对大鼠脑组织损伤程度降低,可降低局灶性缺血性再灌注所诱发的死亡率及神经功能障碍程度,而H2S这种干预机制可能通过直接影响各类诱发脑组织及神经组织细胞凋亡的基因蛋白表达水平实现,但更详细的作用过程仍需进一步研究完善。
综上所述,H2S干预处理能够保护大脑中动脉栓塞局灶性脑缺血再灌注损伤模型大鼠的脑组织,其作用机制可能和激活PI3K、p-Akt通路抑制凋亡相关蛋白Caspase有关,该研究结果可能为临床治疗CIRI患者提供新方向。
[1]胡仲昊, 程小华. 缺血性脑血管病患者并发脑动脉硬化性狭窄部位及危险因素分析[J]. 现代仪器与医疗, 2015, 4(5): 43-44.
[2]孙立新, 李国风, 骆海坤, 等. 硫化氢对大鼠局灶性脑缺血损伤的影响[J]. 河北医药, 2015, 37(18): 2725-2728.
[3]LI H B, DAI X J, JI S H, et al. Hydrogen sulphide and mild hypothermia activate the CREB signaling pathway and prevent ischemia-reperfusion injury[J]. BMC Anesthesiology, 2015, 1(15):119-119.
[4]骆海坤, 张建新, 李国风. 局灶性脑缺血大鼠脑组织硫化氢水平的动态变化[J]. 河北医药, 2015, 3(6): 833-835.
[5]李新娟, 魏林郁, 李超堃, 等. 硫化氢对大鼠局灶性脑缺血/再灌注损伤的保护作用及其机制[J]. 中国药理学通报, 2014,30(9): 1271-1275.
[6]张萌, 李国风, 骆海坤, 等. 外源性硫化氢对大鼠局灶性脑缺血时线粒体功能的影响[J]. 中华麻醉学杂志, 2014, 34(10): 1259-1262.
[7]SONG X R, WEN D S, QI Y, et al. H2S attenuates cognitive de fi cits through Akt1/JNK3 signaling pathway in ischemic stroke[J].Behavioural Brain research, 2014, 2(269): 6-14.
[8]冯磊, 胡丽娟, 王海云, 等. 外源性硫化氢对大鼠局灶性脑缺血再灌注时神经元凋亡的影响[J]. 中华麻醉学杂志, 2016, 36(1):116-119.
[9]CHEN Y Y, HU R L, LI H, et al. Sirtuin 6 is essential for sodium sulfide-mediated cytoprotective effect in ischemia/reperfusionstimulated brain endothelial cells[J]. Journal of Stroke and Cerebrovascular Diseases, 2015, 24(3): 601-609.
[10]李国风, 张建新, 骆海坤, 等. 氨基氧乙酸对大鼠局灶性脑缺血损伤的影响[J]. 中华麻醉学杂志, 2011, 31(8): 984-986.
[11]DING Q, YU Z H, LU L, et al. ROS-dependent neuroprotective effects of NaHS in ischemia brain injury involves the PARP/AIF pathway[J]. Cellular physiology and biochemistry, 2015, 36(4):1539-1551.
[12]张国珍, 郑维红, 梁戎. 川芎嗪对急性脑梗死模型大鼠硫化氢、血浆胆红素和氧化低密度脂蛋白水平变化及意义[J]. 中国生化药物杂志, 2015, 2(3): 28-31.
[13]焦传安, 宋标, 陈志武. 外源性血管内皮衍生超极化因子对脑缺血再灌注损伤的影响[J]. 中国临床药理学与治疗学, 2012,17(6): 648-653.
[14]王梅. 硫化氢在大鼠脑血管EDHF反应中的作用及其抗脑缺血再灌注损伤作用[D]. 合肥: 安徽医科大学, 2014.
[15]骆海坤. 硫化氢对大鼠局灶性脑缺血脑线粒体损伤的影响[D].石家庄: 河北医科大学, 2012.
Experimental study on protective effect of H2S on focal cerebral ischemia-reperfusion injury in rats*
Kun Chen, Hua-feng Qiu, Jing Cong, Hui Zhang
(Nursing Department of Huanghuai College,Zhumadian, Henan 463000, China)
ObjectiveTo investigate the protective effect of hydrogen sulfide (H2S) on the brain and nerve function in rats after focal cerebral ischemia-reperfusion injury and its mechanism.MethodsForty-eight adult male SD rats were randomly divided into sham group, model group and experimental group with 16 in each group(the number was complemented in case of death during modeling process). In the model group and the experimental group, suture method was used to ligate the left middle cerebral artery of the rats for modeling; 10 min after suture,the experimental group had intraperitoneal injection of 25 μmol/kg NaHS saline solution, but the sham group and the model group only
equal volume of saline.ResultsThe mortality rate of 23.81% in the experimental group was signi fi cantly lower than 44.83% in model group (P< 0.05). The percentage of cerebral infarct volume in the model group and the experimental group was signi fi cantly higher than that in the sham group (P< 0.05); the infarct volume percentage of the experimental group was signi fi cantly lower than that of the model group (P< 0.05).p-Akt and caspase in the hippocampal CA1 region of the model group were signi fi cantly higher than those of the sham group (P< 0.05) . Caspase protein in the hippocampal CA1 region of the rats in the experimental group was signi fi cantly lower than that in the model group (P< 0.05). PI3K and p-Akt in the hippocampal CA1 region of the rats in the experimental group were signi fi cantly higher than those in the sham group and the model group(P< 0.05).ConclusionsH2S intervention has protective effect on brain spinal nerve function in the treatment of focal cerebral ischemia-reperfusion injury rat model due to cerebral artery occlusion, its mechanism may be related to the activation of PI3K/p-Akt pathway and inhibition of apoptosis-related protein caspase.
hydrogen sul fi de; embolism; focal cerebral ischemia; reperfusion injury; neurological function
10.3969/j.issn.1005-8982.2018.01.003
1005-8982(2018)01-0011-05
2016-12-16
黄淮学院青年骨干教师资助计划(No:院字[2013]101号);2014年河南省教育厅项目(No:14B180006)
从静,E-mail:1132548483@qq.com
R-332;R743.3
A
(张蕾 编辑)
