半导体光热转换纳米材料的研究进展
2018-01-05王兆洁孟周琪刘子潇MACHARIADaniel胡俊青陈志钢
王兆洁,余 诺, 孟周琪, 刘子潇, MACHARIA Daniel K, 胡俊青, 陈志钢
(东华大学材料科学与工程学院 纤维材料改性国家重点实验室,上海 201620)
青年园地
半导体光热转换纳米材料的研究进展
王兆洁,余 诺, 孟周琪, 刘子潇, MACHARIA Daniel K, 胡俊青, 陈志钢
(东华大学材料科学与工程学院 纤维材料改性国家重点实验室,上海 201620)
癌症已成为严重威胁人们健康的头号杀手,传统的癌症治疗技术存在很多的局限和不足,所以亟需开发一种新型的治疗技术。目前,近红外光驱动的光热消融治疗已经被认为是一种有效的癌症治疗技术,该技术的发展关键是研发高效且生物相容性好的光热转换试剂。半导体光热转换试剂具有价格低廉、光热转换效率高等优点,引起了广泛关注。总结了近年来半导体光热转换试剂的研究进展,主要包括铜基(CuS、Cu9S5和CuSe等)和钨基(W18O49、CsxWO3和WS2等)半导体。另外,还介绍了半导体多功能光热试剂(如G-CuS-DOX和FeS2-350等)在化疗/热疗或者成像/治疗一体化方面的进展。最后,指出了目前存在的问题和发展方向。
癌症;光热治疗;光热试剂;半导体;多功能
1 前 言
据统计数据显示,中国2015年新增约429.2万癌症病例,癌症死亡病例或超过281.4万。也就是说,平均每天有近1.2万人被确诊患癌症,7000多人因患癌死亡。癌症已经成为中国首要的致死病因,同时也是一个主要的公共健康问题[1]。目前,传统的癌症治疗技术主要有手术治疗、化学治疗、放射治疗和中医治疗等[2,3]。这些技术在癌症治疗方面取得了重大进展,但还存在许多不足,例如化疗有很大的毒副作用,手术治疗后很容易复发和转移。因此,还非常有必要发展新技术来治疗癌症。最近,近红外光驱动的光热治疗技术吸引了国内外高度关注,其治疗原理如下:开发光热纳米试剂,并将试剂通过瘤内注射或者尾静脉注射到达肿瘤部位,再用近红外激光透过皮肤来照射肿瘤,瘤内的光热材料吸收近红外光产生热,使得癌细胞温度升高,当癌细胞温度升高到45 ℃时,保持10~20 min癌细胞就会消融。波长范围为700~1100 nm的近红外激光,对生物组织的穿透能力非常强,并且穿透过程中光的衰减很小,是在光热治疗领域中被广泛应用的一种重要光源[4]。而使用近红外光热治疗的一个先决条件是开发高效的、生物兼容性好的、具有靶向性的近红外光热转换材料。
目前,研究最为广泛的光热转换材料主要有4类,分别是贵金属、有机聚合物、碳基纳米材料和半导体化合物。贵金属材料主要有金[5-8]、钯[9]、银[10]等纳米材料。有机化合物光热转换材料常用于增强激光光热治疗效果,主要有有机染料[11],导电聚合物[12]和多巴胺-黑色素[13]等纳米材料。碳基纳米材料主要分为石墨烯类纳米光热材料[14-16]和碳纳米管类光热材料[17-19]。半导体化合物具有成本低廉、制备简单、稳定性好、形貌可调、易于功能化等优点,成为研究者广泛关注和研究的一类光热转换材料。当前纳米半导体光热转换材料主要有硫属铜基化合物和钨氧化物。本文重点介绍本团队制备的半导体基光热材料的研究进展。
2 半导体基光热材料的可控制备
2.1 铜基半导体
在半导体纳米材料中,硫化铜首先被发现具有强的近红外吸收特性,从而被最早用作光热试剂。在2010年,美国德克萨斯大学的陈伟教授[20]制备了硫化铜纳米颗粒,这种颗粒的直径约3 nm。该CuS纳米晶在870 nm处吸收最强,在808 nm激光(功率密度为24 W/cm2)的照射下,10 min内可以使硫化铜水溶液(770 μM)升高12 ℃左右。通过体外实验证明,该硫化铜(400 μM)用40 W/cm2的激光照射5 min,可以将癌细胞完全杀死。但是该研究中实验所使用的808 nm的激光功率密度(24和40 W/cm2)远高于美国激光安全规定的功率密度(808 nm激光强度:0.33 W/cm2)[21]。
为了提高CuS的光热效率同时降低激光使用强度,本团队通过水热法一步合成了一种新型的CuS花状超结构材料[22]。这种材料由六方片状CuS单元构成,这些单元可以作为光学反射镜来增强材料对入射光的吸收性能,并且该材料的尺寸(~1 μm)接近980 nm激光的波长,因此该溶液在980 nm激光激发下可以有效的吸收和散射光,所以超结构在整个波长区域的吸收值大约为其构筑单元(六方片状CuS)的2倍。在980 nm激光(功率密度~0.51 W/cm2)照射下,5 min时CuS超结构水分散液(0.07 mg/mL)升高了11 ℃。另外,把鸡皮遮挡在CuS 超结构水分散液的表面时,温度在5 min时仍升高了10.7 ℃。将CuS超结构注入小鼠肿瘤内,在低功率的980 nm激光照射10 min后,癌细胞可被有效地消融(图1)。
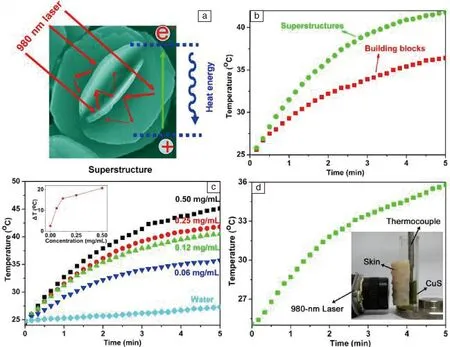
图1 CuS超结构纳米材料吸收增强机理图与光热转换性能[22]Fig.1 Schematic of absorption enhancement mechanism and the photothermal effect of CuS superstructure[22]
由于CuS超结构粒径(~1 μm)较大,将来难以用于静脉注射。为了解决这个问题,本团队又通过高温热解—配体交换联用的方法制备了尺寸更小的亲水性Cu9S5纳米片(~70 nm×13 nm)[23]。和尺寸相近的金纳米棒相比,这种Cu9S5纳米片的消光系数较高(例:在980 nm处的消光系数为 ~1.2×109M-1cm-1),这是因为Cu9S5纳米片是一种空穴掺杂的半导体材料,其p型载流子具有强烈的表面等离子共振吸收,这种吸收类似于贵金属纳米光热转换材料的表面吸收。实验发现在980 nm激光照射下,该Cu9S5纳米片的光热转换效率高达25.7%,略高于金纳米棒(23.7%)。
本团队前期的工作主要以高分子为配体合成纳米材料。相对于高分子,蛋白质具有更好的生物相容性,为了提高CuS的生物相容性,本团队以鸡蛋清为表面配体在37 ℃利用共沉淀法合成了CuS量子点[24]。CuS量子点尺寸约7.1 ± 0.6 nm,并具有很强的近红外吸收能力。在980 nm激光(~0.44 W/cm2)照射下,量子点水溶液(0.25~1.0 mg/mL)在8 min内可以升温17.2~37.4 ℃,其光热转化效率达到47.2%,这种CuS量子点具有较低的细胞毒性(图2)。将CuS量子点的PBS溶液(0.75 mg/mL, 100 μL)注入小鼠肿瘤部位,在980 nm激光(0.44 W/cm2)激发下,肿瘤表面温度开始迅速升高,在30 s时达到50 ℃,在4 min内,肿瘤区域温度达到了56 ℃,能快速的消融癌细胞。因此,该CuS量子点能作为一种有效的、生物相容性好的光热试剂。另外,本团队还制备了半胱氨酸包裹的CuS(Cys-CuS)纳米颗粒,并进行肿瘤细胞的光热治疗,其光热转换效率高达38%[25]。

图2 CuS量子点的TEM照片,光热转换性能和癌细胞的光热消融效果[24]Fig.2 TEM image, photothermal effect of CuS QDs, and the results of photothermal ablation of cancer cells[24]
Cu/S比会影响CuS的尺寸和光热性能,本团队用水/乙醇/聚乙二醇作为溶剂,通过溶剂热法制备了多种CuS光热材料[26]。当Cu/S摩尔比从1/5增加到1/1时,CuS的形貌从类八面体颗粒转化为纳米片甚至纳米颗粒,当Cu/S为1/1时,得到的样品具有尺寸小(~40 nm)、亲水性好和近红外区吸收强等特点,展现了最佳的光热转换性能。
另外,Hessel等[27]制备了Cu2-xSe纳米晶体(直径约16 nm),该材料展现了强的近红外吸收性能,当用800 nm激光照射时,其光热转换效率为22%,与金纳米棒和金纳米壳的光热转换效率相当。
2.2 钨基半导体
在2013年以前,科研人员仅仅发现铜基纳米材料具有强的近红外吸收和光热转换性能,没有发现氧化物半导体也具有这些性能。2013年,本团队以WO3半导体为范例,在其晶格中引入氧空位,首次获得一种W18O49纳米线光热转换试剂[28]。这种W18O49纳米线是通过水热处理WCl6的PEG-乙醇混合溶剂来获得,其长度约为50 nm,厚度仅为~1 nm[28]。W18O49纳米材料具有氧缺陷导致的强等离子共振,因此在近红外区域具有很强的光吸收。在980 nm激光(功率密度为0.72 W/cm2)激发下,W18O49纳米线的水溶液(2.0 g/L)可从室温20 ℃迅速升温到55.8 ℃。将W18O49纳米线的水溶液注入小鼠肿瘤内,在低功率(0.72 W/cm2)的980 nm激光激发下,小鼠肿瘤的表面温度在30 s时升温到44.5 ℃,60 s时升温到49.1 ℃,120 s后温度保持在50.0 ± 0.5 ℃(图3)。对比之下,如果仅仅注入NaCl水溶液,肿瘤表面温度升温不超过1.5 ℃。更重要的是,本团队发现注入W18O49纳米线并光照10 min后,小鼠体内癌细胞被完全消融,这说明了W18O49纳米线具有很好的癌症治疗应用前景。
为了进一步提高其光热性能,本团队尝试调节W18O49纳米线的长度。研究发现,当纳米线长度到达800~1000 nm的时候,也就是接近于980 nm激光波长时,近红外吸收和光热性能优于W18O49-50纳米线[29]。在0.72 W/cm2的980 nm激光照射下,5 min内W18O49-800纳米线溶液温度升高了35.2 ℃,而W18O49-50纳米线溶液只升高了25.6 ℃。将W18O49-800纳米线水溶液注入小鼠肿瘤部位,在980 nm激光(0.72 W/cm2)激发下,肿瘤表面温度从体温35 ℃开始迅速升高,在60 s时达到43.9 ℃,在120 s时达到46.9 ℃,随后逐渐平缓上升并在370 s后平衡在48.5 ± 0.3 ℃。光照10 min后,小鼠体内癌细胞完全被消融。
需要说明的是,W18O49纳米线的光热性能来源其氧缺陷,但是在高温和氧气条件下氧缺陷容易消失导致其光热性能衰减。为了进一步增加W18O49纳米线的光热稳定性,本团队在W18O49中掺入了Cs元素,通过溶剂热-聚乙二醇化两步法制备了亲水性的CsxWO3纳米棒,这些纳米棒有较好的生物兼容性,且在近红外区域(700~1100 nm)展现了强的光吸收特性[30]。在915 nm(0.72 W/cm2)激光激发下,W18O49纳米线7天循环试验后光热性能几乎消失;但是CsxWO3纳米棒(1.0 mg/mL)7天循环试验中升温稳定不变(升温27.4 ℃),表明其具有良好的光热稳定性。以CsxWO3纳米棒作为标准光热试剂,也对比了915 nm和980 nm激光的过热和穿透效应,发现915 nm激光具有更低的过热效应和更好的穿透性,在动物肿瘤治疗中具有更好的应用价值。
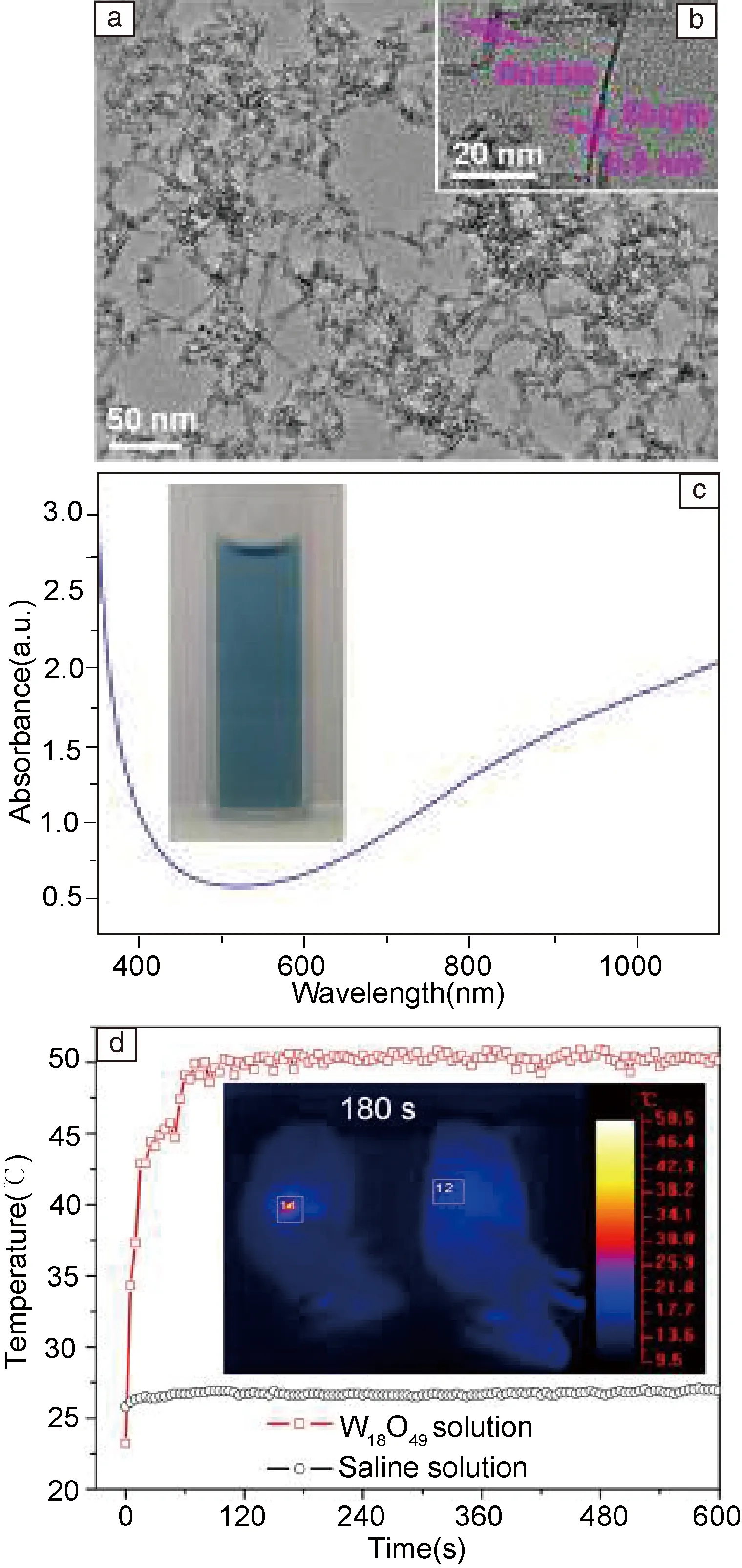
图3 W18O49纳米线的TEM照片、光吸收和激光照射下肿瘤温度变化情况[28]Fig.3 TEM image, absorption spectrum of W18O49 nanowires, and the plots of the temperature within the irradiated tumor area in two mice injected respectively with saline solution and W18O49 nanowires solution as a function of irradiation time[28]
另外,本团队还制备了WS2纳米线,也具有良好的光热转换性能[31]。具有独特缺陷结构的钨基半导体纳米材料的光热性能研究刚刚起步,很多性质如光热转换效率、稳定性、生物相容性等都有待深入研究。
3 半导体多功能光热转换材料
为了克服单一光热治疗的不足,需要进一步开发新的多功能纳米材料,对肿瘤进行联合治疗,提高治疗效果并降低毒副作用。
3.1 热疗-化疗的协同治疗
光热转换材料与药物载体的复合结构,既能负载抗癌药物用于肿瘤的化疗,又能将光能转换成热能,进行光热治疗。热疗和化疗的联合治疗对多种实体瘤都具有协同增强的效果[32-35]。例如,在SiO2表面包覆上Au后,形成SiO2空心球@Au球壳结构,再在其表面偶联上转铁蛋白,并负载抗癌药物;研究表明,在近红外激光激发下,光热治疗联合化疗具有协同增强的效应;靶向配体的作用可以增加药物在肿瘤细胞内的积累,从而提高癌症治疗效果和减少非特异性的副作用[35]。
为了进一步降低CuS纳米材料的细胞毒性,提高其生物相容性,本团队先后制备了Cu9S5@mSiO2-PEG[36]和Cu2-xSe@mSiO2-PEG[37]核壳纳米结构,其中Cu9S5和Cu2-xSe具有光热转换性能,介孔SiO2作为壳层可用于包裹药物,PEG外壳可改善生物兼容性。将它们负载抗癌药物阿霉素(DOX)后用于癌症治疗。例如,每1 mg的Cu9S5@mSiO2-PEG可以负载160 μg的DOX(包封率为63.8%;负载率为13.76%),具有持续的和pH敏感的药物缓释性能,并能有效的将DOX转运至癌细胞内,因此是一种有效的抗癌药物载体;在980 nm激光(输出功率密度为0.72 W/cm2)照射下,将0.15 mL的该材料(450 μg/mL)注射到小鼠的背部皮下组织,温度升高非常迅速,2 min内,从29.8 ℃升高到56.7 ℃,该温度下若保持10 min以上足以杀死肿瘤细胞。两种材料的体外和体内实验都表明:光热和化学治疗组合到一起,展现了比单一方法更好的癌症治疗效果。
为了改善治疗效果和智能性,最近本团队设计并开发了一种具有热响应(LCST=42 ℃)的纳米凝胶(缩写为G),并在其中负载了光热材料CuS和抗癌药DOX,从而得到一种具有“光开关”效应的智能微胶囊(G-CuS-DOX)(图4)[38]。将该微胶囊注入到小鼠体内或者直接到肿瘤部位,无光照射时该微胶囊在人体生理温度变化范围(37~42 ℃)内不会自发释药,避免了化疗的副作用。当微胶囊到达肿瘤部位,用近红外激光精确定位照射肿瘤,肿瘤内的微胶囊会吸收光产生热,导致肿瘤温度升高(~47 ℃),从而具有光热治疗作用(图5a)。同时,肿瘤部位的高温(>42 ℃)促使该部位微胶囊释放药物,而且在体外通过调节激光(功率/辐照时间)可控制肿瘤部位的药物浓度,带来了部位选择性的化学治疗,从而极大地提高药物的利用率,减小了药物的毒副作用(图5a)。这种可控的光热/化学联合治疗方式可有效杀死体内癌细胞,抑制肿瘤的转移。经过24天治疗后,可以消除小鼠肿瘤,其治疗效果优于单一的光热或者化疗效果(图5b)。此外,本团队还合成了全高分子的智能凝胶(PNA-CS-PPy-DOX)作为一种新型的近红外光驱动的给药系统[39]。用聚吡咯(PPy)为光热试剂,用低临界温度为42 ℃的PNA-壳聚糖(PNA-CS)做载体,以DOX作为抗癌药物。PNA-CS-PPy-DOX水溶液在600~1100 nm处有很强的吸收,在915 nm激光照射下,5 min内可以升高7.4~35.3 ℃(PPy: 1~20 ppm),展现了良好的光热转换性能。同时,当温度升高到42 ℃以上时,温度响应的载体会收缩,使药物得到释放。因此,这些研究对未来恶性肿瘤的无/低副作用治疗具有重要意义。

图4 智能纳米胶囊(G-CuS-DOX)的合成过程和形貌[38]Fig.4 Synthesis process and morphology of G-CuS-DOX[38]
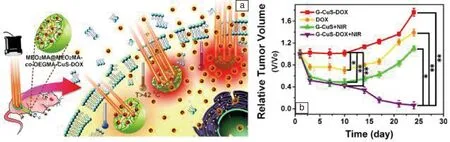
图5 G-CuS-DOX用于肿瘤治疗示意图(a);24天治疗过程中肿瘤体积变化(b)[38]Fig.5 Cancer therapy diagram of G-CuS-DOX (a); Tumor growth curves during 24 days (b) [38]
3.2 “诊疗一体化”的光热试剂
癌症的诊断和治疗在传统临床应用中是两个相对独立的过程,因此,针对癌症的诊断与治疗过程相互分离且诊治效率低下的问题,近年来兴起了一种全新的医疗处理方式—诊断治疗一体化。
将光学和磁性纳米粒子的生物医学应用领域结合可产生意想不到的效果。本团队制备了亲水性的Fe3O4@Cu9S8核壳结构纳米材料,并研究了它的弛豫率以及光热转换能力[40]。该亲水性的纳米材料具有非常高的横向弛豫率(r2)以及高的比值,具有很强T2增强造影效果;同时该核壳结构的纳米材料的光热转换效率可以达到16%,能有效地用于光热治疗。本团队通过体内的T2增强核磁共振成像、近红外热成像以及光热治疗效果,评价了该超小的Fe3O4@Cu9S8核壳结构纳米材料的多功能效果。该多功能纳米材料在小鼠体内不仅仅具有很好的T2增强核磁共振成像和近红外热成像效果,而且还能有效地杀死癌细胞(图6)。
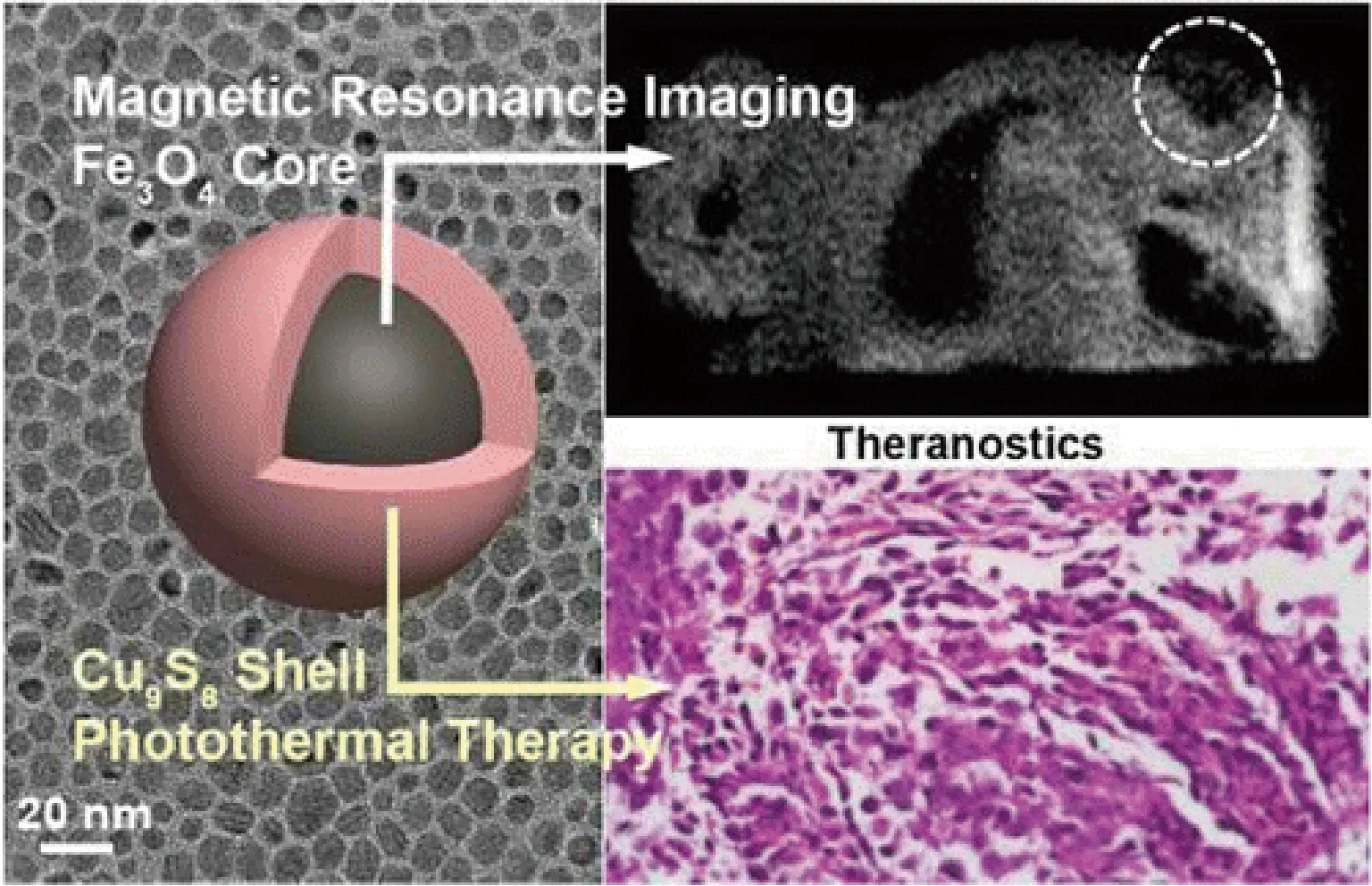
图6 Fe3O4@Cu9S8核壳结构纳米材料成像及光热治疗效果[40]Fig.6 The MR imaging and photothermal therapeutic effect of core-shell Fe3O4@Cu9S8[40]
阳离子交换法可以合成传统方法难以合成的纳米复合物。刘庄教授课题组[41]用阳离子交换法合成了多功能的MnSe@Bi2Se3核壳结构,顺磁性的MnSe核同时具有T1和T2增强的MR成像功能,Bi2Se3壳具有化疗及近红外光吸收功能,从而提高光热治疗效果,并且可以进行CT成像,通过组合实现协同治疗的效果(图7)。另外,刘庄教授课题组[42]通过阳离子交换法合成了FeSe2/Bi2Se3纳米结构,通过调节Bi的含量,可以来调控FeSe2在Bi2Se3纳米片上的浓度,经PEG处理后,FeSe2/Bi2Se3-PEG具有很好的生物相容性。该纳米结构具有高的r2弛豫效应,强烈的X射线和近红外吸收能力,同时螯合了具有放射性的Cu64元素,所以FeSe2/Bi2Se3-PEG纳米材料具有MRI/CT/PA/PET四模成像的功能,并且实现了放疗和热疗的协同治疗效果。

图7 MnSe@Bi2Se3核壳结构的多模成像及协同治疗[41]Fig.7 Multimodal imaging and synergistic thermoradiotherapy of core-shell MnSe@Bi2Se3[41]
核壳结构纳米材料的制备过程非常复杂,单组分半导体纳米颗粒制备相对更简单。如果单组分半导体单纳米颗粒同时具有多种成像和治疗(“all-in-one”)功能,无疑有利于将来大规模制备和应用。最近,本团队合成了“all-in-one”的FeS2纳米颗粒[43]。对于传统的FeS2纳米材料(如FeS2-30),在近红外区没有很好的吸收。当FeS2直径约350 nm(FeS2-350)时,由于FeS2-350纳米材料表面具有非常多的铁缺陷,使其具有强的等离子体共振效应,所以吸收峰从550 nm红移到950 nm,具有很高的光热转换效率(33.1%)。另外,FeS2-350具有T2增强的核磁共振成像功能,同时具有MRI和NIR双模成像功能(图8)。
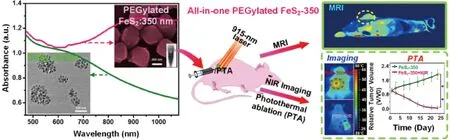
图8 FeS2-350的吸收光谱及光热治疗效果[43]Fig.8 Absorption spectrum and photothermal therapeutic effect of FeS2-350[43]
另外,Cu3BiS3纳米材料也是一种良好诊疗一体化的多功能纳米光热试剂,李博等[44]用溶剂热法一步合成了Cu3BiS3纳米晶,该双金属硫化物具有很好的协同效应,可以进行CT和IR的双模成像来指导光热治疗更好的定位。另外,Cu3BiS3具有强的近红外吸收,能够有效的将915 nm的激光转换成热能,并且具有很高的光稳定性。另外,Zhou等[45]也制备了Cu3BiS3纳米点进行了“诊疗一体化”的研究。
高明远教授课题组[46]利用水溶液法制备了超小的WO3-x纳米点,由于其对X射线具有较高的吸收系数,可以进行光热治疗(PTT)和放射治疗(RT)的协同治疗,并且表现出良好的CT成像功能。另外,WO2.9纳米棒[47],WS2纳米片[48]也被用于图像引导的癌症光热治疗,都具有优异的诊断治疗效果。
4 结 语
近红外光驱动的光热消融肿瘤技术,以其微创性和高效性,为癌症治疗提供了新方向,引起了研究者的广泛关注。半导体材料作为光热转换试剂,具有很多优点,这些半导体基光热转换材料在光热治疗和近红外成像领域展现了光明的应用前景。另外,为了克服单一光热治疗的不足,研究者们进一步开发了新的多功能纳米材料,对肿瘤进行联合治疗,提高治疗效果并降低毒副作用。
为了更好的探索优异的光热转换材料,还有待于在以下方面进行研究:①设计和合成具有高光热转换效率的材料,可以在现有材料的基础进行结构改进,或者寻找具有光热转换效率高的新材料,光热转换材料是光热治疗的基础;②提高光热转换材料的生物兼容性和对肿瘤的靶向性。光热转换材料的表面功能化处理可以提高光热转换材料在生物体内的光热性能的稳定性和循环半衰期,在光热转换材料表面连接一些靶向试剂,引导光热转换材料聚集在癌细胞中或者周围,从而实现对癌症的光热靶向治疗;③光热转换材料最终应用于生物体内,必须要研究和分析光热诊疗过程中纳米材料对癌细胞的消融机制,对正常细胞的副作用以及在体内的代谢情况。④开发新型“all-in-one”光热试剂,使一种纳米材料同时具有光热、化疗、放疗的协同治疗效果,又具有多模成像的功能,使诊断和治疗达到最优效果,减轻患者的痛苦。
References
[1] Chen W, Zheng R, Baade P D,etal.Ca-aCancerJournalforClinicians[J], 2016, 66(2): 115-132.
[2] Nolsoe C P, Torppedersen S, Burcharth F,etal.Radiology[J], 1993, 187(2): 333-337.
[3] Vogel A, Venugopalan V.ChemicalReviews[J], 2003, 103(2): 577-644.
[4] Chen W R, Adams R L, Carubelli R,etal.CancerLetters[J], 1997, 115(1): 25-30.
[5] Lukianova-Hleb E Y, Volkov A N, Wu X,etal.AdvancedMaterials[J], 2013, 25(5): 772-776.
[6] Dreaden E C, Mackey M A, Huang X H,etal.ChemicalSocietyReviews[J], 2011, 40(7): 3391-3404.
[7] Liao J F, Li W T, Peng J R,etal.Theranostics[J], 2015, 5(4): 345-356.
[8] Wang D G, Xu Z A, Yu H J,etal.Biomaterials[J], 2014, 35(29): 8374-8384.
[9] Huang X, Tang S, Yang J,etal.JournaloftheAmericanChemicalSociety[J], 2011, 133(40): 15946-15949.
[10] Liu Z, Cheng L, Zhang L,etal.Biomaterials[J], 2014, 35(13): 4099-4107.
[11] Yu J, Javier D, Yaseen M A,etal.JournaloftheAmericanChemicalSociety[J], 2010, 132(6): 1929-1938.
[12] Yang J, Choi J, Bang D,etal.AngewandteChemie-InternationalEdition[J], 2011, 50(2): 441-444.
[13] Liu Y L, Ai K L, Liu J H,etal.AdvancedMaterials[J], 2013, 25(9): 1353-1359.
[14] Bai J, Liu Y, Jiang X,etal.Biomaterials[J], 2014, 35(22): 5805-5813.
[15] Robinson J T, Tabakman S M, Liang Y,etal.JournaloftheAmericanChemicalSociety[J], 2011, 133(17): 6825-6831.
[16] Yang K, Zhang S, Zhang G,etal.NanoLetters[J], 2010, 10(9): 3318-3323.
[17] Antaris A L, Robinson J T, Yaghi O K,etal.AcsNano[J], 2013, 7(4): 3644-3652.
[18] Jang K, Eom K, Lee G,etal.BiochipJournal[J], 2012, 6(4): 396-403.
[19] Kam N W S, Connell M O, Wisdom J A,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[J], 2005, 102(33): 11600-11605.
[20] Li Y B, Lu W, Huang Q A,etal.Nanomedicine[J], 2010, 5(8): 1161-1171.
[21]AmericanNationalStandardInstitute.AmericanNationalStandardforSafeUseofLasers(ANSIZ136. 1-2000),Orlando,FL:LaserInstituteofAmerica[S]. 2000.
[22] Tian Q W, Tang M H, Sun Y G,etal.AdvancedMaterials[J], 2011, 23(31): 3542-3547.
[23] Tian Q W, Jiang F R, Zou R J,etal.ACSNano[J], 2011, 5(12): 9761-9771.
[24] Zhong R, Peng C, Chen L,etal.RSCAdvances[J], 2016, 6(46): 40480-40488.
[25] Liu X J, Li B, Fu F F,etal.DaltonTransactions[J], 2014, 43(30): 11709-11715.
[26] Luo J, Yu N, Xiao Z,etal.JournalofAlloysandCompounds[J], 2015, 648: 98-103.
[27] Hessel C M, Pattani V P, Rasch M,etal.NanoLetters[J], 2011, 11(6): 2560-2566.
[28] Chen Z G, Wang Q, Wang H L,etal.AdvancedMaterials[J], 2013, 25(14): 2095-2100.
[29] Xu W, Tian Q, Chen Z,etal.JournalofMaterialsChemistryB[J], 2014, 2(34): 5594-5601.
[30] Xu W, Meng Z, Yu N,etal.RSCAdvances[J], 2015, 5(10): 7074-7082.
[31] Macharia D K, Yu N, Zhong R,etal.JournalofNanoscienceandNanotechnology[J], 2016, 16(6): 5865-5868.
[32] Liu H Y, Chen D, Li L L,etal.AngewandteChemie-InternationalEdition[J], 2011, 50(4): 891-895.
[33] Shen S, Tang H Y, Zhang X T,etal.Biomaterials[J], 2013, 34(12): 3150-3158.
[34] Zhang Z J, Wang L M, Wang J,etal.AdvancedMaterials[J], 2012, 24(11): 1418-1423.
[35] Liu H Y, Liu T L, Wu X L,etal.AdvancedMaterials[J], 2012, 24(6): 755-761.
[36] Song G, Wang Q, Wang Y,etal.AdvancedFunctionalMaterials[J], 2013, 23(5): 4281-4292.
[37] Liu X J, Wang Q, Li C,etal.Nanoscale[J], 2014, 6(8): 4361-4370.
[38] Meng Z, Wei F, Wang R,etal.AdvancedMaterials[J], 2016, 28(2): 245-253.
[39] Meng Z Q, Chen X L, Liu Z X,etal.RSCAdvances[J], 2016, 6(93): 90111-90119.
[40] Tian Q, Hu J, Zhu Y,etal.JournaloftheAmericanChemicalSociety[J], 2013, 135(23): 8571-8577.
[41] Song G, Liang C, Gong H,etal.AdvancedMaterials[J], 2015, 27(40): 6110-6117.
[42] Cheng L, Shen S, Shi S,etal.AdvancedFunctionalMaterials[J], 2016, 26(13): 2185-2197.
[43] Meng Z, Wei F, Ma W,etal.AdvancedFunctionalMaterials[J], 2016, 26(45): 8231-8242.
[44] Li B, Ye K C, Zhang Y X,etal.AdvancedMaterials[J], 2015, 27(8): 1339-1345.
[45] Zhou S M, Ma D K, Zhang S H,etal.Nanoscale[J], 2016, 8(3): 1374-1382.
[46] Wen L, Chen L, Zheng S,etal.AdvancedMaterials[J], 2016, 28(25): 5072-5079.
[47] Zhou Z G, Kong B, Yu C,etal.ScientificReports[J], 2014, 4: 3653-3663.
[48] Cheng L, Liu J J, Gu X,etal.AdvancedMaterials[J], 2014, 26(12): 1886-1893.
Research Progress in Semiconductor-BasedPhotothermal Nanoagents
WANG Zhaojie, YU Nuo, MENG Zhouqi, LIU Zixiao, MACHARIA Daniel K, HU Junqing, CHEN Zhigang
(State Key Laboratory for Modification of Chemical Fibers and Polymer Materials, College of Materials Science and Engineering, Donghua University, Shanghai 201620, China)
Cancer is a worldwide leading cause of death. Conventional therapeutic techniques for cancers have some obvious limitations and are unsatisfactory, thus it is very necessary to develop new therapy technology. Recently, near-infrared (NIR) laser-induced photothermal ablation therapy (PAT) has been demonstrated to have great potential to cure tumors, and the prerequisite is to obtain biocompatible and efficient photothermal agents. Among all the photothermal agents, semiconductor-based photothermal nanoagents have attracted increasing interest due to their low cost and high photothermal conversion efficiency. This review attempts to summarize the recent progress on the rational design and fabrication of semiconductor photothermal nanoagents, including Cu-based (CuS, Cu9S5and CuSe) and W-based (W18O49, CsxWO3and WS2) nanomaterials. Furthermore, the semiconductor-based multifunction nanoagents (such as G-CuS-DOX, FeS2-350) are also summarized for the development of synergic photothermal/chemo-therapy or imaging-guided photothermal therapy. This review ends with a summary and some perspectives on the challenges and new directions in this exciting and still emerging area of research.
cancer; photothermal therapy; photothermal agent; semiconductor; multifunction
2016-11-25
国家自然科学基金资助项目(51272299,51473033);东华大学励志计划
王兆洁,女,1991年生,博士研究生
陈志钢,男,1979年生,教授,博士生导师,Email: zgchen@dhu.edu.cn
10.7502/j.issn.1674-3962.2017.12.06
TB34
A
1674-3962(2017)12-0921-08
(编辑 吴 琛)
