花椒多酚提取工艺响应面优化及动力学分析
2018-01-04郭宏垚王小静李稳宏
郭宏垚,李 冬*,雷 雄,王小静,刚 勇,李稳宏
花椒多酚提取工艺响应面优化及动力学分析
郭宏垚,李 冬*,雷 雄,王小静,刚 勇,李稳宏
(西北大学化工学院,陕西 西安 710069)
以多酚收率为优化指标,对花椒中多酚的提取工艺进行研究,通过单因素试验考察处理温度、提取时间、溶剂体积分数、料液比和提取液pH值对多酚提取过程的影响。利用Box-Behnken响应面分析法优化多酚提取的最佳工艺条件为提取溶剂为乙醇溶液、溶剂体积分数48.23%、料液比1∶29.34(g/mL)、处理温度48.99 ℃、提取时间1.75 h、提取液pH 3,在此条件下进行5 次平行实验,预测的多酚收率为55.06 mg/g。此外,研究不同温度下总酚的传质动力学,通过平板模型以Fick第一定律为基础建立了花椒多酚提取的动力学模型,并求解出速率常数、相对萃余率及活化能等关键模型参数,为花椒多酚提取的工厂放大和深入研究提供一定依据。
花椒;多酚;提取工艺;响应面分析法;动力学
植物多酚是植物体内广泛存在的一种芳香族羟基衍生物的总称,其数量庞大,迄今已知的酚类物质已有8 000 种以上[1]。由于其结构复杂、化学活性显著、且存在形态多样,因而多酚类物质的研究进展十分缓慢[2-4]。20世纪中期以后,植物多酚与多种生物活性物质的化学反应及其抗氧化、清除自由基等一系列优越功能被逐步发现,各工作者也开始重视这一研究领域[6-7]。此外,花椒作为我国“八大调味品”之一,其多酚含量相当可观,虽在品种选育和栽培等方面取得进展,但其深加工产业技术还尚在起步阶段[8-11]。
目前,关于花椒多酚提取工艺的响应面法优化及传质动力学等方面的研究相对较少。本实验通过响应面法优化花椒多酚的提取工艺,并利用Fick第一定律建立花椒多酚传质动力学模型,求解出传质速率常数及相对萃余率等提取过程的关键动力学参数,以期完善花椒多酚提取的基础研究,并为深加工技术研究提供一定理论依据。
1 材料与方法
1.1 材料与试剂
花椒由西安韩城花椒采购站提供;乙醇、无水碳酸钠、丙酮、甲醇和乙醇 蚌埠市海兴化工责任有限公司;浓盐酸和没食子 西安瑞林生物科技有限公司;其余试剂均为分析纯。
1.2 仪器与设备
UV-2501PC型紫外-可见分光光度仪 日本岛津公司;DK-98-1型电热恒温水浴锅、FW80型高速万能粉碎机 天津市泰斯特仪器有限公司;IKAMAG RCT型磁力加热搅拌器 德国IKA-Werke公司。
1.3 方法
1.3.1 标准曲线的绘制
称取0.1 g没食子酸,加入100 mL蒸馏水,制备1.0 mg/mL没食子酸溶液。分别移取不同体积的上述溶液至50 mL容量瓶中,加入2 mL福林-酚试剂摇匀,静置5 min,滴加4 mL质量分数10% Na2CO3溶液,置于25 ℃的恒温水浴锅中,显色2 h后进行最大吸收波长扫描[12-13]。在765 nm波长处测定吸光度,以多酚质量浓度(以没食子酸计)为横坐标,吸光度为纵坐标绘制标准曲线,得到多酚的标准曲线方程见公式(1)。

式中:x为多酚质量浓度(以没食子酸计)/(μg/mL);y为所对应的吸光度;相关系数r2=0.999 3,表明该回归方程的拟合程度高,可准确计算多酚质量浓度。
1.3.2 单因素试验与响应面优化试验
分别考察处理温度、提取时间、溶剂体积分数、料液比和提取液pH值等单因素对花椒多酚收率的影响,实验过程如下:准确称取相同批次的备用花椒粉1.0 g,设置不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL))和不同提取液pH值(1、2、3、4、5、6、7),各加入不同体积分数的溶剂(0%、10%、20%、30%、40%、50%、60%、70%、80%、95%),在不同温度(30、40、50、60、70、80、90 ℃)下提取不同时间(0.5、1、1.5、2、2.5 h),分别抽滤并收集提取液,定容至50 mL,测定各组花椒多酚收率。
在单因素试验基础上,采用Box-Behnken响应面法进行优化分析,其各因素的考察基准分别为处理温度50 ℃、溶剂体积分数40%、料液比1∶20(g/mL)、提取时间2 h、提取液pH 3。试验因素及水平见表1。
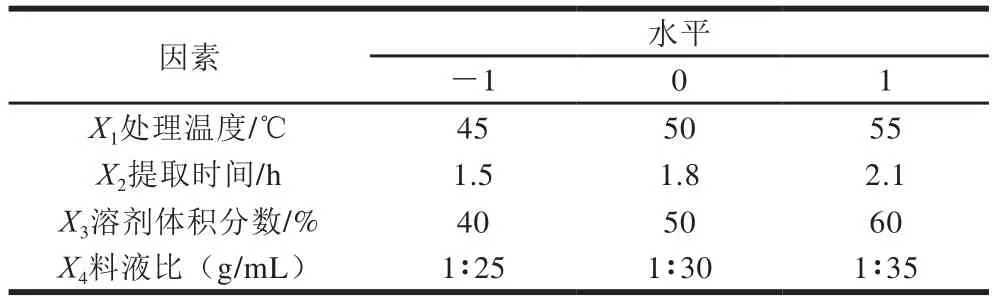
表1 响应面试验因素及水平Table 1 Coded levels and corresponding actual levels of independent variables used for response surface analysis
1.3.3 多酚提取动力学实验
取10 g花椒颗粒于250 mL的烧瓶,用体积分数60%乙醇溶液浸润10 min,再定容至100 mL,恒温水浴回流提取,控制提取温度为313、318、323、328、333 K,分别在不同提取时间为10、30、60、90、120、150、180、210、240 min时取样100 μL,按1.3.1节中公式(1)计算多酚质量浓度。
1.3.4 多酚含量的计算
1.3.4.1 多酚收率的测定
将花椒置于50 ℃干燥,粉碎后筛选14 目颗粒备用。各称取1.0 g粉末,用50 mL溶剂提取,抽滤收集提取液,定容至50 mL。准确吸取0.1 mL提取液进行显色反应,由标准曲线得到提取液中多酚质量浓度,并按公式(2)计算多酚收率。
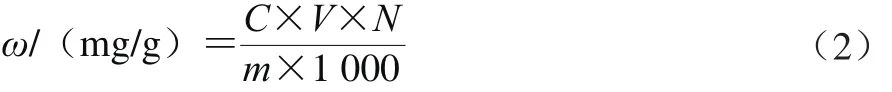
式中:ω为多酚收率/(mg/g);C为没食子酸质量浓度/(μg/mL);V为提取液体积/mL;N为稀释倍数;m为取样质量/g。
1.3.4.2 饱和溶剂吸收率的测定
精确称取不同质量的花椒样品,逐渐滴入60%乙醇溶液,每次滴加后充分振荡并浸润3 min,直至充分吸湿且无多余溶剂,记录消耗的溶液体积。饱和溶剂吸收率的计算见公式(3):

式中:P为饱和溶剂吸收率/(mL/g);V1为滴定管初读数/mL;V2为滴定管终读数/mL;m为样品质量/g。
1.3.4.3 样品质量浓度的测定
每次取样后浸提液总体积将减少100 μL,多次取样将导致提取液总体积减少,也造成提取液中有效成分质量的减少[14]。故其修正质量浓度的计算见公式(4):
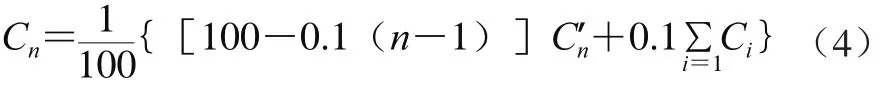
式中:Cn为第n次取样的修正值/(μg/mL);Cn’为第n次取样的测定值/(μg/mL);Ci为第i次取样修正值。
2 结果与分析
2.1 单因素试验结果
2.1.1 溶剂体积分数对花椒多酚收率的影响
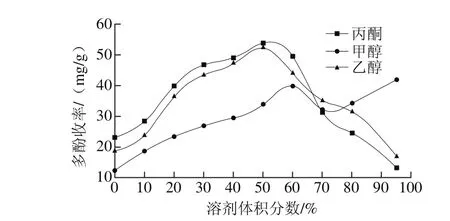
图1 溶剂体积分数对花椒多酚收率的影响Fig. 1 Effect of solvents on the yield of polyphenols
多酚通常与植物大分子物质以氢键等形式结合形成稳定化合物,一般采用有机溶剂断裂氢键来产生多酚,不同的溶剂体积分数对多酚收率影响也较大[15-16]。由图1可知,花椒多酚收率随丙酮体积分数的升高而先增大后减小,当丙酮体积分数为50%时达到较高收率为53.7 mg/g;随乙醇溶液体积分数的变化规律与丙酮类似,当乙醇溶液体积分数达到50%时达到较高收率为52.1 mg/g。当溶剂用量过低时,极性过强,导致糖类等水溶性物质浸出量增大;而溶剂用量过高则造成极性太低,达不到断裂化学键的目的。当用甲醇溶液作溶剂时,多酚收率随着甲醇溶液体积分数的增大先增加后减少,达到很高后,收率又明显增高,这可能是由于高含量甲醇溶液溶出了花椒中过多的弱极性成分,对多酚测量带来干扰[13]。
丙酮的提取效果最好,但鉴于丙酮危险性高且对人体有毒害作用,故不宜作批量提取试剂;而乙醇提取多酚虽略逊于丙酮,但其价格低廉、安全性高且有利于清洁生产[17]。故选择乙醇作为花椒多酚的提取溶剂进行后续工艺优化试验。
2.1.2 处理温度对花椒多酚收率的影响
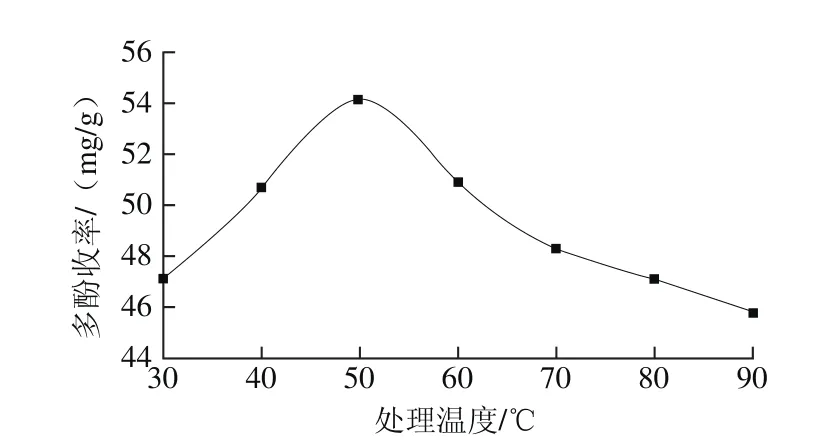
图2 处理温度对花椒多酚收率的影响Fig. 2 Effect of temperature on the yield of polyphenols
较高的处理温度可加快分子运动及传质速率,但温度过高将导致多酚中的热不稳定性成分发生氧化而被破坏[13]。由图2可知,在30~50 ℃范围内多酚收率随温度升高而增大,50 ℃时多酚收率达到最大为54.1 mg/g,当温度高于50 ℃时多酚收率逐渐下降,这可能是由于多酚类物质在高温条件下易被氧化,部分多酚类物质结构发生改变所致。
2.1.3 提取时间对花椒多酚收率的影响

图3 提取时间对花椒多酚收率的影响Fig. 3 Effects of extraction time on the yield of polyphenols
提取时间对目标物质的生产周期和效率影响较大,不同的提取时间也同样影响着多酚收率[16]。由图3可知,在开始2 h内,花椒多酚收率逐渐增高,在2 h时达到最大为52.4 mg/g,之后出现下降趋势。这可能是由于花椒中的多酚类在最初的2 h内就已基本提取完成,随着提取时间的延长,可溶出的多酚类物质越来越少。
2.1.4 料液比对花椒多酚收率的影响
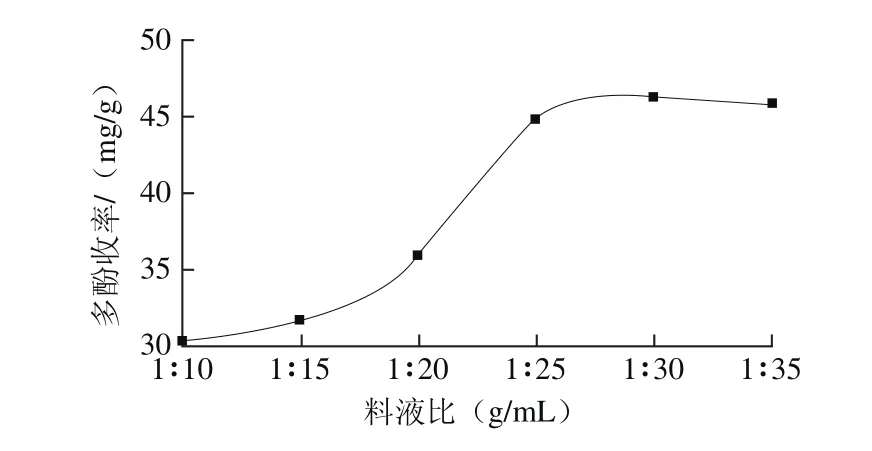
图4 料液比对花椒多酚收率的影响Fig. 4 Effects of solid-to-solvent ratio on the yield of polyphenols
多酚与溶剂间的浓度差是多酚提取的推动力,选择适宜的料液比,不仅有利于提高多酚传质速率和多酚收率,还能降低溶剂消耗与生产成本[13]。由图4可知,花椒多酚收率随提取溶剂用量增大而逐渐升高,当料液比达到l∶25(g/mL)后,多酚收率基本持平。这是由于花椒多酚已大部分溶出,继续增加溶剂用量效果不再显著,反而会造成溶剂损耗。
2.1.5 提取液pH值对花椒多酚收率的影响
适宜的酸度可增加植物组织细胞的通透性,并抑制多酚氧化酶的活性,这不仅有利于有效成分的溶出,还减少了酶促氧化反应的发生,均可提高多酚收率[5]。由图5可知,在pH值为1~3时,多酚收率随pH值上升而增加;当pH值为3时为53.1 mg/g;之后多酚收率逐渐下降。此外,pH值对多酚收率的影响较小,故选择pH值为3,后续响应面分析法中将不再考虑。
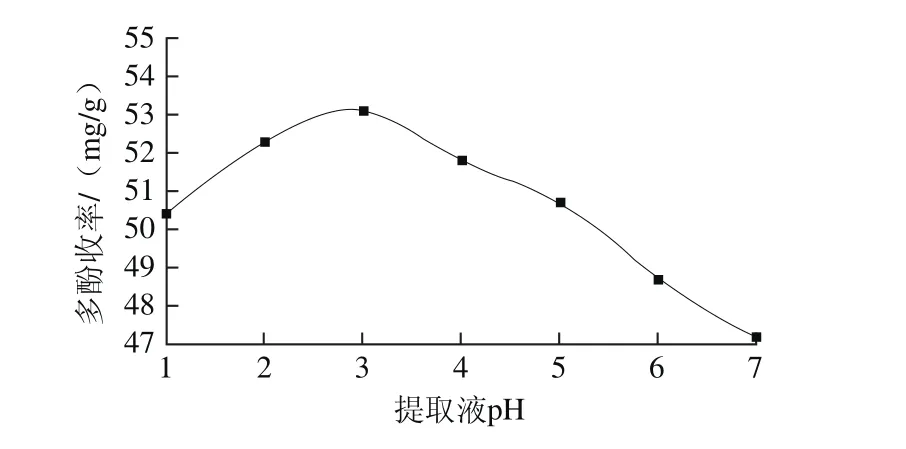
图5 提取液pH值对花椒多酚收率的影响Fig. 5 Effects of solvent pH on the yield of polyphenols
2.2 响应面试验结果分析
在上述单因素试验基础上,利用Box-Behnken试验,分别考察影响多酚提取过程的4 个主要因素,即处理温度(X1)、提取时间(X2)、溶剂体积分数(X3)和料液比(X4),设计四因素三水平响应面优化试验[18]。以花椒多酚收率为响应值,采用Design-Expert 8.06进行优化分析[17,19-20]。试验方案及结果见表2,方差分析见表3,各响应面结果见图6。
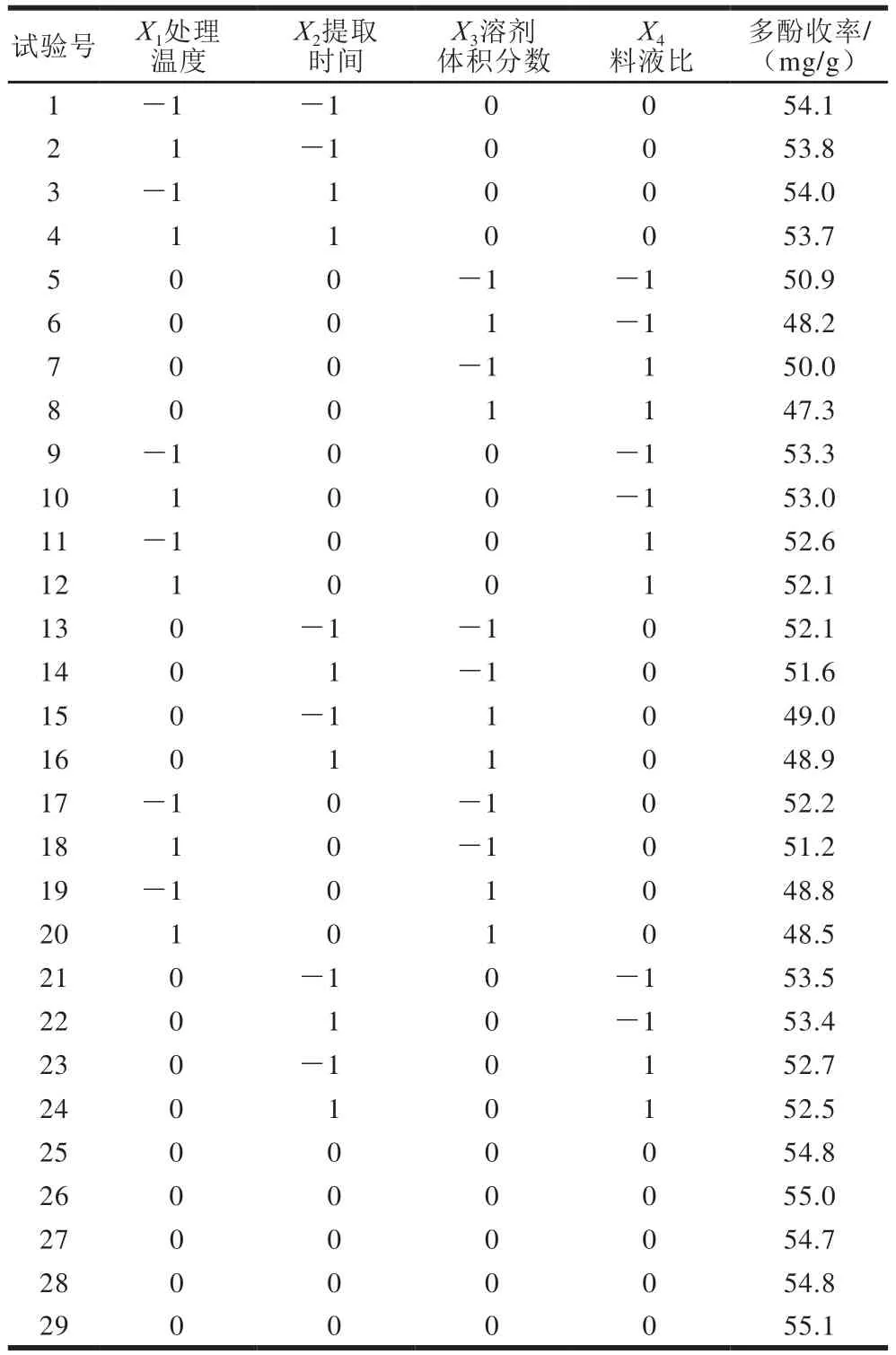
表2 Box-Behnken试验方案及结果Table 2 Box-Behnken design in terms of coded levels with response variable
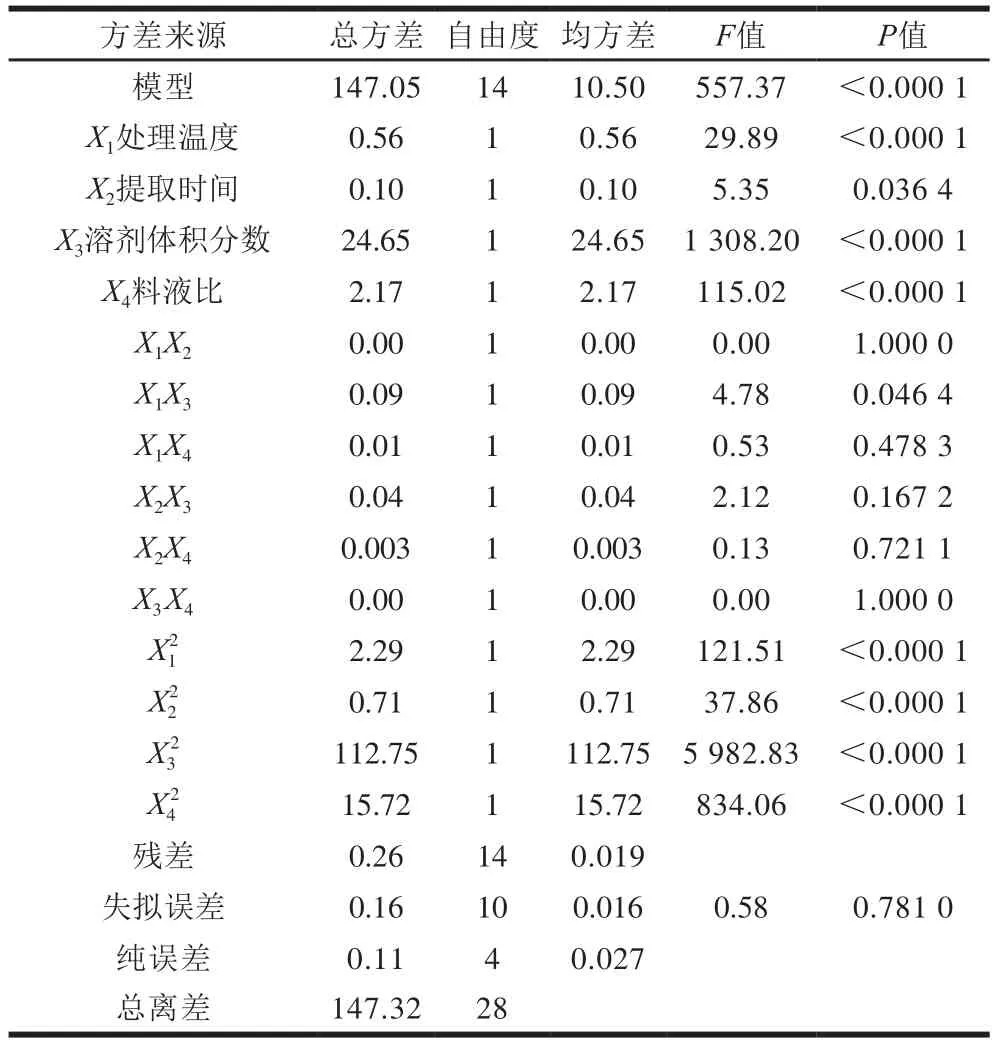
表3 以多酚收率为响应值的方差分析Table 3 Analysis of variance for the regression model
由响应面分析结果对各因素拟合所得回归方程为:

由表3可知,采用该回归方程描述各因素与多酚收率的关系(R2=0.998 2)较显著。由显著性及F值可知,花椒多酚收率的影响因素主次顺序为溶剂体积分数>料液比>处理温度>提取时间。
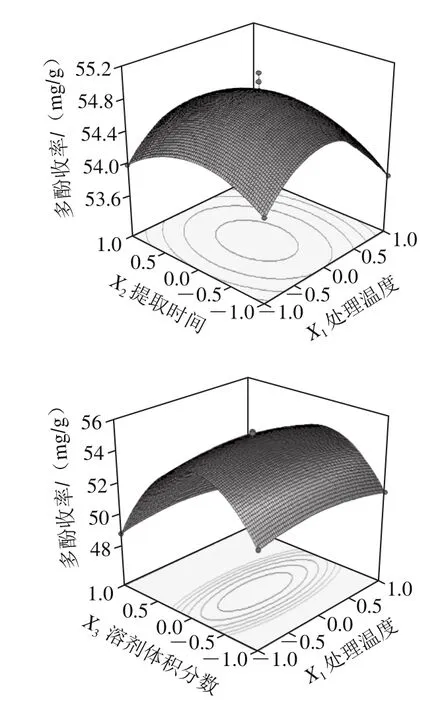
响应面曲线梯度反映各因素对多酚收率的影响大小,曲线越陡则表示该因素对多酚收率影响越明显。由图6可知,溶剂体积分数对多酚收率影响最大,且除X1X2以及X3X4外,因素之间存在一定交互作用,X1X3交互作用影响显著(P<0.05)。这与表3中回归分析结果相符。
利用Design-Expert软件对花椒多酚提取过程的工艺条件进行优化,得到最佳工艺条件为溶剂体积分数48.23%、料液比1∶29.34 (g/mL)、处理温度48.99 ℃、提取时间1.75 h,预测多酚收率为55.06 mg/g。
2.3 多酚提取动力学分析
2.3.1 动力学模型的建立
植物多酚的提取过程常伴随其他有机物质的溶出,一般包括溶剂向颗粒内部渗透,浸润并溶出有效成分;有效成分由颗粒内部迁移至固液界面;有效成分向溶剂主体扩散[21-24]。其中,内扩散被认为是提取过程的速率控制步骤[25]。
采用平板模型,以单颗粒花椒为分析主体,研究花椒多酚提取的动力学过程。假设颗粒内多酚均匀分布,多酚扩散系数不变,花椒颗粒与溶剂无明显温度梯度[26]。其多酚质量浓度变化见图7。

图7 多酚质量浓度变化图Fig. 7 Schematic of plate model showing variation in polyphenol concentration
根据Fick第一定律,在任一t时刻通过界面的多酚通量J可表达为式(6),合并整理得式(7)。

式中:J为多酚传质通量/(mg/min);DS为多酚在颗粒内的扩散系数/(m2/s);DL为多酚在乙醇中的扩散系数/(m2/s);V为乙醇体积/mL;A为两相界面积/m2。

式(7)表明多酚扩散速率与其质量浓度梯度dC/dδ及两相界面积A成正比,式中负号表示多酚传质方向与质量浓度梯度方向相反。
对于特定界面而言,其多酚质量浓度将随时间而改变,即导致dC/dδ随t改变。提取开始时质量浓度梯度大,扩散推动力大,dC/dδ随时间递减速率也大。当溶液中多酚质量浓度逐渐增大,dC/dδ减小,扩散推动力减小,dC/dδ随时间的递减速率也随之减小[27]。故假定某时刻dC/dδ随时间的递减速率与质量浓度梯度成正比,则有式(8):

式中:k为比例常数,表示多酚的表观扩散速率常数,它与多酚物理性质、提取条件和颗粒大小等因素有关。
若花椒颗粒经乙醇溶剂浸润,则记初始多酚质量浓度为C0,积分得式(9)和式(10):

记花椒质量为m g;乙醇体积与花椒的质量比为M(mL/g);饱和溶剂吸收率为P mL/g。故提取液体积为式(11):

设花椒颗粒密度为ρ;A0为单个颗粒扩散面积/m2。则mg花椒样品所含颗粒数n与颗粒总扩散面积A为式(12)、(13):
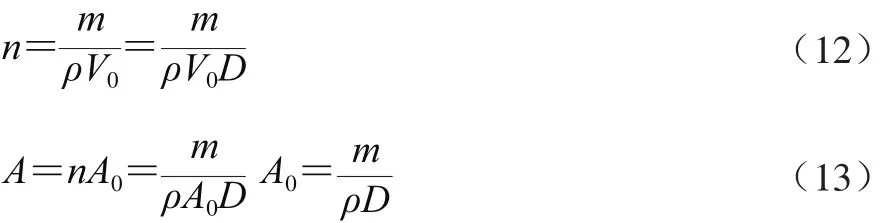
由式(10)、(11)、(13)可推出:
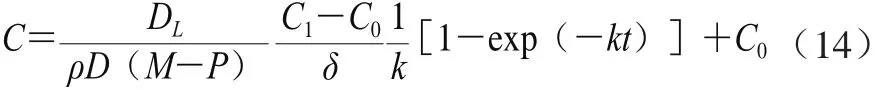
当多酚提取达到平衡时,t→∞时,C=C∞,则得到式(15):
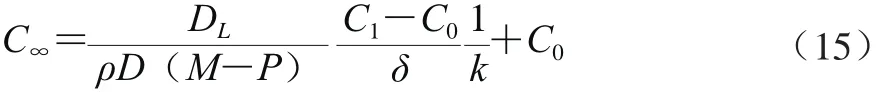
合并整理取对数得式(16)和式(17):
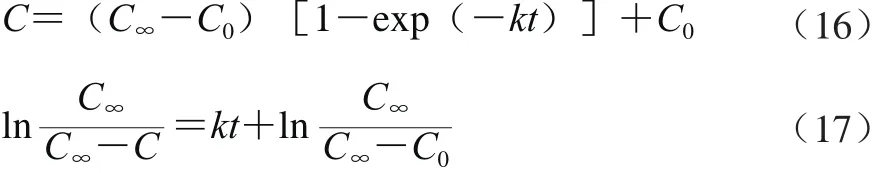
式(14)与(17)即为花椒多酚的提取动力学模型,该模型表征了花椒颗粒大小、料液比、提取时间及温度等因素与多酚质量浓度之间的关系。
2.3.2 动力学模型的求解结果
2.3.2.1 速率常数
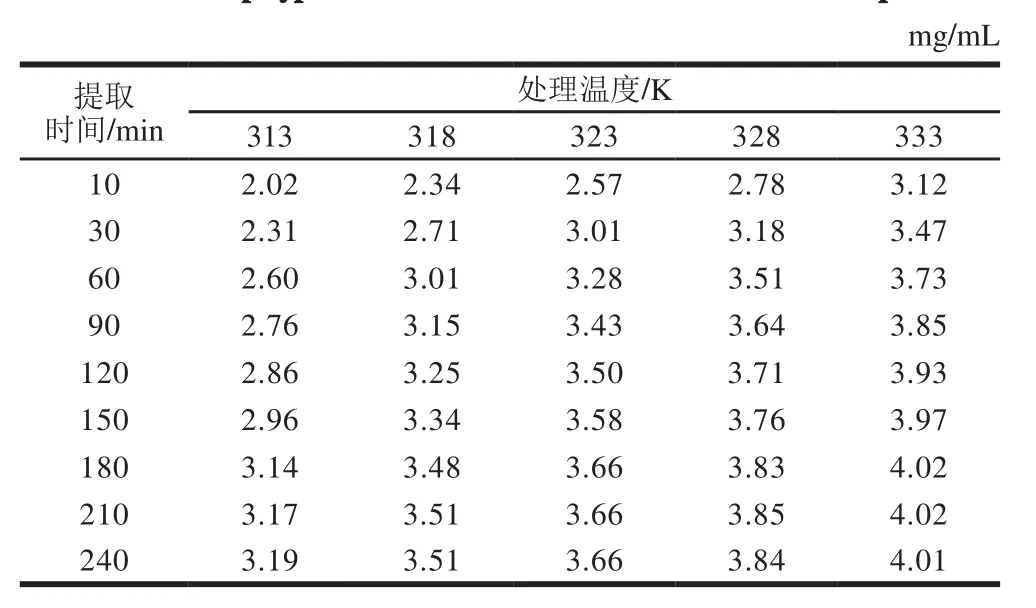
表4 不同温度下提取液中总酚质量浓度Table 4 Total polyphenol concentration in extracts at different temperatures
由表4可知,处理温度越高,多酚溶出速率越快。在达到180 min后,处理温度为323、328 K和333 K时,多酚质量浓度趋于平衡。当提取液浓度在较长时间内基本持平,则可认为达到提取平衡,故取240 min时的多酚质量浓度作为平衡质量浓度。利用表4实验数据作ln[C∞/(C∞-C)]对提取时间t的关系图,结果见图9。
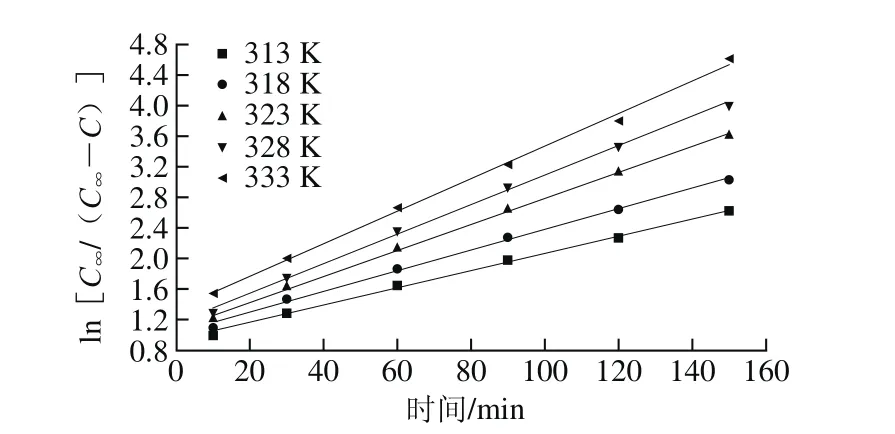
图9 不同温度下ln[C∞/(C∞-C)]与时间t的关系图Fig. 9 Relationship between ln[C∞/(C∞-C)] and extraction time (t) at different temperatures
图9中的方程回归结果和表观速率常数见表5。
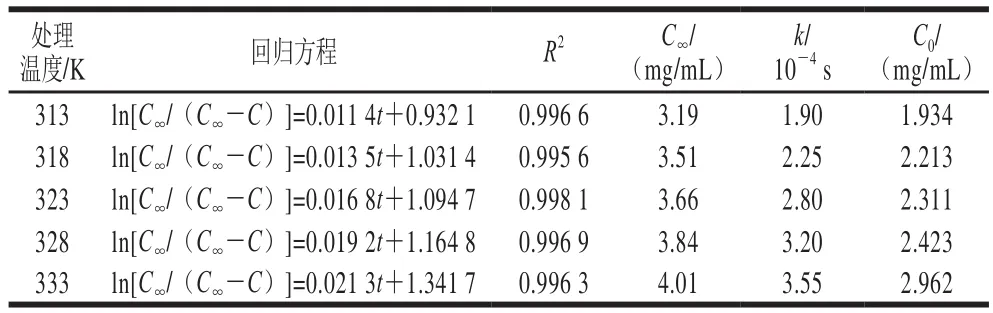
表5 不同温度下ln[C∞/(C∞-C)]与时间t的回归结果Table 5 Regression equations between ln[C∞/(C∞-C)] and t at different temperatures
从图9和表5可知,ln[C∞/(C∞-C)]与t之间线性关系良好(R2>0.99)。表观速率常数随温度升高显著增大,C0随温度的升高也略有升高。
2.3.2.2 相对萃余率
相对萃余率y=(C∞-C)/(C∞-C0),则y=exp(-kt),由表中数据作y-t关系,见图10。
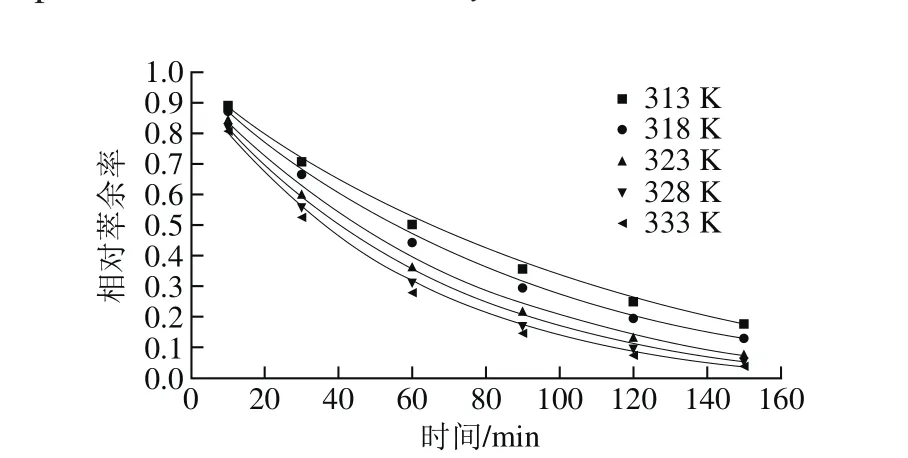
图10 不同温度下相对萃余率(y)与时间(t)的关系Fig. 10 Relationship between relative raffinate rate (y) and time (t) at different temperatures
上述拟合方程的曲线拟合度良好(R2>0.98),花椒多酚提取符合该模型。相对萃余率随时间或温度升高而减小,即收率不断增大,但收率的增长率下降。
2.3.2.3 活化能
多酚提取的表观速率常数与温度遵循Arrhenius公式[28-30]。对lnk和l/T作图,见图11和式(18)。
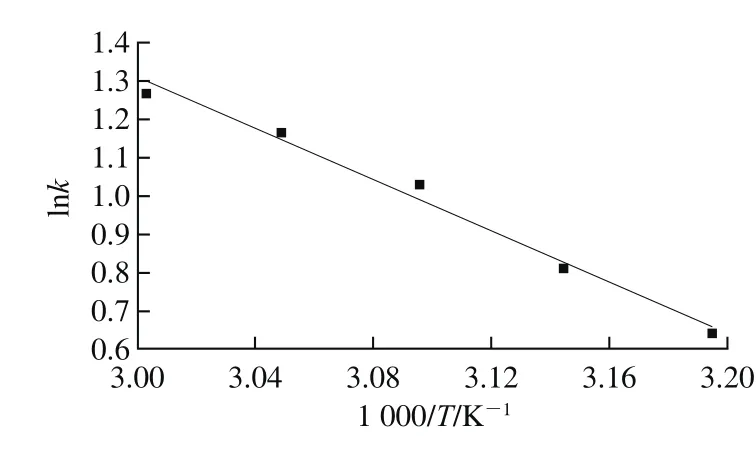
图11 lnk与1/T关系图Fig. 11 Relationship between lnk and 1/T
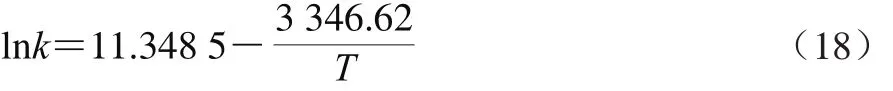
上述回归方程的拟合度良好(R2=0.982 2),花椒多酚提取的活化能为27 824 J/mol。
3 结 论
利用Box-Behnken响应面分析法得到多酚提取的最佳工艺条件为溶剂乙醇溶液体积分数48.23%、料液比1∶29.34(g/mL)、处理温度48.99 ℃、提取时间1.75 h、提取液pH 3,在此条件下进行5 次平行实验,预测多酚收率为55.06 mg/g。
采用平板模型以Fick第一定律为基础,建立了花椒总酚提取动力学模型,得到不同温度下的速率常数随温度升高而显著增大,相对萃余率随时间延长或温度增大而减小,活化能为27 824 J/mol。
[1] BRAVO L. Chemistry, dietary sources, metabolism and nutritional significance[J]. Nutrition Reviews, 2010, 35(11): 36-38.
[2] 程春龙, 李俊氢. 植物多酚的定量分析方法和生态作用研究进展[J].应用生态学报, 2006, 17(12): 2457-2460.
[3] ZHANG X, LIU W, XU Y , et al. Comparison of different cartridges of solid phase extraction for determination of polyphenols in tobacco by UPLC/MS/MS and multivariate analysis[J]. Chemical Research in Chinese Universities, 2011, 27(4): 550-556. DOI:1005-9040(2011)-04-550-07.
[4] IRINA V, IOANA I, MARIANA N, et al. Thermal stability,antioxidant activity, and photo-oxidation of natural polyphenols[J].Chemical Papers, 2017, 68(1): 121-129. DOI:10.2478/s11696-013-0417-6.
[5] EUGENIA D T, FLORENTINA G, CAMELIA A, et al. Polyphenols,radical scavenger activity, short-chain organic acids and heavy metals of several plants extracts from “Bucharest Delta”[J]. Chemical Papers,2017, 69(12): 1582-1590. DOI:10.1515/chempap-2015-0177.
[6] 李春美, 谢笔均. 茶多酚及其氧化产物清除不同体系产生的活性氧自由基的分光光度法研究[J]. 精细化工, 2000, 17(4): 241-245.
[7] 乐薇, 吴士筠. 热浸法提取箬叶总黄酮的动力学研究[J]. 江苏农业科学, 2015, 13(2): 267-273.
[8] 姚佳, 蒲彪. 青花椒研究进展[J]. 中国调味品, 2010, 35(6): 35-39.
[9] 王宏伟. 珍贵植物资源: 花椒[J]. 天津农业科学, 2011, 17(2): 126-128.
[10] 孙丰义, 王丹, 陈海涛, 等. SPME和SAFE对比分析炸花椒油挥发性风味成分[J]. 精细化工, 2016, 33(1): 50-55.
[11] 刘小红, 张尊听, 段玉峰, 等. 市售天然植物香料的抗氧化作用研究[J].食品科学, 2002, 23(1): 143-145.
[12] PEDERSON G L. Review of the Folin phenol protein quantifieation method of Lowry, Rosebrough, Farr and Randall[J]. Analytical Biochemistry, 1979,100(1): 201-220. DOI:10.1016/0003-2697(79)90222-7.
[13] 狄科. 花椒中多酚类物质的提取纯化及活性研究[D]. 南京: 南京农业大学, 2005: 8-13.
[14] 李冬, 李稳宏, 廉媛媛, 等. 化香树果序总黄酮提取动力学研究[J].天然产物研究与开发, 2011, 7(1): 238-244.
[15] 陈舰, 陈育波. 快速溶剂萃取-高效液相法测定茶叶中的多酚[J]. 东莞理工学院学报, 2011, 18(1): 93-99.
[16] 张峻, 吉伟之, 齐欣. 葡萄籽中多酚类物质的提取及其对油脂的抗氧化作用[J]. 食品科学, 2001, 22(10): 43-45.
[17] 马艳弘, 刘晨, 黄开红, 等. 响应面法优化微波提取芦荟皮多糖及其抗氧化活性[J]. 中国食品学报, 2016, 16(6): 96-104. DOI:10.16429/j.1009-7848.2016.06.014.
[18] 何为, 薛卫东. 优化实验设计: 方法及数据分析[M]. 北京: 化学工业出版社, 2014: 6-12.
[19] 应惟娲, 郝玉有, 储炬. 响应面法优化红霉素发酵培养基[J]. 中国抗生素杂志, 2009(5): 272-276.
[20] 白佩, 张园, 胡微月, 等. 响应面法优化TsoH/C催化合成丙烯酸正丁酯[J]. 化学工程, 2016, 11(2): 114-119. DOI:10.3969/j.issn.1005-9954.2016.12.013.
[21] CHU M Q, GU H C, LIU G J. Kinetic model on medicinal herb extraction process[J]. Chinese Traditional Herbal Drugs, 2000, 31: 504-506.
[22] 高蓉. 化香树果序活性成分提取、分离、应用及动力学研究[D].西安: 西北大学, 2009: 20-30.
[23] 赵钟兴, 徐华东, 刘晓辉, 等. 半连续解吸-内部沸腾提取植物有效成分新工艺[J]. 化工进展, 2006, 25(增刊1): 151-154. DOI:10.3321/j.issn:1000-6613.2006.z1.037.
[24] 章凯, 黄国林, 陈中胜, 等. 微波辅助萃取柠檬皮中果胶动力学及热力学研究[J]. 食品科学, 2010, 31(15): 107-111. DOI:10.7506/spkx1002-6630-201015024.
[25] 刘晓庚, 陈梅梅, 陈优生, 等. 胡萝卜中类胡萝卜素的提取动力学[J].食品科学, 2015, 36(16): 61-65. DOI:10.7506/spkx1002-6630-201516011.
[26] 梁英. 黄芩黄酮浸提动力学及浸提工艺研究[D]. 北京: 中国农业大学, 2005: 4-9.
[27] SPIRO M, PAGE C M. The kinetics and mechanism of caffeine infusion from coffee: hydrodynamic aspects[J]. Journal of Science of Food and Agriculture, 1984, 35: 925-930.
[28] 高鹤, 易建勇, 毕金峰, 等. 番木瓜中短波红外干燥特性[J]. 食品科学, 2015, 36(7): 30-35. DOI:10.7506/spkx1002-6630-201507006.
[29] 李梦, 黄雪松, 王超, 等. 柑橘果胶碱法脱脂动力学特征[J]. 食品科学, 2017, 38(7): 136-141. DOI:10.7506/spkx1002-6630-201707022.
[30] 王振斌, 姜美花, 曲文娟, 等. 蜂巢中多酚的提取动力学[J]. 食品工业科技, 2013, 34(15): 136-141. DOI:10.13386/j.issn1002-0306.2013.15.008.
Optimization by Response Surface Methodology and Kinetics of Extraction of Polyphenols from Chinese Prickly Ash
GUO Hongyao, LI Dong*, LEI Xiong, WANG Xiaojing, GANG Yong, LI Wenhong
(College of Chemical Engineering, Northwest University, Xi’an 710069, China)
The extraction of polyphenols from Chinese prickly ash was optimized for increased yield of polyphenols. The influence of temperature, extraction time, solvent concentration, solid-to-solvent ratio and pH on extraction efficiency was investigated initially by one-factor-at-a-time method. Using the Box-Behnken response surface methodology, the optimum extraction conditions were obtained as follows: 48.23% (V/V) acidified ethanol (pH 3) as extraction solvent,solid-to-solvent ratio 1:29.34 (g/mL), temperature 48.99 ℃, and extraction time 1.75 h. Under these optimized conditions,the average yield of polyphenols reached 55.06 mg/g (n = 5). In addition, the mass transfer kinetics during the extraction of polyphenols at different temperatures was investigated. Based on Fick’s first law of diffusion, a kinetic equation was established with the plate model. The key model parameters, including rate constant, relative extraction rate and activation energy, were obtained. These results could provide a theoretical basis for industrial extraction and further study of polyphenols from Chinese prickly ash.
Chinese prickly ash; polyphenols; extraction; response surface analysis; kinetics
10.7506/spkx1002-6630-201802039
TS255.1
A
1002-6630(2018)02-0247-07
郭宏垚, 李冬, 雷雄, 等. 花椒多酚提取工艺响应面优化及动力学分析[J]. 食品科学, 2018, 39(2): 247-253.
10.7506/spkx1002-6630-201802039. http://www.spkx.net.cn
GUO Hongyao, LI Dong, LEI Xiong, et al. Optimization by response surface methodology and kinetics of extraction of polyphenols from Chinese prickly ash[J]. Food Science, 2018, 39(2): 247-253. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201802039. http://www.spkx.net.cn
2017-03-31
陕西省青年科技新星项目(2016KJXX-32);陕西省教育厅服务地方专项计划项目(14JF026)
郭宏垚(1992—),男,硕士研究生,研究方向为化工制药与食品科学。E-mail:812972860@qq.com
*通信作者简介:李冬(1981—),男,副教授,博士,研究方向为石油化工。E-mail:lidong@nwu.edu.cn
