复合界面对食品乳液中脂肪消化的影响
2018-01-04姚晓琳方亚鹏
姚晓琳,聂 珂,陈 玉,张 琨,方亚鹏,*
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.华中科技大学同济医学院公共卫生学院,湖北 武汉 430030;3.福格森(武汉)生物科技股份有限公司,湖北 武汉 430056)
复合界面对食品乳液中脂肪消化的影响
姚晓琳1,2,3,聂 珂1,陈 玉1,张 琨3,方亚鹏1,*
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.华中科技大学同济医学院公共卫生学院,湖北 武汉 430030;3.福格森(武汉)生物科技股份有限公司,湖北 武汉 430056)
以中链甘油三酯为油相制备乳液,将天然高分子与小分子表面活性剂复配,构建阿拉伯胶(gum arabic,GA)或乳清分离蛋白(whey protein isolate,WPI)与吐温80(T80)的复合乳液界面。采用逐层添加或混合添加的方式,调控界面组分的吸附次序,构建不同界面结构的乳液体系。采用体外模拟小肠消化模型和界面流变技术等手段剖析乳液界面结构对脂肪消化速率的影响。结果表明:对于GA、WPI和T80形成的单一乳液体系,GA和WPI的界面弹性模量高于T80界面,黏弹性好。三者抗胆盐取代和延缓脂肪消化能力依次为GA<WPI<T80。在大分子GA或WPI与小分子T80形成的复合乳液体系中,由T80吸附占主导的界面,其延缓脂肪消化和界面抗胆盐取代的能力优于GA或WPI与T80共同吸附的界面结构。
乳液;脂肪消化;复合界面;界面特性
人体对脂质的吸收高达95%,脂质吸收过量是导致肥胖、心血管疾病、Ⅱ型糖尿病、动脉粥样硬化等营养代谢性疾病的主要原因[1-2]。正常人每日膳食所含的脂类中,甘油三酯占90%以上,其消化吸收需经过口腔、胃和小肠途径。脂肪的消化场所主要发生在小肠里[3]。为了使脂肪在十二指肠内被水溶性胰脂肪酶消化,脂肪在胃内可被预乳化成脂肪液滴。当脂滴进入小肠,来自胆囊的胆汁酸盐及磷脂类的表面活性物质能够有效地乳化脂肪颗粒,并吸附在脂滴表面,形成较小的脂肪颗粒。脂肪酶吸附在脂肪颗粒界面可发生酶解,生成甘油二酸酯、甘油一酸酯、脂肪酸和甘油。肠液中的离子(如Ca2+),可将脂质消化产物沉淀,由胆汁酸盐/磷脂胶束从界面上移除,为脂肪酶进一步消化提供吸附位点[4-6]。因此,脂质消化主要是由小肠肠液中的胆汁酸盐、胰脂肪酶和矿物质离子等在乳滴界面共同作用的结果[1,7-8]。目前,国内外研究热点主要集中在设计乳液的精细界面结构,来调控在模拟小肠环境中乳液脂肪的消化过程[9-13]。
食品胶体是一类动植物及微生物由来的多糖和蛋白质等天然高分子。由于其高安全性、生物体相容性、生理功效性等优点,可作为食品原料和添加剂广泛应用于各类食品,在食品结构设计中发挥重要作用。单一的多糖或蛋白吸附在界面上,由于其界面层较薄,极易被胆汁酸盐和胰脂肪酶取代,从而发生脂质快速消化[10-12]。因此,本研究拟将天然高分子与小分子表面活性剂复配,构建阿拉伯胶(gum arabic,GA)/吐温80(T80)或乳清分离蛋白(whey protein isolate,WPI)/T80复合乳滴界面。采用逐层添加或混合添加的方式,调控界面组分的吸附次序,构建相同界面组分但不同界面结构的乳液体系[13-15]。采用模拟体外小肠消化模型和界面流变技术等手段来剖析乳液界面结构对脂肪消化速率的影响,为设计降脂食品结构和脂溶性营养素递送体系提供理论依据。此外,依据食物吞咽流变学原理,随着液体稠度的增加,吞咽障碍患者误吸风险明显降低。因此可采用食品乳液复合界面调控技术设计具有不同流体力学特性(稀流质、浓流质、流动凝胶等)的模型食品体系,为开发适宜吞咽障碍人群的功能食品提供理论参考[16]。
1 材料与方法
1.1 材料与试剂
GA 日本三荣源公司;WPI 美国戴维斯柯公司;T80 汕头市西陇化工厂有限公司;胰脂肪酶(Type II L3126) 美国Sigma公司;中链甘油三酯(medium-chain triglyceride,MCT) 马来西亚KLK食品有限公司;胆汁酸盐3号、NaOH、NaCl、CaCl2(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
PT-MR 2100高速剪切乳化机 瑞士Kinematica公司;M-110L高压纳米均质机 美国Microfluidics公司;DELTA320 pH计 梅特勒-托利多仪器有限公司;Titrino907 pH-stat全自动电位滴定 瑞士万通有限公司;Mastersizer 2000激光粒度仪 英国Malvern公司;Tracker气泡/液滴轮廓分析仪 法国泰克里斯公司。
1.3 方法
1.3.1 溶液配制和乳液制备
采用Tris-HCl缓冲液(10 mmol/L,pH 7.0)配制一定质量分数的GA溶液、WPI溶液和T80溶液,调节pH 7.0,室温条件下滚轴混合过夜,使其溶胀完全。在上述溶液中加入MCT,高速剪切乳化机预乳化3 min(26 000 r/min),采用高压纳米均质机均质,75 MPa一次循环,得到水包油型乳液,整个实验过程在冰水浴条件下完成。
1.3.2 乳液粒径测定
使用Mastersizer 2000型激光粒度仪分别测定不同质量分数的GA乳液、WPI乳液和T80乳液的粒径。为防止多重散射,需要逐滴加入乳液至折光度略高于10%,并在实验过程中持续搅拌。为与配制乳液的溶剂保持一致,在测量乳液粒径时使用超纯水作分散剂。GA-MCT的折光率为1.47,WPI-MCT的折光率为1.54,T80-MCT的折光率为1.08。
1.3.3 复合乳液的制备
对于GA-T80乳液体系,在GA溶液中加入MCT,高速剪切乳化3 min(26 000 r/min),采用高压纳米均质机均质,75 MPa一次循环,得到水包油型乳液,整个实验过程在冰水浴条件下完成。在新制得的乳液中加入T80溶液,磁力搅拌至少3 h,得到终质量分数为10% GA、0.2% T80和20% MCT的复合乳液。采用T80先乳化均质再添加GA吸附可得到T80-GA乳液体系。将GA和T80溶液混合,加入MCT乳化均质,得到GA+T80乳液体系。3 种制备方法条件下乳液终质量分数均为10% GA、0.2% T80和20% MCT。WPI/T80复合乳液体系制备方法参照GA/T80复合乳液体系。
1.3.4 消化动力学测定
取1 mL乳液用Tris-HCl(10 mmol/L,pH 7.0)缓冲液稀释40 倍,取30 mL,调节pH 7.0,在37 ℃条件下水浴振荡30 min。随后加入NaCl、CaCl2、胆盐、脂肪酶,终体积为37.5 mL,得到终浓度为150 mmol/L NaCl、20 mmol/L CaCl2、5 mg/mL胆盐、胰脂肪酶1.6 mg/mL的体外模拟小肠环境[17]。最后用pH-stat全自动电位滴定仪在恒定pH 7.0条件下测定消化动力学曲线。通过消耗的NaOH量可计算得到乳液体系中游离脂肪酸(free fatty acids,FFA)的释放率,从而可评价小肠中脂肪消化的程度。FFA释放率按公式(1)计算:
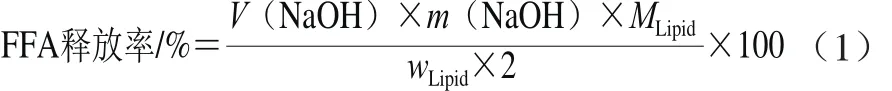
式中:V(NaOH)为消耗NaOH的体积/mL;m(NaOH)为NaOH浓度/(mol/L);wLipid为消化反应中最初的油脂的质量(194 mg);MLipid为中链甘油酸酯的摩尔质量(500 g/mol)。
1.3.5 界面张力和模量测定
用界面流变仪测量各乳化剂在油-水界面吸附时引起的界面张力和界面弹性模量的变化。采用带有U型针头的微量注射器(内径0.56 mm),全自动泵控制油滴体积。测定界面张力时,采用恒定油滴表面积14.0 mm2。测定界面弹性模量时,采用周期控制油滴表面积(14.0±1.4)mm2(即振幅10%),振荡周期为0.05~0.1 Hz的模式。整个实验在37 ℃水浴条件下控温进行。
通过CCD相机高速采集油滴轮廓信息,通过Laplace方程计算得到界面张力,通过监测油滴表面积发生变化时界面张力的变化值,计算得到界面弹性模量[18-19],按公式(2)、(3)计算:

式中:π界面压/(mN/m);γ0是纯油-水界面的张力值/(mN/m);γ为溶液界面张力的变化/(mN/m);A为界面面积/mm2;ε为界面弹性模量/(mN/m)。
1.3.6 界面分步吸附
乳化剂和胆盐在界面上分步吸附引起的界面张力和界面弹性模量变化的测定方法按1.3.5节[19]。对于GA-T80体系,向样品池中加入10 mL含有10 mmol/L Tris-HCl缓冲液(pH 7.0)、150 mmol/L NaCl、20 mmol/L CaCl2的GA溶液, 280 r/min持续搅拌。待GA在油-水界面上吸附平衡后,在12 000 s时加入含有相同水相的T80溶液,待其吸附平衡后,在24 000 s时加入胆盐(终质量浓度0.125 mg/mL),待其吸附平衡。对于T80-GA体系,先加入T80溶液吸附平衡,在12 000 s处再加入含相同水相的GA溶液,待吸附平衡后在24 000 s时加入终质量浓度为0.125 mg/mL的胆盐。对于GA+T80体系,将GA和T80混合溶液加入样品池使其吸附平衡,在24 000 s处加入相同质量浓度的胆盐,待其吸附平衡。WPI和T80复合体系的界面分步吸附操作参照GA和T80复合体系。
1.4 数据处理
各实验均重复3 次以上,结果以±s表示。
2 结果与分析
2.1 单一乳液特性结果
2.1.1 单一乳液的粒径分布
乳液粒径大小是评价乳液物理特性的重要指标之一,可判断乳化剂的乳化活性。在脂肪消化过程中,乳液的比表面积决定了胆盐、脂肪酶在油-水界面的吸附位点,因此乳液粒径大小对脂肪消化速率影响显著[3]。如图1所示,10% GA、1% WPI和0.2% T80制备乳液的粒径分布基本一致,可保证乳液液滴的比表面积一致,消除乳液粒径对脂肪消化速率造成的影响。后续实验均采用此乳化剂质量分数。
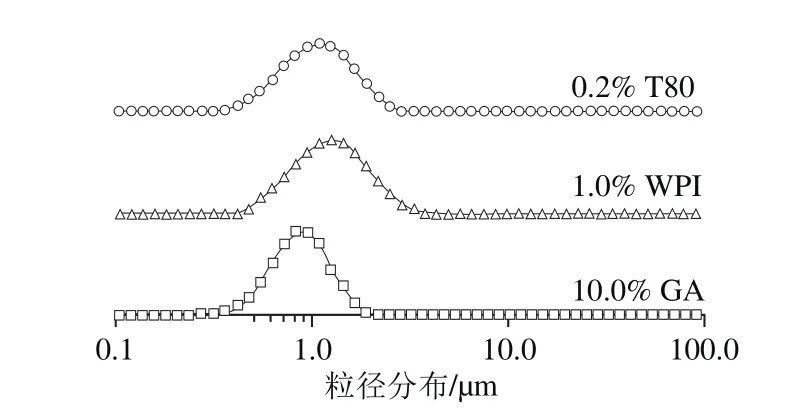
图1 10% GA、1% WPI和0.2% T80制备乳液的粒径分布Fig. 1 Particle size distribution of emulsions stabilized with 10% GA,1% WPI and 0.2%T80
2.1.2 单一乳液的消化动力学
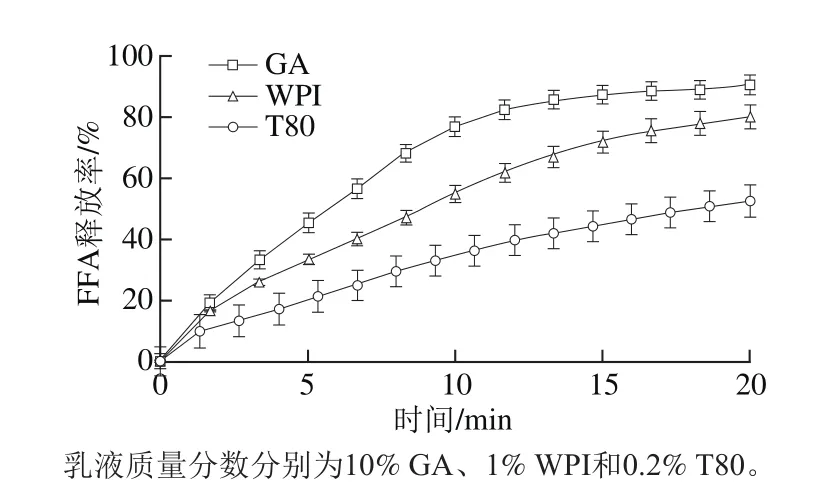
图2 单一乳化剂乳液消化动力学曲线Fig. 2 Kinetics of lipid digestion of emulsions stabilized with 10% GA,1% WPI and 0.2% T80
由图2可知,GA乳液的脂肪消化速率最大,其次为WPI,T80乳液的脂肪消化速率最低。由于GA是大分子链状多糖,分子中的阿拉伯半乳聚糖蛋白(arabinogalactan protein,AGP)约含12%,是主要的提供界面活性的部分[20-21]。AGP中的疏水蛋白部分吸附在界面上,外凸的亲水多糖链部分则提供了空间斥力来抑制乳液颗粒的絮凝和聚集。GA分子中仅有小部分吸附在乳滴界面上,吸附位点少而弱,在模拟肠液中极易被胆盐取代。WPI是球形蛋白质分子,可凭借分子中疏水基团全部吸附在界面上,且蛋白质分子能与胆盐结合,限制胆盐的活动能力,从而降低了消化速率。T80为小分子表面活性剂,可吸附在脂滴界面上形成整齐致密的界面结构,因此可有效阻碍胆盐和脂肪酶在界面上的吸附[22-25]。
2.1.3 单一乳液的界面流变特性
由图3A可知,GA和WPI界面的弹性模量值基本一致,比T80界面的弹性模量值高很多。说明此质量分数条件下GA和WPI形成的界面相对T80有更好的界面黏弹性。这是由于大分子GA和WPI具有较强的空间位阻,在乳滴界面可形成较厚的吸附层,乳滴空间稳定性较好,可在一定程度上抵御外力造成的变形。T80属于小分子表面活性剂,在界面吸附致密整齐,但乳滴的空间稳定性较差,易发生变形和聚集。图3B表明,在加入胆盐后,GA界面的界面张力降低值ΔT为8.42 mN/m,T80界面的界面张力基本不变,WPI界面的界面张力降低值ΔT为1.09 mN/m,由此证明T80的抗胆盐取代能力最优,其次为WPI和GA[19,26-27]。3 种乳化剂所呈现的界面特性与3 种乳液的消化动力学规律相吻合。采用界面流变技术可有效评价乳化剂的界面特性,肠液组分对乳滴界面特性造成的影响以胆盐取代最为显著。因此,通过评价胆盐在界面的取代能力,可在一定程度上判断乳液的脂肪消化动力学规律。
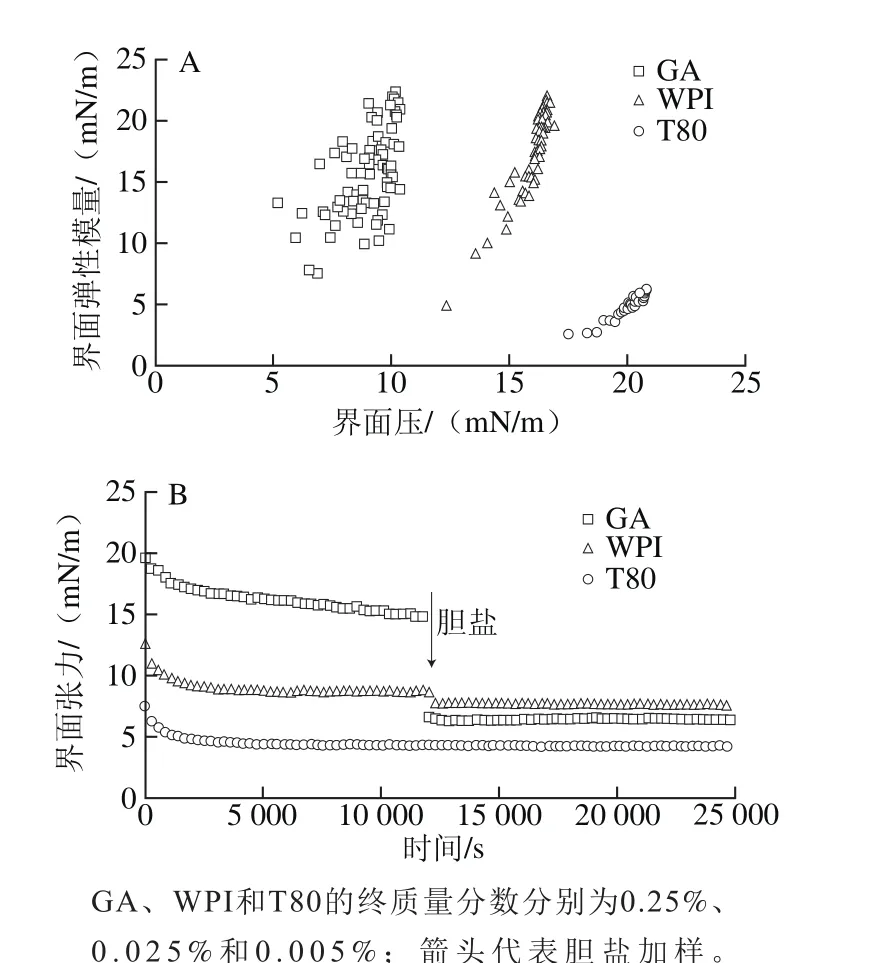
图3 单一乳液界面条件下的界面弹性模量(A)和界面张力(B)Fig. 3 Interfacial dilatational modules (A) and tensions (B) of single oil-water interfacial layer coated with 0.25% GA, 0.025% WPI and 0.005% T80
2.2 复合乳液特性结果
2.2.1 复合乳液的粒径分布
采用大分子GA或WPI与小分子表面活性剂T80设计大分子和小分子复合乳液界面,通过不同的乳液制备方法,调控界面结构组成,以此来评价复合乳液界面对脂肪消化速率的影响。前期研究表明,采用逐层添加的方法制备乳液,二次添加的乳化剂为原位吸附,不会影响到初始乳液的粒径[13]。因此,采用具有相同粒径分布的单一乳化剂质量分数制备逐层吸附或混合吸附乳液,其粒径分布可保持一致。
2.2.2 GA和T80复合乳液
由图4可知,采用GA乳化均质再添加T80吸附的乳液(GA-T80),其消化动力学曲线出现明显的延滞期和加速期[13]。而采用T80乳化均质再添加GA吸附的乳液(T80-GA)以及将GA和T80混合后乳化均质制备的乳液(GA+T80),其乳液消化动力学曲线与GA-T80乳液消化曲线中的延滞期速率相重合,乳液的FFA释放程度依次为GA-T80>GA+T80>T80-GA。研究表明,在多糖或蛋白乳液中加入非离子型表面活性剂,会出现消化动力学曲线的延滞期和加速期[17,28-29],推测脂肪酶在乳滴界面的吸附需要一定的时间是造成延滞期的主要原因[29]。而T80-GA乳液和GA+T80乳液具有和GA-T80乳液类似的延滞期,是由其界面结构所决定的。
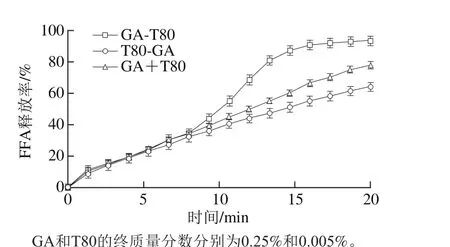
图4 逐层吸附或混合吸附法制备的GA和T80复合乳液体系的脂肪消化动力学曲线Fig. 4 Kinetics of lipid digestion of complex emulsions stabilized with 0.25%GA and 0.005% T80 using layer-by-layer adsorption or mixed adsorption
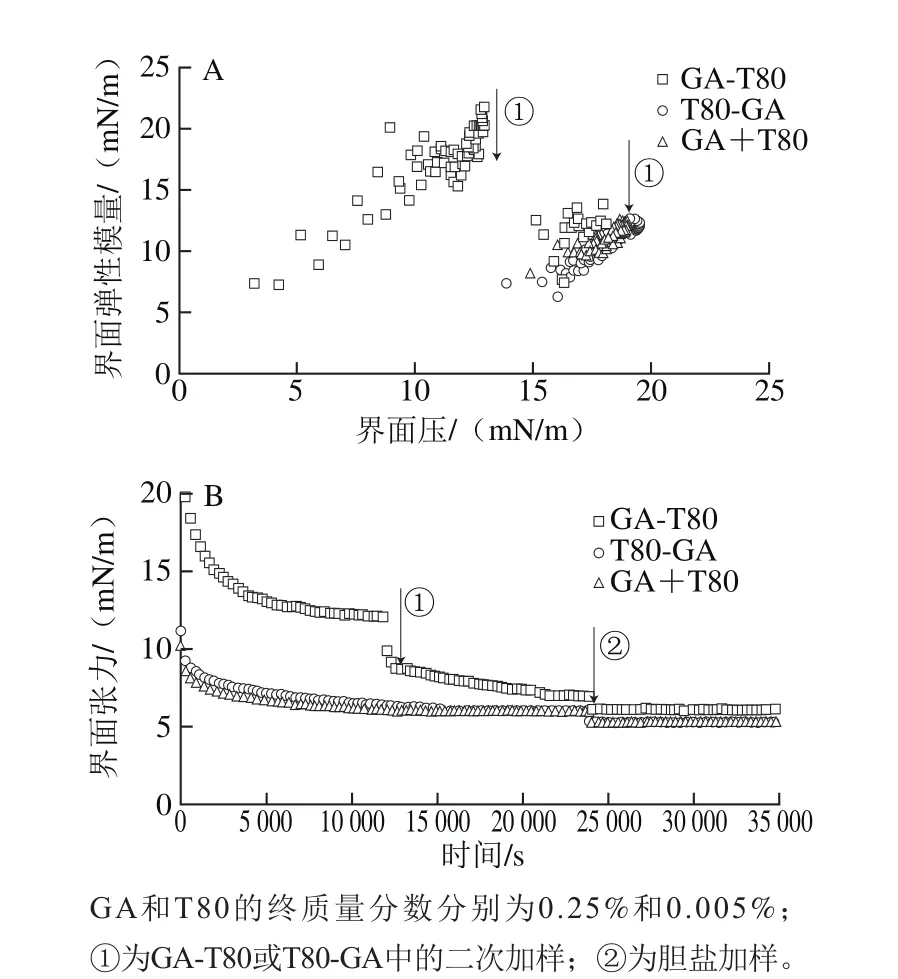
图5 GA和T80复合体系条件下不同吸附次序的界面弹性模量(A)和界面张力变化(B)Fig. 5 Interfacial dilatational modules (A) and tensions (B) of complex oil-water interfacial layer coated with 0.25% GA and 0.005% T80
如图5A所示,GA-T80体系的界面弹性模量值在加入T80后明显下降,但略高于GA+T80和T80-GA两种体系条件下的界面弹性模量值。T80-GA体系的界面弹性模量在加入GA后未发生任何变化,与GA+T80体系的界面弹性模量值基本一致。由图5B可知,GA-T80体系条件下的界面张力值在加入T80后大幅度降低,加入胆盐后也有一定程度的降低(ΔT约为0.91 mN/m)。T80-GA体系的界面张力值在加入GA后未发生变化,与GA+T80体系的界面张力值几乎完全重合,2 种体系在加入胆盐后界面张力值下降程度一致(ΔT约为0.74 mN/m)。由此可推测,GA-T80体系中T80取代了界面上部分GA,形成了GA/T80的混合吸附界面。GA+T80和T80-GA两种体系的界面结构相似,可能为T80主导的界面结构。T80主导的界面结构其抗胆盐取代能力优于GA/T80的混合吸附界面。
对于GA-T80体系,由于GA是链状大分子多糖,仅AGP中的疏水蛋白部分吸附在界面,界面结构较为松散。小分子表面活性剂T80能够填补界面上GA分子间空隙或取代部分GA,形成较为致密的界面结构。对于T80-GA体系,由于T80优越的乳化活性,T80可在界面上整齐排列形成致密界面结构,GA难以找到界面吸附位点,也无法取代已在界面吸附平衡的T80,因此形成以T80主导的界面结构。对于GA+T80体系,将二者共同加入后,GA和T80在界面上竞争性吸附,GA的界面吸附位点较少,乳化活性显著低于T80,难以在界面占据,因此也形成了以T80主导的界面结构[19,26-27]。界面上的T80在一定程度上阻碍或延缓了脂肪酶吸附,即脂肪酶的吸附需耗费一定时间,酶解反应无法立即启动。因此3 种乳液的脂肪消化动力学曲线中均出现了延滞期。不同的是,GA-T80乳液界面为GA和T80共同吸附,与T80相比,GA较易被胆盐取代而使脂肪酶吸附,因此在GA-T80乳液的延滞期后会出现加速期。而以T80为主导的乳液界面,测定时间内未见到明显的加速期。
2.2.3 WPI和T80复合乳液

图6 逐层吸附或混合吸附法制备的WPI和T80复合乳液体系的脂肪消化动力学曲线Fig. 6 Kinetics of lipid digestion of complex emulsions stabilized with 0.025% WPI and 0.005% T80 using layer-by-layer adsorption or mixed adsorption
由图6可知,采用WPI乳化均质再添加T80吸附的乳液(WPI-T80),其消化速率和FFA释放程度最大,其次是将WPI和T80混合后乳化均质制备的乳液(WPI+T80),T80乳化均质再添加WPI吸附的乳液(T80-WPI)消化速率最慢。
由图7A可知,WPI-T80体系中的界面弹性模量在加入T80后大幅度降低,但远高于WPI+T80和T80-WPI体系的界面弹性模量值。T80-WPI体系的界面弹性模量在加入WPI后未发生变化,与WPI+T80体系的界面弹性模量值基本重合。由图7B可知,WPI-T80体系在12 000 s时加入T80后界面张力值显著降低,在24 000 s时加入胆盐后界面张力值降低值ΔT为0.65 mN/m。而T80-WPI体系在加入WPI后界面张力无任何变化,与WPI+T80体系界面张力曲线完全重合。胆盐的加入对二体系的界面张力值也无任何影响。由此可推测,WPI-T80体系中,界面上的WPI界面被T80部分取代,形成了WPI/T80的混合吸附界面[30]。对于T80-WPI体系,由于T80优越的乳化活性,在界面吸附致密,WPI几乎无法取代已在界面吸附平衡的T80,因此形成了以T80主导的界面结构。对于WPI+T80体系,WPI和T80在界面上竞争性吸附,T80呈现出在界面吸附显著的优势。由于本实验为单滴吸附,WPI+T80体系测定的界面弹性模量与界面张力均与T80-WPI接近,乳滴界面以T80吸附为主,不排除有极少量WPI吸附在界面。这是由于,WPI相对于GA具有良好的乳化活性,在乳液形成中很可能存在少量WPI吸附在乳滴界面形成WPI单独包覆乳滴或同一乳滴界面上吸附少量WPI的情况。在乳液消化过程中,WPI吸附界面相对于T80较易被胆盐取代,因此WPI+T80混合吸附体系呈现出比T80-WPI体系更快的消化速率(图6)。同时,也证明T80主导的界面结构的抗胆盐取代能力优于WPI/T80的混合吸附界面[19,26-27]。

图7 WPI和T80复合体系条件下不同吸附次序的界面弹性模量(A)和界面张力变化(B)Fig. 7 Interfacial dilatational modules (A) and tensions (B) of complex oil-water interfacial layer coated with 0.025% WPI and 0.005% T80
3 结 论
脂质在体内消化是个复杂的过程,但其实质是肠液组分(胆盐、脂肪酶、矿物离子等)在乳滴界面共同作用的结果,胆盐的界面取代是影响脂质消化速率的关键因素,可将胆盐对界面上乳化剂的取代能力作为评价其消化难易程度的重要指标。对于由多糖或蛋白组成的单一界面结构,由于其界面层较薄,较易被胆盐取代而完成消化。采用小分子表面活性剂进行修饰的复合界面,会使界面结构更为致密而厚实,可在一定程度上延缓或阻碍胆盐的界面取代。本实验采用天然高分子GA或WPI与小分子表面活性剂T80设计复合乳液界面结构,构建了大分子和小分子的复合乳液界面体系。采用体外模拟小肠消化模型和界面流变技术,评价了界面结构对脂肪消化速率和抗胆盐取代能力的影响。
对于GA、WPI和T80形成的单一乳液界面,GA和WPI的界面弹性模量高于T80界面,黏弹性好。三者抗胆盐取代和延缓脂肪消化的能力依次为GA<WPI<T80。
对于大分子和小分子形成的复合乳液界面,GA-T80体系中的T80取代了界面上部分GA,形成了GA/T80的混合吸附界面,GA+T80和T80-GA两种体系的界面结构相似,可能为T80主导的界面结构。T80主导的界面结构其抗胆盐取代能力优于GA/T80的混合吸附界面,呈现出良好的延缓脂肪消化的能力。同理,WPI-T80体系中,T80取代了界面上部分WPI,形成了WPI/T80的混合吸附界面。T80-WPI体系中T80在界面吸附致密,形成以T80主导的界面结构。对于WPI+T80体系,T80呈现出显著的界面吸附优势。但在乳液形成中可能存在少量WPI吸附在乳滴界面形成WPI单独包覆乳滴或同一乳滴界面上吸附少量WPI的情况。在乳液消化过程中,WPI吸附界面相对于T80较易被胆盐取代,因此WPI+T80混合吸附体系呈现出比T80-WPI体系更快的消化速率。
[1] GOLDING M, WOOSTER T J. The influence of emulsion structure and stability on lipid digestion[J]. Current Opinion in Colloid & Interface Science, 2010, 15(1/2): 90-101. DOI:10.1016/j.cocis.2009.11.006.
[2] WILDE P J, CHU B S. Interfacial & colloidal aspects of lipid digestion[J]. Advances in Colloid & Interface Science, 2011, 165(1):14-22. DOI:10.1016/j.cis.2011.02.004.
[3] MCCLEMENTS D J, LI Y. Structured emulsion-based delivery systems: controlling the digestion and release of lipophilic food components[J]. Advances in Colloid & Interface Science, 2010,159(2): 213-228. DOI:10.1016/j.cis.2010.06.010.
[4] JÓDAR-REYES A B, TORCELLO-GÓMEZ A, WULFF-PÉREZ M J, et al. Different stability regimes of oil-in-water emulsions in the presence of bile salts[J]. Food Research International, 2010, 43(6):1634-1641. DOI:10.1016/j.foodres.2010.05.005.
[5] SARKAR A, YE A, SINGH H. On the role of bile salts in the digestion of emulsified lipids[J]. Food Hydrocolloids, 2016, 60: 77-84.DOI:10.1016/j.foodhyd.2016.03.018.
[6] MALDONADO-VALDERRAMA J, GUNNING A P, RIDOUT M J,et al. The effect of physiological conditions on the surface structure of proteins: setting the scene for human digestion of emulsions[J].European Physical Journal E, 2009, 30(2): 165-174. DOI:10.1140/epje/i2008-10426-0.
[7] PAFUMI Y, LAIRON D, DE LA PORTE P L, et al. Mechanisms of inhibition of triacylglycerol hydrolysis by human gastric lipase[J].Journal of Biological Chemistry, 2002, 277(31): 28070-28079.DOI:10.1074/jbc.M202839200.
[8] BAUER E, JAKOB S, MOSENTHIN R. Principles of physiology of lipid digestion[J]. Asian-Australasian Journal of Animal Sciences,2005, 18(2): 282-295. DOI:10.5713/ajas.2005.282.
[9] PORTER C J, TREVASKIS N L, CHARMAN W N. Lipids and lipidbased formulations: optimizing the oral delivery of lipophilic drugs[J].Nature Reviews Drug Discovery, 2007, 6(3): 231-248. DOI:10.1038/nrd2197.
[10] MUN S, DECKER E A, MCCLEMENTS D J. Influence of emulsifier type on in vitro digestibility of lipid droplets by pancreatic lipase[J].Food Research International, 2007, 40(6): 770-781. DOI:10.1016/j.foodres.2007.01.007.
[11] SUN J H, DECKER E A, MCCLEMENTS D J. Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J]. Food Chemistry, 2009, 114(1): 253-262. DOI:10.1016/j.foodchem.2008.09.069.
[12] CHU B S, RICH G T, RIDOUT M J, et al. Modulating pancreatic lipase activity with galactolipids: effects of emulsion interfacial composition[J]. Langmuir, 2009, 25(16): 9352-9360. DOI:10.1021/la9008174.
[13] ZEEB B, LOPEZ-PENA C L, WEISS J, et al. Controlling lipid digestion using enzyme-induced crosslinking of biopolymer interfacial layers in multilayer emulsions[J]. Food Hydrocolloids, 2015, 46: 125-133. DOI:10.1016/j.foodhyd.2014.12.018.
[14] LEE S J, CHOI S J, LI Y, et al. Protein-stabilized nanoemulsions and emulsions: comparison of physicochemical stability, lipid oxidation,and lipase digestibility[J]. Journal of Agricultural and Food Chemistry,2011, 59(1): 415-427. DOI:10.1021/jf103511v.
[15] SANDRA S, DECKER E A, MCCLEMENTS D J. Effect of interfacial protein cross-linking on the in vitro digestibility of emulsified corn oil by pancreatic lipase[J]. Journal of Agricultural and Food Chemistry,2008, 56(16): 7488-7494. DOI:10.1021/jf800741w.
[16] NISHINARI K, TAKEMASA M, SU L, et al. Effect of shear thinning on aspiration-toward making solutions for judging the risk of aspiration[J]. Food Hydrocolloids, 2011, 25(7): 1737-1743.DOI:10.1016/j.foodhyd.2011.03.016.
[17] YAO X, WANG N, FANG Y, et al. Impact of surfactants on the lipase digestibility of gum arabic-stabilized o/w emulsions[J].Food Hydrocolloids, 2013, 33(2): 393-401. DOI:10.1016/j.foodhyd.2013.04.013.
[18] CASTELLANI O, GUIBERT D, AL-ASSAF S. Hydrocolloids with emulsifying capacity. Part 2-adsorption properties at the n-hexadecanewater interface[J]. Food Hydrocolloids, 2010, 24(2/3): 121-130.DOI:10.1016/j.foodhyd.2009.07.006.
[19] YAO X, ZHANG W, NIE K, et al. Effect of gum arabic, gum ghatti and sugar beet pectin as interfacial layer on lipid digestibility in oil-in-water emulsions[J]. Food Biophysics, 2016, 11(3): 292-301.DOI:10.1007/s11483-016-9441-8.
[20] XIANG S, YAO X, ZHANG W, et al. Gum arabic-stabilized conjugated linoleic acid emulsions: emulsion properties in relation to interfacial adsorption behaviors[J]. Food Hydrocolloids, 2015, 48:110-116. DOI:10.1016/j.foodhyd.2015.01.033.
[21] NAKAUMA M, FUNAMI T, NODA S, et al. Comparison of sugar beet pectin, soybean soluble polysaccharide, and gum arabic as food emulsifiers. 1. Effect of concentration, pH, and salts on the emulsifying properties[J]. Food Hydrocolloids, 2008, 22(7): 1254-1267. DOI:10.1016/j.foodhyd.2007.09.004.
[22] DICKINSON E. Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter, 2008,4(5): 932-942. DOI:10.1039/b718319d.
[23] SINGH H, SARKAR A. Behaviour of protein-stabilised emulsions under various physiological conditions[J]. Advances in Colloid & Interface Science, 2011, 165(1): 47-57. DOI:10.1016/j.cis.2011.02.001.
[24] TZOUMAKI M V, MOSCHAKIS T, SCHOLTEN E, et al. In vitro lipid digestion of chitin nanocrystal stabilized o/w emulsions[J]. Food &Function, 2013, 4(1): 121-129. DOI:10.1039/c2fo30129f.
[25] SARKAR A, MURRAY B, HOLMES M, et al. In vitro digestion of Pickering emulsions stabilized by soft whey protein microgel particles:influence of thermal treatment[J]. Soft Matter, 2016, 12(15): 3558-3569. DOI:10.1039/C5SM02998H.
[26] TORCELLO-GÓMEZ A, JÓDAR-REYES A B, MALDONADOVALDERRAMA J, et al. Effect of emulsifier type against the action of bile salts at oil-water interfaces[J]. Food Research International, 2012,48(1): 140-147. DOI:10.1016/j.foodres.2012.03.007.
[27] MALDONADO-VALDERRAMA J, WOODWARD N C, GUNNING A P, et al. Interfacial characterization of beta-lactoglobulin networks:displacement by bile salts[J]. Langmuir, 2008, 24(24): 6759-6767.DOI:10.1021/la800551u.
[28] 王娜娜, 姚晓琳, 徐琼, 等. 乳液消化的界面调控研究[J]. 食品科技,2013, 38(7): 53-59.
[29] LI Y, MCCLEMENTS D J. Inhibition of lipase-catalyzed hydrolysis of emulsified triglyceride oils by low-molecular weight surfactants under simulated gastrointestinal conditions[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2011, 79(2): 423-431.DOI:10.1016/j.ejpb.2011.03.019.
[30] WOODWARD N C, GUNNING A P, MALDONADOVALDERRAMA J, et al. Probing the in situ competitive displacement of protein by nonionic surfactant using atomic force microscopy[J].Langmuir, 2010, 26(15): 12560-12566. DOI:10.1021/la101632v.
Effect of Complex Interface on Lipid Digestion in Food Emulsion
YAO Xiaolin1,2,3, NIE Ke1, CHEN Yu1, ZHANG Kun3, FANG Yapeng1,*
(1. College of Bioengineering and Food Science, Hubei University of Technology, Wuhan 430068, China;2. School of Public Health, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China;3. Ferguson (Wuhan) Biotechnologies Co. Ltd., Wuhan 430056, China)
In this study, emulsion was prepared with medium-chain triglyceride (MCT) as oil phase, and gum arabic (GA),whey protein isolate (WPI) and Tween 80 (T80) as emulsifiers to design complex emulsion interface. The interfacial structure of emulsions was varied by controlling the sequence of adsorption of the components at the interface using layerby-layer adsorption or mixed adsorption. The effect of interfacial structure on the rate of lipid digestion was evaluated using a simulated intestinal lipolysis model by interfacial rheology. The results showed that individual GA or WPI interface presented higher interface modulus than T80 interface along with good viscoelasticity, and the ability to resist bile salt displacement and delay lipid digestion was as follows: GA < WPI < T80. In complex emulsions, the interface dominated by T80 showed a better ability to delay lipolysis and resist of bile salt displacement than the interface composed of GA (WPI) and T80.
emulsion; lipid digestion; complex interface; interfacial structure
10.7506/spkx1002-6630-201802001
TS20
A
1002-6630(2018)02-0001-07
姚晓琳, 聂珂, 陈玉, 等. 复合界面对食品乳液中脂肪消化的影响[J]. 食品科学, 2018, 39(2): 1-7.
10.7506/spkx1002-6630-201802001. http://www.spkx.net.cn
YAO Xiaolin, NIE Ke, CHEN Yu, et al. Effect of complex interface on lipid digestion in food emulsion[J]. Food Science,2018, 39(2): 1-7. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201802001. http://www.spkx.net.cn
2016-11-24
国家自然科学基金面上项目(31470096);中国博士后科学基金项目(2017M612464)
姚晓琳(1982—),女,副教授,博士,主要从事食品胶体功能化应用研究。E-mail:yaoxiaolin1113@163.com
*通信作者简介:方亚鹏(1977—),男,教授,博士,主要从事食品胶体研究。E-mail:fangypphrc@163.com
