呼吸ICU耐碳青霉烯类鲍曼不动杆菌耐药基因的携带情况及同源性
2018-01-04李天娇符生苗符惠群王旭明龙文芳
李天娇, 黄 涛, 吴 华, 苏 屿, 符生苗, 符惠群, 王旭明, 龙文芳
(1 海南省人民医院,海南 海口 570311; 2 海南医学院公共卫生学院,海南 海口 570311)
·论著·
呼吸ICU耐碳青霉烯类鲍曼不动杆菌耐药基因的携带情况及同源性
李天娇1, 黄 涛1, 吴 华1, 苏 屿1, 符生苗1, 符惠群1, 王旭明1, 龙文芳2
(1 海南省人民医院,海南 海口 570311; 2 海南医学院公共卫生学院,海南 海口 570311)
耐碳青霉烯酶; 鲍曼不动杆菌; 耐药基因; 同源性分析
耐碳青霉烯类抗生素鲍曼不动杆菌(carbapenem-resistantAcinetobacterbaumannii, CRAB)已成为医院感染中的重要病原菌之一,常引起严重的感染,特别是在免疫力低下的患者中,甚至可以引起致死性的感染[1]。碳青霉烯类抗生素是治疗革兰阴性杆菌的最后一道防线[2],因此,碳青霉烯类抗生素在治疗严重感染、复杂感染、多重耐药菌感染有更好的疗效,但随着该类抗生素的广泛应用,目前CRAB菌株日益增多,给临床治疗带来新的挑战。近年来,多地报道了急诊病房及重症监护病房(ICU)鲍曼不动杆菌的医院感染暴发流行[3-4]。由于我院分离CRAB对临床常用的抗菌药物耐药性比较严重,且多来源于呼吸ICU,因此,本研究收集呼吸ICU 3个月来临床患者分离的CRAB 22株,分析其耐药情况。碳青霉烯类抗生素耐药的分子机制主要由于外源性获得碳青霉烯酶,主要分为B类和D类酶,B类酶又称为金属β-内酰胺酶(MBLs),目前鲍曼不动杆菌中已被鉴别出获得性的MBLs有IMP、VIM型酶等,D类酶为苯唑西林酶(OXA型酶),在鲍曼不动杆菌中常见有bla-OXA23、bla-OXA24、bla-OXA51、bla-OXA58[5];前几年本地区的肠杆菌科细菌耐药酶基因(NDM-1,KPC-2)调查[6]结果表明,NDM-1为主要携带酶型,未发现KPC-2酶型,所以本研究选取5种水解碳青霉烯类抗生素常见的耐药酶基因(KPC-2、IMP、VIM、NDM-1、OXA-23)进行检测,了解我院呼吸ICU CRAB耐药酶基因的携带情况,同时利用脉冲场凝胶电泳(PFGE)对分离的22株CRAB进行同源性分析,现将结果报告如下。
1 材料与方法
1.1 试验菌株 收集2015 年10—12月呼吸ICU临床患者送检标本分离的CRAB菌株22株(剔除同一患者检出的重复菌株),使用菌株保存管-70℃保存。
1.2 试剂和仪器 VITEK 2 Compact全自动微生物分析系统及配套的药敏卡。PCR扩增仪使用E-Cycle TM 96 PCR扩增仪;琼脂糖电泳仪为北京六一仪器厂公司电泳仪;琼脂糖电泳成像仪使用JS-380自动凝胶成像系统;PCR扩增试剂使用2×Power Taq PCR Master Mix(BioTeke,PR1700)试剂盒,琼脂糖电泳Marker使用D2000 DNA Marker(TIANGEN,MD114);PFGE电泳仪为Bio-rad,PFGE图像录入Bio Numerics软件包进行处理。
1.3 方法
1.3.1 菌株鉴定及药敏试验 临床分离出的细菌先按目标菌进行分纯,分纯后的单个菌落使用VITEK 2 Compact全自动微生物分析系统及配套的药敏卡进行菌种鉴定、药敏试验。测得的MIC值以2015年美国临床实验室标准化协会(CLSI))的临界值判定敏感性,药敏结果显示亚胺培南或美罗培南对目标菌MIC值≥8 μg/mL,作为CRAB目标菌株收集。
1.3.2 细菌DNA的提取 将培养16~18 h的新鲜培养物悬浮于100~200 μL无菌去离子水中,沸水浴10 min以上,12 000 r/min离心5 min,吸取上清液,-20℃保存。
1.3.3 PCR扩增及测序 采用PCR 法进行基因扩增,各靶基因引物序列和目的产物长度见表1。KPC-2基因引物设计参考Genbank中DQ 989640.1合成。PCR反应条件:94℃预变性5 min;94℃变性15 s,55℃退火30 s,72℃30 s,共25个循环,最后72℃再延伸5 min。PCR扩增完产物经120 V,40 min,1.5%琼脂糖凝胶电泳,用凝胶成像系统观察结果、拍照并将PCR扩增产物送上海生工生物工程公司进行测序,结果与BLAST进行同源性比对。由于没有OXA-23基因和VIM基因的阳性对照,为了保证PCR体系的完整性,在检测OXA-23基因PCR扩增同批体系时同时增加一个KPC-2(893 bp)标本作为阳性对照(KPC-2菌株由广州呼吸疾病研究所卓超教授惠赠);在VIM基因PCR体系中增加NDM-1(292 bp)作为阳性对照,标本为本实验室保留。
1.3.4 耐药菌株同源性分析 22株CRAB采用PFGE法进行同源性分析,实验中所用内切酶、实验条件见表2。
表1CRAB耐药基因PCR扩增引物序列及产物长度
Table1Primer sequences and product length of PCR amplification of CRAB drug resistance genes

目的基因序列(5’-3’)产物长度(bp)NDM⁃1F:CAGCACACTTCCTATCTC292[7]R:CCGCAACCATCCCCTCTTIMPF:TTGACACTCCATTTACTG139[8]R:GATTGAGAATTAAGCCACTCTOXA⁃23F:GATGTGTCATAGTATTCGTCG1058[9]R:TCACAACAACTAAAAGCACTGVIMF:GATGGTGTTTGGTCGCATA390[10]R:CGAATGCGCAGCACCAGKPC⁃2F:ATGTCACTGTATCGCCGTCT893R:TTTTCAGAGCCTTACTGCCC
表222株CRAB PFGE实验方法与条件
Table2Experimental methods and conditions of PFGE of 22 CRAB strains

名称条件名称条件RunTime119hRampinglinearInitialSwitchTime5s起始电流135maFinalSwitchTime20sMarkerH9812VoltageGradient6V/cmMarker内切酶XbaIIncludedAngle120°被测菌内切酶ApaI
1.3.5 PFGE分析方法 PFGE图像录入BioNumerics(Version7.1,Applied maths,Inc.)软件包进行处理,识别图像条带,经统一的分子质量标准进行校准,标定条带位置,必要时进行手工校正。每两个图像之间的相似性系数用Dice系数(Dice coefficients,SD)表示,SD =2nxy/(nx+ny),其中nx是菌株x的总条带数,ny是菌株y的总条带数,nxy是菌株x和菌株y共有的条带数。SD值反映不同菌株PFGE图像之间的相似性程度,范围在0~1之间,0代表完全不一样,1代表完全相同。出现不同条带即判定为不同的型别,对每一个型别都进行命名。根据每两个图像之间的相似性系数,用非加权配对算术平均法(unweighted pair group average method,UPGMA)进行聚类,构建聚类树。
2 结果
2.1 菌株标本来源分布 2015年10—12月呼吸ICU共分离CRAB 22株,其中19株(86.36%)分离于痰,2株(9.09%)分离于尿,1株(4.55%)分离于血。

表3 22株CRAB的耐药结果
2.3 PCR扩增及测序结果 对22株CRAB进行PCR扩增KPC-2、IMP、VIM、NDM-1、OXA-23基因,结果KPC-2、IMP、NDM-1无特异性条带出现,均为阴性;OXA-23基因扩增目的条带在1 058处全部出现特异性条带,阳性率为100%;VIM基因也全部出现特异性条带,阳性率为100%。PCR产物送至上海生工生物工程公司进行测序,结果在GenBank进行BLAST比对确认为OXA-23基因和VIM基因。见图1~2。

M:marker;P:KPC-2(893 bp)阳性对照;1~22:待测菌株

M:marker;P:NDM-1(292 bp)阳性对照;1~22:待测菌株
2.4 PFGE电泳结果与分析 22株CRAB进行PFGE分型、酶切后部分PFGE电泳图见图3。PFGE图像录入BioNumerics软件包进行处理,根据相似度100%的为同一PFGE型别的原则,22株菌分为13种不同带型。每种带型包含菌株数为1~5株不等[其中9种带型(69.23%)分别只包含1株菌,其他4种(30.77%)带型包含菌株数为2~5株]。其中A5、A7和A8 为同一型,A9、A11、A14、A19和A22 为同一型, A4、A10和A12为同一型,A16和A18为同一型。聚类树图结果见图4。
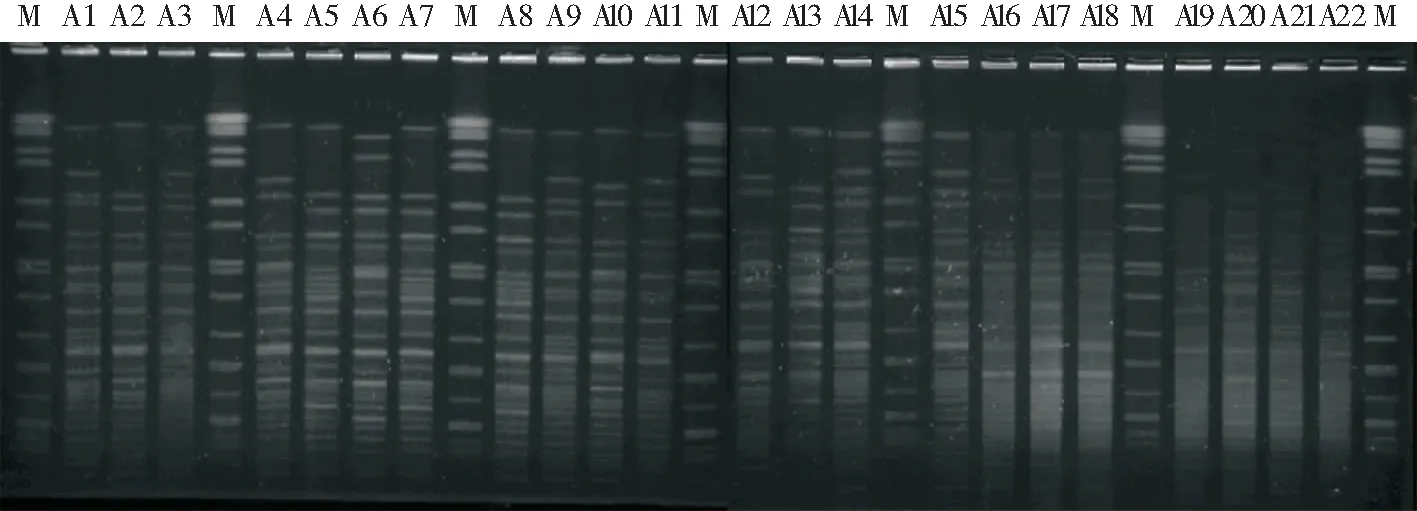
图3 22株CRAB的PFGE电泳图

图4 22株CRAB的PFGE聚类树图
3 讨论
CRAB已成为我国医院感染最重要的病原菌,吸痰器、呼吸机、空调、输液系统均可被污染而将病原菌传播给患者,鲍曼不动杆菌以下呼吸道感染最为常见[11]。我院呼吸ICU分离的CRAB也主要来源于下呼吸道,对临床常用的抗菌药物耐药性比较严重,除了对多粘菌素B均为敏感和对米诺环素的耐药率为9.09%外,对大多抗菌药物的耐药率均>80%,特别是对β-内酰胺类的药物均耐药,因此,治疗CRAB感染的抗菌药物选择非常有限。
近年来,鲍曼不动杆菌成为继铜绿假单胞菌之后的分离最多的非发酵菌,是引起医院感染的重要条件病原菌。而CRAB对抗菌药物耐药的机制具有多样性和繁复性,据文献[12]报道,耐药机制主要是抗菌药物诱导细菌产生β-内酰胺酶的水解酶,能够水解亚胺培南或美罗培南中的β-内酰胺环,使酰胺键断裂而失去抗菌活性,出现了耐碳青霉烯类的多重耐药菌。为了进一步了解我院CRAB的耐药机制,本实验选取KPC-2、IMP、VIM、NDM-1、OXA-23共5种耐药及介导耐药基因进行检测,结果未检测到KPC-2、IMP、NDM-1基因,OXA-23基因和VIM基因阳性均为100%。OXA-23型酶和VIM型酶能水解头孢菌素类及碳青酶烯类抗生素,据研究[13]报道OXA-23型酶是引起鲍曼不动杆菌多重耐药的主要原因之一,全国12所三级甲等医院2007年7月—2008年6月CRAB的OXA-23阳性率为80.4 %;四川省某医院对48株CRAB进行耐药基因检测,其中OXA-23占比70.8%,VIM携带率为31.3%[14];天津市第三中心医院的一次院内调查结果也表明CRAB的耐药基因OXA-23为80.3%[15]。本次实验22株CRAB携带的OXA-23基因和VIM基因总检出率是100%,比上述国内其他地区报道的携带的OXA-23、VIM耐药基因阳性率均高,特别是VIM耐药基因阳性率也达100%,远高于四川某医院报道的31.3%,可能为地域之间的差异或是菌株数较少而造成统计上的局限性,但提示OXA-23和VIM型酶仍是我院CRAB的主要流行酶型。
鲍曼不动杆菌具有在体外长期存活的能力,易引起克隆播撒,由于CRAB 对包括碳青霉烯类的大多数抗菌药物耐药,同一克隆株在同一病区内及不同病区间的播散是其容易暴发流行的主要原因[16]。为明确我院呼吸ICU多重耐药鲍曼不动杆菌是否有暴发流行的趋势,本研究重点收集呼吸ICU的22株CRAB进行同源性分析,22株菌分为13种不同带型。每种带型包含菌株数为1~5株不等,其中9种带型(69.23%)分别只包含1株菌,其他4种(30.77%)带型包含菌株数为2~5株不等。其中A5、A7和A8 为同一型,A9、A11、A14、A19和A22 为同一型, A4、A10和A12为同一型,A16和A18为同一型。总体来看,所有菌株的相似度较高,相似度均大于80%,可能是菌株大多来源于痰的原因。对于100%相似的菌株,可以考虑为同一克隆株,说明呼吸ICU有CRAB小范围的暴发流行。由于CRAB常常通过医护人员的手、污染的医疗器械和空气等途径引起医院感染的暴发流行,病死率高,所造成的经济损失大,后果严重,应引起医院感染管理部门、临床微生物室及其他医院相关管理部门的高度重视[17],加强医院感染管理,合理应用抗菌药物,医护人员严格无菌操作、加强消毒隔离措施,预防耐药菌株在医院内大范围的暴发流行。
[1] 凌月明, 蔡媛媛, 王建福, 等.鲍曼不动杆菌临床分布、易感因素及耐药情况分析[J].检验医学与临床, 2014, 11(2):212-213.
[2] 毛璞, 邱桂霞, 叶丹, 等.重症监护病房碳青霉烯类抗生素耐药鲍曼不动杆菌耐药机制及同源性分析[J].中国感染与化疗杂志, 2012, 12(6):449-452.
[3] 伍国强, 梁海云, 李朝阳, 等.急诊住院病房多重耐药鲍曼不动杆菌医院内感染暴发的原因调查及控制对策[J].现代医药卫生, 2014, 30(9):1322-1324.
[4] 王莉, 周凤萍.ICU多重耐药鲍曼不动杆菌医院感染暴发流行病学调查[J].中国感染控制杂志, 2013, 12(2):113-116.
[5] Brown S,Amyes S.OXA(beta)-lactamases inAcinetobacter:the story so far[J].J Antimicrob Chemother, 2006, 57(1): 1-3.
[6] 李天娇, 李成学, 陈淑萍, 等.海南9株携带blaNDM-1基因肠杆菌科细菌的分离和确认[J].中华检验医学杂志, 2014, 37(1):36-40.
[7] 郑波, 吕媛, 李耘.携带blaNDM-1基因泛耐药肠杆菌科细菌的检测方案[J].中国临床药理学杂志, 2010, 26(11):845-848.
[8] Xionq J, Alexander DC, Ma JH. Complete sequence of pOZ176, a 500-kilobase IncP-2 plasmid encoding IMP-9-mediated carbapenem resistance, from outbreak isolatePseudomonasaeruginosa96[J]. Antimicrob Agents Chemother, 2013, 57(8): 3775-3782.
[9] 余琳, 苏丹虹, 江凤茹, 等.多重耐药鲍曼不动杆菌耐药基因分析与同源性分析[J].实用医学杂志, 2013, 29(12):2018-2021.
[10] 唐慧琴, 陈定强, 吴爱武.耐亚胺培南铜绿假单胞菌的金属β-内酰胺酶检测[J].中国卫生检验杂志, 2014, 24(6):831-833.
[11] 吴震宇, 方玉才, 洪钟亮.鲍曼不动杆菌的临床分布特征及耐药性分析[J].临床合理用药杂志, 2014, 7(9):17-18.
[12] Chen Y, Lu Y, Yin Y, et al. Draft genome sequence of a multidrug-resistant blaOXA-23-producingAcinetobacterbaumanniiST381 isolate from China[J]. J Glob Antimicrob Resist, 2015, 3(4): 300-301.
[13] 马序竹, 吕媛, 张佳, 等.耐亚胺培南鲍曼不动杆菌耐药性及OXA碳青霉烯酶检测[J].中国临床药理学杂志, 2011, 27(4):268-271.
[14] 李光荣, 宋敏, 杨建波, 等.碳青霉烯类耐药鲍曼不动杆菌耐药基因的研究[J].中国全科医学, 2014, 17 (26):3083-3087.
[15] 段樱, 张健东, 王军, 等.PCR检测鲍曼不动杆菌的耐碳青霉烯OXA-23基因[J].广东医学, 2011, 32 (9) :1169-1171.
[16] Zhou H,Yang Q,Yu YS,et al. Clonal spread of imipenem-resistantAcinetobacterbaumanniiamong different cities of China[J].J Clin Microbiol, 2007, 45(12): 4054-4057.
[17] 胡必杰, 宗志勇, 顾克菊, 等.多重耐药菌感染控制最佳实践[M].上海:上海科学技术出版社, 2012:21-22.
Carriageofdrugresistancegenesandhomologyofcarbapenem-resistantAcinetobacterbaumanniiisolatedfromrespiratoryintensivecareunit
LITian-jiao1,HUANGTao1,WUHua1,SUYu1,FUSheng-miao1,FUHui-qun1,WANGXu-ming1,LONGWen-fang2
(1HainanGeneralHospital,Haikou570311,China; 2SchoolofPublicHealth,HainanMedicalUniversity,Hainan570311,China)
ObjectiveTo investigate drug resistance genes and epidemic characteristics of β-lactamase carried by carbapenem-resistantAcinetobacterbaumannii(CRAB) in the respiratory intensive care unit(RICU) in a hospital.MethodsClinically isolated CRAB from RICU patients in October-December 2015 were collected. Five drug resistance genes (KPC-2,IMP,VIM,NDM-1,OXA-23) were specifically amplified by polymerase chain reaction (PCR), amplified products were performed agarose gel electrophoresis and sequencing analysis, the homology was analyzed with pulsed-field gel electrophoresis (PFGE).ResultsA total of 22 CRAB strains were isolated in October-December 2015, 19 (86.36%) of which were isolated from sputum. The resistance rate of 22 CRAB strains to compound sulfamethoxazole was 59.09%, resistance rate to minocycline was 9.09%, all were sensitive to polymyxin B, resistance rates to other antimicrobial agents were more than 80%. Three kinds of resistance genesKPC-2,IMPandNDM-1 were not found by PCR amplification, positive rates ofVIMandOXA-23 were both 100%. PFGE homology analysis revealed that 22 strains were divided into 13 different types, each type contained 1-5 strains, 9 types(69.23%) contained only 1 strain respectively, the other 4 types (30.77%) contained 2-5 strains. A5, A7, and A8; A9, A11, A14, A19 and A22; A4, A10 and A12; A16 and A18 were of the same type respectively.ConclusionThe main types of β-lactamase-resistant genes of CRAB in RICU areVIMandOXA-23. Homology analysis shows a small parts are of the same clone strains, which reveals epidemic of a small scale.
carbapenemase-resistant;Acinetobacterbaumannii; drug resistance gene; homology analysis
[Chin J Infect Control,2018,17(1):16-20]
2017-02-22
海南省自然科学基金(814307)
李天娇(1975-),女(汉族),海南省海口市人,主任技师,主要从事细菌耐药机制研究。
龙文芳 E-mail:hnsea2013@126.com
10.3969/j.issn.1671-9638.2018.01.004
R378
A
1671-9638(2018)01-0016-05
陈玉华)
