替格瑞洛对急诊介入治疗AMI病人炎症细胞亚群的影响
2018-01-04,,,,,
,,, ,,
替格瑞洛对急诊介入治疗AMI病人炎症细胞亚群的影响
柴晓红,王敬萍,徐继尧,闫蕊,张昊洲,庞工力
目的分析替格瑞洛对急诊介入治疗急性心肌梗死(AMI)病人外周血炎症细胞亚群的影响及其临床意义。方法采用流式细胞技术检测替格瑞洛干预1个月后急诊冠状动脉支架植入术后AMI病人外周血血细胞总数、CD4+CD28-T淋巴细胞及调节性T细胞(Treg细胞)含量的变化,并与氯吡格雷组进行比较。结果药物干预1个月后两组间白细胞数、淋巴细胞数、淋巴细胞百分比无明显影响(P>0.05);与氯吡格雷组比较,替格瑞洛组CD4+CD28-T淋巴细胞百分比明显降低(P<0.05),Treg细胞百分比明显增加(P<0.05)。结论替格瑞洛在急性心肌梗死早期应用可下调CD4+CD28-T细胞、上调Treg细胞,可能是其发挥抗炎作用的机制。
急性心肌梗死;替格瑞洛;P2Y12ADP受体;炎症细胞
替格瑞洛是一种新型的选择性P2Y12二磷酸腺苷(ADP)受体拮抗剂,已广泛用于急性心肌梗死(AMI)病人的临床抗血小板治疗。有研究发现,P2Y12ADP受体拮抗剂在抗血小板聚集还具有部分抗机体炎症反应的作用[1-2],如降低体内白介素-6(IL-6)、白介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)水平等[3],但对炎症细胞亚群的影响研究甚少。本研究通过比较替格瑞洛和氯吡格雷对AMI病人急诊冠状动脉支架植入术(PCI)后外周血CD4+CD28-T淋巴细胞、Treg细胞(CD4+CD25+FoxP3+T淋巴细胞)含量的影响,分析替格瑞洛在AMI早期的抗炎作用,为替格瑞洛的非抗血小板作用提供新证据。
1 资料与方法
1.1 临床资料
1.1.1 研究对象及分组 纳入2016年1月-2016年5月因AMI在山西省心血管病医院行急诊PCI术治疗的病人50例,男31例,女19例,年龄45岁~73岁(57.3岁±17.4岁)。将所有入选病人随机分为试验组(25例)和对照组(25例)。
1.1.2 纳入标准 符合世界卫生组织制定的AMI诊断标准;发病12h内行急诊PCI术治疗(均植入Firebird支架);施加干预措施后能坚持服药,1个月后门诊随访;近5年内未服用影响免疫的药物。
1.1.3 排除标准 诊断为AMI,但未行急诊PCI术或发病12h后行PCI术;合并甲状腺功能异常、自身免疫性疾病、肿瘤性疾病、血液性疾病、变态反应性疾病、重度感染等。
1.1.4 治疗方法 两组均给予阿司匹林肠溶片(拜耳医药保健有限公司;国药准字J20130078;规格100mg×30片)0.1g,每日1次;辛伐他汀片(杭州默沙东制药有限公司;国药准字J20130068;规格 40mg×5片)40mg,每晚1次。试验组给予替格瑞洛片(AstraZenecaAB;国药准字J20130020;规格90mg×14片)90mg,每日2次;对照组给予硫酸氢氯吡格雷片[赛诺菲(杭州)制药有限公司;国药准字J20130083;75mg×7片]75mg,每日1次。
1.2 实验仪器及试剂 流式细胞仪(BectonDickinson,BD,USA),FITC-鼠抗人CD4抗体(BD公司,USA),PE-鼠抗人CD28抗体(BD公司,USA),APC-鼠抗人CD25抗体(BD公司,USA),PE-鼠抗人FoxP3抗体(BD公司,USA),人FoxP3BufferA、C(BD公司,USA),淋巴细胞分离液(北京索莱宝公司),磷酸盐缓冲液(PBS,BD公司,USA),普通Buffer(BD公司,USA)。
1.3 血样收集 所有病人均于入院当时及药物干预1个月后使用含有肝素的采血管经肘静脉抽取4mL空腹静脉血,4 ℃保存,待测。
1.4 血细胞分析 抽取2mL空腹静脉血,采用电阻抗法检测血样中白细胞数、淋巴细胞数、淋巴细胞百分比,委托山西省心血管病医院检验科完成。
1.5CD4+CD28-T细胞及Treg细胞含量检测 采用密度梯度离心方法分离淋巴细胞。取2mL淋巴细胞分离液置于离心管中,将外周血样本2mL用PBS1∶1稀释后取2mL缓慢加于淋巴细胞分离液上,1500r/min离心15min,收集第二层细胞(即淋巴细胞),PBS洗涤3次,将细胞分至2个检测管内,调整细胞数至1×106/管,分别检测CD4+CD28-、Treg细胞。
1.5.1CD4+CD28-T淋巴细胞检测 调整细胞数量后向检测管内加入FITC-鼠抗人CD4抗体10μL、PE-鼠抗人CD28抗体10μL、普通Buffer100μL,避光孵育20min,加PBS2mL,1 500r/min离心5min,倒上清液,加普通Buffer250μL重悬浮后机检。
1.5.2Treg细胞检测 调整细胞数后向检测管内加入FITC-鼠抗人CD4抗体10μL、APC-鼠抗人CD25抗体10μL、普通Buffer100μL,避光孵育20min,之后加入2mLBufferA,避光孵育15min,PBS洗涤后加0.5mLBufferC,避光孵育15min,PBS洗涤后加PE-鼠抗人FoxP3抗体10μL,避光孵育30min,PBS洗涤后加普通Buffer250μL重悬浮机检。
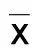
2 结 果
2.1 两组病人一般资料比较 两组病人性别,年龄,发病时间,支架长度及个数,高血压、糖尿病病人比例比较,差异无统计学意义(P>0.05)。详见表1。
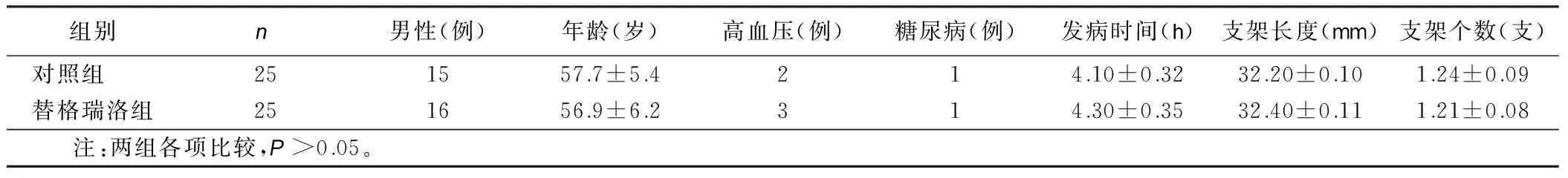
表1 两组病人一般资料比较
2.2 两组病人血细胞分析比较 药物干预前后两组间白细胞总数、淋巴细胞数、淋巴细胞百分比差异无统计学意义(P>0.05)。详见表2。

表2 两组病人血细胞分析比较(±s)
2.3 两组病人CD4+CD28-T细胞及Treg细胞含量比较 药物干预前两组间外周血CD4+CD28-细胞及Treg细胞含量百分比差异无统计学意义(P>0.05);药物干预1个月后,替格瑞洛组CD4+CD28-细胞含量百分比较对照组明显减少(P<0.05),而Treg细胞含量较对照组明显增加(P<0.05)。详见表3。

表3 两组病人CD4+CD28-T细胞及Treg细胞含量比较 %
3 讨 论
血小板聚集是急性冠脉综合征发生发展过程中重要的环节,其中,P2Y12受体ADP激活可引起血小板的活化和聚集,因此抑制P2Y12受体的激活成为抗血小板聚集的重要途径[3]。替格瑞洛和氯吡格雷属于P2Y12ADP受体拮抗剂,但替格瑞洛可不经肝脏代谢直接作用于P2Y12受体,而不受肝脏CYP2C19基因多态性影响,且其代谢产物AR-C124910XX仍具有药理活性[4],因此,替格瑞洛具有更强的抑制P2Y12受体作用。
最新研究表明,血小板活化和P2Y12受体激活同时会对炎症反应过程产生重要的影响[5]。血小板活化是炎症增强的重要原因之一[1,6],它可刺激炎症细胞分化、炎症因子及炎症介质释放,增加血小板-白细胞相互作用等[7]。替格瑞洛可通过抑制血小板表面P2Y12ADP受体抑制血小板活化,减轻机体炎症状态;P2Y12ADP受体不仅分布在血小板表面,还分布于中性粒细胞、巨噬细胞、树突状细胞等炎症细胞表面[8-9],替格瑞洛可通过P2Y12受体抑制炎症细胞激活,减少炎症因子释放,发挥抗炎作用。
本研究发现替格瑞洛较氯吡格雷能有效下调CD4+CD28-T细胞(P<0.05),CD4+CD28-T细胞是缺乏CD28表达的CD4+T细胞,该细胞可表达肿瘤坏死因子相关凋亡诱导配体(TRAIL),促进内皮细胞凋亡[10];同时表达具有传导活化信号功能的衔接分子,介导细胞因子产生和细胞毒样作用,共同促进血管内皮损伤;该细胞表面有白细胞介素-12(IL-12)受体的两个亚基,与IL-12特异性结合,增强机体炎症反应。AMI病人PCI术后支架周围及动脉粥样硬化斑块内炎症反应增强是支架内再狭窄、再发心肌梗死的重要原因之一,本研究表明替格瑞洛下调CD4+CD28-T细胞表达可能是减轻PCI术后机体整体及局部炎症反应的重要原因。
本研究替格瑞洛较氯吡格雷可明显上调Treg细胞(P<0.05),Treg细胞是表达叉头蛋白(FoxP3)的调节性T淋巴细胞[11],通过表达FoxP3、分泌转化生长因子-β(TGF-β)、IL-10、IL-35等细胞因子抑制免疫反应,下调机体免疫应答,增加机体免疫耐受能力[12];还可通过抗原递呈细胞抑制T细胞活化、增殖及功能发挥,且持续表达高亲和力IL-2受体,消耗周围环境中的IL-2,抑制效应T细胞功能,诱导T细胞凋亡。PCI术后机体对支架的免疫排斥是局部炎症反应增强的重要原因,因此替格瑞洛上调Treg细胞可能是减轻支架周围炎症反应,增强机体对支架的免疫耐受的重要因素。
大量研究表明,血小板P2Y12抑制剂可有效减少全身炎症反应和血栓形成[13-14],而替格瑞洛作为新型P2Y12ADP受体拮抗剂,可更有效减少炎症反应及血栓形成。本研究替格瑞洛可下调CD4+CD28-T细胞,上调Treg细胞,但对淋巴细胞总数无明显影响(P>0.05),可能与其通过抑制P2Y12ADP受体降低IL-6、TNF-α和趋化因子配体2并增加集落刺激因子、抗炎细胞因子IL-10的水平[15]调节淋巴细胞亚群分化有关。
综上所述,替格瑞洛可在不影响淋巴细胞总数条件下调节CD4+CD28-T细胞及Treg细胞含量,发挥抗血小板作用同时可能减轻机体炎症反应及由支架植入加重的局部炎症反应,增强机体对支架的免疫耐受能力,对AMI病人PCI术后长期获益有重要影响。
[1]LiveraniE,RicoMC,KunapuliSP,etal.P2Y12receptormodulatessepsis-inducedinflammation[J].ArteriosclerThrombVascBiol,2016,36(5):961-971.
[2]LiuO,JiaL,LiuX,etal.Clopidogrel,aplateletP2Y12receptorinhibitor,reducesvascularinflammationandangiotensinⅡinduced-abdominalaorticaneurysmprogression[J].PLoSOne,2012,7(12):e51707.
[3]DegrauweS,PilgrimT,IglesiasJF,etal.Dualantiplatelettherapyforsecondarypreventionofcoronaryarterydisease[J].OpenHeart,2017,4(2):e000651.
[4]GoelD.Ticagrelor:thefirstapprovedreversibleoralantiplateletagent[J].IntJApplBasicMedRes,2013,3(1):19-21.
[5]ElisabettaLi,LaurieEK,AlexanderYT,etal.TheroleofP2Y12receptorandactivatedplateletsduringinflammation[J].CurrDrugTargets,2014,15(7):720-728.
[6]BakogiannisC,SachseM,StellosK,etal.Platelet-derivedchemokinesininflammationandatherosclerosis[J].Cytokine,2017,S1043-4666(17):30270-30273.
[7]MaulerM,SeyfertJ,DuerschmiedD,etal.Platelet-neutrophilcomplexformation-adetailedinvitroanalysisofmurineandhumanbloodsamples[J].JLeukocBiol,2016,99(5):781-789.
[8] 刘畅,田野.P2Y12受体抑制剂与炎症的研究[J].国际心血管病杂志,2014,41(5):285-287.
[9]NylanderS,SchulzR.EffectsofP2Y12receptorantagonistsbeyondplateletinhibition-comparisonofticagrelorwiththienopyridines[J].BrJPharmacol,2016,173(7):1163-1178.
[10]BrouxB,PannemansK,HellingsN,etal.CX(3)CR1drivescytotoxicCD4(+)CD28(-)Tcellsintothebrainofmultiplesclerosispatients[J].JAutoimmun,2012,38(1):10-19.
[11]MatsumotoK,OgawaM,IsobeM,etal.RegulatoryTlymphocytesattenuatemyocardialinfarction-inducedventricularremodelinginmice[J].IntHeartJ,2011,52(6):382-387.
[12]WingK,YamaguchiT,SakaguchiS.Cell-autonomousandnon-autonomousrolesofCTLA-4inimmuneregulation[J].TrendsImmunol,2011,32(9):428-433.
[13]TrabyL,KollarsM,KaiderA,etal.EffectsofP2Y12receptorinhibitionwithorwithoutaspirinonhemostaticsystemactivation:arandomizedtrialinhealthysubjects[J].JThrombHaemost,2016,14(2):273-281.
[14]ThomasMR,StoreyRF.EffectofP2Y12inhibitorsoninflammationandimmunity[J].ThrombHaemost,2015,114(3):490-497.
[15]ThomasMR,OutteridgeSN,StoreyRF,etal.PlateletP2Y12inhibitorsreducesystemicinflammationanditsprothromboticeffectsinanexperimentalhumanmodel[J].ArteriosclerThrombVascBiol,2015,35(12):2562-2570.
R542.2 R256.2
B
10.3969/j.issn.1672-1349.2017.23.021
1672-1349(2017)23-3015-03
山西省心血管病医院(太原 030024)
王敬萍,E-mailwhw919@sina.com
信息:柴晓红,王敬萍,徐继尧,等.替格瑞洛对急诊介入治疗AMI病人炎症细胞亚群的影响J.中西医结合心脑血管病杂志,2017,15(23):3015-3017.
2017-09-21)
(本文编辑 薛妮)
