正交试验法优选黄芩配方颗粒的水提工艺
2018-01-03郝翠穆岩赵恒强崔莉刘伟刘逢芹
郝翠,穆岩,赵恒强,崔莉,刘伟,刘逢芹
(1. 山东中医药大学药学院,山东 济南 250355;2. 山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南250014;3. 山东省千佛山医院,山东 济南 250014)
正交试验法优选黄芩配方颗粒的水提工艺
郝翠1,2,穆岩2,赵恒强2,崔莉2,刘伟2,刘逢芹3*
(1. 山东中医药大学药学院,山东 济南 250355;2. 山东省分析测试中心,山东省中药质量控制技术重点实验室,山东 济南250014;3. 山东省千佛山医院,山东 济南 250014)
为优选黄芩配方颗粒制备过程中的水提取工艺,采用正交试验法考察了加水量、提取次数和提取时间3个因素在不同水平对配方颗粒中黄芩苷、汉黄芩苷、黄芩素和汉黄芩素总含量和出膏率的影响,并进行了含量测定的方法学验证。结果显示,在本实验条件下,影响成分总含量和出膏率的因素按程度大小依次为煎煮时间、煎煮次数、加水量,且不同煎煮时间具有显著性差异(P<0.05);经过验证实验,确定黄芩配方颗粒最佳水提工艺为加水10倍量,煎煮1 h,煎煮3次。本研究优选的水提取工艺稳定可行,所得产品的有效成分含量和出膏率较高且较为稳定,可用于黄芩配方颗粒的制备。
正交试验;黄芩配方颗粒;水提工艺
黄芩为唇形科植物黄芩ScutellariabaicalensisGeorgi的干燥根,具有清热燥湿、泻火解毒、止血、安胎的功效[1],药用历史悠久,主产于山东、河北、内蒙古等地,《神农本草经》将其列为中品,临床常以单方或复方治疗高血压、冠心病等疾病[2-3]。研究表明,黄芩含黄酮类、酚苷、醇苷等化学成分,其中黄芩苷、汉黄芩苷、黄芩素和汉黄芩素等黄酮类成分为主要药效成分,具有抑菌消炎、抗氧化和改善血液循环等多种药理活性[4-6]。
中药配方颗粒是由单味饮片经水提、浓缩、干燥、制粒而成的新型饮片形式,保留了传统饮片的性味与归经特性,具有起效时间短、剂量准确、便于携带等优点[7-8]。因此,配方颗粒的临床用量近年来快速增长。目前文献多集中于报道不同提取溶剂或先进技术(例如超高压、超临界等)对药材提取率的影响。例如,有报道黄芩提取过程中,使用酶法、醇提等工艺大大高于溶剂水的提取率[9-11],但近期公布的《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》[12]明确规定,配方颗粒提取过程须与汤剂相同,即限定为水提[13-14],而目前对于黄芩配方颗粒制备的水提工艺的研究报道较少。故本实验在传统汤剂的基础上,通过正交试验法考察了加水量、提取次数和提取时间3个因素在不同水平对黄芩配方颗粒中黄芩苷、汉黄芩苷、黄芩素和汉黄芩素总量以及出膏率的影响,优选黄芩配方颗粒的提取工艺,使其更为接近临床汤剂的应用实践,避免过高提取率带来的未知成分或不良反应,可为黄芩配方颗粒的制备和进一步研究提供参考依据。
1 仪器与试药
1.1 仪器
Agilent 1120高效液相色谱仪(包括Agilent DAD 检测器,Agilent Chemstation工作站,美国Agilent);BSA124S天平(德国Sartorius);旋转蒸发仪(宁波新芝生物科技股份有限公司);Scientz-10N冷冻干燥机(宁波新芝冻干设备股份有限公司);GZX-9140 MBE数显鼓风干燥干燥箱(上海博讯实业有限公司医疗设备厂);超声波清洗机(SB-3200DT,宁波新芝生物科技股份有限公司)。
1.2 试药
乙腈(美国Fisher Scientific);无水乙醇(北京益利精细化学品有限公司);甲酸(天津市科密欧化学试剂有限公司);甲酸铵(天津市科密欧化学试剂有限公司);纯净水(娃哈哈集团有限公司);黄芩苷对照品(批号 110715-201318,中国食品药品检定研究院);汉黄芩苷(批号 MUST-13052312)、黄芩素(批号 MUST-13082206)、汉黄芩素(纯度>98%批号 MUST-13092303,成都曼斯特生物科技有限公司);黄芩饮片(批号 16011601,济南禾宝中药材有限公司),经鉴定符合2015版《中国药典》规定。
2 方法与结果
2.1 含量测定方法建立
2.1.1 供试品溶液制备
取黄芩饮片100 g,加水10倍量,称重,煎煮1 h,补足重量,过滤,滤渣再加水,重复煎煮3次,过滤,合并3次水提液,然后减压浓缩至一定体积,冻干24 h后,粉碎过60目筛,乙醇制软材,过20目筛后60 ℃烘干,过20目筛整粒后密封包装,即黄芩配方颗粒。
精密称取0.1 g配方颗粒,置圆底烧瓶中,加70%乙醇40 mL,加热回流30 min,放冷,滤过,滤液置100 mL量瓶中,用少量70%乙醇分次洗涤容器和残渣,补至刻度,摇匀。精密量取1 mL,置10 mL量瓶中,甲醇定容,摇匀过滤,即得供试品溶液。
2.1.2 对照品溶液制备
分别精密称取黄芩苷、黄芩素、汉黄芩苷、汉黄芩素对照品各5 mg,置50 mL量瓶中,分别用甲醇溶解,定容作为对照品储备液,4 ℃冷藏,备用。分别精密吸取对照品贮备液适量,置10 mL量瓶中,定容,摇匀,即得黄芩苷、汉黄芩苷、黄芩素、汉黄芩素浓度分别为30.0、12.0、1.5、0.6 μg·mL-1的混合对照品溶液。
2.1.3 色谱条件
Wates-WAT054275色谱柱(250 mm×4.6 mm,5 μm),流动相A: 20 mmol·L-1甲酸铵的1%甲酸水溶液,流动相 B: 乙腈,洗脱方式(乙腈比例): 0~5 min,18%,5~8 min,18%~23%,8~18 min,23%~26%,18~50 min,40%~54%,流速0.8 mL·min-1,柱温25 ℃,检测波长274 nm,进样量10 μL[15-16]。HPLC色谱图见图1。

1.黄芩苷; 2.汉黄芩苷; 3.黄芩素; 4.汉黄芩素。图1 样品及混合对照品的HPLC色谱图Fig. 1 HPLC chromatograms of representative sample andmixed reference substances
2.1.4 线性关系考察
取2.1.2项下混合对照品溶液1,2,4,6,8,10 mL,分别置10 mL量瓶中,加甲醇定容摇匀,配制成不同浓度对照品溶液,并按2.1.3项下色谱条件测定峰面积,以浓度为横坐标,峰面积为纵坐标,得如下回归方程:黄芩苷回归方程Y=8 478.4X+13.468(r=0.999 4),线性范围0.20~10 μg·mL-1;汉黄芩苷回归方程Y=10 112X+101.97(r=0.999 6),线性范围0.10~10 μg·mL-1;黄芩素回归方程Y=11 035X-5.1(r=0.999 3),线性范围0.10~10 μg·mL-1;汉黄芩素回归方程Y=14 602X-0.402 8(r=0.999 9),线性范围0.20~10 μg·mL-1。结果表明,黄芩苷、汉黄芩苷、黄芩素和汉黄芩素在标示浓度范围内线性关系良好。
2.1.5 精密度实验
取2.1.2项下混合对照品溶液,按2.1.3项下色谱条件进样6次,测得峰面积相对标准偏差均小于3%,表明仪器精密度良好。
2.1.6 重复性实验
取黄芩饮片适量,按照2.1.1项下方法制备6份供试品溶液,按2.1.3项下色谱条件进样,测得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素含有量的相对标准偏差均小于3%,表明该方法重复性良好。
2.1.7 稳定性实验
取2.1.1项下同一供试品溶液10 μL,分别在0,4,8,12,24 h进样,测定,测得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的峰面积,计算相对标准偏差均小于5.0%,表明供试品溶液在24 h内基本稳定。
2.1.8 加样回收率实验
取黄芩配方颗粒适量,共6份,每份加入各对照品溶液100%的量,按照2.1.1项下方法制备供试品溶液,在2.1.3项色谱条件下进样测得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的加样回收率分别为93.32%、97.67%、95.16%和97.48%,相对标准偏差分别为3.08%、2.56%、4.23%和4.78%。结果见表1。

表1 加样回收率实验结果
2.2 正交试验设计
按照 L9(34) 正交设计[17],以煎煮时间(A)、煎煮次数 (B)、加水量(C) 为影响因素,设计3个不同水平进行试验考察。因素水平值见表2。
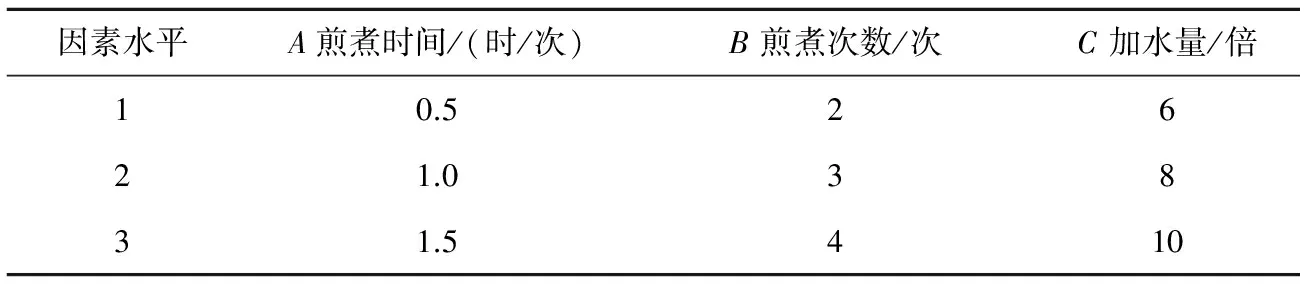
表2 因素水平表
称取黄芩饮片100 g,共9份,按表2所示进行实验,将提取液合并,然后减压浓缩至一定体积,冻干24 h后,粉碎过60目筛,乙醇制软材,过20目筛后60℃烘干,过20目筛整粒后密封包装,即黄芩配方颗粒样品。将样品按照2.1项下方法制备供试品溶液,并以HPLC法进样测定黄芩苷、汉黄芩苷、黄芩素和汉黄芩素4个有效成分含量。
另取黄芩提取液10 mL置于干燥至恒重的蒸发皿中,在恒温水浴锅上蒸干后,于105 ℃烘箱中干燥3 h,置干燥器中冷却30 min,迅速称定质量。按下式计算出膏率:

式中,m1为蒸发皿与干膏总质量;m2为蒸发皿质量;V1为提取液总体积;V2为取的提取液的体积;m为饮片质量。
以上述有效成分总量(总黄酮量)以及出膏率作为评价指标,考察不同因素水平对实验结果的影响。具体结果见表3~4。
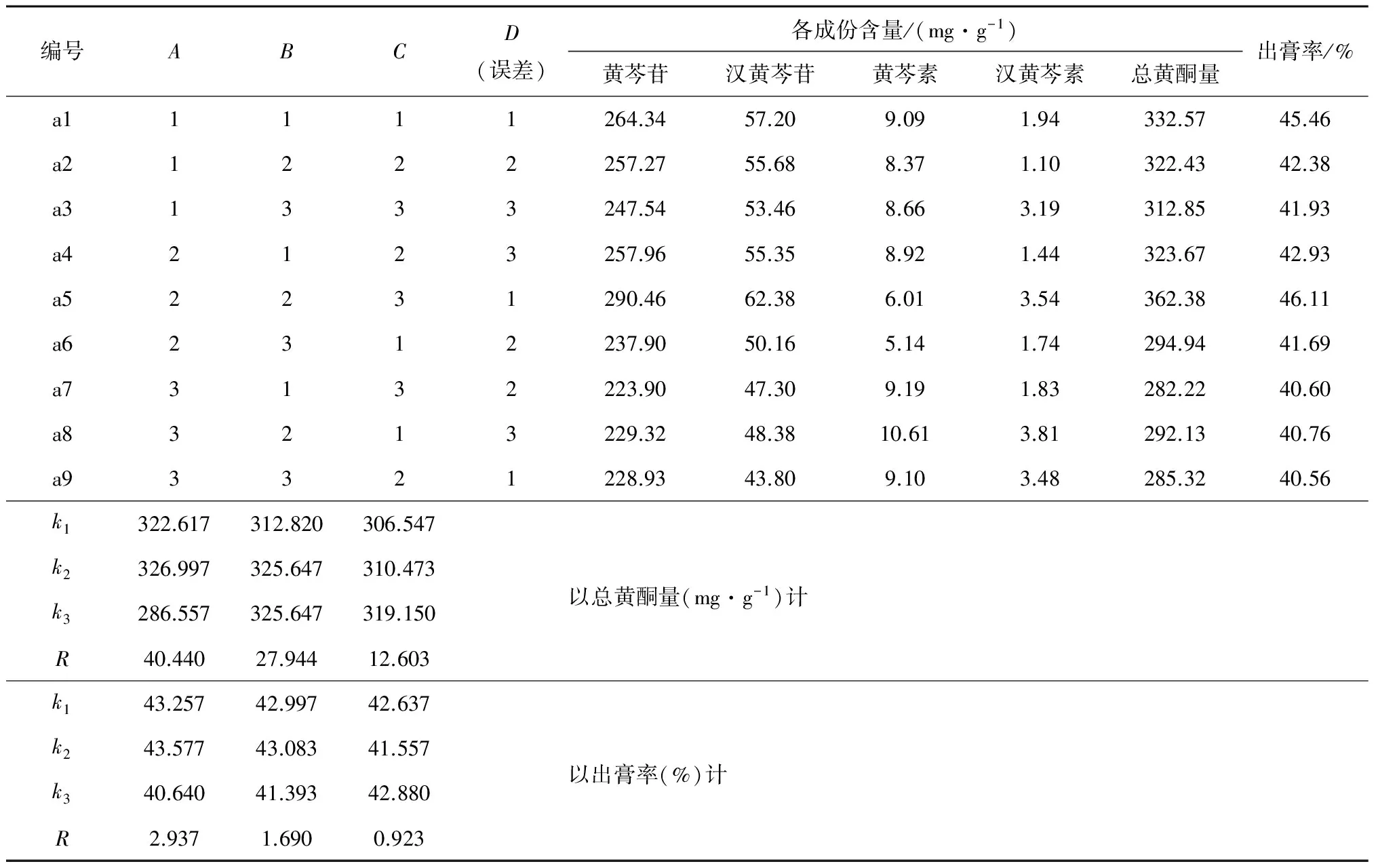
表3 正交试验结果

表4 方差分析结果Table 4 Results of variance analysis
注:F0.05(2,2)=19.00; *表示显著性差异。
2.3 正交试验结果分析
正交试验结果显示,以总黄酮量和出膏率为指标,比较各考察因素的R值可知影响提取效率和出膏率的主要因素是煎煮时间,其次是煎煮次数和加水量。方差分析显示,煎煮时间P<0.05,具有显著差异,因此不同煎煮时间对活性成分的提取率和出膏率具有显著影响。而在考察范围内,不同加水量、煎煮次数P>0.05,此两项因素影响相对较低,推测可能是由于黄酮类成分溶解度较高的原因。
综合总黄酮量和出膏率两个考察指标可知,在制备黄芩配方颗粒时,加水10倍量,煎煮1 h,煎煮3次,煎出总黄酮量和出膏率最高,是较适宜的提取条件。
2.4 验证实验
为进一步验证正交试验优选出的最佳提取工艺的准确性与重现性,故进行3批验证实验。分别称取黄芩饮片3份,每份100 g,按优化所得工艺进行验证实验,并按上述方法考察总黄酮的含量及出膏率情况,结果见表5。
结果表明,在所选取的工艺条件下,总黄酮含量和出膏率较高,且相对稳定。故确定提取工艺为加水10倍量,煎煮1 h,煎煮3次。

表5 验证实验结果
3 讨论
目前,关于黄芩或其他中药提取的文献报道多集中于使用不同提取溶剂或先进技术(例如超高压、超临界等)提高药材活性成分的提取率,但这与传统汤剂的水提方式差异较大,容易造成未知不良反应,不适用于配方颗粒的提取工艺。另外,以往单一成分指标的测定不能准确反映中药复杂体系的质量和药效,因此,本研究采用接近煎煮汤剂形式的水提工艺为研究对象,通过正交试验法研究了水提过程中的加水量、提取次数和提取时间3个因素在不同水平对黄芩配方颗粒中黄芩苷、汉黄芩苷、黄芩素和汉黄芩素总含量和出膏率的影响,并进行了含量测定的方法学验证。
对正交试验进行方差分析可知,各因素对总黄酮量和出膏率的影响程度为煎煮时间大于煎煮次数大于加水量,并且在此实验条件下,煎煮时间具有显著性差异(P<0.05),加水量和煎煮次数对其提取率影响较低,可能是由于黄酮类成分的溶解度较高,对提取水总量要求较低。通过验证实验,确定可用于黄芩配方颗粒的最佳水提工艺为加水10倍量,煎煮1 h,煎煮3次。在此条件下,黄芩苷、汉黄芩苷、黄芩素和汉黄芩素等黄酮类成分提取率和出膏率高且稳定,且提取方法稳定可靠,可为黄芩配方颗粒的制备及进一步研究提供良好的实验基础和参考依据。
[1]国家药典委员会. 中华人民共和国药典2015年一部[S]. 北京:中国医药科技出版社,2015:301.
[2]郑江萍,梁俊,黄良永,等. 黄芩药材及其配方颗粒中黄芩苷的含量比较[J]. 海峡药学,2016,28(5):49-51.
[3]徐玉田. 黄芩的化学成分及现代药理作用研究进展[J]. 光明中医,2010,25(3):544-545.
[4]王孟华,曲玮,梁敬钰. 黄芩的研究进展[J]. 海峡药学,2013,25(9):6-13.
[5] ZHANG X P, TIAN H, WU C J, et al. Effect of baicalin on inflammatory mediator levels and microcirculation disturbance in rats with severe acute pancreatitis[J]. Pancreas, 2008, 38(7) : 732-738.
[6] ZHANG J A, YIN Z, MA L W, et al.The protective effect of baicalin against UVB irradiationinduced photoaging: an in vitro and in vivo study[J]. Plos One, 2014, 9(6) : e99703.
[7]张红梅,宋景政,谭红胜,等. 从汤剂到颗粒剂:中药配方颗粒20年回顾与展望[J]. 世界科学技术-中医药现代化,2012,14(4):1740-1753.
[8]王斌. 中药配方颗粒处方的抽样调查和分析[J]. 北方药学,2016,13(8):166-167.
[9]王宏志,喻春皓,高钧,等. HPLC分析比较炮制和提取方法对黄芩活性成分的影响[J]. 中国中药杂志, 2007, 32(16):1637-1640.
[10]杨宏静. 黄芩乙醇回流提取工艺研究[J]. 实用中医药杂志, 2013, 29(6):492-493
[11] 王宏志,喻春皓,高钧,等. 酶法提取黄芩中黄芩素、汉黄芩素[J]. 新疆中医药, 2007, 30(7):851-854.
[12]国家药典委员会.中药配方颗粒质量控制与标准制定技术要求(征求意见稿)[EB/OL].[2017-03-02]. http://www.chp.org.cn/view/ff808081559d1ea301565ac24962560d?a=xwjx.
[13] 叶殷殷,曾元儿,曹骋,等.中药配方颗粒的研究进展[J].临床医学工程,2011,18(5):807-809.
[14] 陈培胜,朱月信. 中药配方颗粒行业标准研究思路[J]. 中医杂志, 2012,53(6):469-472.
[15] 林启焰,谢凡,程雪梅,等. 正交试验优化滋肾养阴颗粒剂提取工艺[J].中成药,2017,39(1):213-215.
[16] 赵恒强,王晓,周洁,等. 山东产区黄芩HPLC定量指纹图谱研究[J]. 中国现代中药,2014,16(7):528-533.
[17] 王学军,程敏,梁旭华,等.正交试验优化杜仲叶水提液絮凝除杂工艺[J]. 中成药,2017,39(4):842-844.
OptimizationofthewaterextractionconditionsofHuangqindispensinggranulesbyorthogonaltest
HAOCui1,2,MUYan2,ZHAOHeng-qiang2,CUILi2,LIUWei2,LIUFeng-qin3*
(1.ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;2.ShandongProvincialKeyLaboratoryofTCMQualityControlTechnology,ShandongAnalysisandTestCenter,Jinan250014,China; 3.ShandongQianfoshanHospital,Jinan250014,China)
∶For the optimization of the water extraction conditions of Huangqin dispensing granules, orthogonal test method was used to investigate the effects of 3 factors, including different water volumes, extraction frequency and extraction duration, on the total content of baicalin, wogonoside, baicalein and wogonin and the extract rate. Meanwhile, the methodology of the HPLC determination was verified. As a result, under the experiment conditions, the importance order was as follows: extraction duration,extraction frequency,water volume. And extraction durations at different level were significant different (P<0.05). The experiment proved that the suitable extraction condition was that Huangqin slices were added 10 times volume of water and extracted 3 times for 1 h each time. The extraction condition optimized in this paper was practical and stable with high extraction rate of active ingredients, which was suitable to be used in the preparation of Huangqin dispensing granules.
∶orthogonal test; Huangqin dispensing granules; water extraction conditions
10.3976/j.issn.1002-4026.2017.06.004
2017-05-27
山东省中医药科技发展计划(2013-201);山东省科技发展计划(2013GSF1120);山东省自然科学基金(ZR2013HM075,ZR2016YL006)
郝翠(1993—),女,硕士研究生,研究方向为中药新药与中药炮制原理。E-mail: hc56558 @163.com
*通信作者,刘逢芹,女,主任药师,研究方向为中药新剂型与临床药学。E-mail: 13791120885@163.com
R284.2
A
1002-4026(2017)06-0022-07
