HPLC法测定盐酸林可霉素注射液中林可霉素的含量
2018-01-03包爱情陆春波林仙军陈晓林蔡文金
包爱情,陆春波,林仙军,陈晓林,蔡文金
(浙江省兽药饲料监察所,杭州 311101)
HPLC法测定盐酸林可霉素注射液中林可霉素的含量
包爱情,陆春波,林仙军,陈晓林,蔡文金
(浙江省兽药饲料监察所,杭州 311101)
建立并验证了高效液相色谱法测定盐酸林可霉素注射液中林可霉素含量的方法。试验采用十八烷基硅烷键合硅胶色谱柱(4.6 mm×250 mm,5 μm),以0.02 mol/L磷酸氢二铵-乙腈(75∶25,V/V)为流动相,流速为1.0 mL/min,柱温30 ℃,波长为214 nm。试验结果表明林可霉素在0.1~4.0 mg/mL范围内线性良好,R2=1.0000,平均回收率为98.7%(n=9),RSD为0.8%。与《中国兽药典》2015年版一部收载的方法相比,本研究开发的方法优化了流动相,流动相含盐量大大降低,林可霉素峰形更尖锐,理论板数更高。本方法简便、准确、可靠,可用于盐酸林可霉素注射液的质量控制。
盐酸林可霉素注射液;含量测定;高效液相色谱法
林可霉素属于林可胺类抗生素,主要作用于细菌核糖体的50s亚基,抑制肽链延长,干扰细菌蛋白质合成,属生长期抑菌剂。盐酸林可霉素注射液属于人畜共用药,对人与动物的革兰氏阳性菌和支原体感染都有较好的作用[1]。兽用盐酸林可霉素注射液,收录于《中国兽药典》2015版一部[2],其中采用高效液相色谱法对含量和有关物质进行测定。但该方法使用的流动相为0.05 mol/L硼砂溶液(用85%磷酸溶液调节pH值至5.0)-甲醇-乙腈(67∶33∶2,V/V),该流动相中使用了高浓度的硼砂溶液,在流动相配制时硼砂溶解需要较长的时间,且高浓度的盐溶液对色谱柱和液相系统都有较大的损害,长期处于高浓度的盐溶液中,将大大缩短色谱柱和仪器寿命[3]。同时该流动相下林可霉素峰形有前沿现象,峰宽过大容易干扰有关物质的测定。已经发表的文献中已经有较多涉及到对林可霉素的定量,化学发光法[4-5]、酶联免疫法[6-8]、毛细管色谱法[9]、气相法[10]、气质法[11]、液质法[12-13]和液相法[14-15]等方法,但其中液相法多采用不同浓度的硼酸溶液作为流动相。开发一种新的液相方法来改善以上问题,既可以提高检测效率,又可以延长仪器和耗材寿命。本文改进了流动相,开发了高效液相色潽法测定盐酸林可霉素注射液含量的方法,并对方法进行了验证。
1 材 料
1.1 仪器 Aglient 1260 高效液相色谱仪,配安捷伦二极管阵列检测器,美国Aglient公司; XS-205电子天平,瑞士Mettler Toledo公司;KQ-500E型超声波清洗器,昆山市超声仪器有限公司。
1.2 试剂与材料 甲醇、乙腈为色谱纯,Merck KGaA 公司,其余试剂均为分析纯;实验用水为milli-Q超纯水。林可霉素对照品(来源:中国食品药品检定研究院,批号:130432-201510,含量:85.5%);盐酸林可霉素注射液供试品(批号分别为20161201、20161202、20161203,规格10 mL∶1 g),由浙江某厂生产。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent C18 XDB(4.6 mm×250 mm, 5 μm);流动相:0.02 mol/L磷酸氢二铵-乙腈(75∶25,V/V);流速1.0 mL/min;温度30 ℃;检测波长214 nm;进样量10 μL。在此色谱条件下,对照品溶液和供试品溶液的色谱图见图1。在《中国兽药典》2015年版一部中的条件下对照品色谱图见图2。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取林可霉素对照品100 mg,置25 mL棕色容量瓶中,加流动相约20 mL,超声5 min,冷却至室温,用流动相稀释至刻度,作为对照品储备液(约4 mg/mL)。精密量取适量,用流动相稀释成2 mg/mL的对照品溶液,即得。
2.2.2 供试品溶液 精密量取盐酸林可霉素注射液适量,用流动相定量稀释制成每l mL中含林可霉素2 mg的溶液,摇匀。
2.3 方法学考察
2.3.1 线性范围 精密量取对照品贮备液(约4 mg/mL)适量,用流动相稀释成0.1,0.2,0.5,1,2 mg/mL的系列对照品溶液,按上述色谱条件,精密量取10 μL,注入色谱仪,记录色谱图,测定峰面积,以峰面积积分值(Y)对浓度(X,mg/mL)进行线性回归计算,方程为:Y=2209.4X-18.7(R2=1.0000),线性范围0.1~4.0 mg/mL。结果表明在线性范围内,林可霉素浓度与峰面积呈现良好的线性关系。
2.3.2 精密度试验 精密吸取对照品溶液10 μL,按上述色谱条件,连续重复进样6次,记录峰面积,计算结果,林可霉素峰面积的RSD为0.4%,表明仪器精密度良好。
2.3.3 稳定性试验 取同一供试品溶液(批号20161202),分别在0、1、2、4、6、8、12、24 h进样10 μL,记录色谱峰面积,林可霉素峰面积的RSD为0.7%。结果表明供试品溶液在室温下放置24 h稳定。
2.3.4 重复性试验 取同一批供试品(批号20161202),照2.2.2项下方法制备供试品溶液,测定供试品溶液中林可霉素的含量。结果测得林可霉素的峰面积分别为4592.1、4598.1、4569.3、4589.1、4536.1和4578.1,RSD为0.5%,表明方法重复性良好。
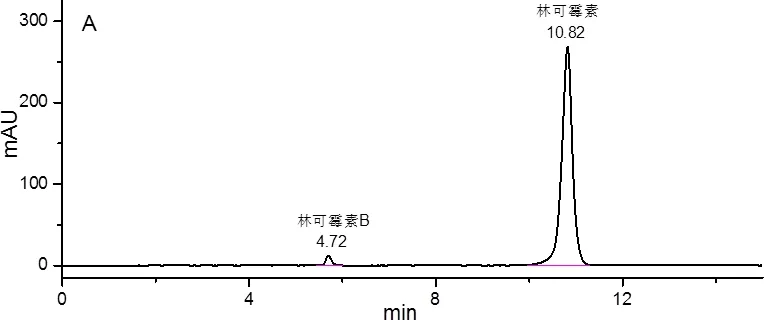
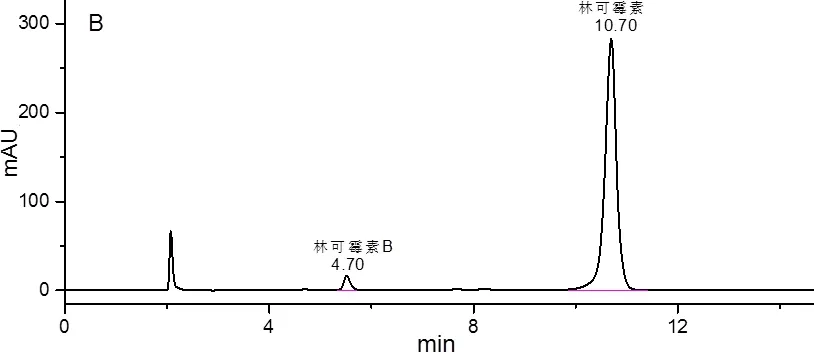
图1 优化条件下(A)对照品色谱图和(B)供试品色谱图(批号为20161202)Fig 1 Chromatograms of (A) the reference substance and (B) the sample(lot munber:20161202) under optimized conditions
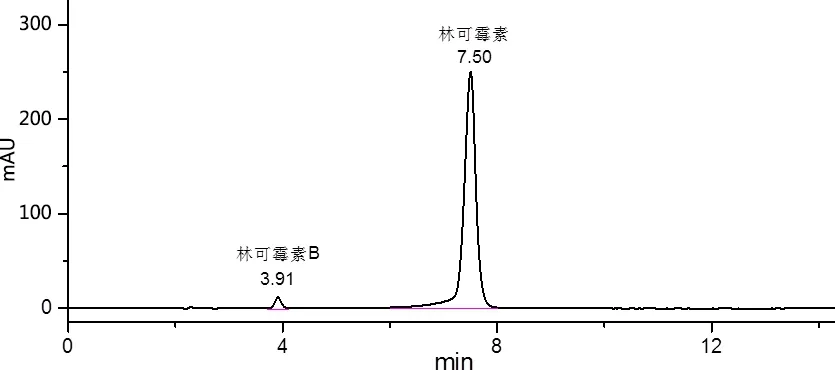
图2 《中国兽药典》2015版条件下对照品色谱图Fig 2 Chromatogram of the reference substance under conditions of Chinese veterinary pharmacopoeia 2015
2.3.5 加样回收率试验 准确量取已知含量的盐酸林可霉素注射液(批号20161202,规格为10 mL∶1 g,含量为103.6 mg/mL)250 μL,共9份,置25 mL量瓶中,按高(120%)、中(100%)、低(80%)三个浓度水平分别添加林可霉素对照品,制得向已知含量制剂中添加已知测定物的添加样品,每个浓度水平的添加样品分别制备3份供试样。用流动相溶解并稀释至刻度,测定并计算回收率,结果见表1。

表1 回收率试验结果表(n=9)Tab 1 Results of recovery test (n=9)
2.3.6 耐用性 在优化的色谱条件下,比较了Waters Symmetry C18(4.6 mm×250 mm)和Aglient Eclipse XDB C18 (4.6 mm×250 mm)色谱柱,结果表明,两者均能使林可霉素峰形尖锐;对温度进行了考察,在本文优化的流动相下选择温度为25 ℃和35 ℃时,除出峰时间发生变化外,其余变化很小;将流动相水相和有机相比例调整为78∶22和72∶28进行测试,结果表明,流动相比例的微调也仅能影响出峰时间,对峰形和理论塔板数影响甚小。不同品牌的色谱柱、不同流动相有机相与水相比例以及不同温度,均能满足试验需要,方法耐用性较强。
2.4 实际样品测定 取不同批号的盐酸林可霉素注射液,按2.2.2项下方法处理,按上述色谱条件进行测定,每个样品制备2份,计算样品中林可霉素的含量,取平均值。同时与《中国兽药典》2015年版一部比较结果(表2)。
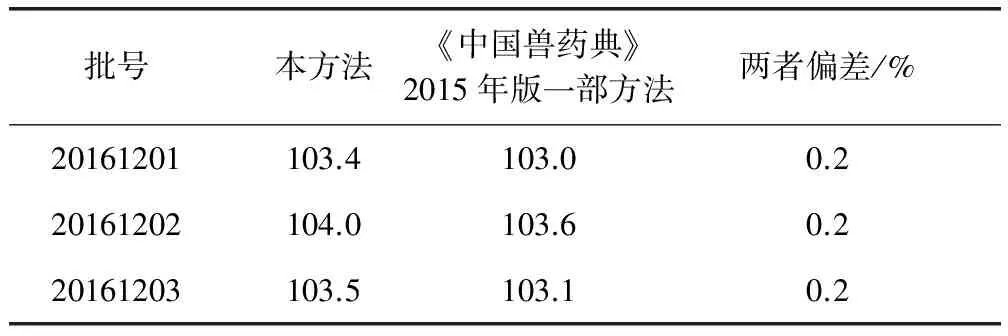
表2 样品含量测定结果(标示量/%,n=2)Tab 2 Results of content determination of samples (labelled amount/%, n=2)
3 讨论与小结
在波长选择上,由于林可霉素在200 nm左右有最大吸收波长,但该处容易受溶剂干扰,因此本文沿用《中国兽药典》中的214 nm作为检测波长。
在流动相优化上,本文尝试了《中国兽药典》2015年版一部中的流动相,水-乙腈(75∶25,V/V),水-甲醇(65∶35,V/V),0.02 mol/L磷酸氢二钾(用85%磷酸调节pH至6.1)-乙腈(75∶25,V/V),以及0.01 mol/L磷酸氢二铵-乙腈(75∶25,V/V),上述流动相体系除最后一种外,其余均导致林可霉素峰形差;而最后一种则在峰形略差于本文选择的流动相,经过优化,选择了本文开发的流动相。由于《中国兽药典》中的流动相使得林可霉素峰有前沿现象,经优化后有很大改善,理论板数也由6245增加到10239,分离性能更好。
使用本文开发的方法与《中国兽药典》2015年版一部方法进行比较,结果表明两者在测定盐酸林可霉素注射液含量时,结果基本一致。方法使用了常用的溶解性好的磷酸氢二铵作为水相的溶质,且配制流动相时不需要调pH,在配制流动相时缩短了时间,提高了检测效率,且低浓度盐溶液有利于仪器的长期使用。
本文开发的方法简便、准确、重现性好,能够有效的控制该产品的质量,为产品标准改进提供了研究基础。
[1] 廖益萍,宋于康. 林可霉素联合肝素钠封管在预防ICU中心静脉导管感染中的作用[J]. 中国药房, 2013, 24 (10): 927-929.
Liao Y P, SONG Y K. Effects of Lincomycin Combined with Heparin Sodium against Infection of Central Venous Catheter in ICU[J]. China Pharmacy, 2013, 24 (10): 927-929.
[2] 中国兽药典委员会. 中华人民共和国兽药典二〇一五年版一部[S].
Commission of Chineses Veterinary Pharmacopoeia. Veterinary Pharmacopoeia of People's Republic of China, 2015, Part1[S].
[3] 王 新. 高效液相色谱柱的保护[J]. 安庆师范学院学报(自然科学版), 2001, 7(4): 71-72.
Wang X. Protection of high-performance liquid chromatographic column[J]. Journal of Anqing Teachers College, 2001, 7(4): 71-72.
[4] Li S, Liu C, Yin G,etal. Aptamer-molecularly imprinted sensor base on electrogenerated chemiluminescence energy transfer for detection of lincomycin[J]. Biosensors and Bioelectronics, 2017, 91: 687-691.
[5] Yang C, Zhang Z, Shi Z. A novel chemiluminescence reaction system for the determination of lincomycin with diperiodatonickelate(IV)[J]. Microchimica Acta, 2010, 168(3): 293-298.
[6] He J, Wu N, Luo P,etal. Development of a heterologous enzyme-linked immunosorbent assay for the detection of clindamycin and lincomycin residues in edible animal tissues[J]. Meat Science, 2017, 125: 137-142.
[7] Cao S, Song S, Liu L,etal. Comparison of an Enzyme-Linked Immunosorbent Assay with an Immunochromatographic Assay for Detection of Lincomycin in Milk and Honey[J]. Immunological Investigations, 2015, 44(5): 438-450.
[8] Burkin M A, Galvidis I A. Development of a competitive indirect ELISA for the determination of lincomycin in milk, eggs, and honey [J]. J Agric Food Chem, 2010, 58(18): 9893-9898.
[9] Kowalski P, Konieczna L, Olędzka I,etal. Development and Validation of Electromigration Technique for the Determination of Lincomycin and Clindamycin Residues in Poultry Tissues [J]. Food Analytical Methods, 2013, 7(2): 276-282.
[10] 陶燕飞,于 刚,陈冬梅,等. 动物可食性组织中林可霉素和大观霉素残留检测方法——气相色谱法[J]. 中国农业科技导报, 2008, 10(S2): 63-68.
Tao Y F, Yu G, Chen D M,etal. Determination of Lincomycin and Spectinomycin in Edible tissue of animal by Gas chromatography[J]. Journal of Agricultural Science and Technology, 2008, 10(S2): 63-68.
[11] Tao Y, Chen D, Yu G,etal. Simultaneous determination of lincomycin and spectinomycin residues in animal tissues by gas chromatography-nitrogen phosphorus detection and gas chromatography-mass spectrometry with accelerated solvent extraction[J]. Food Additives & Contaminants: Part A. 2011, 28(2): 145-154.
[12] Vucicevic-Prcetic K, Cservenk R, Radulovic N. Development and validation of liquid chromatography tandem mass spectrometry methods for the determination of gentamicin, lincomycin, and spectinomycin in the presence of their impurities in pharmaceutical formulations[J]. Journal of pharmaceutical and biomedical analysis, 2011, 56(4): 736-742.
[13] Solliec M, Massé D, Sauvé S. Analysis of trimethoprim, lincomycin, sulfadoxin and tylosin in swine manure using laser diode thermal desorption-atmospheric pressure chemical ionization-tandem mass spectrometry[J]. Talanta, 2014, 128: 23-30.
[14] 李维超,佟若菲,张 囡,等. HPLC法测定复方盐酸林可霉素滴鼻剂中盐酸林可霉素和利巴韦林[J]. 现代药物与临床, 2015, 30(1): 33-35.
Li W C, Tong R F, Zhang N,etal. Determination of lincomycin hydrochloride and ribavirin in Compound Lincomycin Hydrochloride Nasal Drops by HPLC[J]. Drugs & Clinic, 2015, 30(1): 33-35.
[15] 施启红. 用RP-HPLC法测定盐酸林可霉素眼用温敏凝胶中盐酸林可霉素的含量[J]. 药学服务与研究, 2012, 12(2):132-134.
Shi Q H. Determination of the lincomycin hydrochloride content in lincomycin hydrochloride thermosensitive eye gel by RP-HPLC method[J]. Pharmaceutical Care and Research, 2012, 12(2):132-134.
ContentDeterminationofLincomycininLincomycinHydrochlordeInjectionbyHPLC
BAQ Ai-qing, LU Chun-bo, LIN Xian-jun, CHEN Xiao-lin, CAI Wen-Jin
(ZhejiangProvinceInstituteofVeterinaryDrugandFeedstuff,Hangzhou311101,China)
The method for content determination of lincomycin in lincomycin hydrochlorde injection by HPLC was developed and validated. Analysis was performed on a C18 column (4.6 mm×250 mm, 5 μm) with a mobile phase of 0.02 mol/L diammonium phosphate aqueous solution-acetonitrile (75∶25,V/V) at a flow rate of 1.0 mL/min and a column temperature of 30 ℃. The determination wave length was 214 nm. The results showed that a good linear relationship was accepted in the range of 0.1~4.0 mg/mL (R2=1.0000), and the average recovery was 98.7% (n=9)withRSDof 0.8%. In contrast with method in Chinese veterinary pharmacopoeia 2015, the mobile phase was optimized by reducing salinity while the peak shape and number of theoretical plates of lincomycin were improved. This method was convenient, accurate, reliable and was suitable to control the quality of lincomycin hydrochlorde injection.
lincomycin hydrochlorde injection; content determination; high performance liquid chromatography (HPLC)
10.11751/ISSN.1002-1280.2017.12.09
2017-03-21
A
1002-1280 (2017) 12-0047-05
S859.83
包爱情,从事兽药检测工作。E-mail:baoaiqing@126.com
(编辑:侯向辉)
