Cu2+、Zn2+对三疣梭子蟹幼蟹的急性毒性
2018-01-03苏志星许文军郑宽宽罗佶龙王绪杰
苏志星,何 杰,许文军,郑宽宽,罗佶龙,王绪杰
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
Cu2+、Zn2+对三疣梭子蟹幼蟹的急性毒性
苏志星1,何 杰2,许文军1,郑宽宽1,罗佶龙2,王绪杰2
(1.浙江海洋大学水产学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
以三疣梭子蟹幼蟹(体质量为:15.3±1.2 g)为实验动物,采用静水体外暴露法,开展了两种常见重金属离子(Cu2+、Zn2+)的急性毒性和加和等毒性强度联合毒性实验。结果表明:(1)Cu2+、Zn2+对三疣梭子蟹幼蟹的96 h半致死质量浓度分别为3.934 mg/L和3.901 mg/L;三疣梭子蟹幼蟹对Cu2+、Zn2+的96 h安全质量浓度分别为0.039 34 mg/L和0.039 01 mg/L,表明两种重金属对梭子蟹幼蟹的毒性相近;(2)Cu2+、Zn2+离子在加和等毒性强度下对三疣梭子蟹幼蟹96 h联合毒性与其浓度配比相关,低毒性强度的Cu2+对Zn2+具有拮抗作用,低毒性强度的Zn2+对Cu2+具有协同作用,当Cu2+、Zn2+毒性强度相当时表现为相互独立作用。
Cu2+;Zn2+;急性毒性;联合毒性;三疣梭子蟹;幼蟹
三疣梭子蟹(Portunus trituberculatus,以下简称梭子蟹)隶属于节肢动物门、甲壳纲、十足目、梭子蟹科、梭子蟹属,由于其肉质鲜美、营养丰富、经济价值高,已成为我国最受欢迎的养殖品种之一。随着养殖技术的改进和提升,梭子蟹养殖面积不断增加,2016年全国养殖产量达到12.5万t[1]。但是,在梭子蟹池塘养殖产业蓬勃发展的同时,养殖环境的日渐恶化已成为遏制梭子蟹产业发展的重要因素之一。
近年来工业“三废”和农业污染物向海洋中肆意排放,使自然海区环境日渐恶化,对海洋生物的生存产生严重威胁[2]。废水中所含重金属已成为周边养殖海域水环境恶化的最主要污染源之一,其中Cu2+、Zn2+为常见两类;另外,由于Cu2+可用于防治原生动物引起的多种鱼病,Zn2+可以灭杀或除去虾蟹等水产养殖生物的固着类纤毛虫,致使Cu2+、Zn2+已作为常见药物的主要成分而广泛应用于水产养殖实践生产中,因此,有关Cu2+、Zn2+对水产动物的存活、生长及养成质量的影响成为了养殖从业者极为关注的问题。
迄今为止,有关 Cu2+、Zn2+对虾蟹类甲壳动物的毒性作用国内已有较多研究[3-6],但 Cu2+、Zn2+对三疣梭子蟹急性毒性研究主要集中于大眼幼体、溞状幼体和稚蟹期,尚未见其对梭子蟹幼蟹期的生态毒理报道。笔者于2017年7月在浙江海洋水产研究所西轩岛实验基地以三疣梭子蟹幼蟹作为实验动物,开展Cu2+、Zn2+两种常见重金属离子对梭子蟹幼蟹的急性毒性效应研究,以期为养殖环境评估和水产养殖安全用药提供科学依据。
1 材料和方法
1.1 材料
1.1.1 实验动物
实验于2017年7月在浙江海洋水产研究所西轩渔业科技岛进行。在养殖池塘去雄期间用诱钓的方法捕捉梭子蟹幼蟹500余只,暂养于室内水泥池内,水深0.5 m,暂养期间连续增氧,每天下午17:00投喂新鲜野杂鱼。3 d后,选择表体无损伤,十足健全、规格相近(平均体质量为15.3±1.2 g)的健康个体参试。
1.1.2 实验药物
实验药物CuSO4·5H2O、ZnSO4·7H2O购自于国药集团化学试剂有限公司,均为分析纯。实验前用蒸馏水配置成一定质量浓度的母液备用,实验时用海水稀释到所需浓度。
1.1.3 实验理化条件
实验所用海水经24 h暗沉淀处理,二次脱脂棉过滤,水温26.2~29.5℃,盐度26~27,pH 7.8~8.2,水质符合我国《渔业水质标准》(GB11607-89)[7]。
1.1.4 实验容器
实验所用容器为聚乙烯水族箱,规格(39×21×20.5 cm),实验前用对应的浓度药物浸泡12 h以上。
1.2 实验方法
1.2.1 Cu2+、Zn2+单一金属离子对梭子蟹幼蟹的急性毒性
经预实验确定梭子蟹幼蟹实验药物浓度范围(96 h后的全致死浓度下限和全活浓度上限)后,设置5个 Cu2+和 Zn2+质量浓度梯度组,分别为 1.25 mg/L、2.50 mg/L、5.00 mg/L、10.00 mg/L、20.00 mg/L 和 2.07 mg/L、3.11 mg/L、4.67 mg/L、7.00 mg/L、11.20 mg/L,组内设3个重复,另设对照组。向实验容器内分别加入不同质量浓度Cu2+、Zn2+溶液,溶液所用体积为10 L。采用不投饵、静水连续充气的方法,保持水质和Cu2+、Zn2+的稳定,开展单一药物对幼蟹的急性毒性实验。每一质量浓度梯度各放梭子蟹幼蟹10只,每隔2 h检查一次实验蟹的情况,及时捞出死亡个体以免影响水质,每隔24 h将所有溶液更换一次并记录当日死亡率。
1.2.2 Cu2+、Zn2+对梭子蟹幼蟹的联合毒性
以单一重金属离子96 h的半致死质量浓度LC50作为致死阈浓度,计为一个毒性强度单位,通过加和等毒性强度方式设置两种重金属联合毒性浓度梯度,Cu2+、Zn2+两种重金属的加和方式为 A(0+1.0)、B(0.2+0.8)、C(0.4+0.6)、D(0.6+0.4)、E(0.8+0.2)和 F(1.0+0)6 个组合,其中 A 和 F 组为对照组,药液所用体积为10 L,每组内设3个重复,采用不投饵、静水连续充气的方法,连续观察受试个体的活动情况,及时取出死亡个体,同上述方法一样,每24 h换液一次并计算死亡率。
1.3 数据处理
根据实验药物对梭子蟹的急性毒性结果,建立死亡率-质量浓度对数直线回归方程,借助SPSS19.0得到各相应时段的回归方程和半致死浓度值LC50以及死亡率和质量浓度之间的相关性(P<0.05为显著水平),利用96 h的半致死浓度通过以下公式计算安全浓度(SC):SC=0.01×96 h LC50。
2 实验结果
2.1 Cu2+-Zn2+对梭子蟹幼蟹的单一毒性效应
实验开始后,梭子蟹幼蟹在两种重金属毒性胁迫下表现出相似的行为特征,但在同种重金属不同实验药物质量浓度下的中毒现象存在明显差异,具体表现为低质量浓度组药物对实验蟹的毒性作用不明显,与对照组基本相同,受试个体在入液后没有表现明显的不适反应,静置于容器底部,而高质量浓度组药物对实验蟹的毒性作用明显,实验蟹入液后反应剧烈,焦躁不安,上下游动,活动频率增加,个体不适性明显增强,经过一段时间的适应才趋于安静。随着时间的延长,各药物浓度组受试个体在容器内的活动能力也明显减弱,死亡个体数量明显增加。由表1可知,死亡率与药物质量浓度和受试时间之间成正相关,即随着药物浓度的升高,死亡率显著升高,但从梭子蟹幼蟹急性致毒死亡情形随时间变化来看,在实验质量浓度设置范围内,各药物致梭子蟹幼蟹急性死亡的跃变特征表现为:Cu2+对梭子蟹幼蟹的死亡跃变临界质量浓度在5~10 mg/L之间,Zn2+的死亡跃变临界质量浓度为7~11.2 mg/L之间。
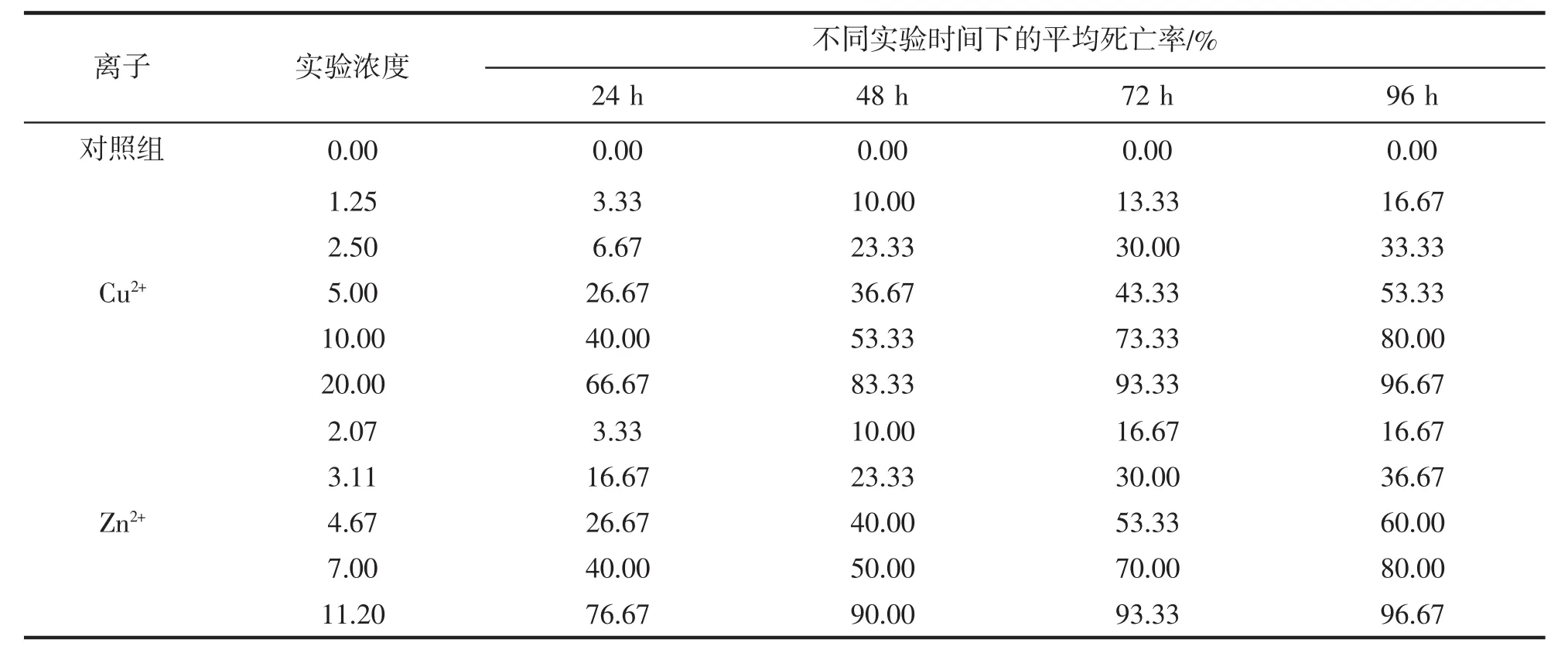
表1 Cu2+、Zn2+对梭子蟹幼蟹的急性毒性效应Tab.1 The acute toxicity of Cu2+,Zn2+to juveniles of P.trituberculatus
根据表1中的实验结果计算获得Cu2+、Zn2+对梭子蟹急性毒性的死亡率-质量浓度对数回归方程(表2)。结果表明,在相同的实验条件下,不同实验药物质量浓度组的致死效应存在明显差异(F值均大于相应的 F0.05),建立的回归方程也显示出较好的正相关性(R2均大于 0.9)。Cu2+、Zn2+对梭子蟹 24 h、48 h、72 h、96 h的半致死质量浓度 LC50值分别为 12.299 mg/L、7.192 mg/L、4.826 mg/L、3.934 mg/L和 7.280 mg/L、5.607 mg/L、4.397 mg/L、3.901 mg/L,LC50值随着实验时间的延长而减小。另外,各实验时间段内的Cu2+的LC50值均略大于Zn2+,这表明Zn2+对梭子蟹的毒性比Cu2+稍强。由96 h半致死质量浓度LC50值计算可得Cu2+、Zn2+离子的安全质量浓度分别为0.039 34 mg/L和0.039 01 mg/L。
2.2 Cu2+-Zn2+对梭子蟹幼蟹的联合毒性效应
Cu2+-Zn2+对梭子蟹幼蟹的联合毒性作用见表3。可知,Cu2+-Zn2+在加和等毒性强度下对梭子蟹幼蟹96 h联合毒性所表现的毒性特征,与两种离子之间的匹配比例紧密相关。由表3可知,在同一毒性强度配比内,随着时间的增加,死亡率逐渐上升;而不同毒性强度配比间在相同受试时间内的死亡率也存在明显差异,具体表现为:Cu2+-Zn2+两种离子之间存在协同、拮抗或相互独立作用,即较低毒性强度的Cu2+对Zn2+具有拮抗作用,低毒性强度的Zn2+对Cu2+具有协同作用,当Cu2+、Zn2+毒性强度相当时表现为相互独立作用。
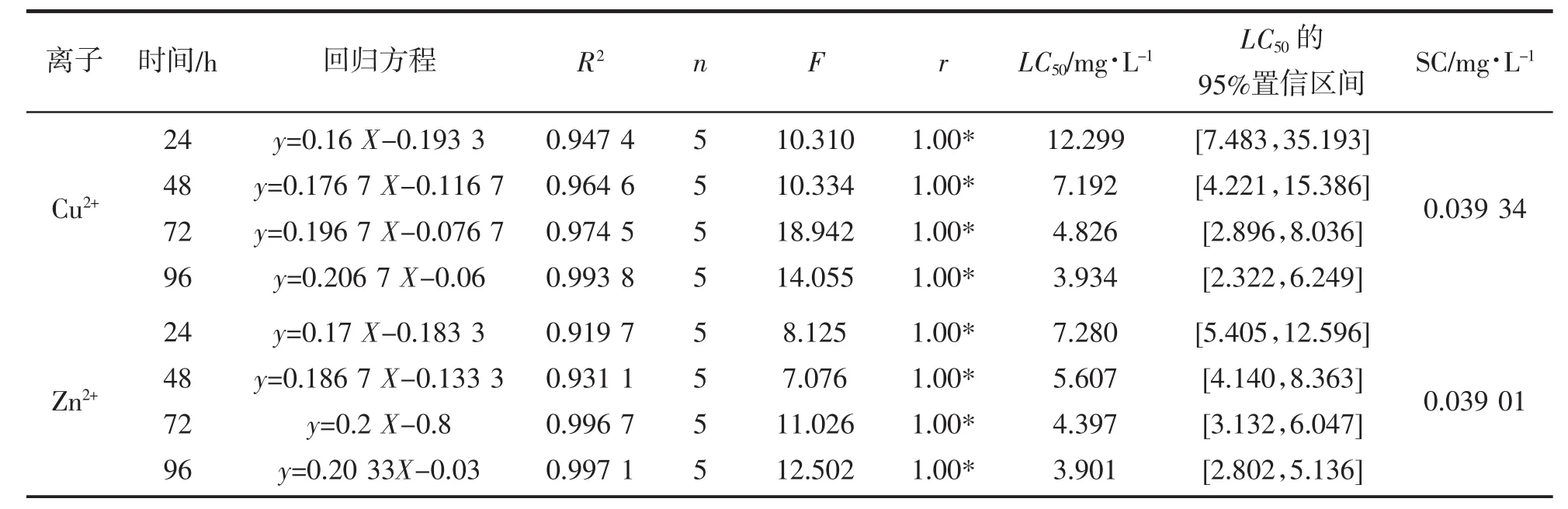
表2 Cu2+、Zn2+对梭子蟹幼蟹单一毒性效应特征分析Tab.2 Analysis on acute toxicity of Cu2+,Zn2+to juveniles of P.trituberculatus
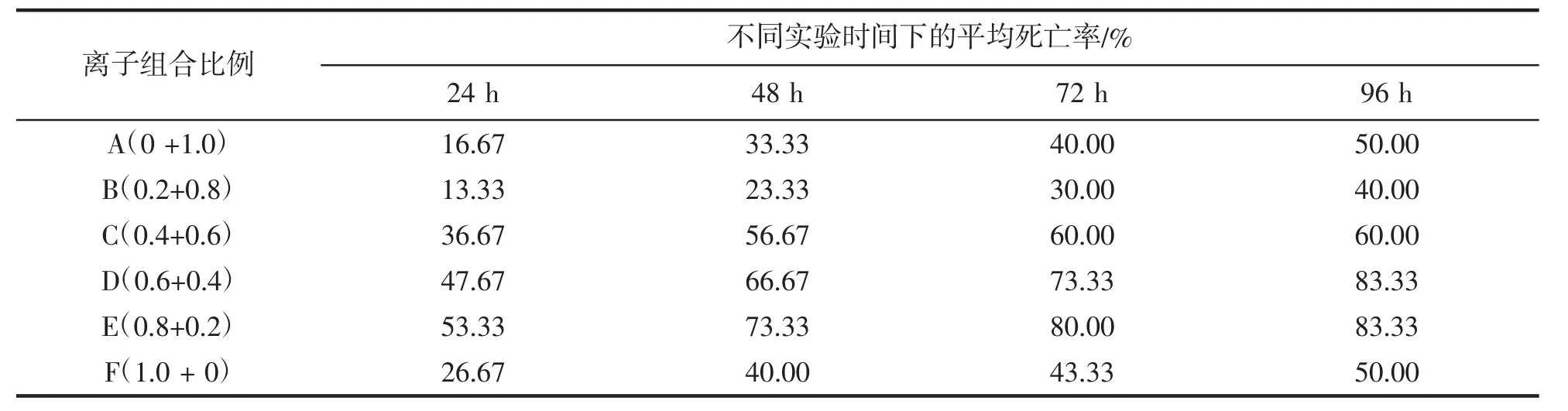
表3 Cu2+-Zn2+联合毒性对梭子蟹幼蟹的毒性效应Tab.3 The joint toxicity of Cu2+and Zn2+to juveniles of P.trituberculatus
3 讨论
3.1 Cu2+、Zn2+对梭子蟹幼蟹的毒性效应
Cu2+、Zn2+是甲壳动物生存所必需的微量元素,低浓度的Cu2+、Zn2+有益于生长发育,但高浓度的Cu2+、Zn2+会对甲壳动物机体产生毒害作用。梭子蟹幼蟹在高质量浓度的Cu2+、Zn2+溶液中表现出明显的中毒症状,主要表现为焦躁不安,上下游动,试图逃逸进行避毒,而在挣扎无果后,其选择静卧不动,以减少代谢水平和能量消耗,这与大多数水生动物应对毒物胁迫的行为对策相似。另外,同其它水生动物一样,虾蟹类甲壳动物机体中也含有重要的生物解毒组分-热稳定蛋白(HSP),对重金属的毒性作用都有一定的抵御能力。金属硫蛋白(MT)是HSP的主要成分[9],含有大量的半胱氨酸残基,其对金属离子具有高度亲和力[10]。当生物机体中含有过量重金属时,可以诱导MT与其结合,产生络合物,有效缓解重金属对机体的毒害作用。但是,虾蟹类机体内的MT的含量有限,诱导其表达也是有一定限度的,随着金属离子的浓度不断升高以及机体在溶液中暴露时间不断延长,MT络合物的形成将成下降趋势,导致的结果是重金属离子不断在生物机体中富集,其生理生化功能将受到严重损害,具体表现为中毒现象加深以致死亡率上升。本研究发现:低浓度Cu2+、Zn2+实验组在机体暴露24 h内的死亡率极低,随着重金属浓度的不断上升以及实验时间的不断延长,而且Cu2+、Zn2+两种金属离子不同质量浓度梯度组的致死效应存在显著差异(F均大于F0.01),建立的各时间段死亡率-质量浓度之间的回归方程具有高度拟合性(可决定系数R2均大于等于0.9197),且两者之间的相关性极高(r均为显著水平),这表明梭子蟹幼蟹死亡率与重金属质量浓度之间紧密相关,这与重金属对水生动物的作用特征相吻合。铜锌与其他一些重金属不同,低浓度铜锌是生物体必需的;结合幼蟹和成蟹金属硫蛋白含量情况、对铜锌的需求情况分析毒性区别分析。
3.2 关于梭子蟹幼蟹对Cu2+、Zn2+安全浓度的评价
Cu2+、Zn2+可用于杀灭原生动物、纤毛虫以及控制蓝藻的爆发等,已作为常见渔药的主要成分而广泛应用于虾蟹类养殖生产中。由表4所列不同虾蟹类对Cu2+、Zn2+的96 h质量安全浓度中可见,不同种类虾蟹对Cu2+、Zn2+的耐受性不同,其中中华绒螯蟹Eriocheir sinensis与克氏原螯虾Procambarus clarkii的耐受强度远高于锯缘青蟹Scylla serrata和罗氏沼虾Macrobrachium rosenbergii,而且同一种类不同发育阶段或规格对同种重金属离子的安全浓度也不同,本研究中梭子蟹幼蟹对Cu2+、Zn2+离子的质量安全浓度分别为0.039 34 mg/L和0.039 01 mg/L,远高于大眼幼体阶段的质量安全浓度(分别为:0.002 91 mg/L和0.010 4 mg/L),表现出生物体规格越大,对有毒物质耐受性越强的特征。另外,梭子蟹幼蟹对Cu2+的质量安全浓度高于我国渔业水质标准(GB11607-89)所规定的浓度(0.01 mg/L),这表明梭子蟹幼蟹对Cu2+耐受性较高,因此笔者建议在商品蟹的检测中应特别注意Cu2+的含量。
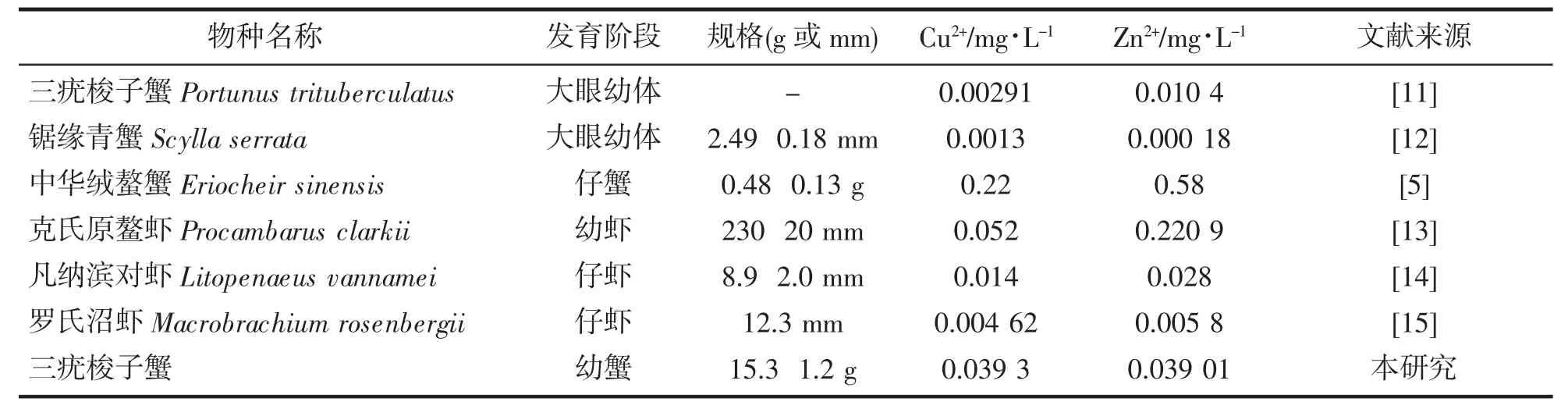
表4 我国主养虾蟹类对Cu2+、Zn2+的96 h质量安全浓度Tab.4 The safety concentrations of Cu2+and Zn2+of foremost cultivation shrimp and crabs in China
3.3 Cu2+、Zn2+对梭子蟹幼蟹的联合毒性效应机理的初步探讨
本研究在设定的质量浓度配比与时间范围内,Cu2+、Zn2+对梭子蟹幼蟹的联合作用效果会随着毒性强度的配比不同而改变,具体表现为低毒性强度的Cu2+对Zn2+具有拮抗作用,而低毒性强度的Zn2+对Cu2+具有协同作用。这可能是Cu2+、Zn2+共同作用改变了单一重金属离子对机体的毒性作用机制,使细胞膜的通透性发生改变,导致重金属离子进入细胞的难易程度发生改变[16]。同时,作为水生生物机体重要解毒组分金属硫蛋白与不同重金属离子的鳌合性存在差异,一般毒性较强的重金属会先和金属硫蛋白结合[17]。所以,当Cu2+、Zn2+同时存在时,机体中的金属硫蛋白鳌合物的合成速率受到影响;当金属硫蛋白鳌合物达到饱和,重金属离子对机体的毒害作用将显著增强,即当Cu2+毒性强度为0.2时,金属硫蛋白鳌合物未能饱和度,致使需要部分Zn2+参与形成螯合物而消除了毒性,表现为低浓度的Cu2+对Zn2+的拮抗作用;而当Cu2+与MT结合达到饱和会和Zn2+一起表现毒性,并且较之前的毒性更强,表现为低毒性强度的Zn2+对Cu2+的协同作用;而当Cu2+、Zn2+毒性强度相近时,表现为相互独立作用。但是,由于实验中的各种因素,如生物、环境以及毒性强度配比设计等都会对联合毒性的结果产生影响,所以,有关Cu2+、Zn2+对梭子蟹幼蟹的联合毒性作用机理还需进一步开展研究。
[1]农业部渔业管理局.2016年中国渔业统计年鉴[M].北京:中国农业出版社,2017.
[2]蔡立哲,洪华生,洪丽玉.菲律宾蛤仔对锌、铅的积累特征[J].环境科学学报,1999,19(hj):319-322.
[3]王志铮,王伟定,杨 阳,等.4种重金属离子对彩虹明樱蛤(Moerella iridescens)的急性致毒效应[J].海洋与湖沼,2007,38(4):373-378.
[4]韩小铮.镉、铅、铜对长江华溪蟹细胞超微结构与酯酶同工酶的影响[D].太原:山西大学,2004.
[5]杨志彪,赵云龙,周忠良,等.CuSO4对中华绒螯蟹蜕皮、生长和存活的影响[J].水生生物学报,2006,30(5):563-569.
[6]褚武英.几种重金属在淡水动物体内的富集及其毒理研究[D].上海:上海师范大学,2003.
[7]国家环保局.GB11607-1989渔业水质标准[S].北京:中国标准出版社,1989.
[8]张美琴,陈海仟,吴光红,等.水体中锌与镉在中华绒螯蟹体内吸收蓄积的相互作用[J].水产学报,2010,34(8):1 270-1 276.
[9]LIU F,WANG W X.Facilitated Bioaccumulation of Cadmium and Copper in the Oyster Crassostrea hongkongensis Solely Exposed to Zinc[J].Environmental Science&Technology,2013,47(3):1 670-1 677.
[10]李培军,熊先哲,杨桂芬,等.动物生物标志物在土壤污染生态学研究中的应用[J].应用生态学报,2003,14(12):2 347-2 350.
[11]包坚敏,王志铮,杨 阳,等.4种重金属离子对三疣梭子蟹大眼幼体的急性毒性[J].浙江海洋学院学报:自然科学版,2007,26(4):395-398.
[12]翁卫华,李少菁.重金属对锯缘青蟹幼体的急性毒性[J].渔业研究,1996(4):15-19.
[13]陈细香,康瑞莲,蔡月明,等.4种重金属对克氏原螯虾的急性毒性研究[J].安徽农业科学,2012,40(32):15 715-15 718.
[14]白东清,郭永军,董少杰,等.Cu2+·Zn2+·SDS·DBS对凡纳滨对虾仔虾的毒性试验[J].安徽农业科学,2009,37(30):15 074-15 076.
[15]江 敏,臧维玲,姚庆祯,等.四种重金属对罗氏沼虾仔虾的毒性作用[J].上海海洋大学学报,2002,11(3):203-207.
[16]孙振兴,王慧恩,王 晶,等.汞、镉、硒对刺参(Apostichopus japonicus)幼参的单一毒性与联合毒性[J].海洋与湖沼,2009,40(2):228-234.
[17]彭 雪,黄晓亮,陈思涵,等.镉、汞单独及联合胁迫对中华绒螯蟹的急性毒性[J].水产科学,2015,34(4):220-226.
Acute Toxicity of Cu2+,Zn2+to Juveniles of Portunus trituberculatus
SU Zhi-xing1,HE Jie2,XU Wen-jun1,et al
(1.School of Fisheries of Zhejiang Ocean University,Zhoushan 316022;2.Marine and Fishery Research Intitute of Zhejiang Ocean University,Marine and Fisheries Research Institute of Zhejiang Province,Zhoushan 316021,China)
Portunus trituberculatus juveniles with body weight of 15.3±1.2 g have been chosen as the subjectsof our experiment which were exposed to heavy metalions(Cu2+,Zn2+)to investigate the influences of acute toxicity and joint toxicity by using stagnophile test method.The results showed that the median lethal concentrations(LC50)of Cu2+,Zn2+for 96 h to juveniles of P.trituberculatus was 3.934 mg/L and 3.901 mg/L respectively,and the safety concentrations(SC)of Cu2+,Zn2+for 96 h was 0.039 34 mg/L and 0.039 01 mg/L,respectively.The results of the joint toxicity experiment showed that the joint toxicity at 96 h by the pairs of Cu2+-Zn2+was found complicated in relation to the concentration,low intensity Cu2+and high intensity Zn2+were antagonism,low intensity Zn2+and high intensity Cu2+were synergism and same intensity of Cu2+and Zn2+showed absolute effect.
Cu2+;Zn2+;actute toxicity;joint toxicity;Portunus trituberculatus;juveniles
S912
A
2096-4730(2017)04-0302-06
2017-03-30
浙江省科技厅计划项目(2016F50042;2015F30003);舟山市科技项目(2017C43032);浙江海洋大学博士启动基金(22135010815)
苏志星(1991-),男,安徽安庆人,硕士研究生,研究方向:蟹类健康养殖.E-mail:zxsu1991@hotmail.com
许文军(1971-),男,教授,研究方向:海水健康养殖.E-mail:wjxu1971@hotmail.com.
