勒夏特列原理与化学平衡常数
2018-01-02李卓阳
李卓阳
(山东省平度市第一中学 266700)
勒夏特列原理与化学平衡常数
李卓阳
(山东省平度市第一中学 266700)
勒夏特列原理可以定性的判断一些化学平衡移动问题,在解决这些问题时也很方便,无论教师还是学生遇到这些问题,都习惯运用勒夏特列原理,勒夏特列原理成为解决此类问题的主要工具.
勒夏特列原理;化学平衡常数;定量
新课改后,在苏教版和鲁科版的高中化学教科书中突出了化学平衡常数的地位,强化了用平衡常数来解决化学平衡移动问题的应用.那么勒夏特列原理与化学平衡常数谁更具有优势?
以前,学生对勒夏特列原理的理解可能有很多误区.往往认为勒夏特列原理是无条件的,在任何环境下都可以使用,其实并非如此,学生要关注勒夏特列原理适用的条件.从热力学的观点来探究知识,分析原理,明确知识本质.在探究中学生要明确:如果改变影响平衡的一个方面,整个平衡就会向能够减弱这种改变的方向移动,形成一种动态的平衡.如“沉淀溶解平衡、电离平衡、盐类水解平衡等”.在使用勒夏特列原理时,只能允许有一个因素发生改变,其他条件被认为是封闭不动的,否则就会出现错误.例如氨的合成过程,按照勒夏特列原理分析,很多学生会认为到实验反应过程中,如果温度和压力固定保持不变,在这个时候加入氨气,实验平衡会朝着合成氨的方向移动.但是实际上并非如此,学生通过用浓度商Q跟平衡常数K的比值来看,会发现这个结果跟勒夏特列的判断是截然不同的,这与学生的理论推断相反.因为合成氨的化学反应过程并不是一个封闭体系,勒夏特列原理在这个环境中不适用,不符合应用条件.下面通过一个例题详细说明.

如果应用勒夏特列原理,平衡一定向正向移动.但是这个判断是错误的.下面利用平衡常数和浓度商来判断正确的方向.该体系的平衡常数可表示为:

在原来平衡的混合物中,1.0L气体含分子(0.5mol+0.2mol+0.2mol)=0.9mol.当加入平衡体系中加入0.18molN2时,体系即时有分子(0.9mol+0.18mol)=1.08mol,在理想气体情况下,温度和压强不变,瞬时体系的气体总体积变为1.0L×1.08mol/0.9mol=1.2L,此时浓度商Q可表示为:
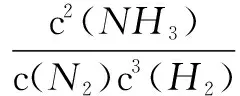
由于Q>K,平衡将向逆方向移动.为什么利用勒夏特列原理判断平衡移动方向是错误的呢?原因是只关注了N2的分子数量变化,忽略了H2和NH3的气体体积变化.所以勒夏特列原理并不是什么情况下都可以用的.
在了解了化学平衡常数之后,明确浓度商Q跟平衡常数K完全能够解决这个问题.因为,不管是什么样的实验体系,开放的或者是混合的,都是可以应用的,而不像勒夏特列原理那样有条件约束,在某些环境下不可使用.应用化学平衡常数解决平衡问题时,需要在大脑中建立一个基于状态分析的探究程序,尤其要明确浓度和压强与化学反应平衡状态的影响.在探究中,学生要明确:在一个化学反应平衡系统中,首先要弄清平衡时,Q=K.如果这时候的外界环境发生变化,包括浓度、温度、压强的改变会对K或Q产生什么样的影响?通过怎样的调整和变化才能够使Q重新等于K,重新回到平衡的状态.例如,如果增加反应物的浓度,K保持不变,这个时候浓度商Q就会变小,这是化学反应就会向着生成物浓度增大,反应物浓度减少的变化进行,直到平衡为止.化学平衡常数还有其他的应用,如:
1.化学平衡常数可用来判断反应进行的程度(即反应限度)

A.①>②B.①<②C.①=②D.不能确定
解析平衡常数越大,表示化学反应进行地越彻底;平衡常数越小,表示反应向正向进行的程度越小.如果一个化学反应的平衡常数的数值在105左右,通常认为,反应可以进行得比较完全;相反,一般,如果一个化学反应的平衡常数的数值在10-5左右,则认为这个反应很难进行.各个化学反应的平衡常数相差很大,如本题中给出的两个化学反应:反应①的程度很小,而反应②进行的程度很大.因此,B选项是正确的.
2.化学平衡常数可用来判断化学反应的热效应.


t/℃70080083010001200K0.40.60.811.442.6
该反应ΔH 0(填“<”、“>”或“=”).
解析K值的大小与浓度、压强和是否使用催化剂无关,只与温度这一外界条件有关,温度发生变化时平衡常数也会发生改变.温度越高,K值越大,则正反应为吸热反应;温度越高,K值越小,则正反应为放热反应.在题中,平衡常数随温度的增大而增大,该反应的正反应为吸热反应,因此ΔH>0.
3.判断一个化学反应是否达到平衡状态
4.计算物质的含量、转化率、平衡浓度等
前面我们讲过勒夏特列原理不是在所有条件下都成立的,不能用勒夏特列原理解释所有的化学平衡移动的问题:勒夏特列原理只完全适用与封闭、均相体系,只能在改变影响化学平衡的一个条件时适用.在这一基本前提下,可以运用勒夏特列原理定性解释化学平衡移动的问题.
例4 在配制FeCl3溶液时,为什么通常加入少许稀盐酸?
解FeCl3是一种强酸弱碱盐,溶液中存在着水解平衡:

在配制FeCl3溶液时,加入酸可使平衡向逆反应方向移动,抑制水解.
总之,勒夏特列原理的使用有局限性:这个原理更加注重的是从理论上来探究化学知识;是一种定性的认识,而不是定量的计算.而平衡常数有科学理论基础,并经过实验检验,有定量计算,所以化学平衡常数应该作为解决化学平衡移动问题的主要工具.用勒夏特列原理定性判断平衡移动方向,有时比较难,需要考虑多方面的因素和条件,才能够判断出化学平衡的移动方向.但是勒夏特列原理是通过平衡常数进行定量的计算,这个常数就像是计算的中介一 样,使化学变化的数量可以加以测量,更加准确地进行计算,达到快速解决问题的目的.可以说勒夏特列原理展示了一个客观变化的共同规律.
[1]徐守兵.勒夏特列原理和化学平衡常数学习现状的调查分析和教学反思[J]. 化学教育,2011(06):42-44.
[2]孟彦.对“化学平衡常数”教学内容的看法和建议[J]. 化学教与学,2011(11):26-38.
G632
A
1008-0333(2017)31-0093-02
2017-07-01
李卓阳(2000.3-),男,山东平度人,现读于山东省平度市第一中学,曾代表学校参加省化学竞赛,并获一等奖.
闫久毅]
