紫马铃薯花青素提取工艺研究
2018-01-02许娟妮曾钰婷白玛玉珍祁驰恒谭淑琼李淑萍
许娟妮,曾钰婷,白玛玉珍,斯 年,祁驰恒,欧 珠,谭淑琼,李淑萍
(西藏农牧科学院蔬菜研究所,西藏拉萨 850032)
紫马铃薯花青素提取工艺研究
许娟妮,曾钰婷,白玛玉珍,斯 年,祁驰恒,欧 珠,谭淑琼,李淑萍
(西藏农牧科学院蔬菜研究所,西藏拉萨 850032)
以紫马铃薯为主要原料,采用乙醇浸提法提取紫马铃薯花青素,并采用单因素方法优化其工艺参数。结果表明,紫马铃薯提取最佳工艺参数为乙醇体积分数60%,料液比1∶30(g∶mL),提取温度60℃,提取时间2 h,盐酸调节pH值为1,在此条件下紫马铃薯花青素提取量为1.27 mg/g。
紫马铃薯;花青素;提取工艺
紫色马铃薯为紫皮紫瓤、内外色泽均一的有色马铃薯,起源于安第斯山脉,并已在南美洲种植多年,但近年来紫马铃薯被引入中国,产量每年增长5%左右[1]。现已培育出很多紫色马铃薯品种,国内有黑紫马铃薯、紫罗兰、黑美人、紫龙、紫薯号等;国外有英国的紫黑色皮肉的品种Congo和Negresse,捷克的Violette、秘鲁紫等[2]。紫色马铃薯果肉为深紫色,外观好看,颜色诱惑力强。果肉淀粉含量高达13%~15%,口感较好,品质极佳[3];每100 g含蛋白质2.3 g,脂肪0.1 g,碳水化合物16.5 g,钙11 mg,铁1.2 mg,磷64 mg,钾342 mg,镁22.9 mg,胡萝卜素0.01 mg,硫胺素0.1 mg,核黄素0.03 mg,烟酸0.4 mg,抗坏血酸16 mg,花青素100 mg;且阿魏酸和咖啡酸等羟基苯乙酸使紫马铃薯花色苷酰化,使其稳定性显著提高,可用作食品的红色至紫红色着色剂而添加到冰激凌、奶制品饮料、奶酪、水产品、果汁饮料等食品中,紫马铃薯是我国近年引进的马铃薯新品种,在育种和栽培方面的技术已经成熟,近几年国内的紫色马铃薯产量飞速提高。紫马铃薯因含有丰富的花色苷成分,拥有广阔的产业发展前景。随着紫马铃薯产业的日益成熟和人们对天然色素日益增长的需求,紫马铃薯花色苷将成为一个良好的天然色素来源[4]。对紫马铃薯中的花色苷提取及稳定性进行研究,可为紫色马铃薯的开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
(1)原料。紫马铃薯,西藏自治区农牧科学院蔬菜研究所提供,新鲜紫马铃薯洗净、切片,于60℃下干燥、粉碎,过80目筛,备用。
(2)试剂。盐酸、乙醇、氢氧化钠、无水氯化钙、氯化钠、氯化钾、硫酸锌、硫酸铝、硫酸亚铁、硫酸铜,以上所有试剂均为分析纯。
1.1.2 设备与仪器
UV5200型紫外可见分光光度计,上海科登精密仪器有限公司产品;JA2003型电子天平,上天精密科学仪器有限公司产品;SC-3610型低速离心机,科大创新股份有限公司产品;KQ-250DE型超声波清洗器,昆山市超声仪器有限公司产品;101-2A型电热恒温鼓风干燥箱,天津市泰斯特仪器有限公司产品;600型电热恒温水浴锅,北京科伟永兴仪器有限公司产品;PHS-3C型pH计,上海仪电科学仪器股份有限公司产品。
1.2 试验方法
1.2.1 紫马铃薯色素提取工艺流程
新鲜紫黑马铃薯→清洗→切片→干燥→粉碎→浸提→离心→测定。
1.2.2 紫黑马铃薯花青素提取单因素试验
分别研究提取剂质量分数、pH值、提取温度、提取时间、料液比5个因素对紫马铃薯花青素提取效果的影响,每个试验平行3次。
(1)提取剂质量分数对紫马铃薯花青素提取率的影响。称取1 g烘干后的紫马铃薯粉置于100 mL三角瓶中,分别使用质量分数为0,20%,40%,60%,80%的乙醇溶液为提取剂,料液比为1∶20,pH值1,于60℃水浴中提取2 h,离心过滤,取上清液,测定吸光度,计算花青素含量,分析提取剂质量分数对紫马铃薯花青素提取效果的影响。
(2)pH值对紫马铃薯花青素提取的影响。称取1 g烘干后的紫马铃薯粉置于100 mL三角瓶中,按1∶20比例加入60%乙醇溶液,分别使用HCl调节pH值为1.0,1.5,2.0,2.5,3.0,3.5,于60℃水浴中提取2 h,离心过滤,取上清液,再次用HCl调节pH值为1,测定吸光度,计算花青素含量,分析pH值对紫马铃薯花青素提取效果的影响。
(3) 提取温度对紫马铃薯花青素提取的影响。称取1 g烘干后的紫马铃薯粉置于100 mL三角瓶中,按1∶20比例加入60%乙醇溶液,使用HCl调节pH值为1,分别于30,40,50,60,70,80℃水浴提取2 h,离心过滤,取上清液,测定吸光度,计算花青素含量,分析提取温度对紫马铃薯花青素提取效果的影响。
(4) 提取时间对紫马铃薯花青素提取的影响。称取1 g烘干后的紫马铃薯粉置于100 mL三角瓶中,按1∶20比例加入60%乙醇溶液,使用HCl调节pH值为1,于60℃下分别提取 0.5,1.0,1.5,2.0,2.5,3.0 h,离心过滤,取其上清液,测定吸光度,计算花青素含量,分析提取时间对紫马铃薯花青素提取效果的影响。
(5)料液比对紫马铃薯花青素提取的影响。称取1 g烘干后的紫马铃薯粉置于100 mL三角瓶中,按 1∶10,1∶15,1∶20,1∶25,1∶30,1∶35的比例分别加入60%乙醇溶液,使用HCl调节pH值为1,于60℃水浴中提取2 h,离心过滤,取上清液,测定吸光度,计算花青素含量,分析料液比对紫马铃薯花青素提取效果的影响。
1.2.3 紫马铃薯花青素含量的测定
花青素含量测定采用pH值示差法,取1 mL花青素溶液,分别用pH值1.0和pH值4.5的缓冲溶液定容至10 mL,待定溶液平衡90 min后,以蒸馏水作参照,2种溶液分别在530 nm和700 nm处测吸光度,按公式(1)进行计算含量。
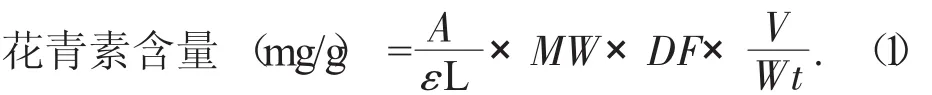
式中:A=(A530 nm pH值1.0-A700 nm pH值1.0)
-(A530 nm pH值4.5-A700 nm pH值4.5)
ε——矢车菊苏-3-葡萄糖苷的消光系数,26900
DF——稀释因子
MW——矢车菊素-3-葡萄糖苷的相对分子量449.2
V——最终体积,mL;
Wt——产品质量,g;
L——光程,1 cm。
1.3 数据统计处理
数据处理采用SPSS数据分析软件分析处理,数据相互比较分析应用方差分析及t检验。
2 结果分析
2.1 提取剂质量分数对紫马铃薯花青素提取量的影响
提取剂质量分数对紫马铃薯花青素提取量的影响见图1。

图1 提取剂质量分数对紫马铃薯花青素提取量的影响
花青素易溶于极性溶剂中,而乙醇常被作为天然产物的萃取剂,具有安全廉价、黏性小、易回收等诸多优点,试验选用乙醇溶液作为提取剂。由图1可知,提取剂质量分数对紫马铃薯花青素提取率有显著影响,花青素的提取率随着提取剂质量分数的增大而提高,当提取剂质量分数达到60%时,提取率达到最大;而当提取剂质量分数超过60%以后,花青素的提取率随着提取剂质量分数的升高而有所降低。可能由于提取剂质量分数较低时,淀粉和其他水溶性物质溶解性好,影响了花青素的溶出,导致提取率较低,而当提取剂质量分数过高时,脂溶性物质容易溶出,降低了花青素的提取率。
2.2 pH值对紫马铃薯花青素提取率的影响
对于一个给定的pH值,花青素的4种结构之间存在着平衡:蓝色的醌式(脱水)碱、红色的花烊正离子(AH+)、无色的甲醇假碱和查尔酮。在pH值较低时,以红色的花烊正离子为主,随着pH值的增大,花色苷的颜色将褪至无色,最后在高pH值时变成紫色或蓝色。花青素在中性和碱性条件下不稳定,因此一般在酸性条件下进行提取。
提取剂pH值对紫马铃薯花青素提取量的影响见图2。
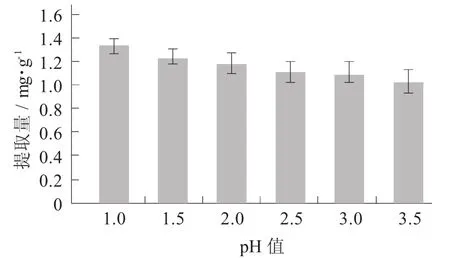
图2 提取剂pH值对紫马铃薯花青素提取量的影响
由图2可知,随着提取剂pH值的增大,紫马铃薯色素提取量呈下降趋势,当提取液的pH值为1.0时,色素的提取量达到最大值。说明萃取剂中较强的酸性有利于紫马铃薯花青素物质的溶出,且能使色素在此条件下稳定,而高pH值能将花青素裂解为花色素基元和糖基2个部分,导致花色素结构不稳定。因此,将紫马铃薯花青素提取剂的pH值范围设为1.0。
2.3 提取温度对紫马铃薯花青素提取量的影响
提取温度对紫马铃薯花青素提取量的影响见图3。
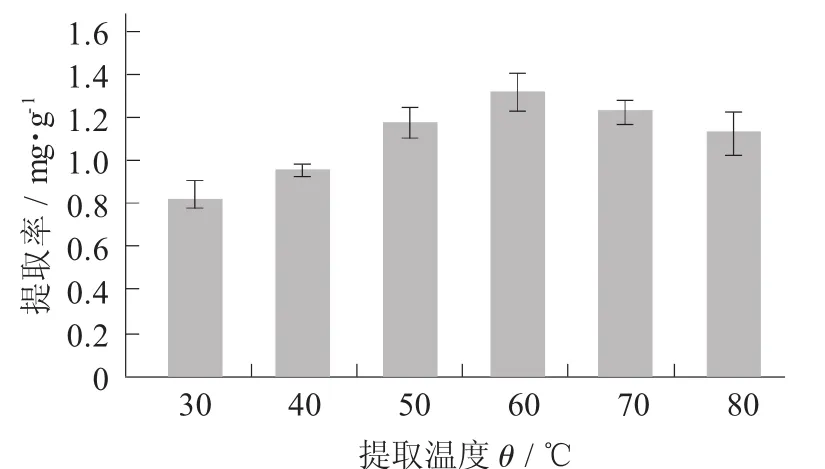
图3 提取温度对紫马铃薯花青素提取量的影响
由图3可知,随着提取温度的升高,紫马铃薯花青素提取量呈上升趋势,而超过60℃时又略有下降。说明在低温阶段,随着提取温度的升高,色素的溶出率增加,但是随着提取温度继续升高,导致花青素被氧化,结构受到破坏,朝着无色的查尔酮式结构移动,对色素的稳定性不利。因此,将紫马铃薯花青素提取温度的范围设为50~70℃。
2.4 提取时间对紫马铃薯花青素提取量的影响
提取时间对紫马铃薯花青素提取量的影响见图4。
由图4可知,在一定范围内随着提取时间的延长,紫马铃薯花青素提取量的变化不大,说明提取时间对色素提取效果的影响不大。当提取时间为2 h时,提取量已经达到最大值,从实际经济的角度考虑,因此将提取时间范围设为2 h。
2.5 料液比对紫马铃薯花青素提取量的影响
料液比对紫马铃薯花青素提取量的影响见图5。
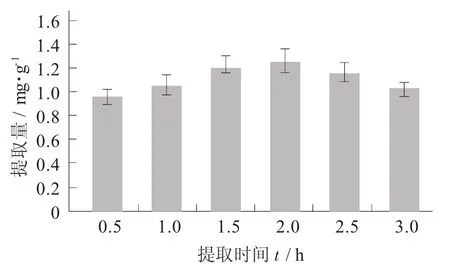
图4 提取时间对紫马铃薯花青素提取量的影响
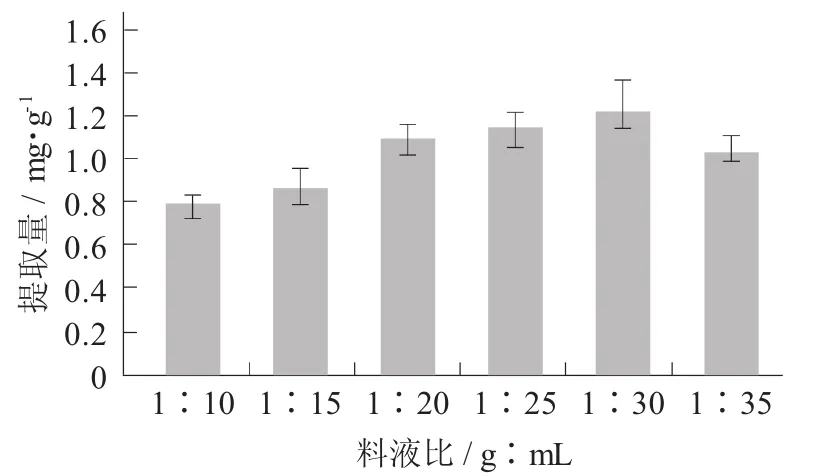
图5 料液比对紫马铃薯花青素提取量的影响
由图5可知,料液比对色素提取效果的影响较大,随着料液比的逐渐增大,紫马铃薯花青素提取率呈先上升再下降的趋势,当料液比1∶30时,提取率达到最大值。料液比是影响提取量的重要因素,料液比越小,两相间的浓度差越小,传质推动力就越小;其次,料液比会影响两相的混合情况,提高料液比能增大传质推动力,但杂质也随之升高,从而降低了花青素的提取量,并会造成大量溶剂的浪费和浓缩成本的升高。因此,将料液比范围设置为1∶20~ 1∶30。
3 结论
紫马铃薯花青素的最佳提取试验条件为提取温度60℃,提取剂质量分数60%,料液比1∶30,提取时间2 h,盐酸调节pH值1,紫马铃薯花青素的提取率最高,在此条件下紫马铃薯花青素提取量为1.27 mg/g。
[1]C R Brown.Antioxidants in potato[J].American Journal of Potato Research,2005 (2):163-172.
[2]韩海华,梁名志,王丽,等.花青素的研究进展及其应用 [J].茶叶,2011,37(4):217-220.
[3]徐春明,庞高阳,李婷.花青素的生理活性研究进展[J].中国食品添加剂,2013(3):205-210.
[4]崔倩.紫马铃薯花色苷的提取纯化和结构鉴定 [D].杭州:浙江大学,2011.◇
Study on the Extraction Process of Purple Potato Anthocyanins
XU Juanni,ZENG Yuting,BAIMA Yuzhen,SI Nian,QI Chiheng,OU Zhu,TAN Shuqiong,LI Shuping
(Tibet Agriculture and Husbandry Institute of Vegetables,Lhasa,Tibet 850032,China)
With purple potato as the main raw material, purple potato anthocyanins were extracted with ethanol extraction method,and its technological parameters was optimized by using single factor method.The results showed that the purple potato extract optimum process parameters for the volume fraction of 60%ethanol,solid-liquid ratio 1∶30(g∶mL),extraction temperature 60℃,the extraction time 2 h,hydrochloric acid to adjust pH 1,under the condition of the purple potato anthocyanins extracted amount was 1.27 mg/g.
purple potato;anthocyanins;extraction process
TS264.4
A
10.16693/j.cnki.1671-9646(X).2017.12.035
1671-9646(2017) 12b-0029-03
2017-10-12
现代农业产业技术体系建设专项资金(CARS-10-ES25)。
许娟妮(1982— ),女,在读硕士,副研究员,研究方向为马铃薯遗传育种。
