两种微藻对凡纳滨对虾幼体成活率的影响
2017-12-29陈标雷小婷卓瑞群向文洲潘庆
陈标, 雷小婷, 卓瑞群, 向文洲, 潘庆,*
两种微藻对凡纳滨对虾幼体成活率的影响
陈标1, 雷小婷1, 卓瑞群1, 向文洲2, 潘庆1,*
1. 华南农业大学海洋学院, 广州 510642 2. 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室(LMB), 广州 510301
试验旨在研究钝顶螺旋藻()和sp两种微藻培育凡纳滨对虾()幼体效果, 为开发凡纳滨对虾开口饵料提供参考依据。实验对照组D0投喂商品螺旋藻粉, 实验组D1、D2分别投喂钝顶螺旋藻和sp., 每组3个重复,每个重复2万尾凡纳滨对虾幼体, 在300 L育苗桶中饲养七天。结果表明, D0和D1组间凡纳滨对虾存活率无显著差异(>0.05), 但两组极显著高于D2组(<0.01)。在凡纳滨对虾育苗过程中, 水体总氨氮浓度小于50 umol·L-1、亚硝酸盐氮浓度小于2 umol·L-1。钝顶螺旋藻可以保证较高的幼体变态存活率, 可以作为凡纳滨对虾开口饵料新资源开发利用。
钝顶螺旋藻;sp.; 凡纳滨对虾; 幼体; 存活率; 氨氮
1 前言
微藻是一类分布广泛、营养丰富的自养生物, 通常含有30%—40%蛋白质、10%—20%脂肪酸、5%—15%碳水化合物[1-2], 富含EPA、ARA和DHA等多不饱和脂肪酸[3], 对幼苗变态发育具有重要作用, 在鱼、虾、蟹、贝等水产动物育苗中不可或缺[4]。常用饵料微藻约有40多种, 包括绿藻门、硅藻门、金藻门和蓝藻门等多个门类[5]。钝顶螺旋藻属于蓝藻门, 含有丰富蛋白质、维生素、脂肪酸和矿物质[6], 在饲料中添加螺旋藻能显著促进对虾生长发育和免疫力[7]。sp.为绿藻门、四胞藻纲、属藻类, 不仅蛋白质含量高, 氨基酸组成合理, 而且脂肪的含量丰富, 占干重的20%—25%[8]。
凡纳滨对虾, 俗称南美白对虾, 又称白脚虾或白肢虾。具有生长快, 适应性强, 离水存活时间长, 耐盐范围广, 杂食性等优点, 是世界上养殖产量最高的三大对虾品种之一[9]。氨氮为凡纳滨对虾育苗过程中水体普遍存在的有害物质[1011]。当氨氮浓度超过临界值, 会导致对虾幼体或仔虾大量死亡[1213]。育苗过程中使用营养均衡, 适口性好的饵料, 将提高仔虾生长率, 存活率, 免疫力和抗病力。本试验利用商品螺旋藻, 钝顶螺旋藻和sp.为凡纳滨对虾开口饵料, 分析投喂不同种微藻对凡纳滨对虾幼体成活率、变态时间及水体氨、亚硝酸盐氮含量影响, 以期为微藻在对虾育苗中应用提供理论基础。
2 材料方法
2.1 实验设计与饵料
本试验于广东省湛江粤海东海岛种苗基地开展。对照组D0投喂商品螺旋藻粉(100%藻粉, 云南某公司), 实验组D1、D2分别投喂中国科学院南海海洋研究所提供的钝顶螺旋藻()和sp.。钝顶螺旋藻脂肪酸组成较为简单, 棕榈酸C16:0、亚油酸C18:2n-6和亚麻酸C18: 3n-3占80%以上, 饱和脂肪酸和不饱和脂肪酸比例接近1:1;sp.藻株以不饱和脂肪酸为主, 饱和脂肪酸和不饱和脂肪酸比例接近1:3, 其中亚麻酸相对含量高达34% (中国科学院热带海洋生物资源与生态重点实验室测定)。每个处理设三个平行, 每个平行凡纳滨对虾幼体2万尾, 育苗水体为300 L, 试验周期为七天(168 h)。
2.2 实验动物与饲养管理
本实验所用亲虾为国外良种场引进, 根据GB/T 15101.1—1994检验合格, 不携带特定病原。雄虾10-12月大, 体长>15 cm, 净重>35—40 g; 雌虾10—12月大, 体长>15 cm, 净重>35—40 g。选用亲虾催产孵化出来的活动能力强, 附肢划动有力的无节幼体发育为溞状幼体, 开始饵料投喂实验。溞状幼体培育条件及投喂策略见表1。其中, 溞Ⅰ期藻粉和虾片用300目筛网搓洗投喂, 溞Ⅱ期藻粉和虾片用250目筛网搓洗投喂, 溞Ⅲ期藻粉和虾片用200目筛网搓洗投喂。每天早上于7:30测量水体温度及对虾幼体密度, 并根据幼体密度调整投饵量。溞Ⅰ期(Z1)水体温度为28.0—30.0 ℃, 微弱充气; 溞Ⅱ期(Z2)水体温度为30.5—31.0 ℃, 充气量为微波状; 溞Ⅲ期(Z3) 水体温度为30.5—31.0 ℃, 充气量为沸腾状。
2.3 样品采集及测定方法
每天分别于7:00和19:00各取一次水样, 分别取上中下层水混合样品, 测定水中氨氮、亚硝酸盐等水质因子。每天16:00取一定数量幼体进行镜检, 并记录幼体发育变态时间及幼体数量变化情况。
水中氨氮采用奈氏试剂法测定, 亚硝酸盐氮采用重氮-偶氮比色法测定, 盐度使用盐度计测量, 幼体密度采用水体比例法进行估算。
2.4 数据统计与处理
试验数据用平均值±标准误表示, 采用SPSS 20.0版软件进行分析和统计, 先对数据作单因素方差分析(One-way ANOVA), 若组间差异显著, 再采用Duncan’s多重比较, 显著性水平为0.05。
3 试验结果
3.1 微藻对凡纳滨对虾幼体存活率影响
随两种微藻培育凡纳滨对虾时间增加, 各组凡纳滨对虾存活率逐渐降低。7天后, D0、D1和D2组凡纳滨对虾幼体存活率分别为51.51%±5.86%, 51.52%±1.24%, 2.88%±2.25%。其中, D2组凡纳滨对虾幼体存活率极显著低于D0组和D1组 (<0.01), 后两者无显著差异(>0.05)(表2)。
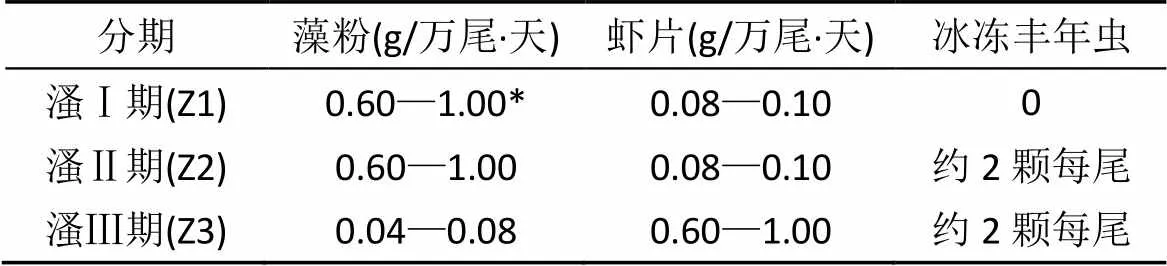
表1 凡纳滨对虾溞状幼体各期投喂量
注: *投喂量初期为0.60 g/万尾·天, 水体计数法估量幼体变态发育到下一期占半数时调整为1.00 g/万尾·天, 下同。
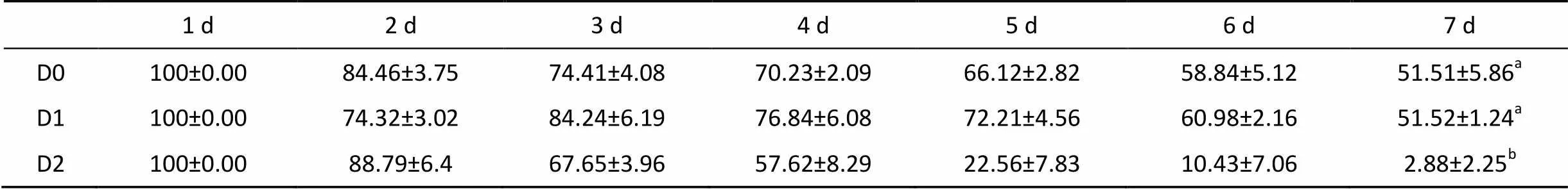
表2 各饵料组凡纳滨对虾幼体7天的存活率(%)
注: 数据肩标字母不同表示差异显著(<0.05)。
3.2 微藻对凡纳滨对虾幼体各期变态率影响
微藻对凡纳滨对虾幼体各期变态率的影响见表3。两种微藻培育第三天时, 各实验组Z2均多于Z1; 培育第四天时, D0和D1组Z2少于Z3, 而D2组Z2多于Z3且Z3多余Z1; 培育第五天时, D0和D1组均为Z3, D2组Z2多于Z3且Z3多余Z1; 培育第六天和第七天时, D0和D1组Z3多于M1, D2组Z2多于Z3。经过7天培育, D2组未能顺利完成退壳几乎停留在Z2, D1组比D0组溞状幼体从第Ⅲ期到糠虾幼体第Ⅰ期顺利蜕壳比例相对较高。
3.3 微藻对凡纳滨对虾育苗期间水体氨氮含量影响
两种微藻对凡纳滨对虾育苗期间水体氨氮含量影响见表4。投喂微藻后72小时内各组氨氮含量均呈现为上升趋势, 72小时各实验组氨氮含量分别到达(40.39±0.97) μmol·L-1, (33.42±0.44) μmol·L-1和(27.93±1.15) μmol·L-1。随后各组氨氮含量均在一定范围内呈现波动变化趋势, 168小时各组氨氮含量分别为(44.81±0.91) μmol·L-1, (44.81±0.91) μmol·L-1和(24.00±1.67) μmol·L-1。
3.4 微藻对凡纳滨对虾育苗期间水体亚硝酸盐氮含量影响
两种微藻对凡纳滨对虾育苗期间水体亚硝酸盐氮的影响见表5。凡纳滨对虾育苗期间各组水体亚硝酸盐氮含量均呈现缓慢上升趋势。两种微藻培育凡纳滨对虾168小时期间各组亚硝酸盐氮含量无显著差异(>0.05)。其中, 经过培育168小时, D0组水体亚硝酸盐氮含量为(1.50±0.10) μmol·L-1, D1组水体亚硝酸盐氮含量为(1.35±0.07) μmol·L-1, D2组水体亚硝酸盐氮含量为(1.50±0.10) μmol·L-1。

表3 各饵料组凡纳滨对虾幼体在微藻饲养7天中所处的变态期
注: *Z1代表溞状幼体第Ⅰ期, Z2代表溞状幼体第Ⅱ期, Z3代表溞状幼体第Ⅲ期, M1代表糠虾幼体第Ⅰ期。
表4 育苗水体中氨氮含量 (umol·L-1)

Tab.4 The content of ammonia nitrogen in seed rearing water (umol·L-1)
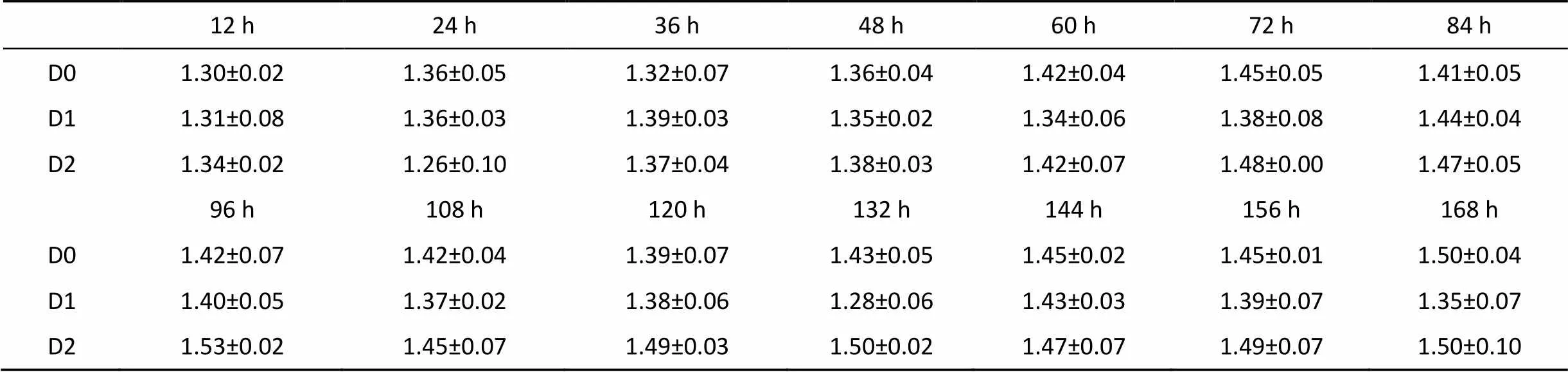
表5 投喂微藻饵料后育苗水体中亚硝酸盐氮含量 (umol·L-1)
4 讨论
4.1 投喂不同微藻对凡纳滨对虾幼体存活率及变态率的影响
凡纳滨对虾繁殖周期长, 生长快, 疾病抵抗能力强, 在我国沿海区域广泛养殖。凡纳滨对虾蛋白质需要量为30%, 脂类需要量为6%—7.5%[14-15]。在水产动物育苗过程中, 饵料不合适或者营养不足会影响幼体存活率和变态[16]。微藻含有丰富蛋白质、脂肪、维生素及微量元素等。其中, 螺旋藻富含蛋白质(60%—70%), 多不饱和脂肪酸和矿物质[17],sp脂肪含量为干重的33.04%[18]。营养丰富的微藻是贝类、鱼虾等经济水产养殖动物的良好天然饵料[19]。
在本试验条件下, 综合育苗过程中幼体生长、变态、发育和最终存活率等指标表明, 投喂商品螺旋藻和钝顶螺旋藻的凡纳滨对虾幼体存活率相对较好, 能较为顺利变态到下一期, 并且投喂商品螺旋藻粉的溞状幼体Ⅲ期发育到糠虾幼体Ⅰ期时间更短。相似研究结果已有报道, 刘惠芳等发现螺旋藻可以替代传统的蛋黄、黄豆浆及卤虫幼虫来投喂幼虾, 并且能更好地促进其生长发育[20]。刘立鹤等认为, 螺旋藻能促进凡纳滨对虾生长, 提高饲料消化利用率[21]。何金星等通过对饲料添加螺旋藻对克氏原螯虾生长性能的影响研究结果表明, 适量螺旋藻能促进螯虾生长, 其中, 2%螺旋藻添加量对成虾增重率和不同虾龄螯虾的含肉率明显提升[22]。在凡纳滨对虾育苗过程中, 螺旋藻粉能有效保证对虾幼体存活率, 一定程度上能促进其变态发育, 是凡纳滨对虾开口饵料的资源微藻之一。
本试验中投喂螺旋藻的凡纳滨对虾幼体存活率显著高于投喂sp.的凡纳滨对虾幼体存活率, 该现象可能是由于sp.细胞壁较坚固[23], 凡纳滨对虾摄食sp.后, 不易消化, 幼体营养吸收不足, 不能顺利变态发育到下一阶段所致。目前, 未见sp.在凡纳滨对虾培育中应用的相关报道, 尚有待进一步深入研究。而螺旋藻含有丰富蛋白质、维生素、脂肪酸和矿物质, 在饲料中添加螺旋藻能显著提高对虾存活率并促进变态发育[6-7]。因此, 螺旋藻可以作为凡纳滨对虾开口饵料新资源开发利用。
4.2 投喂不同微藻对凡纳滨对虾育苗期间氨氮含量及亚硝酸盐氮含量的影响
氨氮及亚硝酸盐氮均是对虾育苗过程中重要水质污染因素, 主要由对虾残饵、排泄物及未能清出死虾苗等有机物分解产生[24-26]。研究表明, 当养殖水体中的亚硝酸盐氮进入对虾血淋巴后, 能够使得氧合血蓝蛋白转化为脱氧血蓝蛋白, 以至于血淋巴对氧的亲和性降低, 降低机体的输氧能力, 对机体产生毒害作用[27-28]。
凡纳滨对虾幼虾水体中总氨氮及亚硝酸盐氮的安全浓度分别为56.21 μmol·L-1、136.43 μmol·L-1[10],在本试验条件下, 各组水中的总氨氮和亚硝酸盐氮含量均在安全浓度范围内(总氨氮(非离子氨氮)<50 μmol·L-1、亚硝酸盐氮<2 μmol·L-1)。总氨氮的浓度随着培育时间延长而呈明显上升趋势, 这是由于试验过程中不换水, 对虾育苗过程中氨氮浓度持续上升, 而且上升速度越来越快。该现象与饵料和粪便被微生物分解产氨及对虾本身排泄氨等有关[29-30]。本试验中尽管总氨氮浓度和亚硝酸盐氮的浓度都在安全浓度范围内, 但幼虾成活率还是呈下降趋势, 说明即使在安全浓度的氨氮和亚硝酸盐氮, 含量偏高对幼体成活率、变态率和生产效益仍有一定负面影响。
[1] RENAUD S M, THINH L V, PARRY D L. The gross composition and fatty acid composition of 18 speciese of tropical australian microalgae for possible use in mariculture[J]. Aquaculture, 1999, 170(2): 147–159.
[2] FUJII K, NAKASHIMA H, HASHIDZUME Y, et al. Potential use of the astaxanthin-producing microagle,sp. GK 12, as a functional aquafeed for prawns[J]. Journal of Applied Phycology, 2010, 22(3): 363–369.
[3] BROWN M R. Nutritional value and use of microalgae inaquaculture[M]. México: Intech open access publisher, 2002.
[4] BROWN M R, JEFFREY S W, GARLAND C D. Nutritional aspects of microalgae used in mariculture; a literature review [M].CSIRO Marine Laboratories Report, 1989.
[5] PAUW N, PERSOONE G. Micro-algae for aquaculture[M]. //Borowitzka M A, BorowitzkaL J. Micro-algal Biotechnology. Cambridge, U. K: Cambridge University Press,1988.
[6] GATLIN D M.Dietary supplements for the health and quality of cultured fish: Cabi[M]. United kingdom: Cabi, 2007.
[7] 高志刚, 唐建清, 沈美芳等. 螺旋藻在水产养殖中的应用[J]. 水产养殖, 2002, 5(4): 39–40.
[8] PEREIRA H, CUSTODIOL, RODRIGUES M J, et al. Biological Activities and Chemical Composition of Methanolic Extracts of Selected Autochthonous Microalgae Strains from the Red Sea[J]. Marine Drugs, 2015, 13(6): 3531–3549.
[9] 宫春光, 于清海, 陈福杰. 南美白对虾育苗中弧菌病和丝状细菌病的防治对策[J]. 科学养鱼, 2008, 09: 50–51.
[10] 彭自然, 臧维玲, 高杨, 等. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响[J]. 上海水产大学学报, 2004, 13(3): 274–278.
[11] 谢达祥, 陈晓汉, 黄均, 等. 水体中钙和镁对凡纳滨对虾幼体成活率和生长的影响[J]. 水利渔业, 2007, 2(05): 46–51.
[12] 李兰生, 林洪, 卢敬让. 虾池生态系的氮平衡及氨水平的生物调控虾池中三氮的动态趋势[J]. 海洋湖沼通报, 1999, 4: 53–57.
[13] 舒廷飞, 温琰茂, 汤叶涛. 养殖水环境中氮的循环与平衡[J].水产科学, 2002,21(2): 30–34.
[14] COLVIN LB, BRAND CW. The protein requirement of penaeid shrimp at various life-cycle stages in controlled environment systems [J]. Proceedings of the annual meeting-World Mariculture Society. 1977, 8(1): 821–840.
[15] 杨奇慧, 周歧存. 凡纳滨对虾营养需要研究进展[J]. 饲料研究, 2005, 7(6): 50–53.
[16] 史会来, 楼宝, 毛国民, 等. 不同饵料对舟山牙鲆仔稚鱼生长发育及存活的影响[J]. 上海水产大学学报, 2008, 6(17): 680–683.
[17] 沈子伟. 螺旋藻在水产动物养殖中的应用[J]. 河北渔业, 2006, 12: 8–10.
[18] YANG F F, XIANG W Z, SUN X M, et al. A novel lipid extraction method from wet microalgasp. at room temperature[J]. Marine Drugs. 2014, 12(3): 1258– 1270.
[19] 陈自强, 鹿寿, 廖一波. 微藻饵料对双壳贝类幼体生长影响的研究进展[J]. 科技通报, 2013, 29(7): 46–67.
[20] 刘惠芳, 宋志刚. 螺旋藻在水产动物生产中的应用[J]. 中国饲料, 2002, 9: 13–15.
[21] 刘立鹤, 郑石轩, 徐焕新, 等. 饲料中添加螺旋藻对凡纳滨对虾生长、体组分的影响[J]. 水产学报, 2005, 29(6): 791–797.
[22] 何金星, 窦寅, 唐建清, 等。饲料添加螺旋藻对克氏原螯虾生长性能的影响[J]. 江苏农业科学, 2009, 2: 209– 212.
[23] DELAVEGA M, DÍAZ E, VILA M, et al. Isolation of a new strain ofsp. and characterization of its potential biotechnological applications[J]. Biotechnology Progress. 2011, 27(6): 1535–1543.
[24] 陈昌生, 邹春平, 纪德华, 等. 延迟投饵对南美白对虾状幼体存活、变态和生长的影响[J]. 海洋学报(中文版), 2003, S2: 208–213.
[25] 赵春民. 南美白对虾育苗期间“红体病”大规模暴发的原因及其防治技术初探[J]. 科学养鱼, 2008, 12: 52–53.
[26] 张特. 凡纳滨对虾仔虾能量代谢及藻菌对育苗水体和废水调控作用研究[D]. 湛江: 广东海洋大学, 2012.
[27] 曾祥玲, 王安利. 凡纳对虾育苗水中氨氮和亚硝酸盐氮的变化及对幼体的影响[J]. 科学技术与工程, 2006, 16: 2433–2437.
[28] 黄翔鹄, 李活, 李长玲, 等. 牟氏角毛藻对对虾育苗水质及抗逆性的影响[J]. 广东海洋大学学报, 2008, 06: 46–50.
[29] 朱春华, 李广丽, 文海翔. 南美白对虾早期幼体消化酶活力的研究[J]. 海洋科学, 2003, 8(05): 54–57.
[30] 何本茂, 童万平, 韦蔓新. 不同模式对虾养殖水体中硝酸盐和亚硝酸盐的变化特征及其影响因素[J]. 广西科学, 2005,12(1): 76–79.
陈标, 雷小婷, 卓瑞群, 等. 两种微藻对凡纳滨对虾幼体成活率的影响[J]. 生态科学, 2017, 36(6): 78-82.
CHEN Biao, LEI Xiaoting, ZHUO Ruiqun, et al. Effects of two microalgae on the survival rate oflarvae[J]. Ecological Science, 2017, 36(6): 78-82.
Effects of two microalgae on the survival rate oflarvae
CHEN Biao1, LEI Xiaoting1, ZHUO Ruiqun1, XIANG Wenzhou2, PAN Qing1,*
1. College of Marine Sciences,South China Agricultural University,Guangzhou510642, China 2.Key Laboratory of Tropical Marine Bio-resources and Ecology (LMB), South China Sea Institute of Oceanology, Guangzhou 510301, China
The feeding trial was conducted to compare the effects ofandsp. on the survival rate oflarvae and provide the theoretical basis for shrimp’s start-feed. Three experimental groups in triplicate were designed and 20 thousand nauplius in each 300L tank were fed with commercial Sprinulian (D0),(D1) andsp.(D2), separately, for 7 days. The results showed that the survival rates of D0 and D1 were significantly higher than those of D2 (<0.01), while there was no significant difference between D0 and D1 (>0.05). The contents of ammonia nitrogen and nitrite nitrogen were below 50 μmol·L-1and 2 μmol·L-1respectively during shrimp larvae culture. The results indicated thatcould ensure higher survival rate in metamorphosis and be used as a new resource in shrimp’s start-feed.
;sp;; survival rate; larvae; ammonia nitrogen
10.14108/j.cnki.1008-8873.2017.06.011
S963.73
A
1008-8873(2017)06-078-05
2016-09-22;
2016-11-07
广东省渔港建设与渔业产业发展专项(A201601A13); 中国科学院海洋生物资源可持续利用重点实验室开放基金(LMB17011008)
陈标(1987—), 男, 河北保定人博士研究生, 主要从事水产经济动物营养代谢, E-mail: chenbiao11@mails.ucas.ac.cn
潘庆(1969—), 女, 教授, 主要从事水产经济动物营养饲料, E-mail: qpan@scau.edu.cn
