山东省各地市蜜蜂黑蜂王台病毒抽样检测分析
2017-12-29李桂林马兰婷郭恒俊胥保华郭兴启
李桂林 王 颖 马兰婷 郭恒俊 胥保华 郭兴启
(1 山东农业大学生命科学学院,泰安 271018;2 山东农业大学动物科技学院,泰安 271018)
山东省各地市蜜蜂黑蜂王台病毒抽样检测分析
李桂林1 王 颖2 马兰婷2 郭恒俊1 胥保华2 郭兴启1
(1 山东农业大学生命科学学院,泰安 271018;2 山东农业大学动物科技学院,泰安 271018)
蜜蜂黑蜂王台病是由蜜蜂黑蜂王台病毒(Black queen cell virus, BQCV)引起的蜜蜂疾病,目前在世界范围内均有分布。为检测山东省蜜蜂黑蜂王台病毒在蜂群中的携带情况,本研究对山东省17地市部分蜂场蜜蜂携带BQCV的情况进行抽样调查,并首次通过逆转录聚合酶链式反应(RT-PCR)方法初步对17地市的蜜蜂样本进行了快速病原学检测。检测结果显示,山东省17地市的62个蜂场中有来自7个地市的13个蜂场的蜂群携带BQCV,检出率为4.769%。结合调研情况及鉴定结果,我们还提供了5条可能防御蜜蜂黑蜂王台病发生的措施。希望本研究为有效预防山东省蜜蜂黑蜂王台病的发生提供参考。
蜜蜂黑蜂王台病毒;RT-PCR;山东省
1 前言
蜜蜂作为自然界中最重要的授粉者[1],极具社会效益及经济价值。然而,近年来由于受到各种不利环境胁迫及各种蜜蜂疾病的影响,全球范围内蜜蜂的数量正逐渐减少[2-4]。蜜蜂病毒病是一种特殊的蜜蜂疾病,不仅与弱势蜂群的死亡相关,还影响蜜蜂的行为、生理及形态多个方面,其在多个国家都有分布,并在世界范围内快速扩散,现已成为世界上引起蜂群损失的主要原因[5-7]。近年来,蜜蜂病毒病不仅成为养蜂行业的热点话题,也成为养蜂研究的重要课题之一。
蜜蜂黑蜂王台病是蜜蜂病毒病的一种,由蜜蜂黑蜂王台病毒(Black queen cell virus,BQCV)引起。自2000年完成BQCV的南非株(GenBank:AF183905.1)全基因组测序以来,目前NCBI上已收藏7株BQCV的全基因组序列。近年来蜂产品贸易的全球化,使BQCV在世界范围内广泛流行。在分类上,BQCV属于类小核糖核酸病毒、双顺反子病毒科、蟋蟀麻痹病毒属[8-10];在形态上,BQCV是呈球形的、无囊膜的、直径为30 nm的病毒粒子。BQCV传播广泛,可感染蜜蜂(蜂王、工蜂、雄蜂)的卵、幼虫、蛹及成蜂,也可以感染不同蜂种甚至非膜翅类昆虫。BQCV的传播方式分为水平传播及垂直传播[11]。感染方式为隐性感染[12],看似健康的蜂群里的蜜蜂可能携带BQCV,在各种不利环境条件下(高温、低温、营养不良及外敌入侵等),蜜蜂体内的BQCV可被激活并快速复制,最终导致蜂群大量死亡[3,13]。蜂群的大量死亡不仅给蜂农带来不可估量的损失,也将影响养蜂相关的产业。蜜蜂体内携带BQCV并不可怕,可怕的是各种环境压力导致蜜蜂体内BQCV的激活,继而导致BQCV被大量复制,最终导致蜂群崩溃。由于蜜蜂黑蜂王台病给蜂群带来严重危害,近年来针对BQCV的研究与日俱增[14-19]。
鉴于蜜蜂黑蜂王台病的发病特点及流行性,提前检测出蜂群中是否携带BQCV,做好预防措施,及时切断BQCV的传播途径是必要的。本研究参照Benjeddou 等人设计的引物[20],采用逆转录聚合酶链式反应(RT-PCR),对山东省17地市蜂群携带BQCV的状况进行调查,首次报道了山东省17地市部分蜂场蜜蜂携带BQCV的情况,为有效预防山东省蜜蜂黑蜂王台病的发生提供参考。
2 材料与方法
2.1 样品的采集
2016年7 月至2016年11月,我们先后调研了山东省17个地市的62个蜂场,并从蜂场采集蜜蜂样品,保存在-80℃超低温冰箱内备用。蜂种包括意大利蜜蜂(Apis mellifera)和中华蜜蜂 (Apis cerana cerana),多数蜜蜂样品是意大利蜜蜂,部分是中华蜜蜂。
2.2 试剂
RNAiso plus由TAKARA公司生产;氯仿、异丙醇、无水乙醇由天津市凯通化学试剂有限公司生产;5× All-In-One RT MasterMix (with AccuRT Genomic DNA Removal Kit)由ABM公司生产;EasyTaq®DNA Polymerase、pEASY®-T1 Simple Cloning Vector 及Trans1-T1 Phage Resistant Chemically Competent Cell由北京全式金生物生产;Plasmid Mini Kit I由上海拜力生物科技有限公司生产;琼脂糖凝胶DNA回收试剂盒由北京索莱宝科技有限公司生产。10mm dNTP mixture由生工生物工程(上海)股份有限公司生产。
2.3 引物的设计与合成
在本研究中用到的扩增BQCV的引物借鉴于Benjeddou 等人设计的引物,上游引物(BQCVup)为:5'-TGGTCAGCTCCCACTACCTTAAA-3',下游引物(BQCVdown)为:5'-TGGTCAGCTCCCACTAC CTTAAAC-3'[20],该对引物由生工生物工程(上海)股份有限公司合成。
2.4 样品 RNA的提取
利用Trizol法提取样品总RNA。具体步骤如下:液氮研磨采集的蜜蜂样品至粉末状,称取0.05~0.1 g粉末至无RNA酶的1.5 ml离心管里(离心管里事先被分装了1 ml的RNAiso plus),立即旋涡震荡1 min,室温放置5 min;12000 g,4℃离心10 min;取上清至新的1.5 ml离心管里,加入200 μl的氯仿,剧烈震荡15 s,室温放置3 min用来沉淀蛋白;12000 g,4℃离心15 min;取上清至新的1.5 ml离心管里,加入500 μl异丙醇用来沉淀RNA,轻轻地颠倒混匀,室温放置10 min;12000 g,4℃离心10 min;去上清,加入1 ml预冷的75%的无水乙醇,漂洗RNA;7500 g,4℃离心5 min;用真空泵抽去75%的无水乙醇,室温放置3 min,使残留的无水乙醇尽量挥发完;加入30 μl的无RNA酶的水,吸打数次,溶解RNA,稍离心,保存在-80℃超低温冰箱内备用。
2.5 cDNA第一链的合成
用 5× All-In-One RT MasterMix (with AccuRT Genomic DNA Removal Kit)合 成cDNA第 一 链。RNA模板加入2 μg,再加入AccuRT Reaction Mix(4X)至两者的总体积为8 μl;42℃孵育2 min;分别加入 AccRT Rection Stopper (5X) 2 μl,5X All-In-One RT MasterMix 4 μl,Nuclease-free H2O 6 μl,吸打混匀,25℃孵育10 min,42℃孵育15 min,85℃孵育5 min;适当离心后,放-20℃冰箱内备用。
2.6 PCR扩增体系及扩增程序
以合成的第一链cDNA为模板,建立以下25 μl的反应体系:模板1 μl,上游引物1 μl,下游引物 1 μl,10XEasyTaq®Buffer 2.5 μl,10mm dNTP mixture 溶 液 1 μl,EasyTaq®DNA Polymerase 0.25 μl,双蒸水18.25 μl。反应条件为:94℃ 10 min;94℃ 40 s,48℃ 40 s,72℃ 50 s,共35个循环;72℃后延伸10 min。获得的PCR产物经1 %琼脂糖凝胶电泳鉴定。
2.7 标准阳性模板的制备
采集山东农业大学养殖的中华蜜蜂,按上述方法提取RNA,并反转录获得cDNA第一条链,以此为模板,以BQCVup、BQCVdown为引物进行PCR的扩增。扩增产物经1 %琼脂糖凝胶电泳鉴定,用凝胶成像系统(产自北京赛智科技有限公司)成像,把含目的条带的凝胶切下,用琼脂糖凝胶DNA回收试剂盒进行胶回收。胶回收产物连pEASY®-T1 Simple Cloning Vector。将连接产物转化到Trans1-T1 Phage Resistant Chemically Competent Cell。次日挑选阳性单克隆菌送至生工生物工程(上海)股份有限公司测序。目的基因的测序结果在NCBI上进行Nucleotide BLAST,以检测目的基因扩增的正确性。选取测序正确的阳性单克隆菌的质粒作为标准阳性模板。
2.8 检测采集的山东省17地市的蜜蜂样本中BQCV的携带情况
首先对采集的蜜蜂样本按上面提到的RNA提取方法进行RNA的提取,并制备cDNA第一条链。用来检测的各蜂场的每个样品均由20只蜜蜂组成,用液氮研磨至粉末状,称取0.05~0.1 g粉末用来提取RNA,剩余的粉末放-80℃超低温冰箱备用。在进行PCR检测时,每个样品做两个平行。PCR产物经1%琼脂糖凝胶电泳,然后用全自动凝胶成像仪拍照。阳性对照中模板是质粒(上面提到的标准阳性模板),阴性对照的模板是双蒸水,其他反应体系及反应条件不变。
3 结果与分析
3.1 体系调研的基本情况
本研究对山东省17个地市(济南、青岛、淄博、德州、烟台、潍坊、日照、莱芜、菏泽、滨州、济宁、泰安、临沂、聊城、威海、枣庄及东营等)的蜂场进行抽样调查。调查发现蜂农主要养殖意大利蜜蜂,大部分蜂场有爬蜂现象,多数蜂场的蜜蜂被感染蜂螨。采集的样品被带回实验室后,先用液氮冷冻,然后立即放入-80℃超低温冰箱保存。
3.2 标准阳性模板的获得
首先将从疑似患有BQCV的蜜蜂中得到的cDNA作为PCR扩增的模板,并采用Benjeddou 等人设计的引物[20](该引物已在世界范围内被多人用来筛选BQCV[21-23]),进行PCR扩增。PCR扩增结果如图1所示,在选取的7个模板中,有六个模板可扩出条带,条带大小与理论扩增片段大小一致。1、3及7号目的条带分别被用来切胶、胶回收,胶回收产物进一步被用来做连接转化,挑选阳性单克隆菌测序。测序获得的目的序列在NCBI上Blast,结果显示与之同源的核苷酸序列全来自BQCV。以上结果表明,我们扩出来的片段就是BQCV的序列。山东农业大学饲养的中华蜜蜂蜂群购自临沂的某蜂场,在2016年9月份我们从这家蜂场采集的样品中也检测到了BQCV,初步说明该蜂场的蜜蜂携带BQCV,也进一步证实了我们扩出的序列是BQCV的。选取1号样品的菌进行摇菌,用Plasmid Mini Kit I抽提质粒,提取的质粒作为检测山东省17地市BQCV存在情况的阳性对照模板。
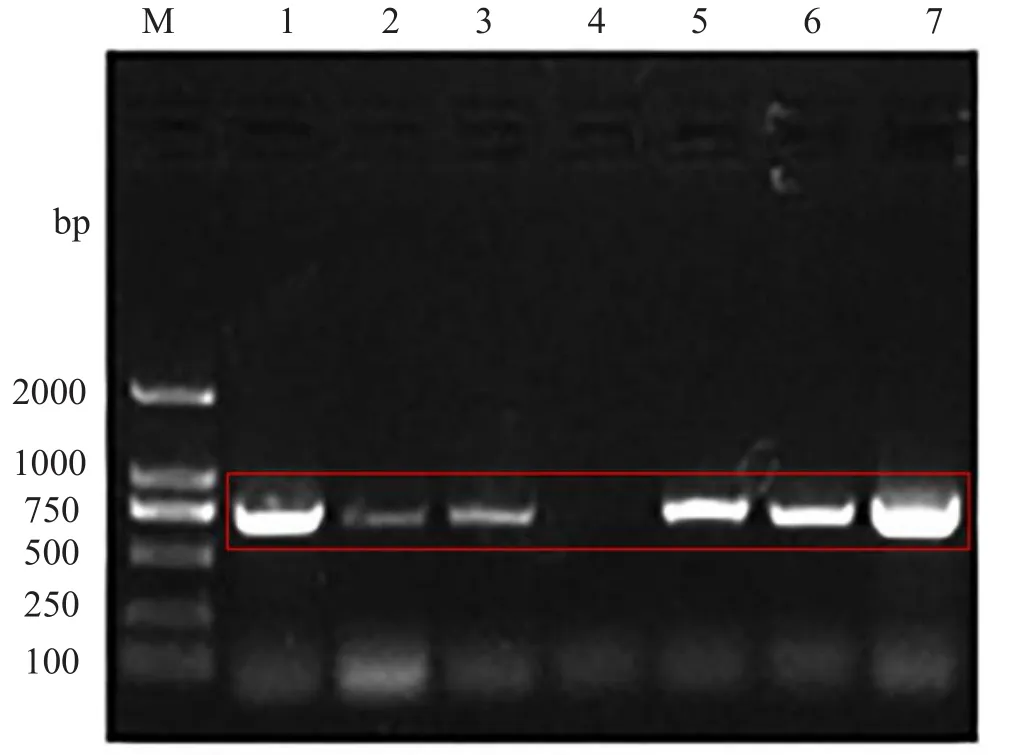
图1 BQCV基因PCR扩增结果电泳图
3.3 山东省17地市蜂群携带BQCV的抽样调查结果
采用RT-PCR初步检测采集的蜜蜂样品中是否含有BQCV。本研究共调研山东省17地市的62个蜂场,采集了128份样品。在山东省17个地市的62个蜂场中,有7个地市(日照、泰安、临沂、枣庄、滨州、威海和淄博),13个蜂场的蜂群初步被检测到携带BQCV,检出率为4.769%。其中3家蜂场的样品来自日照,3家蜂场的样品来自泰安,2家蜂场的样品来自临沂,2家蜂场的样品来自枣庄,1家蜂场的样品来自滨州,1家蜂场的样品来自威海,1家蜂场的样品来自淄博(表1)。

表1 山东省检出BQCV的地市的情况
4 讨论
蜜蜂黑蜂王台病毒的感染方式为隐性感染,这种感染方式不易被观察到,直到蜂王幼虫及蛹变黑,巢房房壁变黑时,才能呈现出可观察的现象[19,24]。RT-PCR方法具有快速、特异性强、敏感性高等特点,可用于快速检测BQCV的存在,也为快速诊断蜜蜂黑蜂王台病提供一种新的途径。本研究用分子生物学的手段,用RT-PCR方法初步检测了BQCV在山东省17地市的蜂群中携带情况。
实验结果显示,在山东省17地市,62个蜂场中,有来自泰安、淄博、日照、临沂、枣庄、滨州、烟台和威海等7个地市的13个蜂场的蜜蜂初步被检测到携带BQCV(检出率为4.769%),在青岛、东营、潍坊、德州、聊城、莱芜、济南、烟台、菏泽及济宁的蜂场未检测到BQCV的存在。此结果初步说明BQCV在山东省分布并不广泛。通过本研究,可以通知被检测出BQCV存在的蜂场的蜂农加强防御BQCV增殖的意识,以免造成不必要的损失。值得提出的是,日照岚山区部分蜂场的蜜蜂于2016年11月初出现大量死亡的现象,我们在当地三家蜂场采集了病(死)蜂样品,经RT-PCR鉴定显示:三家蜂场的蜜蜂均携带BQCV,相对于本实验室所鉴定的其他蜜蜂病原,BQCV的含量还是较强的(数据未显示)。经调研这三家蜂场,发现蜂农对蜂群饲养管理不规范,蜂群群势弱。本地区蜜蜂突发性大量死亡可能原因之一是:这三家蜂场的蜂群本身就携带BQCV,只是BQCV的滴度低,不足以引起蜜蜂患病。在各种不利环境(寒流来袭及饲料不足等)的影响下,蜜蜂体内的BQCV被激活,再加上与其他蜜蜂病原(蜂螨、慢性麻痹病毒、克什米尔病毒及残翅病毒等)的混合感染,导致蜂群出现大规模病死现象。蜂群的大量死亡给蜂农造成大量损失,也间接影响养蜂行业,通过这一事件,我们觉得有必要加强蜂农防御蜜蜂病毒病的意识。
蜜蜂给我国带来巨大的经济效益,然而BQCV导致的蜜蜂急剧死亡也给国家造成极大经济损失。鉴于目前还没有针对BQCV的彻底治疗方法,因此保持蜂群健康,预防蜜蜂黑蜂王台病的发生显得尤为重要。为减少蜜蜂黑蜂王台病的发生,以下防御措施可供参考:(1)有效治理狄斯瓦螨(这是保证蜂群健康的最有效的措施)。Chantawannakul等首次报道了瓦螨可携带BQCV[25]。瓦螨的刺吸行为可使寄生在瓦螨身上的病毒粒子进入蜜蜂血淋巴,如果瓦螨寄生的是被病毒感染的蜜蜂,那么蜜蜂血淋巴里存在的病毒颗粒也可被瓦螨一块吸取,继而造成病毒在不同蜜蜂个体间传播。此外,由于生物免疫抑制作用,隐藏在蜜蜂体内潜在的病毒可被激活[26,27]。通过与多位蜂农的交谈发现,如果在养蜂的过程中对螨防治的好,基本上可以获得强群,蜂群一般不会出现不明原因的死亡现象。目前针对瓦螨的防治已有比较成熟的办法,因此,可以通过控制蜂群中的瓦螨来间接控制蜜蜂黑蜂王台病的发生。(2) 蜜蜂黑蜂王台病的发生可能与蜜蜂微孢子虫病有一定的联系,当与蜜蜂微孢子虫合并感染时导致极强的致病性,给养蜂业带来巨大损失。蜜蜂微孢子虫病爆发的高峰期是春季和初夏,因此在春季及初夏可以通过严格控制蜜蜂微孢子虫病的发生来间接防治蜜蜂黑蜂王台病的爆发[23,28,29]。(3)及时切断其他蜜蜂病毒的传播途径。由于蜜蜂病毒的多重感染对蜂群带来的损失远高于单一感染,势必会导致弱势蜂群的产生,再加上不利环境的刺激,势必使蜜蜂病毒被激活并大量复制的概率增加[24,30,31]。因此,我们可以定期对蜂场及蜂场所使用的各种蜂具进行消毒,减少各种病毒的增殖,进而减少BQCV与其他蜜蜂病毒混合感染的机会。切断各种蜜蜂病毒的传播途径,防止蜜蜂受到病毒的多重感染,减少弱势蜂群的产生,有利于蜂群抵抗BQCV的侵染。(4)饲养强群,选用年轻的优质蜂王[4,11]。相比弱群,强群里的蜜蜂有较强的免疫力及抗病性[19,24,30]。在各种不利环境因子的应激压力下,强群的蜜蜂有更强的适应性,潜伏在蜜蜂体内的BQCV不易被激活。另外,因蜜蜂病毒可通过垂直传播途径传给后代,因此选用健康的、不携带蜜蜂病毒及抗病能力强的优质蜂王来繁育后代,就减少了蜜蜂病毒通过垂直传播途径传给后代的机会。(5)加快研究抗BQCV药物的步伐。Aurori等提出月桂可做为潜在的治疗受BQCV感染的蜂群的抗病毒药物[16],这当然还要进一步试验验证。此外,随着科技的发展,可利用RNA干扰的原理及技术,制造抗BQCV的药物用于防治蜜蜂黑蜂王台病的发生也是可行的。
总之,通过抽样调查及RT-PCR方法,本研究发现山东省17地市蜂群携带BQCV的现象不普遍,此结果为下一步预防蜜蜂黑蜂王台病的发生提供了参考。另外,希望本研究根据调研情况及对查阅文献的总结提出的可能预防蜜蜂黑蜂王台病的方法,能对蜂农了解防治蜜蜂黑蜂王台病的方法提供帮助。
[1] Williams I H. The dependence of crop production within the European Union on pollination by honey bees [J]. Intercept Limited, 1994, 6: 229-257.
[2] Thomas C D, Cameron A, Green R E, et al. Extinction risk from climate change [J]. Nature, 2004, 427(6970): 145-148.PMID: 14712274.
[3] Tentcheva D, Gauthier L, Zappulla N, et al. Prevalence and seasonal variations of six bee viruses inApis melliferaL. and varroa destructor mite populations in france [J]. Applied &Environmental Microbiology, 2004, 70(12): 7185-7191.
[4] Genersch E, Ohe W V D, Kaatz H, et al. The german bee monitoring project: a long term study to understand periodically high winter losses of honey bee colonies [J]. Apidologie, 2010,41(3): 332-352.
[5] Allen M, Ball B. The incidence and world distribution of honey bee viruses [J]. Bee World, 1996, 77(3): 141-162.
[6] Aubert M, Brenda B, Fries I. Virology and the honey bee.2008.
[7] Ecotono L. Ecological impacts of invasive alien species on bees [J]. Ecology Letters, 2011, 14(7): 702-708.
[8] Leat N,Ball B, Govan V, et al. Analysis of the complete genome sequence of black queen-cell virus, a picorna-like virus of honey bees [J]. Journal of General Virology, 2000, 81(8): 2111-2119.
[9] Mayo M A Virus taxonomy-houston 2002 [J]. Archives of Virology, 2002, 147(5): 1071-1076.
[10] Chen Y P, Pettis J S, Collins A, et al. Prevalence and transmission of honeybee viruses [J]. Journal of Applied Mechanics, 2006, 72(1): 606-611.
[11] Chen Y P, Siede R. Honey bee viruses [J]. Advances in Virus Research, 2007, 70(1): 33-80.
[12] Hails R S, Ball B V, Genersch E. Infection strategies of insect viruses [J]. 2008.
[13] Cho Y H, Yoo M S, Kim E H, et al. Development of rapid detection method for black queen cell virus (BQCV) using the loop-mediated isothermal ampli fi cation (lamp) in honeybees [J].Korean Journal of Apiculture, 2007,22(2): 139-144.
[14] Tanner G. Differential susceptibility of drone vs. worker honey bees to nosema ceranae and BQCV infections? [J].Zusammenfassung, 2009.
[15] Wang X H, Song Z Y, Zheng Y, et al. Cloning and sequence analysis of the VP gene of the capsid protein of China BQCVJL1 strain from black queen cell virus [J]. Heilongjiang Animal Science & Veterinary Medicine, 2015.
[16] Aurori A C, Bobiş O, Dezmirean D S, et al. Bay laurel (Laurus nobilis) as potential antiviral treatment in naturally BQCV infected honeybees [J]. Virus Research, 2016, 222: 29-33.
[17] Yang Q, Song Z Y, Feng X, et al. Analysis of the complete genome sequence of black queen cell virus JL1 from infected honeybees in China [J]. Bulletin of Entomological Research, 2016,106(5): 561-568.
[18] 王向辉,宋战昀,郑言,等. 黑蜂王台病毒中国BQCVJL1株衣壳蛋白VP基因克隆及序列分析[J]. 黑龙江畜牧兽医,2015(21):48-51.
[19] 王向辉,郑言,隋佳辰,等. 黑蜂王台病毒研究进展[J].中国畜牧兽医,2016, 43(1): 248-255.
[20] Benjeddou M, Leat N, Allsopp M, et al. Detection of acute bee paralysis virus and black queen cell virus from honeybees by reverse transcriptase PCR [J]. Applied & Environmental Microbiology, 2001, 67(5): 2384-2387.
[21] Teixeira E W, Chen Y, Message D, et al. Virus infections in brazilian honey bees [J]. Journal of Invertebrate Pathology, 2008,99(1): 117-119.
[22] Choe S E, Nguyen L T K, Jin H N, et al. Prevalence and distribution of six bee viruses in KoreanApis cerana, populations[J]. Journal of Invertebrate Pathology, 2012, 109(3): 330-333.
[23] Yang B, Peng G D, Li T B, et al. Molecular and phylogenetic characterization of honey bee viruses, Nosema, microsporidia,protozoan parasites, and parasitic mites in China [J]. Ecology &Evolution, 2013, 3(2): 298-311.
[24] 杨倩,张健,宋战昀,等. 蜜蜂黑蜂王台病研究进展[J].病毒学报,2015, 31(3): 318-325.
[25] Chantawannakul P, Ward L, Boonham N, et al. A scientific note on the detection of honeybee viruses using real-time PCR(Taqman) in varroa mites collected from a Thai honeybee (Apis mellifera) apiary [J]. Journal of Invertebrate Pathology, 2006,91(1): 69-73.
[26] Le-Gall O, Christian P, Fauquet C, et al. Picornavirales, a proposed order of positive-sense single-stranded RNA viruses with a pseudo-t = 3 virion architecture [J]. Archives of Virology, 2008,153(4): 715-727.
[27] 刁青云,吴杰,姜秋玲,等. 中国蜂业现状及存在问题 [J].世界农业,2008(10): 59-61.
[28] Evans J D, Spivak M. Socialized medicine: individual and communal disease barriers in honey bees [J]. Journal of Invertebrate Pathology, 2010, 103 (Suppl 1): S62–S72.
[29]张炫,陈彦平,和绍禹. 蜜蜂病毒学研究进展[J]. 应用昆虫学报,2012, 49(5): 1095-1116.
[30] Bailey L, Ball B V, Perry J N. Association of viruses with two protozoal pathogens of the honey bee [J]. Annals of Applied Biology, 1983, 103(1): 13-20.
The sampling inspection analysis of black queen cell virus in various cities of Shandong province
Li Guilin1, Wang Ying2, Ma Lanting2, Guo Hengjun1, Xu Baohua2, Guo Xingqi1
(1 State Key Laboratory of Crop Biology, College of Life Sciences, Shandong Agricultural University, Taian 271018,China; 2 College of Animal Science and Technology, Shandong Agricultural University, Taian 271018, China)
Black queen cell disease is one of the honeybee diseases that is caused by black queen cell virus (BQCV),which is spread around the world at present. In this paper, some apiaries of seventeen cities in Shandong province was chosen to perform sampling inspection analysis to detect the carrying situation of BQCV in the honeybee of Shandong province, and the selected samples were carried out preliminary rapid pathogen detection by reverse transcription and polymerase chain reaction (RT-PCR) for the fi rst time. The results showed that the honeybee from thirteen apiaries of seven cities was detected carrying BQCV in sixty-two apiaries of seventeen cities in Shandong province. The detection rate was 4.769%. Furthermore, we provide five possible measures to prevent black queen cell disease in this study through combining investigation situation and detection result. We hope that the fi ndings in this paper can provide a reference for the effective prevention of black queen cell disease in Shandong province.
Black queen cell virus; RT-PCR; Shandong province
山东省现代产业技术体系创新团队专项基金(No. SDAIT-24-04)
李桂林(1990-),女,硕士研究生,主要从事蜜蜂抗病抗逆分子生物学研究,E-mail: guilinli1@163.com
郭兴启(1963-),男,教授,博导,E-mail: xqguo@sdau.edu.cn
