芘胁迫下紫玉兰根系活性及根系分泌物的响应
2017-12-29王姣龙李际平谌小勇1d闫文德1d梁小翠1d
王姣龙 ,李际平 ,谌小勇 ,1d,2,闫文德 ,1d,梁小翠 ,1d,章 帆
(1. 中南林业科技大学 a. 生命科学与技术学院;b. 南方林业生态应用技术国家工程实验室;c. 林学院;d. 城市森林生态湖南省重点实验室,湖南 长沙 410004;2. College of Arts and Sciences, Governors State University, Illinois 60484, USA)
芘胁迫下紫玉兰根系活性及根系分泌物的响应
王姣龙1a,1b,李际平1c,谌小勇1a,1b,1d,2,闫文德1a,1b,1d,梁小翠1a,1b,1d,章 帆1a,1b
(1. 中南林业科技大学 a. 生命科学与技术学院;b. 南方林业生态应用技术国家工程实验室;c. 林学院;d. 城市森林生态湖南省重点实验室,湖南 长沙 410004;2. College of Arts and Sciences, Governors State University, Illinois 60484, USA)
以紫玉兰为试验对象,设置三种芘处理浓度(L0: 0 mg/kg,L1: 500 mg/kg,L2: 2000 mg/kg),采用气相色谱质谱联用技术(GC-MS)对根系分泌物的组分进行分析,测定根系分泌物中总碳(TC)和总氮(TN)及根系活性吸收面积,为进一步研究植物根系分泌物与多环芳烃污染修复的响应机理提供基础数据,也为进一步筛选植物修复树种提供依据。结果表明:(1)随芘浓度升高,根系分泌物中检测的物质种类减少;(2)芘胁迫下根系分泌物中化学成分变化较大;(3)紫玉兰根系活性吸收面积及酸性磷酸酶活性均不存在显著相关性;(4)根系分泌物中TC含量随着芘胁迫浓度的升高呈下降趋势,而TN含量呈上升趋势。试验结果表明植物的生理过程比植物结构特征对芘胁迫更为敏感。
紫玉兰;根系分泌物;根系活性;芘;根际修复
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是指由两个以上苯环以稠环形式相连的化合物,主要由煤炭、石油、汽油、木材、烟草等其它有机高分子化合物的不完全燃烧产生,是一类广泛存在于环境中的具有致癌、致畸、致突变性的持久性有机污染物(Persistent Organic Pollutants,POPs)[1-2]。这些年来,由于人类活动生产的加剧,导致环境中PAHs大量增加,直接危及人体健康和环境生态安全。因此,PAHs污染问题已引起世界各国的普遍关注[2-3]。
植物修复(Phytoremediation)是污染环境修复和治理研究领域的一个前沿课题,具有成本低、原位修复、美化环境、无二次污染等优点,表现为最具潜力的PAHs污染物修复技术之一,其中植物根系分泌物发挥着独特的作用。根系分泌物种类繁多,数量各异,在增加土壤养分的有效性,调节有机体之间的化感作用,提高长期碳汇能力,改善根际区的微生态环境和协调根际微生物种群数量及其活力等方面发挥着独特的功能作用[4-5]。根系分泌物对PAHs的修复和清除机理主要体现在根系分泌物中的酶能够直接分解PAHs,及根系分泌物能够诱导和强化微生物群体对PAHs的降解。由于不同种类的植物释放的根系分泌物不同,而不同的根系分泌物组成对PAHs的去除效果不同。因此,研究不同植物种类的根系分泌物特征,探讨根系分泌物组成和数量在PAHs胁迫下的反应,是一项具有重要意义的工作。
近年来的研究表明,在PAHs污染胁迫下,植物根系分泌物的数量和种类发生改变。杨艳[6]曾报道PAHs胁迫下黑麦草根系分泌物中可溶性有机酸、草酸和可溶性总糖的含量均高于无污染对照,随着培养液中菲、苊、萘浓度提高,可溶性有机碳、草酸及可溶性总糖的分泌量增大。谢明吉[7]等研究得出黑麦草根系分泌有机酸、总糖以及氨基酸的量都随菲质量浓度的上升而变化,在菲处理下,低分子有机酸的组成无明显变化,但含量随菲质量浓度上升而提高,总糖和氨基酸含量均随菲质量浓度上升出现先升高后下降的趋势。因此,植物分泌的有机酸可能在加速多环芳烃清除中发挥了重要作用。另外,有研究发现PAHs污染胁迫也能对根际的酶类产生影响。Liu 等[8]研究发现高苯并 [a]芘 (BaP)(100 mg/kg) 能 显 著 提 高 紫花 苜 蓿Medicago sativaL.根际土壤中多酚氧化酶和脱氢酶的活性。但迄今为止,这类研究仍显不多,且多局限在农作物和草本植物方面,有关林木方面的研究鲜有报道。
城市绿化树种作为城市森林的重要组成部分,在减少浮尘天气,改善空气质量,修复污染等方面有着不可或缺的作用。本研究选取紫玉兰Magnolia lilii floraDesr.为试验材料,并选取在南方城市环境中和污染土壤中浓度一般较高的四环PAH芘(Pyr,pyrene),作为多环芳烃代表物,研究在不同浓度芘污染胁迫下紫玉兰根系生理特性及根系分泌物的响应,以期为进一步研究根系分泌物对PAHs污染环境的植物修复机理提供依据,为筛选高效修复PAHs土壤污染的绿化树种提供参考,并为市政园林规划提供科学依据。
1 材料与方法
1.1 试验设计
试验于2014年5—12月份在中南林业科技大学南方林业生态应用技术国家工程实验室自动调节温室中进行,供试树种为我国南方城市常用绿化树种紫玉兰2年生实木苗。将幼苗根系用清水洗净后,移植到Φ20 cm的塑料盆中,每盆装石英砂3 kg,每个树种设3个芘浓度处理(对照L0 mg/kg,低浓度处理L1:500 mg/kg,高浓度处理L2:2 000 mg/kg(芘/石英砂)),每处理3重复。每隔2天浇灌1次营养液,每次100 mL。营养液大量元素采用改良Hoagland配方,微量元素采用Amon配方。用Ca(OH)2或稀H2SO4调整全营养液pH值,整体调整到5.5左右。
1.2 根系分泌物收集和提纯
缓苗处理30 d后,将幼苗根系用自来水小水流冲洗干净,再用新制去离子水(且加入了少量百里酚以抑制微生物活动)浸泡5 min并冲洗3次,然后以10株为单元放置在装有300 mL 0.5 mmol/L CaCl2的广口容器中,用锡箔纸包裹广口瓶,以使根系处在黑暗状态,收集过程仍然连续通气,收集24 h。收集分泌物的容器预先高温消毒处理。滤纸过滤后置于冰箱冷藏(4 ℃)保存,根系分泌收集后苗木用于根系酸性磷酸酶活性的测定。将得到的根洗液减压浓缩至20 mL(浓缩15倍),加入40 mL CH2Cl2,振荡6 h,分液,重复2次,将两次收集的有机溶剂合并,过0.45 μm膜,减压浓缩至干,加入过0.45 μm膜的CH2Cl22 mL于-20 ℃冰箱保存,留作GC-MS分析。
1.3 根系分泌物成分的GC-MS分析
测定条件:GC-MS型号为GC6890/MS5973气相色谱质谱联用仪,毛细管柱DB-5 ms(30 m×0.25 mm,涂膜厚:0.25 μm)。进样口温度280 ℃,柱温 50 ℃,保持 3 min,以 10 ℃/min程序升温至290 ℃,保持20 min。载气为He,流量 1 mL/min,进样量l μ/mL。MS电子轰击源70 eV,扫描范围M /Z35-800AMU,扫描速度0.2 s扫全程,离子源温度为200 ℃,接口温度250 ℃,检测电压1 kv,溶剂切除时间:3 min。应用NIST 107质谱数据库,人工分析总离子流图并与 NIST 质谱数据库的标准图谱核对,通过计算机检索进行未知物及相对含量(面积归一化法)测定。
1.4 根系分泌物成分的TC与TN分析
采用日本岛津TOC-500测定仪测定。
1.5 根活力的测定
用甲稀蓝法进行测定[9]。利用0.010 g/L的甲稀蓝溶液,配置成不同浓度甲稀蓝溶液,然后以水为参比在分光光度计下比色,取波长660 nm,读出光密度,以甲炼蓝浓度为横坐标,光密度为纵坐标绘成标准曲线。取待测根系用滤纸将水吸干再用排水法测定其根系体积,把0.000 2 mol/L甲稀蓝溶液分别倒在3个编号的100 mL管中,每管溶液量约10倍于根的体积,准确记下每管的溶液用量。取根系,用吸水纸小心吸干数次,慎勿伤根,然后顺次浸入盛有甲燃蓝溶液的离心管中,每管中浸90 s。注意每次取出时都要使甲稀蓝溶液能从根上流回到原离心管中。从上述3个离心管中各取1 mL甲稀蓝溶液,分别稀释10倍,摇匀后在660 nm波长下比色测定,根据甲稀蓝标准曲线上查出相应的浓度(mg/mL)。按下式计算根系表面积:
总 吸 收 面 积(m2) =[(C1-C1′)×Vl] + [(C2-C2′)×V2] ×1.1。
活跃吸收面积(m2) =[(C3-C3′)×V3] ×1.1。
活跃吸收面积比(%)=活跃吸收面积/总吸收面积×100。
式中:C为溶液原来的浓度g/L;C′为浸提后的浓度g/L;1,2,3为离心管编号。
1.6 根系分泌性酸性磷酸酶活性的测定
采用Mclanchlan法[10]。取一株完整植株,将其两侧根系分取1株完整的幼苗植株,将其根系置于盛有大约80 mL由0.2 mol/L醋酸纳缓冲液(PH 5.8)为溶剂的0.5 g/L对硝基苯磷酸二钠(P-NPP)酶反应液并包裹有黑纸的离心管中,25℃下培养60 min。取出植物后加入1 mL NaOH(6 mol/L)溶液终止酶促反应,同时设置空白对照组,对照组不放植株其他相同。然后以对照组溶液为参比在分光光度计下比色,取405 nm波长比色测定,酶活性是以单位时间内单位重量鲜根或单株根系水解p-NPP生成的对硝基苯酷的量来表示(nmol/g·FW·min)。
酶活性 nmol/g·FW·min= 试样A/(0.019×T×W)×V总。
式中:A为试样的吸光度;
0.019为pH=14时,对硝基酚的μmol吸光系数,即对硝基酚的浓度为1 μmol/L时,其A=0.019;
V总=V1+V2。
V1为反应液体积,V2为NaOH (6 mol/L)溶液体积;T为时间,min;FW为根鲜质量。
1.7 数据分析
数据采用Excel进行统计分析,利用SPSS18.0进行方差分析和显著性分析,P<0.05为差异显著。
2 结果分析
2.1 根系分泌物成分的比较
紫玉兰L0处理水平下根系分泌物共鉴定到35种物质(表1),包括7种烷烃类(质量比共5.12%,下同),1种烯烃(0.71%),2种苯(1.13%),4种硅氧烷(8.21%),1种酯(0.81%),4种酮(5.34%), 4种酚(11.82%),4种醛(3.42%),1种醚(4.72%),2种有机酸(3.30%),1种氨基酸(8.65%),4种杂环类化合物(47.56%),含量较多的为:吡啶>酚>咔唑>氨基酸>呋喃,含量较少的为:胺肟<烯烃<酯。
芘胁迫处理下,紫玉兰根系分泌物发生明显改变(表1),与对照中出现的35种物质相比,L1处理下有27种物质没有在紫玉兰根系分泌物中出现,有31种没有在L2处理下出现。另一方面,有20种和11种物质分别在L1和L2胁迫处理下出现,而没有在L0处理中出现(表2)。紫玉兰根系分泌物在L1处理含量较多的为:吡啶>酰肼>酰胺>芘,含量较少的为:酮<酚<醛。L2处理水平下含量较多的为:吡啶>芘>酰肼,含量较少的为:胺肟<噻喃<酯。
随着芘浓度的升高,紫玉兰根系分泌物中检测的化合物总的种类减少,L0处理(35种)>L1处理(27种)>L2处理(14种)。经过芘处理的根系分泌物中均检测到芘的存在,且芘的质量比随着处理浓度的升高而升高,L1处理(10.23%) > L2处 理(34.72%)。3个 水平下根系分泌物中均检测到了烷烃、烯烃、硅氧烷、酯、胺肟、吡啶;其中吡啶在L0、L1、L2 3个处理水平下含量均为最高,质量比分别为:28.13%、24.29%、35.73%。其中有2种化合物(3-羧胺吡啶-N-(2-三氟甲苯基)胺肟、二十三烷)在3种处理水平的根系分泌物中均检测到,5种化合物(甲基异丁香酚、3,4-(亚甲基二氧)苯丙酮、3,4,5-三甲氧基苯甲醛、二十烷、1-溴-11-碘十一烷)在L0、L1处理的根系分泌物中检测到,2种化合物(二十四烷、Ethanone, 2-(1H-imidazo[4,5-b]pyridin-2-yl)-1-(4-morpholyl)-)在L0、L2处理中均检测到,3种化合物(芘、N’-(2,4,6(1H,3H,5H)-Trioxopyrimidin-5-ylidenemethyl)-2-nitrobenzhydrazide、六苯基环三硅氧烷)在L1、L2处理中均检测到。
2.2 根活力的比较
由图1可知,紫玉兰根系总吸收面积范围为4.83~5.42 m2,其中L0处理下总吸收面积最小,L1处理下最大,不同处理水平之间无显著差异(P>0.05);活跃吸收面积范围为2.53~2.71 m2,L0处理下最小,L2处理下最大,不同处理水平之间无显著差异(P>0.05);根系活跃吸收面积百分比范围为46.68%~52.38%,其中L1处理水平下最小,L0处理水平下最大,不同水平之间无显著差异(P>0.05)。

表1 不同芘胁迫处理下紫玉兰根系分泌物中化学成分分析结果Table 1 Component analysis of root exudate in different pyrene treatments of Magnolia liliiflora Desr.

表2 L1及L2胁迫处理下紫玉兰根系分泌物中特有成分分析结果Table 2 Component analysis of root exudate in L1 and L2 pyrene treatments of Magnolia liliiflora Desr.

图1 不同芘浓度处理对紫玉兰根系活性总吸收面积、活跃吸收面积的影响Fig.1 In fluence oftotal root absorption area and active root absorption area in different pyrene treatments of Magnolia lilii flora Desr.
2.3 酸性磷酸酶活性的比较
由图2所示,紫玉兰根系酸性磷酸酶活性范围为 9.45 ~ 16.78 nmol/g·FW·min,L1 处理水平下酸性磷酸酶活性最小,L0处理水平下最大,L0、L1、L2处理水平之间无显著差异(P>0.05)。
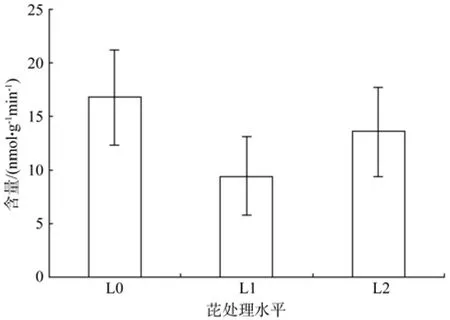
图2 不同芘浓度对紫玉兰根系酸性磷酸酶活性的影响Fig.2 In fluence of root acid phosphates activity in different pyrene treatments of Magnolia lilii flora Desr.
2.4 根系分泌物中TC、TN含量的比较
由图3可知,紫玉兰根系分泌物中TC含量范围为9.38~24.15 mg/L,含量大小顺序为:L0>L1>L2,而且L0、L1与L2三个不同处理之间均存在显著差异(P<0.05);紫玉兰根系分泌物中TN含量范围为0.98~3.5 mg/L,含量大小顺序为:L2>L1>L0,其中,L0处理与L1、L2存在显著差异(P<0.05),L1与L2之间不存在显著差异(P<0.05)。随着芘胁迫浓度的升高,根系分泌物中TC含量呈下降趋势,而TN含量呈上升趋势。
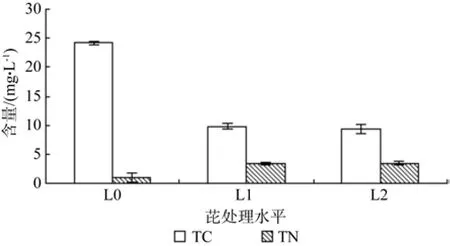
图3 不同芘浓度处理对紫玉兰根系分泌物中TC、TN含量的影响Fig 3 In fluence of TC and TN in different pyrene treatments of Magnolia lilii flora Desr.
3 讨 论
根系分泌物成分及含量的变化是植物对环境刺激响应的集中表现[11-12]。植物在受到一定有害物质毒害时,根系分泌物组成成分的浓度会发生变化,增加根系分泌物中部分组分的产生和累积[13-14],这主要是植物对有害物质毒害的应激反应,通过增加根系分泌物调节根际微域环境,使得根际微域环境利于有害物质的分解[4,11,14-16]。另外,根系分泌物中主要有机酸、氨基酸等成分及含量的变化,可对胁迫物质在土壤中的吸附一解吸附平衡产生重要的影响[9,17]。本试验中,与对照处理的相比,L1和L2芘胁迫处理下不少化合物没有在根系分泌物中出现。L0处理下紫玉兰根系分泌物中鉴定到的35种化合物,在L1处理和L2处理下只分别只出现了8种和4种,另一方面,有20种和11种物质分别在L1和L2胁迫处理下出现,而没有在L0处理中出现(表2),这种调节机理有待进一步研究。但是,一些研究结果已表明,不同逆境胁迫下,根系分泌物会发生变化。朱旭恒[18]研究了不同逆境胁迫条件下杉木幼苗的根系分泌物的变化,得出杉木幼苗在酸胁迫、营养胁迫、铝胁迫、邻羟基苯甲酸胁迫4种胁迫前期根系分泌物的种类和数量要远远多于胁迫中后期。叶思诚[9]以一年生的油茶芽苗砧嫁接苗和实生苗为材料,研究了不同磷水平下油茶根分泌物的差异,结果显示无磷(3种)和低磷(6种)水平有机酸的种类数量均比常磷(2种)和高磷(2种)要多,根系分泌物中的主要成分为酯和烷烃类化合物,且两类化合物相对含量之和在88.66%~96.36%范围内,并随着磷水平降低,酯类化合物的比例呈递增趋势,而烷烃的比例呈递减趋势。张俊英[19]等研究了氮素对不同大豆品种根系分泌物中有机酸的影响,结果表明合丰25号根系分泌的有机酸种类和数量无论苗期或花期、接种或不接种根瘤菌,均表现为硝态氮处理高于酰胺态氮处理。也有研究发现,铝可诱导耐铝玉米根系增加柠檬酸的分泌[12,20],芘胁迫下玉米根系分泌物中丝氨酸和酒石酸含量增加,芘胁迫也会导致黑麦草根系分泌物中草酸、氨基酸含量的增加[21]。这些结果与本研究类似,均认为外界胁迫能够对根系分泌物成分组成及含量造成影响。
植物根系总面积、活跃吸收面积及酸性磷酸酶活性是体现根系活性的重要指标。本研究中,紫玉兰根系活性的几个指标在不同芘浓度处理水平之间无显著差异,说明芘胁迫没有显著地影响紫玉兰幼苗根系的生长。有研究表明,芘胁迫能够影响植物根系活力,且随着芘浓度的增加呈现先增加后降低的趋势[22],根系分泌量与根系活力正相关,根系活力大、 根系分泌量也相应增多[23]。本试验与上述研究结果有差异,可能是由于芘浓度不同以及处理时间不同而引起[24]。
随着芘胁迫浓度的升高,紫玉兰根系分泌物中TC含量下降,而TN含量增加.这主要与根细胞的选择透过性有关,当膜完整性和选择性受损时,膜的透性就会增加,有机物从活体中大量释放,并引起不正常的泄漏[25]。研究表明,植物在受到毒害时会增加分泌物的产生和累积[13-15,26,27]等研究表明在一定浓度范围内,在芘污染胁迫下,植物根系分泌量随着芘处理浓度的增大而增加,但高于一定浓度时,则分泌量减少。
本实验研究结果表明,芘对紫玉兰根系分泌物的影响是十分明显的,不仅改变了根系分泌物释放的总物质种类,而且改变了根系分泌物的物质组成及其相对比例。在芘胁迫下,一些化合物没有在根系分泌物种出现,而一些物质被释放出来。全碳含量下降而全氮含量增加,表明紫玉兰根系组织和细胞对这些物质的保护和调节,也可能是由于根系生理功能遭到破坏的结果,具体的反应机理还有待进一步研究.而芘处理下,紫玉兰根系总面积和活跃面积未发生明显改变。上述结果表示,紫玉兰根系生理过程(如本研究中的根系分泌物释放过程)比根系结构特征(如根表面积)对PAHs胁迫更为敏感。
[1] Wilcke W. Globalpatterns of polycyclic aromatic hydrocarbons(PAHs) in soil[J]. Geoderma,2007,141(3):157-166.
[2] Cerniglia CE. Biodegradation of polycyclic aromatic hydrocarbons[J]. Current Opinion in Biotechnology,1993, 4(3):331-338.
[3] Haritash AK, Kaushik CP. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review[J]. Journal of hazardous materials,2009, 169(1):1-15.
[4] Anew AM, John WG.Ectomycorrhizas-extending the capabilities of rhizosphere remediation[J].Soil Biology and Biochemistry,2000, 32:1475-1484.
[5] 蔡 琼.林木根系分泌物研究进展[J].长江大学学报: 自科版, 2013, 10(11): 55-58.
[6] 杨 艳.多环芳烃污染的根系分泌效应[D].南京:南京农业大学, 2009.
[7] 谢明吉,严重玲,叶 菁.菲对黑麦草根系几种低分子量分泌物的影响[J].生态环境,2008, 17(2):576-579.
[8] Liu S, Luo Y, Cao Z,et al.Degradation of benzo[a] pyrene in soil with arbuscular mycorrhizal alfalfa[J]. Environmental Geochemistry and Health, 2004,26(2): 285-293
[9] 叶思诚.油茶适应低磷胁迫的根系生理响应[D].长沙:中南林业科技大学,2013.
[10] Mclanchlan KD. Acid phosphatase activity of intact rootsand phosphorus nutrition in plantsⅠ. Assay conditions and phosphatase activity[J]. Australian Journal of Agricultural Research, 1980,31(3): 429-440.
[11] 刘克彪,张元恺,李发明. 黑果枸杞种子萌发对水分和钠盐胁迫的响应[J]. 经济林研究,2014, 32(4):45-51.
[12] 周乃富,袁 军,高 超, 等. 生草栽培对油茶林地土壤理化性质的影响[J]. 经济林研究,2014, 32(3):76-80.
[13] Ma J F, Zheng S J, Matsumoto H. Speci fic secretion of citric acid induced by Al stress in Cassiatora L[J]. Plant Cell Physiology,1997, 38:1019-1025.
[14] 林 琦, 陈英旭, 陈怀满, 等.小麦根际铅、镉的生态效应[J].生态学报, 2000, 20 (4): 634-638.
[15] 许 超,夏北成.芘对玉米根系分泌氨基酸的影响[J].生态环境学报, 2009,18(1): 172-175.
[16] 万大娟,贾晓珊,陈 娴.多氯代有机污染物胁迫下植物某些根系分泌物的变化[J].中山大学学报:自然科学版,2007,46(1): 110-113.
[17] 旷远文,温达志,钟传文,等.根系分泌物及其在植物修复中的作用[J].植物生态学报,2003, 27(5):709-717.
[18] 朱旭恒.不同逆境胁迫对杉木幼苗生理指标及根系分泌物的影响[D].福州:福建农林大学,2009.
[19] 张俊英,王敬国,许永利,等.氮素对不同大豆品种根系分泌物中有机酸的影响[J].植物营养与肥料学报,2007,13(3):398-403.
[20] Pellet D M, Grus D L, Kochian L V. Organic acid exudation as aluminum tolerance mechanism in maize[J]. Planta, 1995, 196:788-795.
[21] 杨 静.PAHs污染土壤植物修复的根际效应及机制[D].杭州:浙江大学,2012.
[22] 杨志峰.土壤芘污染对蔬菜的毒害特征[D].泰安:山东农业大学, 2006.
[23] 贺永华.根际土壤中甲磺隆除草剂快速降解及其生态化学机制[D].杭州:浙江大学, 2006.
[24] 许 超,林小方,夏北成.玉米幼苗根系分泌物对芘污染的响应[J]. 生态学报,2010, 30(12):3280-3288.
[25] 杨 艳,凌婉婷,高彦征,等.几种多环芳烃的植物吸收作用及其对根系分泌物的影响[J].环境科学学报,2010,30(3):593-599.
[26] 沈 宏, 严小龙, 郑少玲, 等.铝毒胁迫诱导菜豆柠檬酸的分泌与累积[J].应用生态学报, 2002, 13(3): 307-310.
[27] 赵文滔,朱 凡,陈 婷,等. 加根条件下PAHs污染土壤理化性质的动态变化[J]. 中南林业科技大学学报,2015,35(7):100-104.
Response of polycyclic aromatic hydrocarbon pyrene on root exudate components and root activity ofMagnolia lilii floraDesr.
WANG Jiaolong1a,1b, LI Jiping1c, CHEN Xiaoyong1a,1b,1d,2, YAN Wende1a,1b,1d, LIANG Xiaocui1a,1b,1d, ZHANG Fan1a,1b
(1a. College of Life Science and Technology; b. National Engineering Laboratory for Applied Technology of Forestry and Ecology;c. College of Forestry; d. Provincial Key Laboratory for Urban Forest Ecology, Central South University of Forestry and Technology,Changsha 410004, Hunan, China; 2. College of Arts and Sciences, Governors State University, Illinois 60484, USA)
In this study, changes in root exudate components were investigated under three concentrations of pyrene (L0: 0 mg/kg,L1: 500 mg/kg and L2: 2000 mg/kg) for a common urban greening tree speciesMagnolia lilii florain pot experiments. Root exudates were identi fied by GC-MS technique, total carbon (TC) and total nitrogen (TN) in root exudates were measured, and root activity was also examined forMagnolia lilii floraunder three pyrene concentration treatments. Our results suggested that physiological processes of roots such as root exudation were more sensitive to pyrene stress than root structure features. The study provides scienti fic basis for further examining the inter-mechanisms between root exudates and PAH pollutants, and continuously selecting effective plant species in phytoremediation. Results showed that (1) the total number of chemical substances in root exudates decreased with increasing of pyrene concentrations; (2) Under the in fluence of pyrene, the chemical constituents of root exudates was considerably altered; (3) No signi ficant differences were found in root absorption area and root acid phosphates activity inMagnolia lilii floraunder in fluence of pyrene; and (4)With increase of pyrene concentration, the content of TC in root exudates decreased, while TN content increased.
Magnolia lilii flora; root exudates; root activity; pyrene; phytoremediation
S727.28
A
1673-923X(2017)02-0050-07
10.14067/j.cnki.1673-923x.2017.02.009
2015-08-07
湖南省科技计划项目(19801-5011);国家林业行业公益性科研专项(201404316);湖南省高校创新平台开放基金项目(12K070);国家林业局软科学研究项目(2013-R09);湖南省自然科学基金创新群体项目(湘基金委字[2013]7号);中南林业科技大学青年科学研究基金重点项目(QJ2010008A)
王姣龙,硕士 通讯作者:李际平,教授,博士生导师;E-mail:lijiping@csuft.edu.cn
王姣龙,李际平,谌小勇,等. 芘胁迫下紫玉兰根系活性及根系分泌物的响应[J].中南林业科技大学学报,2017, 37(2):50-56.
[本文编校:吴 彬]
