电针对抑郁大鼠行为学及海马β—CaMKⅡ蛋白的影响
2017-12-28尹平陈泽钦韩栩珂徐世芬
尹平 陈泽钦 韩栩珂 徐世芬

摘要 目的:观察针刺对抑郁大鼠的行为学改变及作用机制。方法:将18只雄性WKY大鼠随机分为电针组(EA)、假针组(sham EA)、模型组(model)。Wistar雄性大鼠6只设为正常组(normal)。21 d后通过糖水使用、强迫游泳实验对大鼠进行行为学评价,用免疫荧光法检测大鼠海马中β-CaMKⅡ表达。结果:与正常组比较,模型组海马β-CaMKⅡ表达和蔗糖水摄入比均明显下降(P<0.05),强迫游泳的不动时间增加(P<0.05)。与假针组比较,电针组海马β-CaMKⅡ表达和蔗糖水摄入比均明显增加(P<0.05),强迫游泳的不动时间减少(P<0.05)。结论:电针对WKY抑郁模型大鼠的行为学核心症状有明显的改善作用,明显增加海马中β-CaMKⅡ的表达,这可能是电针通过影响海马的β-CaMKⅡ从而治疗抑郁症的机制之一。
关键词 电针;抑郁症;缰核;β-CaMKⅡ
Abstract Objective:To observe the effects of electroacupuncture(EA) on depressive-like behavior and its mechanism.Methods:Eighteen male WKY rats were randomly divided into EA,Sham,and model groups.Six Wistar rats were divided into normal group.The behaviors were evaluated by sucrose preference test and force swimming test after 21 days,and the expression of β-CaMKⅡ was detected by immunofluorescence.Results:Compared with the control group,the level of β-CaMKⅡ expression of hippocampus in the model group decreased significantly along with Sucrose preference test(P<0.05).Meanwhile,immobile time of force swimming test increased significantly (P<0.05).Compared with sham group,EA group increased significantly in the β-CaMKⅡ expression of hippocampus and sucrose preference test (P<0.05),and decreased significantly in immobile time of force swimming test(P<0.05).Conclusion:Electroacupuncture can improve the WKY rats′ depressive-like behaviors and the expression of β-CaMKⅡ protein in hippocampus.This might be one of the mechanisms of Electroacupuncture on depression which is mediated by hippocampus.
Key Words Electroacupuncture; Depression; Hippocampus; β-CaMKⅡ
中圖分类号:R245.3文献标识码:Adoi:10.3969/j.issn.1673-7202.2017.02.037
抑郁症是一种以悲伤、内疚、兴趣减弱、快感缺失等多种躯体心理症状为表现的严重精神障碍性疾病,严重者有自杀倾向[1]。研究显示,抑郁症的发病在世界范围内逐年上升,带来的巨大的经济和精神心理负担给家庭和社会造成了巨大的影响[2]。抑郁症病因复杂而多样,可能与基因、心理及周围环境等多种因素共同作用而相关[3]。经典的抗抑郁药物使用普遍,但仍具有作用效果延迟、药物使用依赖、治疗效果不确定性等缺点[4]。传统病理生理学分子机制认为抑郁症主要与大脑内的单胺能神经递质在脑内的水平失衡相关,近年来另外一种神经可塑性假说受到了越来越多的认可[5]。该假说认为缰核中β-CaMKⅡ在抑郁症发病机制中起到了关键的作用,长期的负面情绪对包括缰核、海马在内的与奖赏情绪相关的神经环路造成可塑性的变化,从而加重抑郁症状[6]。针灸在调治精神疾患的使用已具有上千年的历史,且疗效显著易于推广[7]。电针治疗后对海马β-CaMKⅡ的研究尚少,我们在本实验旨在观察电针后海马活性的改变,从而探讨电针治疗抑郁症的相关机制。
1 材料与方法
1.1 材料
1.1.1 动物
4周龄Wistar和Wistar Kyoto(WKY)SPF级雄性大鼠,购于北京维通利华实验动物技术有限公司,合格证编号:SCXK(京)2012-0001。动物购进后适应性喂养1周,自由摄食饮水,12 h昼夜循环,室温(22±2)℃,相对湿度为50%~60%。
1.1.2 试剂与仪器
蔗糖,购于Sigma公司。5%蔗糖水溶液:蔗糖100 g溶于蒸馏水中,定容至2L;异氟烷,深圳市瑞沃德生命科技有限公司;4%多聚甲醛,上海元象医疗器械有限公司;一抗,novus公司NB600-1428,1:50;荧光二抗,488-山羊抗小鼠,谷歌生物GB25301;二甲苯,国药集团化学制剂有限公司;DAPI,谷歌生物,G1012;抗荧光淬灭封片剂,谷歌生物,G1401;G6805_1A电针治疗仪购于上海华谊医用仪器厂;强迫游泳实验系统购于上海移数信息科技有限公司;包埋机,武汉俊杰电子有限公司,JB-P5;倒置荧光显微镜和成像系统,日本尼康,Nikon Eclipse Ti-SR/Nikon DS-U3。
1.2 方法
1.2.1 分组与操作 18只WKY大鼠随机分至电针组、假针组和模型组;Wistar大鼠6只设为正常组。并记录初始体重。正常组、模型组常规饲养,不予治疗。
电针组:WKY大鼠8只,适应性喂养1周。根据《实验动物针灸穴位图谱》选取大鼠“百会”“印堂”穴为治疗穴位。将电针治疗仪导线的正负极两端露出铜丝并缠绕于0.25 mm×25 mm—次性不锈钢毫针上,胶布固定。在透明储物盒底部钻3个直径约为1 cm的小孔,与导线相连的毫针通过其中一个孔,另外2个小孔为通气孔。治疗时,将大鼠置于实验台上,分别刺入百会,印堂穴约5 mm,胶布固定针灸针。将事先准备好的透明储物盒盖住大鼠后,采用电针仪,频率设置为2Hz连续波电,电流强度根据大鼠的耐受情况调整,即头部出现颤动并且不嘶叫为度,从0.1 mA开始依次逐渐加大,每次治疗15 min,共3周。治疗过程中,注意观察大鼠是否要将针灸针剥掉,如有上述情况,可轻轻拍打储物盒,转移大鼠注意力。另外,保持整个实验环境的安静,避免声音或动作过大造成大鼠恐慌。
假针组:WKY大鼠6只,适应性喂养1周。采用与电针组同样的抓取方法,将同型号针灸针刺入大鼠百会、印堂体表,针灸针与导线相连,不通电。留针时间与治疗时间均同电针组。
1.2.2 检测指标与方法
1.2.2.1 糖水偏好实验(Sucrose Preference Test,SPT)
正式实验前48 h,训练大鼠适应含糖饮水。第一个24 h,每笼均放置2个水瓶,其中1瓶为5%蔗糖水150 mL,另一瓶为纯水150 mL。随后24 h,禁食禁水。正式实验时,给予大鼠5%蔗糖水和纯水各150 mL,12 h后两瓶水的位置进行调换,24 h后根据每只大鼠的糖水和纯水的饮用量来分别得出糖水喜好比。计算公式为:[(糖水饮用量)/(糖水饮用量)+(纯水饮用量)]×100%[8]。
1.2.2.2 强迫游泳实验(Force Swimming Test,FST)
强迫游泳实验装置为高40 cm,直径30 cm的透明丙稀酰胺树脂材料圆桶。将大鼠置于水温为23~25 ℃,水位32 cm的圆桶中,保证大鼠后肢不能触及圆桶底部。实验第一天对全部大鼠进行15 min预游,结束后擦干继续饲养。24 h后进行5 min的强迫游泳测试,记录并分析不动时间(漂于水面,不动或微小动作时间)。每只大鼠测试结束后需重新换干净的水,避免遗留粪便及气味对下一只大鼠测试造成干扰。
1.2.2.3 免疫荧光(Immunofluorescence)
行为学试验后麻醉、开胸,经左心室冷藏生理盐水冲洗至两肺变白后,4%多聚甲醛灌流固定,取脑后石蜡包埋,修整切片(6um)。之后操作如下:
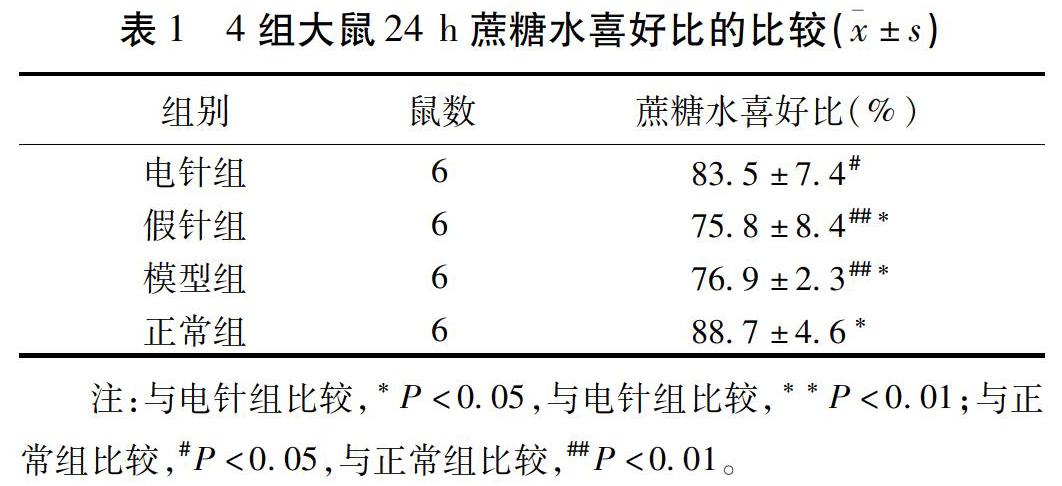
1)石蜡切片脱蜡至水:二甲苯Ⅰ15 min-二甲苯Ⅱ15 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-85%乙醇5 min-5%乙醇5 min-蒸馏水洗。2)抗原修复:置于柠檬酸抗原修复缓冲液(pH6.0)中修复。中火8 min,停火8 min,转中低火7 min。冷却后置于PBS(pH7.4)中晃动洗涤5 min×3次。3)BSA封闭:滴加3%BSA室温封闭30 min。4)加一抗湿盒内4 ℃孵育过夜。5)加二抗,晃动洗涤5 min×3次。滴加二抗避光室温孵育50 min。6)DAPI复染细胞核,晃动洗涤5 min×3次。滴加DAPI染液避光室温孵育10 min。7)封片:晃动洗涤5 min×3次用抗荧光淬灭封片剂封片。8)镜检拍照:切片于尼康倒置荧光显微镜下观察并采集图像。(紫外激发波长330~380 nm,发射波长420 nm;FITC红光激发波长465~495 nm,发射波长515~555 nm)。DAPI染出来的细胞核在紫外的激发下为蓝色,β-CaMKⅡ阳性表达为相应荧光素标记的红光。在显微镜下记录阳性表达个数,每只大鼠选取5张切片,每个切片选取3个视野,取其平均数。
1.3 统计学方法
实验数据以均数±标准差(±s)表示,用SPSS 21.0统计软件分析处理。多组间比较采用单因素方差分析(One-Way ANOVA),多组间两两比较用LSD法。所有统计结果均以P<0.05为差异有统计学意义。
2 结果
2.1 电针对各组大鼠蔗糖水喜好比的影响 电针组与假针组比较,喜好率明显升高,差异有统计学意义(P<0.05),但低于正常组,差异有统计学意义(P<0.05);模型组、假针组与正常组比较喜好率明显减少,差异有统计学意义(P<0.01)。表示WKY鼠蔗糖水喜好率低于正常大鼠,可代表为兴趣缺失的表现,电针可改善抑郁模型大鼠兴趣缺失的症状。见表1。
2.2 电针对各组大鼠强迫游泳实验的影响 电针组与假针组比较,强迫游泳的不动时间明显减少,差异有统计学意义(P<0.05),模型组与正常组比较不動时间显著增大,差异有显著统计学意义(P<0.01)。WKY大鼠在强迫游泳中的不动时间越长,表明求生欲望越低,其抑郁症状越明显,该数据表明与正常组比较,WKY大鼠抑郁症状明显,经电针治疗后,可减少WKY大鼠强迫游泳中不动时间,改善抑郁症状。见表2。
2.3 电针对β-CaMKⅡ免疫荧光技术的检测 免疫荧光检测结果显示,图中箭头所指色的圆圈样表达为β-CaMKⅡ的阳性表达,蓝色为细胞核的显像,由上至下分别为电针组、假针组、模型组和正常组;由左至右分别为单β-CaMKⅡ的阳性表达、单细胞核表达和β-CaMKⅡ与细胞核融合图。电针组与假针组比较,海马中β-CaMKⅡ阳性表达个数明显增加(P<0.05),模型组与正常组比较β-CaMKⅡ阳性表达数减少(P<0.01)。β-CaMKⅡ在WKY大鼠海马中表达越高,说明海马的突触可塑性传递活性越强,其抑郁症状越轻,该数据表明与正常组比较,WKY大鼠海马活性较低,经电针治疗后,可增加海马核中β-CaMKⅡ的表达,改变海马活性,改善抑郁症状。见图1。
3 讨论
抑郁症在中医属于“郁病”“癫病”“百合病”等病症范畴。中医认为情志是抑郁症的重要致病原因,但是否发病与情志刺激的强度、持续时间和体质状况有密切联系。此病位在脑,与心、肝、肾等多个脏腑有关。“病变在脑,首取督脉[9]”,治疗应以督脉的穴位为主来醒脑开窍、化郁开结、畅达情志。督脉与脑的关系密不可分,在治疗抑郁症中起着重要的作用。百会为督脉与手足三阳经及足厥阴肝经之会,位于头顶之颠,有醒脑开窍,升提阳气之功,是宁心安神、定惊益智的要穴。《针灸大成》云:“主心烦闷,惊悸健忘,忘前失后,心神恍惚。”印堂为经外奇穴,是督脉在前额所过之处,为调神清脑、疏通脑络的要穴,两穴相配伍可增强治疗情志疾患的疗效,而且可以减少多个穴位在治疗中产生的不确定性。本课题组长期应用此二穴于抑郁症的治疗,不仅起效快、无不良反应,还可以有效改善饮食、消化、运动等多系统伴发紊乱的症状[10]。
WKY抑郁模型大鼠模拟了抑郁症患者的核心临床症状,被广泛应用于机制和疗效研究[11]。本实验中WKY大鼠明显处于抑郁状态,与正常大鼠SPT和FST中活动性的测试均可体现出兴趣降低、快感缺失等特点,证明该模型符合抑郁模型成功的评判标准。本实验研究发现,电针可明显的改善抑郁大鼠行为学症状,可以增加大鼠对蔗糖水的摄入量,减少大鼠在强迫游泳中的不动时间,多方面改善大鼠的抑郁行为学表现。而这种电针对行为学的作用,可能是通过调节海马的β-CaMKⅡ而实现的。
关于抑郁症的发病机制,传统经典的单胺类神经递质学说认为是由于脑内去单胺类神经递质功能紊乱而造成的,然而此学说并不能完全解释抑郁症的机制,且在其指导下的用药也有局限性。Li[6]等发现缰核中β-CaMKⅡ的过度表达可增加突出传递效率和抑郁样核心症状,通过干预下调其表达后,则动物的抑郁症状发生了逆转。在临床的突破性治疗中也证实了缰核在其中的作用[12]。他在中枢神经系统的单胺类神经调节中有着关键的作用,是连接前脑边缘系统和中脑单胺中心的中心枢纽[13]。刺激缰核能抑制5-羟色胺能中心中缝背核及中缝核(Dorsal Raphe Nucleus,DRN)和多巴胺能中心腹侧被盖区(Ventral Tegmental Area,VTA)的神经元活动[14-15],对下游海马也起到直接和间接的抑制作用。电针干预后,通过影响缰核的活性,使缰核的活性降低,继而减少对下游腹侧被盖区、中缝核和中缝背核、海马等核团的抑制,从而相继增加了β-CaMKⅡ在海马中的表达,改善海马突触活性[16],增加递质的释放而起到治疗作用。多年的研究表明,针刺改善抑郁症的机制是多靶向的复合作用[17],但进一步深入研究缰核-海马关系在电针治疗抑郁症中具有着深刻的意义。
参考文献
[1]Dennis Cl A K.Interventions(other than pharmacological,psychosocial or psychological)for treating antenatal depression[Z].The Cochrane Library:The Cochrane Collaboration,2009.
[2]Tanahashi N,Takagi K,Amagasu N,et al.Effect of acupuncture stimulation on rats with depression induced by water-immersion stress[J].NEUROSCI LETT,2016,618:99-103.
[3]Lawson R P,Nord C L,Seymour B,et al.Disrupted habenula function in major depression[J].2016.
[4]H M.Evaluation of Outcomes With Citalopram for Depression Using Measurement-Based Care in STAR*D:Implications for Clinical Practice[Z].Am J Psychiatry,2006:28-40.
[5]Nissen C,Holz J,Blechert J,et al.Learning as a Model for Neural Plasticity in Major Depression[J].BIOL PSYCHIAT,2010,68(6):544-552.
[6]Li K,Zhou T,Liao L,et al.CaMKII in Lateral Habenula Mediates Core Symptoms of Depression[J].SCIENCE,2013,341(6149):1016-1020.
[7]紀倩,李志刚,唐银杉,等.不同电针刺激对慢性应激抑郁模型大鼠行为学及海马谷氨酸转运体的影响[J].针刺研究,2013,38(3):202-207.
[8]Xu J,She Y,Su N,et al.Effects of Electroacupuncture on Chronic Unpredictable Mild Stress Rats Depression-Like Behavior and Expression of p-ERK/ERK and p-P38/P38[J].EVID-BASED COMPL ALT,2015,2015:1-8.
[9]徐世芬.抑郁症发病机制及其针刺干预的研究进展[J].针灸临床杂志,2007,23(6):51-54.
[10]徐世芬,庄礼兴,唐纯志.针刺对抑郁大鼠行为学及神经内分泌的影响[J].时珍国医国药,2009,20(12):3137-3138.
[11]She Y,Xu J,Duan Y,et al.Possible antidepressant effects and mechanism of electroacupuncture in behaviors and hippocampal synaptic plasticity in a depression rat model[J].BRAIN RES,2015,1629:291-297.
[12]Karl Kiening P K F H.Remission of Major Depression Under Deep Brain Stimulation of the Lateral Habenula in a Therapy-Refractory Patient[J].BIOL PSYCHIAT,2010(67):e9-e11.
[13]Li B.Synaptic potentiation onto habenula neurons in learned helplessness model of depression[J].NATURE,2011,7335(470):535-539.
[14]Yang L,Hu B,Xia Y,et al.Lateral habenula lesions improve the behavioral response in depressed rats via increasing the serotonin level in dorsal raphe nucleus[J].BEHAV BRAIN RES,2008,188(1):84-90.
[15]Heldt S A,Ressler K J.Lesions of the habenula produce stress-and dopamine-dependent alterations in prepulse inhibition and locomotion[J].BRAIN RES,2006(1073/1074):229-239.
[16]Mao L M,Jin D Z,Xue B,et al.Phosphorylation and regulation of glutamate receptors by CaMKII[J].Sheng Li Xue Bao,2014,66(3):365-372.
[17]Liang J,Lu J,Cui S,et al.Effect of acupuncture on expression of brain-derived neurotrophic factor gene and protein in frontal cortex and hippocampus of depression rats[J].Zhen ci yan jiu=Acupuncture research,2012,37(1):20-24.
