蒙古口蘑交配型鉴定分析*
2017-12-28刘晓婷郭九峰王淑妍孙国琴李亚娇
刘晓婷,郭九峰**,王淑妍,孙国琴,李亚娇,那 日
(1.内蒙古大学物理科学与技术学院离子束生物工程自治区重点实验室,内蒙古 呼和浩特 010021;2.内蒙古农牧业科学院蔬菜研究所,内蒙古 呼和浩特 010031)
〈育种与驯化〉
蒙古口蘑交配型鉴定分析*
刘晓婷1,郭九峰1**,王淑妍1,孙国琴2,李亚娇2,那 日1
(1.内蒙古大学物理科学与技术学院离子束生物工程自治区重点实验室,内蒙古 呼和浩特 010021;2.内蒙古农牧业科学院蔬菜研究所,内蒙古 呼和浩特 010031)
对3株野生蒙古口蘑Tricholoma mongolicum Imai.子实体进行担孢子收集,采用单孢稀释法分离鉴定得到300株蒙古口蘑单孢菌丝体,利用三轮交配法对其中101株进行交配型鉴定,试验统计结果进行χ2检验,并对4种不同交配型的单核菌株进行ISSR分子标记验证。结果显示,可观察到典型的4种交配反应菌落形态并可用ISSR分子标记技术加以区分验证。所得蒙古口蘑交配类型属于四极性交配系统,为A、B因子互不连锁的双因子控制。
蒙古口蘑;单核菌丝;三轮交配法;ISSR;交配类型
蒙古口蘑 (Tricholoma mongolicum Imai.)[1]为我国北方草原上生长的优质野生食用菌,在内蒙古地区,尤以锡林郭勒盟产出的蘑菇最为人喜爱,又名草原口蘑、白蘑菇[2]、白(口)蘑、蒙古白丽蘑等,隶属于担子菌门(Basidiomycota) 担子菌纲(Basidiomycetes) 伞菌目 (Agaricales) 口蘑科 (Tricholomataceae) 口蘑属(Tricholoma) 或白丽蘑属(Leucocalocybe)[3-4],其子实体中等大,菌盖直径5 cm~17 cm,白色且光滑,半球状至平展,初期边缘内卷,菌褶白色稠密、不等长,菌柄白色且粗壮,基部稍膨大,菌肉肥厚,具香气味,是当地牧民祖祖辈辈都喜爱的传统美食[5-6]。其富含人体所需必需氨基酸,营养丰富且均衡,又具药用价值,能起到一定的抗癌作用,可辅助治疗病毒性疾病,提高人体免疫力,较好地预防骨质疏松症等[7-9]。据当地的牧民们讲,在二十多年以前,夏秋季节常出现蒙古口蘑蘑菇圈现象。但现如今受各种因素影响,蒙古口蘑生态环境遭受较为严重的破坏,其资源也越来越少,目前已被列入《国家重点保护野生植物名录(第二批)》。自1992年田绍义[10]在《真菌学报》上第1次报道成功驯化栽培蒙古口蘑后,国内外再没有报道显示有其驯化成功的情况。截至日前,蒙古口蘑人工栽培也未取得相关研究进展。
交配类型是遗传学问题中较为基础且重点的研究对象,为食(药)用菌遗传育种的相关研究提供基础性资料[11-12]。近些年,食(药)用菌遗传育种的探索愈加深入[13-15],而基础性生物学的试验研究却少见报道,更未见蒙古口蘑交配型系统鉴定的试验报道。探明蒙古口蘑的交配型系统,旨在为进一步研究蒙古口蘑交配型基因等其他功能基因提供相应的参考,以期指导蒙古口蘑的遗传育种研究工作,为研究草原珍稀食用菌的遗传学及生物学习性,加速其驯化和育种研究等提供基础依据,为野生食(药)菌的开发和市场化生产提供基础资料。
1 材料与方法
1.1 供试材料
试验所用蒙古口蘑子实体采自内蒙古锡林郭勒盟白音锡勒草原,为蒙古口蘑核心生长区。
1.2 培养基、主要试剂与仪器
MS+平板培养基:市购MS培养基,另外加1.5 g·L-1酵母浸出粉和1.5 g·L-1酸水解酪蛋白,自然pH[16];齐氏(Ziehl)石炭酸复红染液、Taq PCR Master Mix等;OLYMPUS光学显微镜、PCR仪、电泳仪、凝胶成像分析系统仪等。
1.3 担孢子的收集和单核体分离
分子鉴定:取少量口蘑组织,提取DNA,用真菌18S rRNA和ITS4通用引物进行PCR扩增,结果见参考文献[16]。
分别将编号为Ⅰ、Ⅱ、Ⅲ的3个新鲜成熟的蒙古口蘑子实体用小刀削去少许菌柄,在超净工作台上用75%的酒精擦拭菇体表面进行消毒,再用无菌水快速冲洗菇体表面3次,用灭菌的吸水纸将菇体表面水分尽量吸干。采用常规孢子弹射法收集担孢子,收集得到的孢子印低温密封保存备用。
采用常规单孢稀释法制备孢子悬浮液,在显微镜下用血球计数板挑选稀释至100 μL含40个~60个担孢子的稀释度,作为该试验的担孢子悬液,涂布平板,25℃避光培养。培养后跟踪观察,待孢子萌发形成肉眼可见微小菌落时,立刻挑取单菌落分别转移至新的MS+平板培养基上进行插片培养[17]。
1.4 单孢萌发菌株的鉴定
一段时间后,上述新的MS+平板上的菌落长大且延伸生长到盖玻片上后,直接取出制作玻片,以齐氏(Ziehl)石炭酸复红染液染色1 min~2 min后,镜检,无锁状联合者判定为单核菌丝。挑选300株单核菌丝,顺序编号,人工气候室避光培养备用。
1.5 单核体杂交和双核体检出
分别对供试单核体菌落取直径0.6 cm的圆块,在新的培养基上距离2 cm接种2个单核体培养块,约20 d两单核菌丝体接触后,继续培养4 d~6 d,观察交接区菌丝体生长情况和菌落形态,并制片镜检,以锁状联合情况判断双核体情况。
1.6 交配型鉴定试验
三轮交配[18]试验:收集的孢子经培养后鉴定出来的单核菌丝体中,随机取出101个,顺序编号为Ⅰ1~Ⅰ101。第1轮:从101株单核菌丝体中随机选1株作为T1,T1与其余100株单核菌丝体分别交配,经检验,随机挑选1株与T1发生亲和的设T2;第2轮:将T2与上轮与T1不亲和的菌株分别配对,经检验,随机挑选1株与T2不亲和的设为T3;第3轮:将T3与上一轮中其余菌株分别配对,经检验,随机挑选1一株与T3亲和的设为T4。根据“亲和”、“平贴”、“栅栏”等菌落形态观察和镜检有无锁状联合来统计各轮各种反应数量,并推断每组的交配型,确定蒙古口蘑交配类型。重复3次(编号Ⅰ~Ⅲ)。
1.7 交配型实得比例的χ2检验
卡方检验上述试验结果,公式为:

式中:Oi即每种交配数的实际观测值;Ei即固定交配类型下每种交配数的理论值。
1.8 蒙古口蘑不同交配型ISSR分子鉴定
以蒙古口蘑单核菌丝体DNA为模板,设计并筛选ISSR引物,从分子水平上对不同交配基因型蒙古口蘑单核菌株进行分类。
20 μL PCR 反应体系:10 μL 2×Taq PCR Master Mix、1 μL引物(10 pmol·μL-1)、1 μL DNA模板、8 μLddH2O。
PCR反应程序:94℃预变性4 min;94℃变性1 min,45℃退火1 min,72℃延伸1 min,共38个循环;72℃继续延伸10 min。4℃保存。
电泳条件:1.5%琼脂糖凝胶,恒压100 V,30 min。
2 结果与分析
2.1 单核菌丝的鉴别与形态观察
单核菌丝在光学显微镜油镜下(1 000×)镜检,无锁状联合者为单核菌丝。
2.2 蒙古口蘑担孢子交配类型鉴定结果
采用三轮交配法,第1次试验:第1轮选T1为Ⅰ1,Ⅰ1与其余100株单核菌丝体交配,共100个试验皿,经检验,其中与Ⅰ1发生亲和菌株个数为37个,从中随机挑选Ⅰ52设为T2;第2轮将T2与上一轮与Ⅰ1不亲和的63个菌株交配,经检验,其中与Ⅰ52发生亲和菌株个数为23个,不亲和的40个,从与中随机挑选Ⅰ6设为T3;第3轮将T3与上一轮中与Ⅰ52不亲和的其余39个菌株交配,经检验,与Ⅰ6发生亲和反应的菌株个数为10个,从中随机挑选Ⅰ63设为 T4。
在进行本次交配反应时,可以明显观察到有4种基本的菌落反应形态,见图1。亲和反应,两菌株菌落交界处,菌落形态明显不同,常表现为高耸,而且白色加深,菌丝凝结很难挑取(图1A);栅栏反应,两菌株菌落属于不亲和反应,各自生长,在交界处形成明显的“沟壑”,此处无菌丝体生长,且两菌落在近交界处表现为明显的相互抑制(图1B);平贴反应,两菌株菌落属于不亲和反应,各自生长,在交接处没有明显的“栅栏”,而是有“平贴”现象,这种不亲和可能也是1种相互抑制的生长(图1C);无交界的不亲和反应,两菌株菌落也属于不亲和反应,各自生长,两菌落交接处既不形成形态不同的亲和菌丝体,也不形成“沟壑”或“平贴”的抑制反应,而是互不影响,最终两菌落全部长到一起,难分彼此(图1D)。
统计4种反应数量,比值大约为1:1:1:1,可初步判定蒙古口蘑属四极性交配系统。根据四极性交配反应原理,亲和反应为基因型AxBy×AyBx的两株菌株交配,栅栏反应为基因型AxBx×AyBx的两株菌株交配,平贴反应为基因型AxBx×AxBy的两株菌株交配,无交界不亲和反应为基因型AxBx×AxBx的两株菌株交配(x=1或2;y=1或2)。可推断本次试验的T1、T2、T3、T4的交配基因型:若设T1交配型为A1B1,则 T2交配型为 A2B2,则 T3交配型为 A1B2或 A2B1,若T3交配型为A1B2,则T4交配型为A2B1,若T3交配型为A2B1,则T4交配型为A1B2。

图1 四种交配反应菌落形态Fig.1 Colony morphology of four mating reactions
2.3 交配型实得比例的χ2检验结果
三轮交配情况(3次重复试验)见表1。
以第1次试验第1轮反应为例,将4种交配型基因对应的反应数卡方检验:
χ2=(37-25)2/25+(24-25)2/25+(20-25)2/25+(19-25)2/25=7.078,P待测=7.078
自由度n=3时,查χ2表知P0.050=7.81>7.078,所以P待测>0.05,代表实测值与理论值差异不显著,即蒙古口蘑4种担孢子单核菌株的比例符合1∶1∶1∶1,A、B因子在减数分裂时自由组合,这一结果表明蒙古口蘑交配类型属于四极性交配系统,为A、B因子互不连锁的双因子控制系统。
2.4 ISSR分子鉴定结果
以上述结果中第1次试验筛选出的4种不同交配型单核菌株Ⅰ1、Ⅰ52、Ⅰ6和Ⅰ63的DNA为模板,以 13号引物 (5’-3’):GAGAGAGAGAGAGA GATG,做PCR扩增,电泳结果见图2。
从图3可以看出,4种不同交配型单核菌株Ⅰ1、Ⅰ52、Ⅰ6和Ⅰ63的随机扩增产物,从条带数量与位置均有不同,再次从分子角度进一步验证有4种不同基因型的试验结果。
3 结论与讨论
3.1 结论
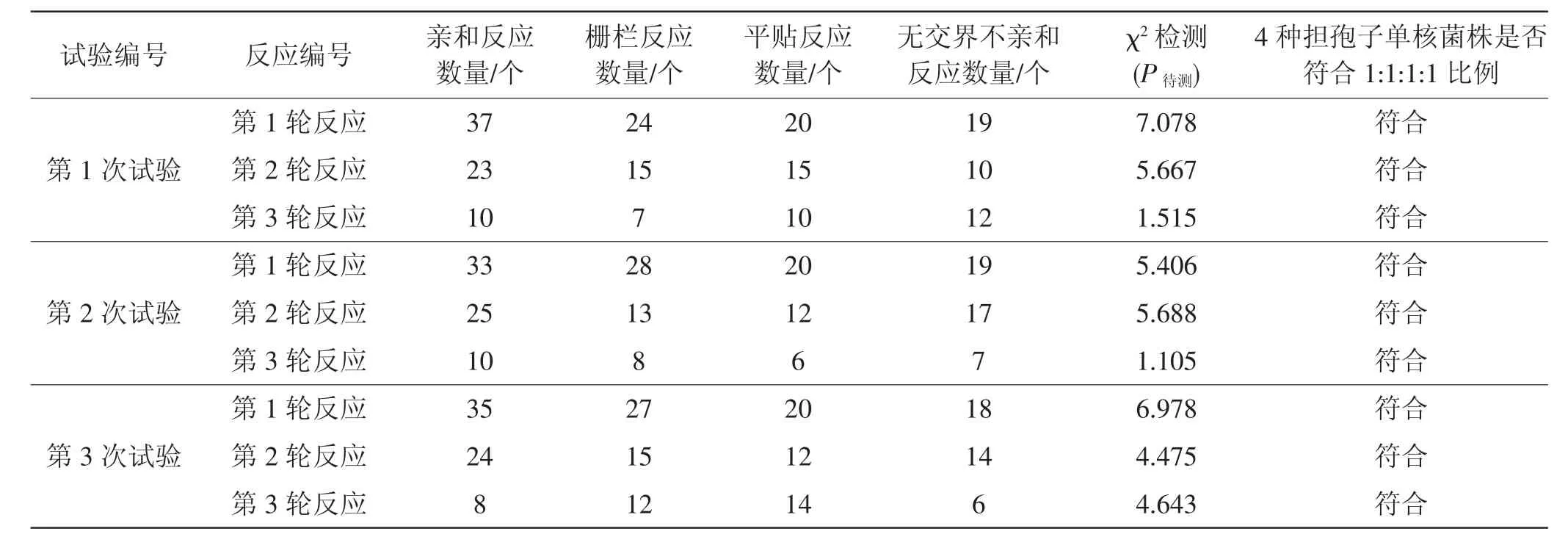
表1 重复试验三轮交配情况Tab.1 Mating situation of repeated tests
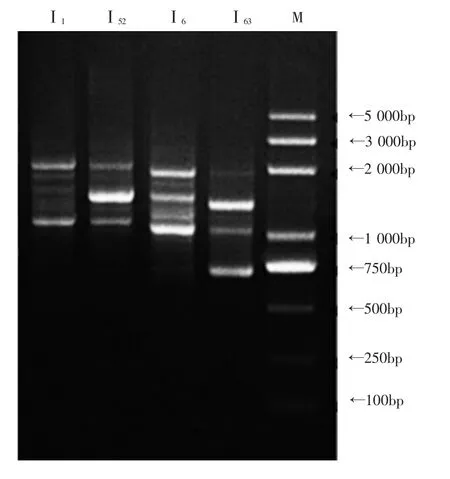
图2 蒙古口蘑单核菌丝体ISSR-PCR结果Fig.2 ISSR-PCR result of primary hypha of Tricholoma mongolicum
通过上述结果,可得出以下几点结论。
蒙古口蘑单核菌丝交配时,可以观察到典型的4种交配反应:亲和反应、栅栏反应、平贴反应、无交界不亲和反应;含不同交配型基因的蒙古口蘑单核菌丝体可用ISSR分子标记技术加以区分和验证;所得蒙古口蘑交配类型属于四极性交配系统,为A、B因子互不连锁的双因子控制系统。
3.2 讨论
传统的真菌交配型鉴定方法为单核菌株两两之间进行交配,仅一轮统计交配反应类型和数量,便可推断交配类型,但这样组合数量巨大,如101株单核菌株两两之间互相交配,有5 050个组合(C2101=5050)。而三轮交配法[18]以两两交配的原理为基础,通过每一轮交配选出同类型反应,有效降低试验数量,大幅度降低工作量,同时,与原生质体杂交的鉴定方法相比,该方法也具有操作简单的明显优势,加之三轮交配法建立在统计学的原理之上,试验结果可靠,故本试验选择该方法对蒙古口蘑交配型进行鉴定分析。
另外,试验中两菌株交配反应的菌落表现,可以大致区分出反应类型,如亲和反应在交界处有明显的不同菌丝体形态,不亲和反应在交界处有明显的互相抑制生长的菌落形态。但在实际操作过程中,一定要结合光学显微镜检查是否有锁状联合去判断反应是否为亲和,一方面为了再一次确定表现明显的反应,另一方面为了验证一些表现不明显的或无代表性表型[19]的交配反应类型,确保试验的准确性。
ISSR技术已广泛应用于食用菌遗传育种方面[20-21]。该技术能从分子水平揭示出菌株间的遗传差异、亲缘关系及筛选与待测基因紧密连锁的基因片段,为育种时选育亲本原料提供具有针对性、准确的遗传信息,有利于选育出产量高、品质好的优良品种。目前,ISSR分子标记技术在国内食用菌交配型分析、遗传多样性及育种方面已有大量报道[22-23]。本文验证了ISSR技术可对蒙古口蘑单核菌丝加以区分并进行分类,若将大量的蒙古口蘑单核菌丝进行ISSR分子标记,可分类后统计每类数量,进行蒙古口蘑4种担孢子单核菌株比例1∶1∶1∶1,以及A、B因子在减数分裂时自由组合的验证。故将其与三轮交配法配合使用,可进一步增加试验结果的可信度。
综上,本文利用经典的三轮交配法对野生珍稀食(药)用菌蒙古口蘑进行了交配型鉴定分析,确定了蒙古口蘑的交配类型属于四极性交配系统,并验证了ISSR分子标记技术可结合三轮交配法应用于蒙古口蘑单核菌丝的分类与交配型鉴定,为日后对蒙古口蘑遗传育种、人工驯化与栽培的相关研究提供资料,为其市场化开发与利用奠定基础。
[1]Imai S.On an edible mongolian fungus“Pai-mo-ku”[J].Procimper acad tokyo,1937,13(7):280-282.
[2]刘培贵,宋刚.“口蘑”食菌研究札记[J].云南植物研究,1993,15 (2):149-154.
[3]董冬,图力古尔.蒙古口蘑分类地位研究 [J].菌物研究,2013 (3):172-175.
[4]Yu XD,Deng H,Yao YJ.Leucocalocybe,a new genus for Tricholoma mongolicum(Agaricales,Basidiomycota)[J].African Journal of Microbiology Research,2011,5(31):5750-5756.
[5]卯晓岚.中国大型真菌[M].河南:河南科学技术出版社,2000:1-719.
[6]大自然博物馆编委会.大自然博物馆·百科珍藏图鉴系列:蘑菇[M].北京:化学工业出版社,2014:1-253.
[7]吴恩奇,图力古尔.蒙古口蘑研究进展[J].中国食用菌,2007 (4):3-5.
[8]Um MY,Park JH,Gwon SY,et al.Agaricus bisporus attenuates dextran sulfate sodium-induced colitis[J].Journal of Medicinal Food,2014,17(12):1383-1385.
[9]EI Enshasy HA,Hatti-Kaul R.Mushroom immunomodulators:unique molecules with unlimited applications[J].Trends in Biotechnology,2013,31(12):668-677.
[10]田绍义,杨发茂.蒙古口蘑驯化栽培成功[J].真菌学报,1992 (2):146-149.
[11]杜敏华.食用菌栽培学[M].北京:化学工业出版社,2007:8.
[12]李玉,刘淑艳.菌物学[M].北京:科学出版社,2015:3.
[13]谭笑,滕立平,路杨,等.白灵侧耳 (白灵菇)杂交育种研究进展[J].菌物研究,2015(3):175-180.
[14]戴玉成.我国8种重要药用真菌研究进展--药用真菌专刊序言[J].菌物学报,2017(1):1-5.
[15]杨杨.灰树花EST-SSR引物开发及遗传多样性研究[D].长春:吉林农业大学,2016.
[16]刘晓婷,郭九峰,王淑妍,等.蒙古口蘑担孢子萌发及初生菌丝生物学特性研究[J].北方园艺,2016(16):136-141.
[17]杨勇.放线菌气生菌丝插片培养法研究[J].宁夏大学学报:自然科学版,1986(1):60-63.
[18]张红,曹晖,潘迎捷,等.黑木耳交配型的研究[J].菌物系统,2002(4):559-564.
[19]季哲,李玉祥,薛淑玉.黄伞的交配型性状研究[J].菌物学报,2004(1):38-42.
[20]孟虎,孙国琴,睢韡,等.ISSR技术在食用菌研究上的应用[J].北方园艺,2016(5):207-210.
[21]李辉平.ISSR在食用菌遗传多样性研究中的应用[D].北京:中国农业科学院,2007.
[22]冯伟林,蔡为明,金群力,等.杏鲍菇担孢子交配型的鉴定分析[J].浙江农业学报,2010,22(1):100-104.
[23]宋小亚,肖扬,边银丙.ISSR标记在黑木耳单核体遗传分析中的应用[J].菌物学报,2007,26(4):528-533.
著作权转让声明
全体著作权人:
全体著作权人同意:论文发表在《中国食用菌》上,自论文发表之日起,该文的复制权、发行权、信息网络传播权、汇编权在全世界范围内免费转让给《中国食用菌》编辑部。论文的著作权人保证:
(1)论文是著作权人独立取得的原创性研究成果;论文内容不涉及国家机密;
(2)未曾以任何形式、用任何文种在国内外公开发表过;
(3)论文的内容不侵犯他人著作权和其他权利,否则著作权人将承担由于论文内容侵权而产生的全部责任,并赔偿由此给《中国食用菌》编辑部造成的全部损失。并承诺:
(1)以后不将以任何形式在其他任何地方发表该论文;
(2)此声明对全体著作权人均有约束力;
(3)著作权人保证其本人具有代表其他著作权人做出各项承诺之权利。
注:不同意上述转让声明的著作权人,在收到论文刊用通知5日内书面回复《中国食用菌》编辑部。
Identification for Mating Type of Tricholoma mongolicum
LIU Xiao-ting1,GUO Jiu-feng1,WANG Shu-yan1,SUN Guo-qin2,LI Ya-jiao2,NA Ri1
(1.Key Laboratory of Ion Beam Biotechnology,College of Physical Science and Technology,Inner Mongolia University,Huhhot 010021,China;2.Institute of vegetables,Inner Mongolia Academy of Agriculture and Livestock Sciences,Hohhot 010031,China)
This study is to identificate for mating type of Tricholoma mongolicum by three rounds of mating method.We first collected the basidiospores of three strains of wild T.mongolicum,and 300 strains of mononuclear myceliums were obtained by single spore dilution method.Then the mating type on the 101 strains were tested and the chi-square test to the results were made.It was verified the four different mating type of mononuclear myceliums by ISSR molecular markers.The results showed that edible fungi of T.mongolicum belonged to the typical tetrapolar heterothallic mating system.It can be observed typical four mating reactions of their colony morphology and can be used ISSR molecular markers to distinguish validation.
Tricholoma mongolicum;mononuclear mycelium;three rounds of mating method;ISSR;mating type
S646.9
A
1003-8310(2017)06-0018-05
10.13629/j.cnki.53-1054.2017.06.004
国家自然科学基金(No.51267014)。
刘晓婷(1991-),女,在读硕士研究生,主要研究方向为环境生物物理。E-mail:liuxiaoting0522@sina.com
**通信作者:郭九峰(1964-),男,博士,教授,主要从事生物物理与生物技术研究。E-mail:guojf101@sina.com
2017-09-20
