固相萃取/高效液相色谱-串联质谱法同时检测环境水样中24种农药残留
2017-12-27马洋帆赵红霞聂晓静
何 欣,马洋帆,赵红霞,聂晓静
(大连理工大学 环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
固相萃取/高效液相色谱-串联质谱法同时检测环境水样中24种农药残留
何 欣*,马洋帆,赵红霞,聂晓静
(大连理工大学 环境学院,工业生态与环境工程教育部重点实验室,辽宁 大连 116024)
建立了一种固相萃取/高效液相色谱-串联质谱(SPE/HPLC-MS/MS)同时检测水体中24种农药的分析方法。样品用乙腈提取后,经固相萃取小柱富集净化。以乙腈-0.1%(体积分数)甲酸水溶液为流动相梯度洗脱,在电喷雾离子源正离子模式下(ESI+)采用多反应监测(MRM)模式检测。结果显示,24种农药在1~200 μg/L范围内具有良好的线性关系,相关系数(r2)均不小于0.998,水样中3个添加水平(5、20、100 μg/L)下的回收率为65.9%~127.8%,相对标准偏差(RSD)为0.7%~14.2%;方法检出限为0.05~0.71 ng/L。采用该方法对大连地区10个河流入海口及2个水库的水样进行了检测,12个站位的样品中共检出10种农药,质量浓度为0.2~558.3 ng/L。结果表明,所建立的SPE/HPLC-MS/MS方法高效、灵敏、可靠,可用于实际水体中多种农药的同时检测。
固相萃取;高效液相色谱-串联质谱;农药;水样检测
农药因可以灭杀昆虫、真菌和其他危害农作物生长的生物而广泛用于世界各国[1]。现代农业科学的不断发展,使得越来越多种类的农药应用于农作物中,在提高农作物产量的同时,也对环境产生了巨大的危害,其所产生的污染成为我国影响范围最大的一种有机污染[2]。我国的农药利用率低,大部分农药会残留在环境中,通过降水、地表径流、土壤淋溶等途径进入水体,从而破坏水生生态系统的平衡,特别是农田附近的河流和湖泊污染严重,鱼类死亡率高,甚至引起人类的健康问题。
由于环境基质复杂多变,故对建立同时检测环境中多种农药残留的方法要求较高。目前,农药的检测方法主要是液液萃取、固相萃取和固相微萃取等前处理方法结合色谱分析技术,如气相色谱-质谱(GC-MS)[3-4]、气相色谱-串联质谱(GC-MS/MS)[5]、高效液相色谱(HPLC)[6-7]、高效液相色谱-质谱(HPLC-MS)[8-9]、高效液相色谱-串联质谱(HPLC-MS/MS)[10-11]、超高效液相色谱-串联质谱(UPLC-MS/MS)[12-13]等。多反应监测模式的HPLC-MS/MS因具有特异性强、灵敏度高、线性动态范围宽等特点,而被广泛用于农药的检测[14-17]。
国内对农药残留的分析局限于农作物和土壤,目前已报道的水体中快速、高效的农药检测方法有限,且所检测农药的种类较少。江阳等[18]分析了饮用水中13种农药的残留情况,简化了样品前处理的过程,但杂质干扰较大,检出限较高,不能满足更低残留量的检出要求。闫凤丽等[19]检测了环境水体中6种磺酰脲类除草剂残留,前处理采用固相膜萃取,易于堵塞,传质阻力较大,检出限较高,并且单一的液相色谱分析技术灵敏度较低,选择性较差,不能满足复杂水体中多种类农药的同时检测需求,因此对水体中多种类农药高效准确分析方法的开发尤为重要。
本研究采用SPE/HPLC-MS/MS技术,建立了水体中13种磺酰脲类除草剂、3种酰胺类除草剂、3种新烟碱类杀虫剂和其他5种农药同时测定的分析方法。经过SPE前处理技术,水样富集倍数高,可用于实际水样中微量农药的残留分析,并且对固相萃取小柱、洗脱溶剂、上样pH值等前处理的实验条件进行了优化。该方法成功应用于实际10个河流入海口及2个水库水样中目标农药残留的检测。
1 实验部分
1.1 仪器与试剂
液相色谱:Agilent 2100 SL,安捷伦科技有限公司;质谱:Agilent 6410B 三重四极杆串联质谱仪,安捷伦科技有限公司;色谱柱:Xterra®MS C18(3.5 μm,2.1 mm×100 mm),沃特世科技(上海)有限公司;真空固相萃取装置:12管防交叉污染型,Supelco公司。乙腈(色谱纯,Sigma-Aldrich公司);甲醇(色谱纯,天津市科密欧化学试剂有限公司);甲酸(分析纯,天津天河化学试剂厂);超纯水(18.2 MΩ·cm,Milli-Q Water公司)。
标准品:噻吩磺隆、甲磺隆、甲嘧磺隆、醚苯磺隆、氯磺隆、酰嘧磺隆、三氟啶磺隆钠盐、甲磺胺磺隆、烟嘧磺隆、苄嘧磺隆、吡嘧磺隆、氯吡嘧磺隆、氟胺磺隆、扑草净、嗪草酮、噻虫啉、氯噻啉、氟虫腈、除草定、噻虫嗪、异丙甲草胺、乙草胺、丁草胺、丙环唑,均购自北京百灵威科技有限公司,纯度均高于98%。
1.2 液相色谱-质谱/质谱分析条件
液相色谱条件:Waters Xterra MS C18(3.5 μm,2.1 mm×100 mm)色谱柱,流动相:A为0.1%甲酸水溶液,B为乙腈,流速0.25 mL/min,洗脱梯度程序:0~10 min,25%B;10~15 min,25%~50%B;15~20 min,50%~60%B;20 min后,100%B。
质谱条件:电喷雾离子源,正离子扫描模式,干燥气温度为350 ℃,干燥气流速为8 L/min,毛细管电压为4 000 V,电喷雾压力为25 psi。
1.3 样品前处理
水样经0.45 μm玻璃纤维滤膜过滤,用量筒准确量取500 mL于棕色玻璃瓶中,用盐酸调至pH 3.5,随后进行固相萃取。首先分别用10 mL乙腈、超纯水和pH 3.5的超纯水活化小柱,然后导入水样,控制流速为5 mL/min。用pH 3.5的超纯水冲洗瓶子和柱子,并在真空条件下抽干。用10 mL乙腈对固相萃取柱进行洗脱,使其在重力作用下,自由滴落,在水浴氮吹仪上氮吹至近干,然后用0.1%甲酸水-乙腈溶液(8∶2)定容至500 μL于液相小瓶中,涡旋待测。
2 结果与讨论
2.1 仪器条件优化
2.1.1质谱条件优化将储备液稀释至20 μg/L后,对其质谱条件进行优化。采用全扫描模式(Scan)确定目标物的母离子;采用选择离子扫描模式(SIM),优化碎裂电压(Fragmentor);在子离子扫描模式(Product ion)下,确定碎片离子;在多重反应监测模式(MRM)下,优化碰撞能量(CE)。通过优化得到的母离子、子离子、去簇电压和碰撞能量如表1所示。
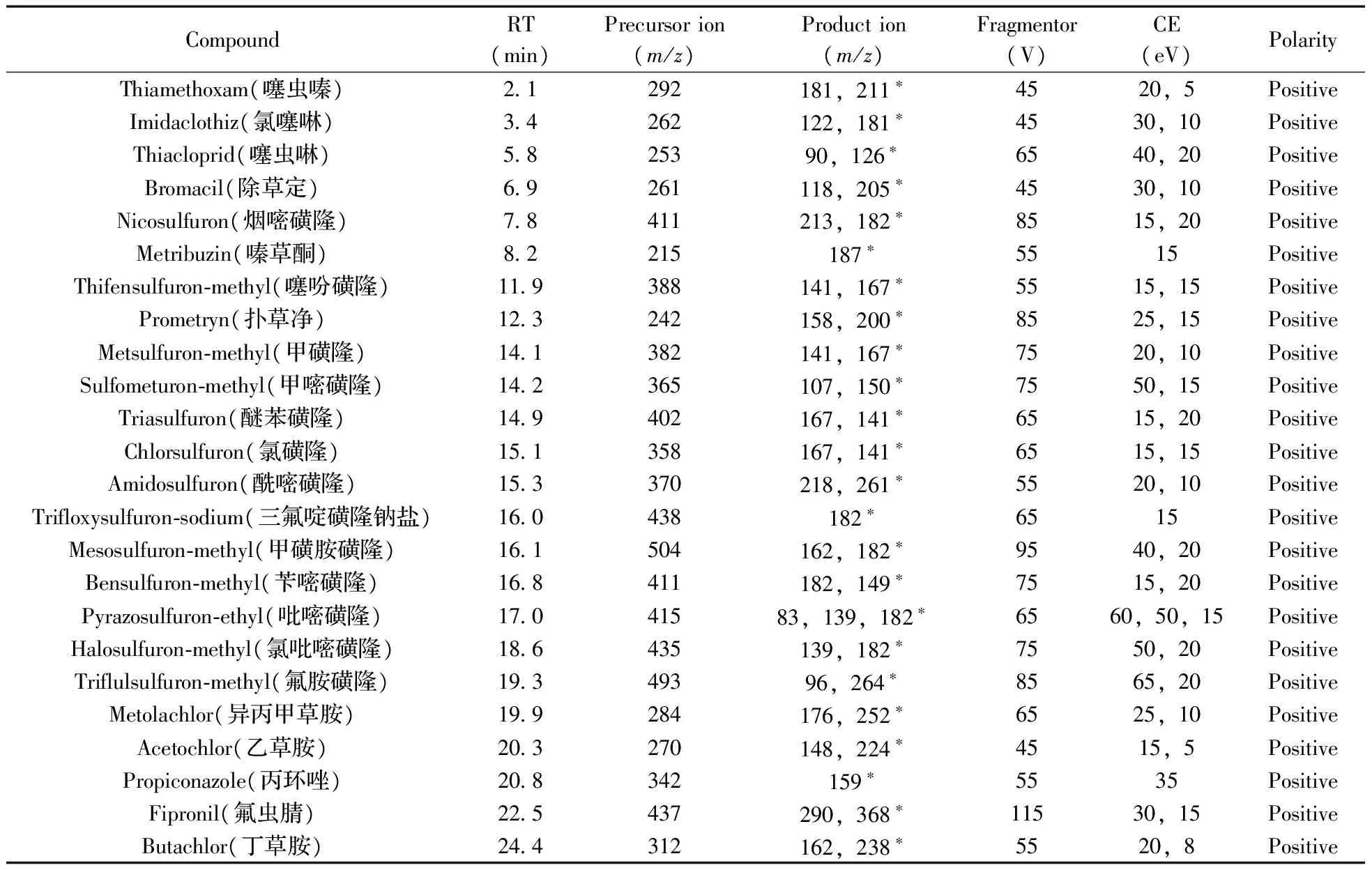
表1 24种农药的质谱检测参数Table 1 MS detection parameters of the 24 pesticides
*quantitative ion;CE:collision energy
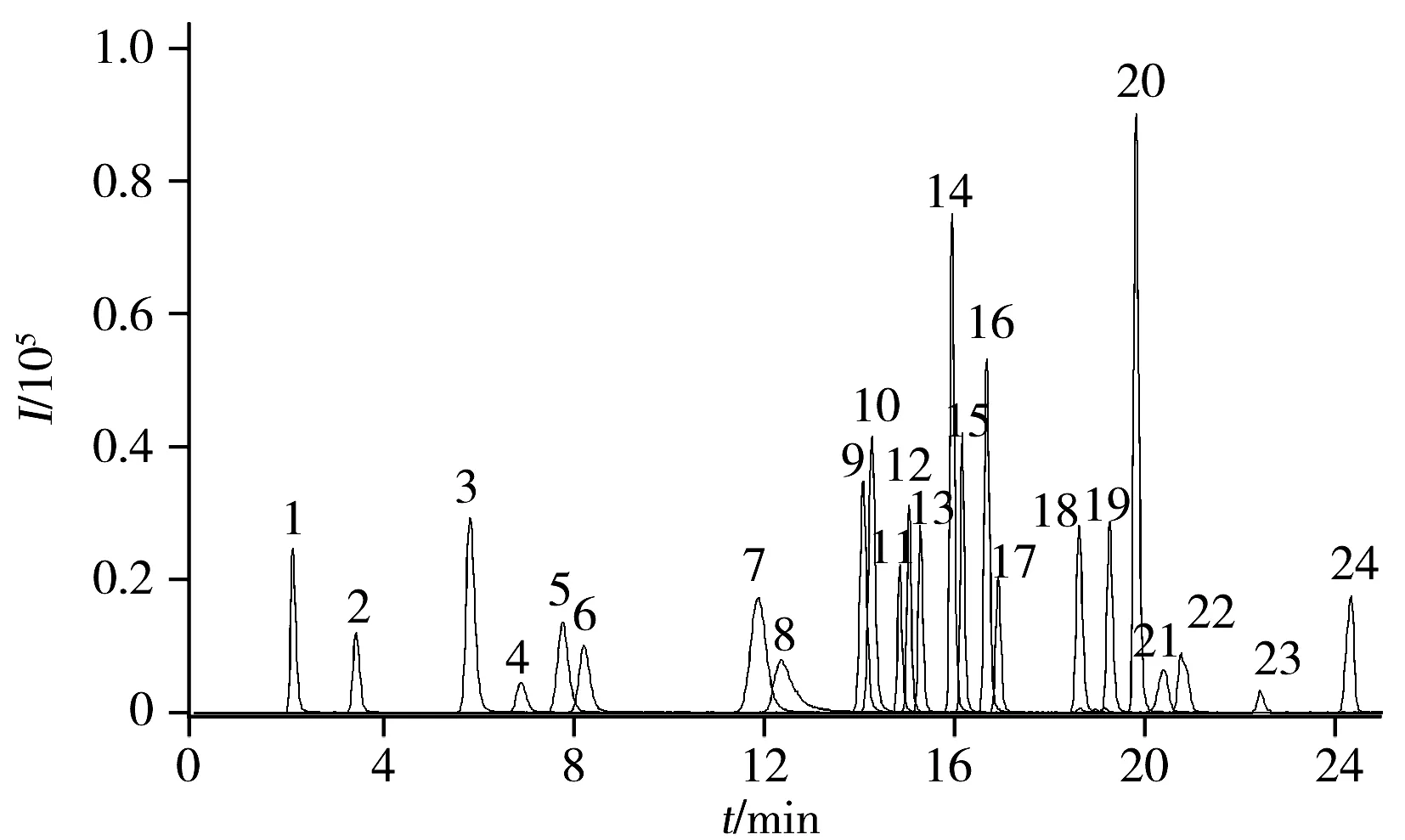
图1 24种农药标准样品的色谱图Fig.1 HPLC-MS/MS chromatogram of the 24 pesticides standards1.thiamethoxam;2.imidaclothiz;3.thiacloprid;4.bromacil;5.nicosulfuron;6.metribuzin;7.thifensulfuron-methyl;8.prometryn;9.metsulfuron-methyl;10.sulfometuron-methyl;11.triasulfuron;12.chlorsulfuron;13.amidosulfuron;14.trifloxysulfuron-sodium;15.mesosulfuron-methyl;16.bensulfuron-methyl;17.pyrazosulfuron-ethyl;18.halosulfuron-methyl;19.triflulsulfuron-methyl;20.metolachlor;21.acetochlor;22.propiconazole;23.fipronil;24.butachlor
2.1.2流动相优化由于实验采用ESI+模式,而酸性条件一般可提高[M+H]+化合物的正离子响应,因此选用酸性流动相,可以加强离子化效率,从而提高检测灵敏度[20],所以在水相中添加甲酸来增强农药的分离度。实验考察了0.1%甲酸水溶液、0.2%甲酸水溶液、0.3%甲酸水溶液分别与甲醇、乙腈为流动相时对分离效果和质谱响应的影响。结果表明,当有机相为乙腈,水相为0.1%的甲酸水溶液时,24种农药在出峰位置和峰形一致的情况下具有更大的峰面积,因此采用乙腈为有机相,0.1%的甲酸水溶液作为水相。
由于所分析的目标物种类较多,为缩短仪器的分析周期,提高仪器的分析能力,选择合适的洗脱梯度至关重要。实验中不断优化有机相与水相的配比,最终得到24种农药标准样品在100 μg/L质量浓度下的总离子流图如图1所示。
2.2 前处理方法优化
环境水体的基底复杂,且农药残留浓度一般较低,为去除基底干扰以及提高农药检测的灵敏度,需对样品进行前处理。由于固相萃取(SPE)具有回收率高、富集倍数高、萃取时间短以及有机溶剂用量少等优点,被广泛应用于样品预处理[21-23]。
2.2.1固相萃取柱的优化考察了Sep-Pak C18和Oasis HLB两种固相萃取小柱在100 μg/L加标水平下对24种农药的富集和回收效果,3组平行实验的结果如图2所示。对于大部分农药来说,两种SPE柱差别较小,但噻虫嗪、甲磺隆、氯磺隆、氟胺磺隆、丁草胺在C18柱的回收率较低,分别为19.02%、52.67%、55.75%、60.71%、44.82%;在HLB柱的回收率为82.3%~108.1%,且重现性较好。因此,本方法采用Oasis HLB作为SPE小柱。
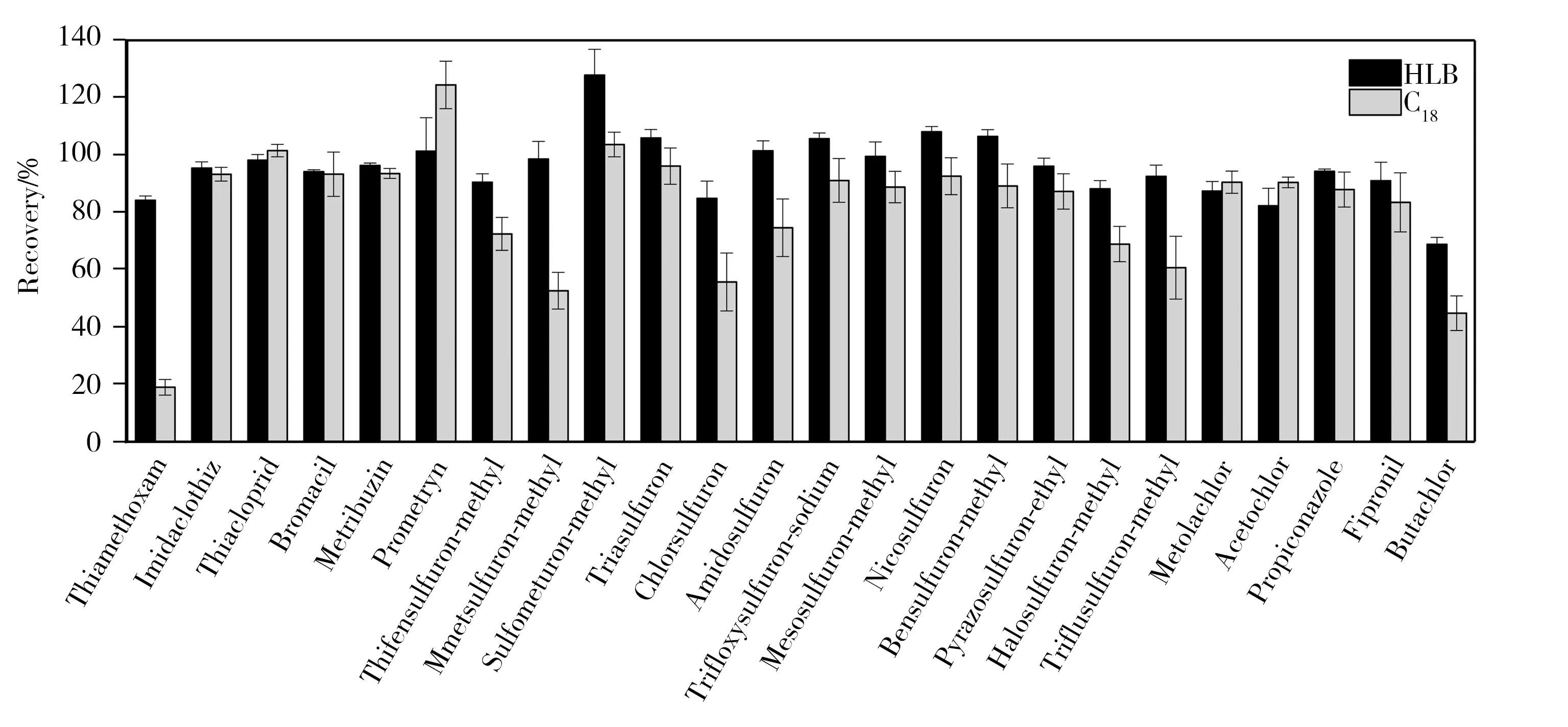
图2 不同固相萃取柱对24种农药净化效果的比较Fig.2 Comparison of the clean-up effects of different SPE cartridges for 24 target pesticides
2.2.2洗脱溶剂的优化洗脱剂的组成在SPE萃取过程中决定着分析物是否被完全洗脱,从而影响分析物的回收率[24]。实验比较了洗脱溶剂体积(6、8、10、12 mL)对回收率的影响,结果发现洗脱溶剂的体积为10 mL时,目标物的回收率最优。其次,考察了乙腈和甲醇两种洗脱溶剂在100 μg/L加标水平下对24种农药回收率的影响,进行3组平行实验。当用乙腈作为洗脱溶剂时,得到22种农药的回收率为82.3%~108.1%,甲嘧磺隆的回收率为127.8%,丁草胺的回收率为68.8%;而用甲醇作为洗脱溶剂时,异丙甲草胺、乙草胺、丁草胺和噻吩磺隆的回收率较低,分别为54.07%、47.55%、37.95%、62.75%。相对于甲醇来说,乙腈作为洗脱溶剂时3个平行实验的相对标准偏差(RSD)为0.7%~11.7%,比较稳定。因此,本方法采用乙腈作为固相萃取的洗脱溶剂。
2.2.3洗脱溶剂的优化水样的酸碱性可影响农药在水中存在的状态(离子态、分子态)、稳定性以及与固相萃取小柱填料的相互作用[25],从而影响目标物的回收率。由于本方法所选的农药大部分为弱酸性,因此选用酸性的水样环境更利于农药的富集。实验中采用盐酸将水样的pH值分别调至2.5、3.5、4.5,每组平行3次。结果发现,当上样的pH值为3.5时,24种农药的回收率普遍较优,并且3次平行实验的RSD相对稳定。因此,本方法选择将水样调至pH 3.5后上样。
2.3 标准曲线、检出限
实验中配制2、5、10、20、50、100 μg/L质量浓度的标准工作溶液,绘制标准曲线。由于扑草净和异丙甲草胺的检出限较高,氟虫腈的检出限较低,因此绘制扑草净和异丙甲草胺的标准曲线时,其浓度梯度为其他21种农药的1/2;氟虫腈为其他21种农药浓度的2倍。以各目标物色谱峰的信噪比(S/N)等于3来确定仪器的检出限(IDL),方法的检出限(MDL)换算为浓缩1 000 倍前水样中可检出的目标物质量浓度(ng/L)。24种农药的线性关系、IDL和MDL见表2。结果表明,24种农药的线性相关系数(r2)均不小于0.998,方法检出限为0.05~0.71 ng/L,该方法的线性范围好,检出限低,灵敏度高。

表2 24种农药的线性关系、仪器检出限和方法检出限Table 2 Linear relationship,IDLs and MDLs of the 24 pesticides
2.4 回收率与精密度
选取不含目标分析物的地表水样品进行精密度和加标回收率的试验。24种标准品的加标水平为5、20、100 μg/L,每组平行实验3次(n=3),计算加标回收率,结果如表3所示。24种农药的加标回收率为65.9%~127.8%,RSD为0.7%~14.2%,表明该方法的精密度和回收率符合残留分析要求。
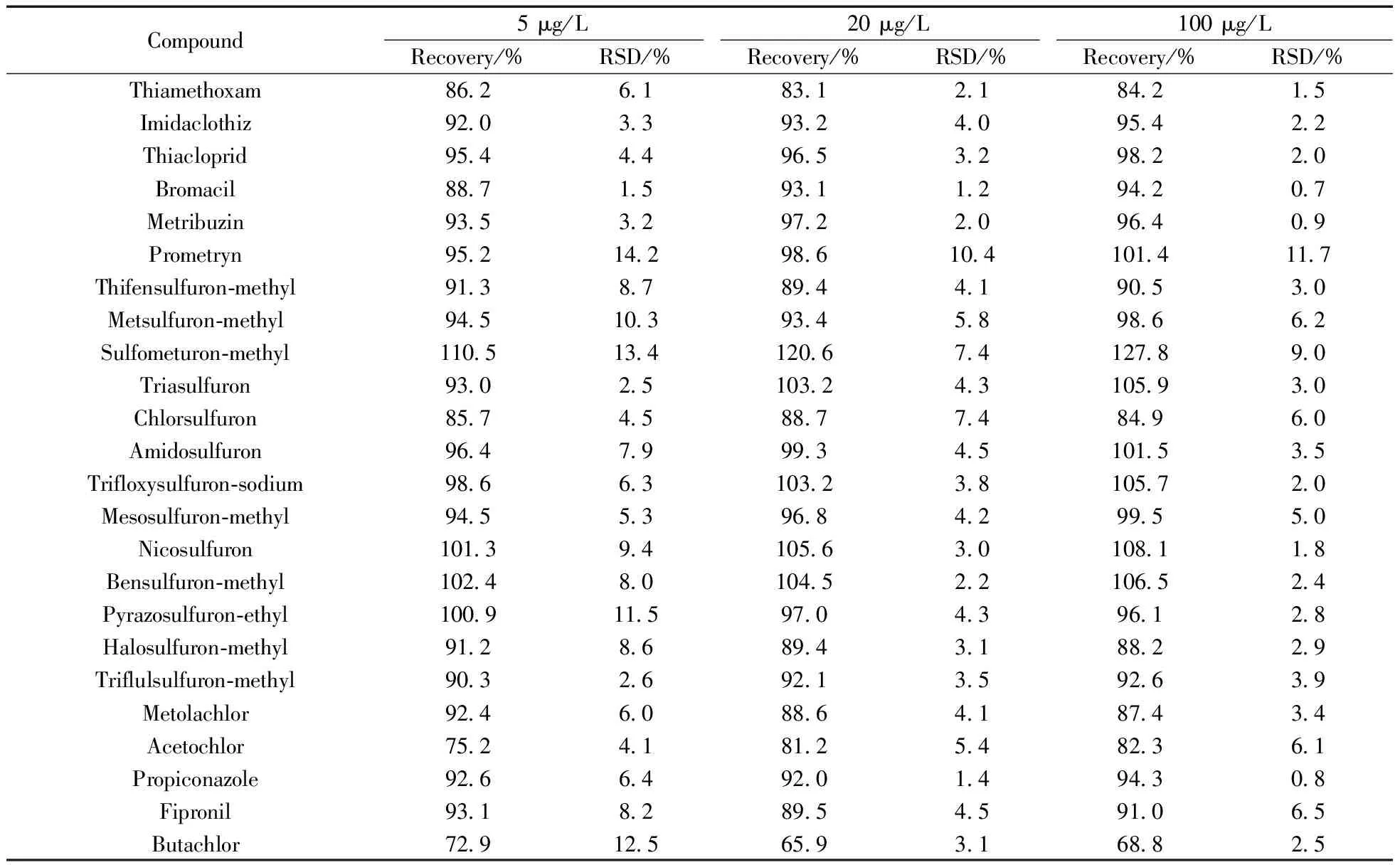
表3 水样中24种农药的加标回收率和相对标准偏差(n=3)Table 3 Spiking recoveries and relative standard deviations of the 24 pesticides in water samples(n=3)
2.5 实际样品的分析
采用所建立的方法对大连地区10个河流入海口及2个水库水样中的农药进行了分析,共检出10种农药,农药残留情况如表4所示。由表可知,水体中检出的10种农药的残留量为0.2~558.3 ng/L,氯磺隆、除草定、乙草胺的检出率低,检出浓度相对较低;氯噻啉、扑草净、异丙甲草胺的检出率高,并且检出浓度也较高。其中,S4(黄石礁)水样中扑草净的浓度最大,为558.3 ng/L。
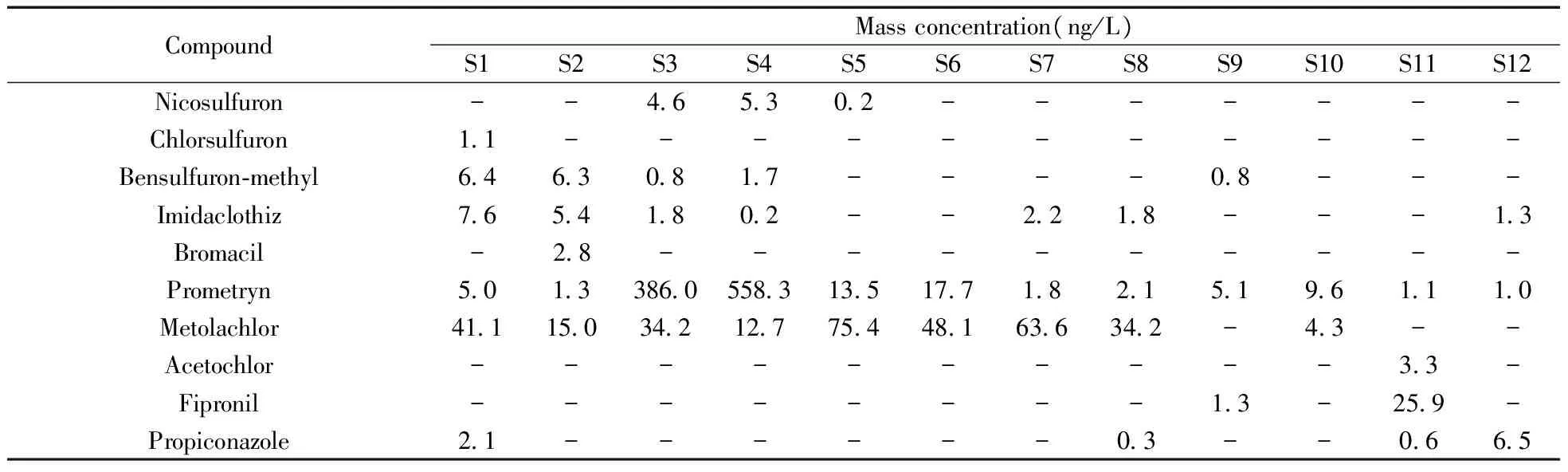
表4 12个地点水样中农药的分析结果Table 4 Analytical results of pesticides in water samples of 12 sites
-:not detected
3 结 论
本研究建立了固相萃取/高效液相色谱-串联质谱(SPE/HPLC-MS/MS)同时检测水体中常见24种农药的检测方法,该方法高效快速、准确可靠,检出限低,可满足多种农药残留的分析要求,具有很大的应用前景。
[1] Wu Z F.PesticideScienceandAdministration(吴志凤.农药科学与管理),2012,33(7):34-35.
[2] Zhang W J,Cao B W,Li S Q,Zhang Y B.WorldPesticides(张文君,曹兵伟,李少青,张一宾.世界农药),2016,38(6):8-14.
[3] Song W,Lin S S,Sun G D,Chen M,Yuan D X.Chin.J.Chromatogr.(宋伟,林珊珊,孙广大,陈猛,袁东星.色谱),2012,30(3):318-26.
[4] Liu X L,Li X S,Liu S W,Zhou L,Pan C P.Chin.J.Anal.Chem.(刘晓亮,李雪生,刘绍文,周利,潘灿平.分析化学),2013,41(4):553-558.
[5] Ye Q,Lu D H,Deng Y C,Huang J X,Luo C.ChineseJournalofPesticideScience(叶倩,路大海,邓义才,黄健祥,骆冲.农药学学报),2016,18(2):268-272.
[6] Li J Z,Chu X G,Cai H X,An J,Yang Q.Chin.J.Chromatogr.(李建中,储晓刚,蔡会霞,安娟,杨强.色谱),2006,24(6):585-588.
[7] Hou R Y,Hu J F,Qian X S,Su T,Wang X H,Zhao X X.FoodAdditives&ContaminantsPartA,2013,30(10):1761.
[8] Ye G B,Zhang W,Cui X,Pan C P,Jiang S R.Chin.J.Anal.Chem.(叶贵标,张微,崔昕,潘灿平,江树人.分析化学),2006,34(9):1207-1212.
[9] Bao S P,Zhang X Q,Wu Z P,Gu A G,Wang L,Hong H,Zhu L L.Agrochemicals(包素萍,张晓强,武中平,顾爱国,王莉,洪华,朱利利.农药),2014,(4):257-259.
[10] Wang D L,Jian Q,Zheng Z T,Song W C,Sun X,Zhu H,Yang B B.J.Instrum.Anal.(王冬兰,简秋,郑尊涛,宋稳成,孙星,朱宏,杨邦保.分析测试学报),2016,35(3):351-354.
[11] Sánchez-Hernández L,Higes M,Martín M T,Nozal M J,Bernal J L.FoodAdditives&ContaminantsPartA,2016,33(3):442-451.
[12] Wang F,Li T,Ma C.Chin.J.Chromatogr.(王菲,李彤,马辰.色谱),2013,31(3):191-199.
[13] Wang D,Hou C J,Zhao E C,Jia C H.J.Instrum.Anal.(王东,侯传金,赵尔成,贾春虹.分析测试学报),2015,34(6):681-685.
[14] Qiao C K,Huang Y N,Luo J,Wang C,Fang J B,Xie H Z.Agrochemicals(乔成奎,黄玉南,罗静,王超,方金豹,谢汉忠.农药),2015,(5):340-342.
[15] Ma L,Huang L Q,Chen J B,Yin J,Zhan X P,Zhao L.J.Instrum.Anal.(马琳,黄兰淇,陈建波,尹君,占绣萍,赵莉.分析测试学报),2016,35(6):698-703.
[16] Su Y Z,Li F,Qi X,Shi X L,Wang Z B.J.Anal.Sci.(粟有志,李芳,齐鑫,史秀丽,王振宝.分析科学学报),2015,31(2):203-207.
[17] Liu Y J,Hou Z G,Liang S,Fang N,Zhao X F,Wang X H,Lu Z B.Agrochemicals(刘亚娟,侯志广,梁爽,方楠,赵晓峰,王鑫宏,逯忠斌.农药),2017,(3):193-196.
[18] Jiang Y,Wang Y,Wei H,Yong L,Hu B,Zhu L.Chin.J.HealthLab.Technol.(江阳,王艳,魏红,雍莉,胡彬,朱岚.中国卫生检验杂志),2016,(2):184-188.
[19] Yan F L,Ma J P,Tan P G,Lu X,Jiang L H.J.Instrum.Anal.(闫凤丽,马继平,谭培功,卢曦,姜莲华.分析测试学报),2013,32(11):1328-1332.
[20] Wu J,Zhu F,Ji W L,Li F,Ruan L P,Liu H L.FoodSaf.Qual.DetectionTechnol.(吴健,朱峰,吉文亮,李放,阮丽萍,刘华良.食品安全质量检测学报),2015,(12):4966-4974.
[21] Yang Q H,Cheng X Y,Yang P,Qian S,Dan D Z.Chin.J.Anal.Chem.(杨秋红,程小艳,杨坪,钱蜀,但德忠.分析化学),2011,39(8):1208-1212.
[22] Liu J L,Zhang C,Wang X J,Wang T,Li Y.Chem.J.Chin.Univ.(刘建林,张琛,王夏娇,王婷,李鱼.高等学校化学学报),2012,33(1):37-43.
[23] Jiang J,Li P W,Xie L H,Ding X X,Li Y,Wang X P,Wang X F,Zhang Q,Guan D.Chin.J.Anal.Chem.(姜俊,李培武,谢立华,丁小霞,李英,王秀嫔,汪雪芳,张奇,管笛.分析化学),2011,39(1):72-76.
[24] Zhao X L,Wang C Z,Li L F,He J X.ModernFoodScience&Technology(赵晓磊,王成忠,李龙飞,何金兴.现代食品科技),2014,(2):264-268.
[25] Du J,Zhao H X,Chen J W.Chin.J.Chromatogr.(杜鹃,赵洪霞,陈景文.色谱),2015,33(4):348-353.
Simultaneous Determination of 24 Pesticide Residues in Environmental Water Using Solid-phase Extraction and High Performance Liquid Chromatography-Tandem Mass Spectrometry
HE Xin*,MA Yang-fan,ZHAO Hong-xia,NIE Xiao-jing
(Key Laboratory of Industrial Ecology and Environmental Engineering of Ministry of Education,College of Environment,Dalian University of Technology,Dalian 116024,China)
A method of solid-phase extraction(SPE) and high performance liquid chromatography-tandem mass spectrometry(SPE/HPLC-MS/MS) was developed for the simultaneous determination of 24 pesticides in water.The samples were extracted with acetonitrile,then enriched and purified with solid-phase extraction cartridges.Acetonitrile and 0.1%(by volume) formic acid aqueous solution were used as mobile phases.Target pesticides were analyzed by HPLC-MS/MS in positive electrospray ionization(ESI+) under multiple reaction monitoring(MRM) mode.Results showed that 24 pesticides were separated in 25 min with excellent linear relationships(r2≥0.998).The recoveries at spiked levels of 5,20,100 μg/L in water samples ranged from 65.9%-127.8% with relative standard deviations(RSDs) of 0.7%-14.2%.The limits of detection were in the range of 0.05-0.71 ng/L.This method was applied in the detection of the water samples from 10 estuaries and 2 reservoirs in Dalian,and 10 pesticides were detected in the concentration range of 0.2-558.3 ng/L.The proposed SPE/HPLC-MS/MS method is efficient and sensitive,and is suitable for the determination of various pesticides in actual water samples.
solid-phase extraction(SPE);high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);pesticides;water detection
2017-07-19;
2017-08-30
中央高校基本科研业务费(DUT15LAB04)
*
何 欣,博士,工程师,研究方向:环境分析化学,E-mail:hexin@dlut.edu.cn
10.3969/j.issn.1004-4957.2017.12.012
O657.63;O657.7
A
1004-4957(2017)12-1487-07
