Hg对锦州湾表层沉积物异养细菌代谢酶活性的影响研究
2017-12-27徐庆彤刘瑞志郭小雅刘庆庆郝晨林
徐庆彤, 刘瑞志, 郭小雅, 李 捷, 雷 坤, 刘庆庆, 郝晨林
Hg对锦州湾表层沉积物异养细菌代谢酶活性的影响研究
徐庆彤1, 2, 刘瑞志2, 郭小雅3, 李 捷1, 雷 坤2, 刘庆庆2, 郝晨林2
(1. 青岛理工大学 环境与市政工程学院, 山东 青岛 266033; 2. 中国环境科学研究院 环境基准与风险评估国家重点实验室, 北京 100012; 3. 山东省胶东调水局, 山东 青岛 266033)
为了解重金属Hg对锦州湾海域表层沉积物中异养细菌的主要代谢酶的影响, 采用Hakanson潜在生态危害指数法对锦州湾表层沉积物中重金属Hg开展潜在生态风险评价, 利用平板扩散法测定了9个站位沉积物中异养细菌四种水解酶活性。结果显示: 锦州湾海域表层沉积物中重金属污染严重, Hg的含量和潜在生态危害河口最为严重, 向外逐步递减, 表明本海域表层沉积物中的Hg主要由陆源输入; 表层沉积物中异养细菌水解酶活性与抗性异养菌比例均表现为西南部河口区高于东北部外海海域, 与重金属Hg的含量分布及Hakanson潜在生态危害指数基本相似, 这表明长期高浓度的重金属污染, 改变了锦州湾海域表层沉积物中的异养菌的生理代谢过程, 在生理或遗传物质上对重金属产生了一定的抗性; 磷酸酶、蛋白酶、脂肪酶与沉积物中Hg的含量具有显著正相关性, 说明其对重金属Hg较为敏感, 在一定程度上可作为反映锦州湾海域沉积物中重金属Hg污染状况的生物学指标。
重金属; 潜在生态危害; 异养细菌; 水解酶; 平板扩散法; 抗性
微生物是生态系统中有机物最重要的分解者和初始利用者, 在整个生态系统物质循环和迁移转化过程中发挥重要作用[1-3]。在海洋环境中, 微生物生产的水解酶类具有非常重要的作用, 它能够将海水中的大分子的高聚物和颗粒态的有机物分解为可溶性有机物, 便于过细胞膜进入生物体内, 为生物所利用[4]。高浓度重金属等胁迫下, 会改变微生物菌群的结构和代谢过程, 影响环境中微生物的生物多样性结构和菌群代谢功能[5]; 同时微生物代谢酶类的变化也能够反映环境受重金属污染的水平。近年来, 重金属污染对近岸海域微生物多样性和代谢功能的影响已日益受到关注[4, 6]。
锦州湾位于渤海西北, 辽东湾北, 葫芦岛市东, 锦州市西南, 是一个三面环陆, 一面临海的半封闭海湾[7]。随着工农业的发展、人口的增长, 排入锦州湾内的污水不仅有周边市县的生活污水, 还有葫芦岛锌厂等众多企业排放的工业废水通过连山河、五里河和茨山河等由锦州湾西南部汇合后汇入锦州湾, 这些污水中含有大量的重金属、有机物、磷酸盐、石油等, 严重影响了周边海域的水环境质量状况[8]。此外, 近几年锦州湾海域的围填海造成了湾内纳潮量的减少、水动力减弱, 降低了海湾的自净能力, 加剧了水环境的污染[9]。为了研究重金属对锦州湾海域表层沉积物中异养细菌分布及代谢酶类的影响, 本实验将锦州湾海域表层沉积物中分离、纯化、鉴定得到的116株(17属)菌株在一定浓度的重金属Hg胁迫下, 通过平板扩散法测定了淀粉酶、蛋白酶、磷酸酶和脂肪酶四种水解酶的活性, 揭示重金属污染胁迫下微生物代谢功能的调整规律, 从微生物代谢功能变化角度解析重金属污染效应。
1 材料与方法
1.1 研究区域
本研究于2012年8月在连山河、五里河和茨山河汇合口的入海口外的海域放射状布点, 抓斗式采泥器采集沉积物样品, 将表层(0~5cm)沉积物, 一部分装入灭菌管中, 另取一部分装入聚乙烯密封袋中, 驱尽空气密闭, 均置于–20℃条件下保存, 采样点位分布见图1。

图1 锦州湾海域表层沉积物采样站位分布图
1.2 实验方法
1.2.1 表层沉积物重金属测定方法
将沉积物样品于真空冷冻干燥机中冷冻干燥, 去除杂质, 研磨, 过100目筛, 充分混匀, 储存备用[10]。称取0.500 g样品于小烧杯中, 加入30 mL 王水, 盖上表面皿, 放在电热板上加热2 h, 保持王水处于微沸状态, 冷却, 定容至100 mL, 以0.7% KBH4为还原剂, 利用液相色谱-原子荧光光度计联用仪对其测定[11]。
1.2.2 Hakanson潜在生态危害指数法
本文用Hakanson潜在生态危害指数法对锦州湾海域表层沉积物中的重金属Hg进行评价[12], 其计算方法如下:
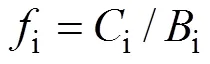
式中,i为重金属i的污染系数;i为表层沉积物中重金属的实测含量;i为重金属i的评价参比值, 本文选取国内学者测定的锦州湾沉积物重金属背景值0.25 mg/kg做参比[7];i为单个重金属i的潜在生态危害指数;i为重金属i的毒性相应系数, 反映了重金属在水相、沉积相和生物相之间的相应关系, 本试验评价的重金属Hg的毒性相应系数为40[13]。

表1 单一重金属潜在生态危害指数对应的危害程度分级标准
1.2.3 平板扩散法测定水解酶活性
1.2.3.1 菌悬液的制备
将从沉积物样品中经分离、纯化、鉴定[15-16]共得到的116株(17个属)异养细菌, 分别接种于牛肉膏蛋白胨液体培养基中, 于28℃、200 r/min摇床中培养24 h获得种子培养液; 吸取2 mL种子培养液接种到60 mL新的液体培养基中, 同样条件下培养24 h得到所需菌悬液。
1.2.3.2 试验培养基的制备[15]
在牛肉膏蛋白胨基础培养基中分别添加不同的底物制成试验培养基。淀粉酶: 可溶性淀粉(10g/L); 磷酸酶: 1%的磷酸酚酞溶液(每100 mL培养基添加0.1mL); 蛋白酶: 等体积的脱脂牛奶(105℃, 10 min灭菌); 脂肪酶: 三丁酸甘油酯(每100 mL培养基添加1 mL)。
准确称取HgCl2(分析纯)5.430 0g, 用无菌去离子水定容后, 再用0.22 μm的膜过滤, 配成浓度为200 mmol/L的重金属标准溶液, 作为储备液。将灭菌(121℃, 30 min)后的上述四种水解试验培养基冷却至40~50℃, 加入一定量的重金属储备液, 摇匀, 使其最终浓度为1 mmol/L。
用打孔器将滤纸片制成6 mm的小圆片, 灭菌后, 蘸取适量的上述菌悬液贴到各水解试验培养基表面, 设置三个平行样, 恒温培养箱35℃倒置培养2 d后, 测量产生的透明圈直径, 取平均值[17]。
2 结果与讨论
2.1 锦州湾表层沉积物中重金属Hg的含量及其潜在生态风险分布
锦州湾海域表层沉积物重金属Hg在J9站位含量最低为0.179 mg/kg, 属于第一类沉积物质量标准(≤0.20 mg/kg), J7和J8站位属于第三类沉积物质量标准(≤1.00 mg/kg), 其余6个站位均属于劣三类(>1.00 mg/kg), J1站位重金属Hg的含量最高, 其值为13.034 mg/kg, 平均含量为4.337 mg/kg, 超出第三类沉积物质量标准, 标准偏差为3.89。锦州湾海域表层沉积物中重金属Hg的含量分布有一定的差异(图2)。重金属Hg的含量空间分布趋势由锦州湾西南部河流入海口向东北部外海海域逐渐降低, 这表明, 锦州湾海域表层沉积物中重金属Hg主要由陆源输入[18]。
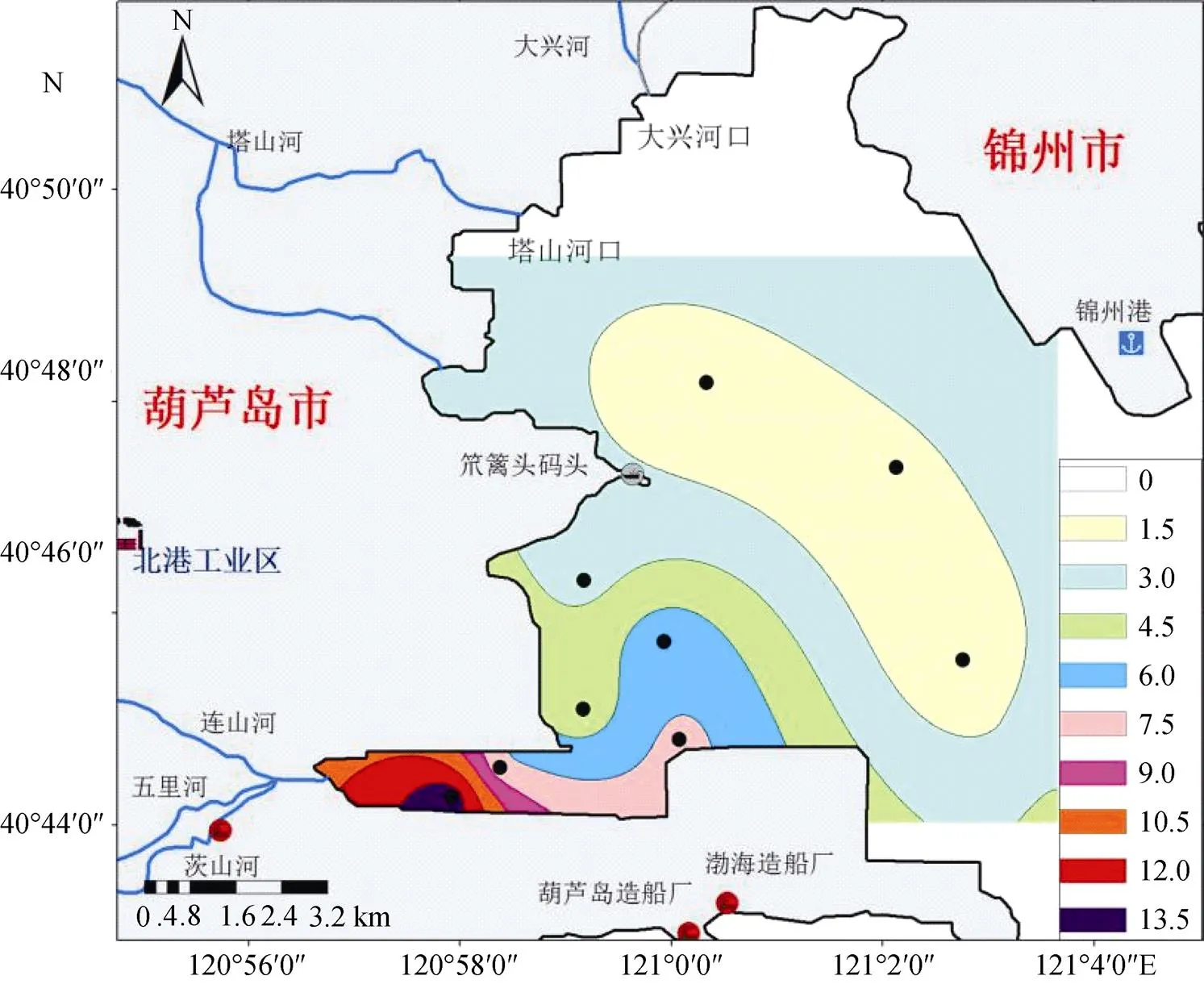
图2 锦州湾海域表层沉积物中重金属Hg的含量 (mg/kg)
将锦州湾研究海域表层沉积物中的重金属Hg含量平均值与国内其他典型海湾进行比较(表2), 研究发现, 本海域重金属Hg的含量明显高于其他海湾, 表明锦州湾研究海域表层沉积物中的重金属平均含量在国内海湾中处于相对较高的水平, 锦州湾表层沉积物中的重金属污染相对严重。
重金属Hg的潜在生态危害指数评价结果如表3所示, 研究区域i在27.72~2085.39之间, 最小值在J9站位, 最大值在J1站位。重金属Hg在整个研究海域的潜在生态危害分布具有明显的差异, 在西南部近岸海域潜在生态危害极强, 东北部海域危害较弱, 东部与外海相连的区域危害最弱。

表2 锦州湾表层沉积物中重金属Hg平均含量与国内其他海湾比较
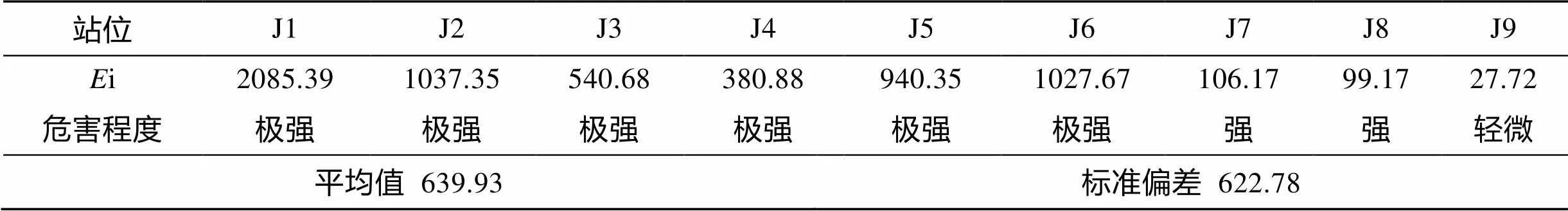
表3 锦州湾海域表层沉积物中重金属Hg的潜在生态危害指数评价结果
综上所述, 锦州湾海域表层沉积物中, 重金属Hg具含量较高, 且Hg的毒性水平也很高, 具有极强的潜在生态危害风险。在J1站位, Hg的含量最多, 超过了第三类沉积物质量标准,i值最大, 危害程度为极强。这主要是由于该站位于锦州湾西南部五里河、连山河和茨山河三条河流入海口处, 附近有一个葫芦岛锌厂以及北港工业区的许多企业, 其排放的工业废水含有大量的重金属, 此外, 该处入海口较窄长, 湾内的潮流运动较弱, 重金属较多的沉降在入海口内[13]。
2.2 重金属Hg胁迫下异养细菌水解酶活性大小分布
本文研究了重金属Hg胁迫下锦州湾海域表层沉积物中的异养菌水解酶活性, 包括淀粉酶、磷酸酶、蛋白酶和脂肪酶, 见表4和图3。

表4 锦州湾海域表层沉积物中异养细菌水解酶产生的透明圈直径
淀粉酶可直接参与海洋C循环, 在海洋有机物污染防治中具有重要作用[24], 研究海域各站位表层沉积物中异养细菌淀粉酶水解产生的透明圈直径由西南部河口向东部外海海域先增大后减小; 磷酸酶能够裂解有机磷化合物, 在农药污染以及富营养化防治中具有重要作用[25], 透明圈直径差别较小, 西南部河口区略高于东北部外海海域; 蛋白酶是一种优良的酶制剂, 在海洋有机物污染以及船舶防污领域具有重要的作用[26], 透明圈直径差别较小, 西南部河口区高于东北部外海海域; 脂肪酶是一类具有多种催化能力的酶, 在海洋石油污染方面具有重要作用[27], 透明圈直径具有明显差异, 西南部河口区明显高于东北部外海海域。
海洋微生物能够利用代谢酶类将溶解态和颗粒态有机物降解成小于600 Da的小分子物质, 这对海洋环境的可持续发展非常关键[28-29]。因此, 了解重金属胁迫下微生物水解酶活性的强弱对环境中大分子有机物的分解以及海洋生态系统的能量流动和物质循环均具有重要意义。总体上, 重金属Hg胁迫下, 锦州湾海域表层沉积物中异养细菌水解酶活性表现为西南部河口区高于东北部外海海域, 与重金属Hg的含量分布趋势基本相似。锦州湾海域西南部河口区重金属Hg的含量低, 在本实验中高浓度重金属Hg胁迫下, 重金属离子与异养细菌酶分子必需基团巯基进行不可逆结合, 从而抑制了水解酶的活性[30]; 西南部河口区重金属Hg含量高, 长期高浓度重金属暴露下, 有些微生物通过改变生理代谢等过程对重金属产生不同程度的抗逆性能, 与其抗性有关的水解酶会表现出一定的活性并得到积累[31], 因此本研究中, 高浓度重金属Hg胁迫下, 西南部河口区异养菌水解酶表现出较高的活性。
2.3 重金属Hg胁迫下抗性异养菌比例分布
锦州湾海域表层沉积物中抗性异养菌所占比例如图4所示。水解酶作用下, 重金属含量最高的J1站位, 有50%左右的异养菌对重金属Hg产生抗性, 而在重金属含量低的J7站位, 抗性异养菌的数量所占的比例仅为20%左右, 西南部河口区各站位抗性异养菌所占的比例明显高于东北部外海海域各站位, 与重金属Hg的含量分布趋势相似。产生本结果的原因为: 本研究中异养细菌在高浓度重金属Hg试验培养基中培养时间为2d, Hg对异养细菌产生短期的“触杀”效应[32], 而锦州湾海域表层沉积物中的重金属污染是长期积累的, 部分微生物通过自身生理代谢功能的应性改变, 进而适应不利外部条件, 对重金属产生不同程度的抗逆性能, 从而能够在本研究高浓度重金属环境下存活下来。

图3 锦州湾海域表层沉积物中抗性微生物4种水解酶透明圈直径大小(cm)

图4 锦州湾海域表层沉积物抗性异养细菌比例分布
有关研究表明, 微生物群落通常用于揭示重金属长期污染的结果, 微生物对重金属的抗性与环境中重金属的含量有直接关系[33, 34]。长期重金属污染环境中, 微生物自身会发展一系列的抗性机制以减小外界环境对机体的伤害[35], 研究分离菌株与重金属抗性的关系对环境污染状况的治理具有重要的意义。
2.4 异养细菌水解酶活性与沉积物中Hg含量之间的相关关系
用SPSS19对重金属Hg胁迫下异养细菌水解酶活性与表层沉积物中Hg含量之间的相关性进行分析, 结果如表5所示。

表5 异养细菌水解酶活性与重金属Hg含量之间的相关关系
注: “**”表示=0.01时显著相关
重金属胁迫下, 磷酸酶、蛋白酶、脂肪酶活性与表层沉积物中Hg含量之间具有极显著正相关性, 相关系数分别为0.878、0.814、0.871(<0.01), 而淀粉酶与重金属Hg含量之间不存在相关性。这表明磷酸酶、蛋白酶、脂肪酶对重金属Hg较为敏感, 在一定程度上可作为反映锦州湾海域重金属Hg污染状况的生物学指标。
3 结论
(1) 锦州湾海域表层沉积物中重金属Hg的含量以及潜在生态危害具有明显的空间分布特征, 呈现从河口向外海方向递减的趋势, 最高值出现在锦州湾西南部五里河、连山河和茨山河入海口处, 最低值出现在锦州湾东部与外海相连接处。与国内其他海湾相比, Hg的平均含量处于相对较高水平, 潜在生态危害极强。
(2) 锦州湾海域表层沉积物中异养细菌水解酶活性表现为西南部河口区高于东北部外海海域, 与重金属Hg的含量分布及Hakanson潜在生态危害指数趋势基本相似。西南部河口区重金属污染严重, 长期高浓度的重金属污染, 改变了锦州湾海域表层沉积物中的异养菌的生理代谢过程, 一些对重金属敏感的菌株会逐渐产生适应性, 水解酶活性的增加是异养细菌在逆境下的适应表现之一。磷酸酶、蛋白酶、脂肪酶与沉积物中Hg含量之间存在极显著正相关性, 对沉积物中的重金属更为敏感, 可作为反映重金属污染状况的灵敏性指标, 进而反映锦州湾海域表层沉积物的环境质量。
(3) 锦州湾海域表层沉积物中抗性异养菌的数量西南部河口区明显高于东北部外海海域, 这种趋势表明锦州湾海域异养细菌的重金属抗性与沉积物中重金属的长期积累有一定的关系。东北部海域重金属含量低, 异养细菌对重金属的抗性低, 本研究中高浓度重金属含量对该海域的异养细菌产生了短期的“触杀”效应, 而西南部河口区沉积物中的重金属污染是长期积累的, 在该区域存活的异养细菌在生理或遗传物质上必定对重金属产生一定的抗性。
[1] Kosolapov D B, Kuschk P, Vainshtein M B, et al. Microbial processes of heavy metal removal from carbon-deficient effluents in constructed wetlands[J]. Engineering in Life Sciences, 2004, 4: 403-411.
[2] Alqarawi A A, Abdallahb E F, Hashem A. Alleviation of salt-induced adverse impact via mycorrhizal fungi in Ephedra aphylla Forssk[J].Journal of Plant Interactions, 2014, 9 (1): 802-810.
[3] Jay S S. Microbes: The chief ecological engineers in reinstating equilibrium in degraded ecosystems[J]. Agr Ecosyst Environ, 2015, 203: 80-82.
[4] Bong C W, Malfatti F, Azam F, et al. The effect of zinc exposure on the bacteria abundance and proteolytic activity in seawater[C]// Hamamura N, Suzuki S, Mendo S, et al. Interdisciplinary Studies on Environmental Chemistry Biological Responses to Contaminants. Terrapub, 2010: 57-63.
[5] Silver S, Phung L T. A bacterial view of the periodic table: genes and proteins for toxic inorganic ions[J]. Journal of Industrial Microbiology & Biotechnology, 2005, 32, 587-605.
[6] Wu H, Ding Z H, Liu Y, et al. Methylmercury and sulfate-reducing bacteria in mangrove sediments from Jiulong River Estuary, China[J]. Journal of Environmental Sciences, 2011, 23(1): 14-21.
[7] 张玉凤, 王立军, 霍传林, 等. 锦州湾表层沉积物重金属污染状况评价[J]. 海洋环境科学, 2008, 27(2): 178-181.Zhang Yufeng, Wang Lijun, Huo Chuanlin, et al. Assessment on heavy metals pollution in surface sediments in Jinzhou Bay[J]. Marine Environmental Science, 2008, 27(2): 178-181.
[8] Chapman P M. Sediment quality assessment: status and outlook[J]. Aquatic Ecological Health, 1995, (4): 183-194.
[9] 王伟伟, 殷学博, 吴英超, 等. 海岸带开发活动对锦州湾环境影响分析[J]. 海洋科学, 2010, 34(9): 94-96.Wang Weiwei, Yin Xuebo, Wu Yingchao, et al. The environmental impact analysis of coastal exploitations in Jinzhou Bay[J]. Marine Sciences, 2010, 34(9): 94-96.
[10] 赵明明, 王传远, 孙志高, 等. 黄河尾闾及近岸沉积物中重金属的含量分布及生态风险评价[J]. 海洋科学, 2016, 40(1): 68-75. Zhao Mingming, Wang Chuanyuan, SunZhigao, et al. Concentration, distribution, and ecological risk assessment of heavy metals in sediments from the tail reaches of the Yellow River Estuary[J]. Marine Sciences, 2016, 40(1): 68-75.
[11] 王庚, 彭婧, 史红星. 电感耦合等离子体质谱同时测定沉积物中12种重金属元素[J]. 环境化学, 2011, 30(11): 1944-1948. Wang Geng, Peng Jing, Shi Hongxing, et al. Simultaneous determination of twelve heavy metals in sediment by ICP-MS[J]. Environmental Chemistry, 2011, 30(11): 1944-1948.
[12] 缪雄谊, 叶思源, 郝玉培, 等. 黄河三角洲表层土壤重金属环境质量评价[J]. 海洋科学, 2016, 40(2): 65-76. Miao Xiongyi, Ye Siyuan, Hao Yupei, et al. Assessment of heavy metal contamination in the surface soil of the Yellow River Delta, China[J]. Marine Sciences, 2016, 40(2): 65-76.
[13] 李艺红, 王宏, 刘瑞志, 等. 锦州湾表层沉积物重金属潜在生态风险评价[J]. 沈阳理工大学学报, 2013, 32(5): 17-22. Li Yihong, Wang Hong, Liu Ruizhi, et al. Potential ecological risk evaluation of heavy metals in the surface sediments of Jinzhou Bay[J]. Journal of Shenyang Ligong University, 2013, 32(5): 17-22.
[14] 李爱华, 岳思君, 马海滨. 真菌孢子三种计数方法相关性的探讨[J]. 微生物学杂志, 2006, 26(2): 107-110. Li Aihua, Yue Sijun, Ma Haibin. Correlativity of three counting methods of fungal spore[J]. Journal of Microbiology, 2006, 26(2): 107-110.
[15] 朱旭芬. 现代微生物学实验技术[M]. 杭州: 浙江大学出版社, 2011. Zhu Xufen. Modern experimental technique of microbiology[M]. Hangzhou: Zhejiang University Press, 2011.
[16] 张丽红, 刘艳芳, 胡青平. 中国南海一株固氮类芽孢杆菌的筛选和分离鉴定[J]. 海洋科学, 2015, 39(3): 100-105. Zhang Lihong, Liu Yanfang, Hu Qingping. Isolation and identification of a Paenibacillus sp. Producing nitrogenase activity from South China Sea[J]. Marine Sciences, 2015, 39(3): 100-105.
[17] Jiya J, Rajesh G, Abdulaziz A, et al. Heavy metal pollution exerts reduction/adaptation in the diversity and enzyme expression profile of heterotrophic bacteria in Cochin estuary, India[J]. Environmental Pollution, 2011, 159: 2775-2780.
[18] Balachandran K K, Laluraj C M, Martin G D, et al. Environmental analysis of heavy metal deposition in a flow-restricted tropical estuary and its adjacent shelf[J]. Environ Forensics, 2006, 7: 345-351.
[19] 张现荣, 张勇, 叶青, 等. 辽东湾北部海域沉积物重金属环境质量和污染演化[J]. 海洋地质与第四纪地质, 2012, 32(2): 21-29. Zhang Xianrong, Zhang Yong, Ye Qing, et al. Environment quality of Liaodong Bay and pollution evolution of heavy metals[J]. Marine Geology & Quaternary Geology, 2012, 32(2): 21-29.
[20] 秦延文, 苏一兵, 郑炳辉, 等.渤海湾表层沉积物重金属与污染评价[J]. 海洋科学, 2007, 31(12): 28-33. Qin Yanwen, Su Yibing, Zheng Binghui, et al. Heavy metals and pollution assessment in surface sediments of Bohai Bay[J]. Marine Sciences, 2007, 31(12): 28-33.
[21] 胡宁静, 石学法, 刘季花, 等. 莱州湾表层沉积物中重金属分布特征和环境影响[J]. 海洋科学进展, 2011, 29(1): 63-72. Hu Ningjing, Shi Xuefa, Liu Jihua, et al. Distributions and impacts of heavy metals in the surface sediments of the Laizhou Bay[J]. Advances in Marine Science, 2011, 29(1): 63-72.
[22] 张珂, 王朝晖, 冯杰, 等.胶州湾表层沉积物重金属分布特征及污染评价[J]. 分析测试学报, 2011, 30(12): 1406-1411. Zhang Ke, Wang Zhaohui, Feng Jie, et al. Distribution and pollution assessment of heavy metals in surface sediments of Jioazhou Bay[J]. Journal of Instrumental Analysis, 2011, 30(12): 1406-1411.
[23] 柴小平, 胡宝兰, 魏娜, 等. 杭州湾及邻近海域表层沉积物重金属的分布、来源及评价[J]. 环境科学学报, 2015, 35(12): 3906-3916. Chai Xiaoping, Hu Baolan, Wei Na, et al. Distribution, sources and assessment of heavy metals in surface sediments of the Hangzhou Bay and its adjacent areas[J]. Acta Scientias Circumstantiae, 2015, 35(12): 3906-3916.
[24] 杨文静, 王在贵, 刘朝良, 等. 家蚕肠道产淀粉酶细菌的分离鉴定及其酶基因的克隆与表达[J]. 激光生物学报, 2011, 20(2): 219-229. Yang Wenjing, Wang Zaigui, Liu Chaoliang, et al. Isolation and identification of the Amylase-producing bacteria in silkworm intestine and cloning and expression of their amylase genes[J]. Acta Laser Biology Sinica, 2011, 20(2): 219-229.
[25] 庄百川. 一株产碱性磷酸酶菌株的分离鉴定及发酵条件研究[D]. 杭州: 浙江大学, 2006: 1-44. Zhuang Baichuan. Studies on isolation and identification of an alkaline phosphates-producing bacterium and its fermentation conditions[D]. Hangzhou: Zhe Jiang University, 2006: 1-44.
[26] 张晓. 海洋产蛋白酶菌的分离、培养及其防污活性研究[D]. 青岛: 中国海洋大学, 2013: 1-68. Zhang Xiao. Isolation, culture and antifouling activity test of marine bacteria which can produce protease[D]. Qingdao: Ocean University of China, 2013: 1-68.
[27] 邬敏辰, 孙崇荣, 邬显章. 平板扩散法粗略确定碱性脂肪酶的活性[J]. 无锡轻工大学学报, 2000, 19(2): 168-172. Wu Minchen, Sun Chongrong, Wu Xianzhang. Diffusion plate assay for quick and rough estimation of Alkaline lipase activity[J]. Journal of Wuxi University of Light Industry, 2000, 19(2): 168-172.
[28] Hoostal M J, Gabriela B M, Bouzat J L. Local adaptation of microbial communities to heavy metal stress in polluted sediments of lake Erie[J]. FEMS Microbiology and Ecology, 2008, 65: 156-158.
[29] Yamada N, Suzumura M. Effects of seawater acidification on hydrolytic enzymes[J]. Journal of Oceanography, 2010, 66: 233-241.
[30] 李志超. 甲基汞对大鼠脑内巯基酶活性的影响[J]. 环境卫生学杂志, 1983, (1): 50-51. Li Zhichao. Effects of methylmercury on activities of thiol enzymes in rat brain[J]. Journal of Environmental Hygiene, 1983, (1): 50-51.
[31] Souza M D, Nair S, Lokabharathi P A, et al. Metal and antibiotic-resistance in psychrotrophic bacteria from Antarctic marine waters[J]. Ecotoxicology, 2006, 15: 379-384.
[32] Pennanen T, Frostegard A, Fritze H, et al. Phospholipid fatty acid composition and heavy metal tolerance of soil microbial communities along two heavy metal-polluted gradients in coniferous forests[J]. Applied and Environmental Microbiology, 1996, 62: 420-428.
[33] 宋超, 郑春丽, 王建英. 微生物硫酸盐的同化途径及其与重金属抗性的关系[J]. 安徽农业科学, 2012, 40(11): 6368-6370. Song Chao, Zheng Chunli, Wang Jianying. Microorganism sulfate assimilation pathway and its pelationship with heavy metal resistance[J]. Journal of Anhui Agricultural Sciences, 2012, 40(11): 6368-6370.
[34] 王建坤. 铅锌污染对土壤微生物多样性的影响[D]. 四川: 四川农业大学, 2009. Wang Jiankun. The effects of Zinc-lead pollution on the diversity of soil microorganisms[D]. Sichuan: Sichuan Agricultural University, 2009.
[35] Diazravina M, Baath E, Frostegare A. Multiple heavy metal tolerance of soil bacterial communities and its measurement by a thymidine incorporation technique[J]. Applied and Environmental Microbiology, 1994, 60 (7): 2238-2247.
(本文编辑: 康亦兼)
Research on effects of Hg on the metabolic enzymes of heterotrophic bacteria in surface sediments of Jinzhou Bay
XU Qing-tong1, 2, LIU Rui-zhi2, GUO Xiao-ya3, LI Jie1, LEI Kun2, LIU Qing-qing2, HAO Chen-lin2
(1. School of Environmental and Municipal Engineering, Qingdao University of technology, Qingdao 266033, China; 2. State Key Laboratory of Environmental Criteria and Risk Assessment (SKLECRA), CRAES, Chinese Research Academy of Environmental Sciences, Beijing 100012, China; 3. Shandong Province Jiaodong Water Transfer Bureau, Qingdao 266033, China)
To understand the effects of Hg on the major metabolic enzymes of heterotrophic bacteriain the surface sediments of Jinzhou Bay, in this study, we conducted field investigations and collected surface sediment samples from Jinzhou Bay in August 2012. We evaluated the potential ecological risk of Hg using the Hakanson method and performed diffusion plate assays to measure the activity of four kinds of metabolic enzymes of heterotrophic bacteria. The results showed that the content and potential ecological risk of Hg were highest and most serious in the estuary and this situation gradually weakened from the estuary to the ocean, which indicated that most Hg in the surface sediments of Jinzhou Bay originated from land sources. The metabolic enzyme activity of heterotrophic bacteria and the ratio of resistant heterotrophic bacteria were both higher in the southwest coastal waters than in the northeast offshore waters, which were also similar to the distribution of the heavy metal Hg content and the Hakanson potential ecological risk. This indicates that the metabolism of heterotrophic bacteria changed under long-term high concentrations of heavy metals pollution and produced a certain physiological resistance to heavy metals. The contents of phosphatase, protease, and lipase showed a significant positive correlation with the content of the heavy metal Hg, respectively, which indicates that they can be used as sensitivity indexes to reflect heavy metal Hg pollution in the surface sediments of Jinzhou Bay.
heavy metal; potential ecological risk; heterotrophic bacteria; metabolic enzyme; diffusion plate assay; resistance
[National Science and Technology Basic Work, No.2013FY111100- 005; Special Fund for Marine Public Welfare Industry Research, No.201505001; Natural Science Foundation of Shandong Province, No. ZR2013DM003; Special Fund for Environmental Public Welfare Industry Research, No.201409100]
Sep. 30, 2016
X172
A
1000-3096(2017)08-0108-08
10.11759/hykx20160930001
2016-09-30;
2016-12-08
科技基础工作专项(2013FY111100-005); 海洋公益性行业科研专项项目(201505001); 山东省自然科学基金项目(ZR2013DM003); 环保公益性行业科研专项(201409100)
徐庆彤(1991-), 男, 山东潍坊人, 硕士研究生, 主要研究方向为环境微生物, E-mail: Andyxqt@163.com; 刘瑞志(1980-), 通信作者, 博士, 副研究员, 主要从事环境微生物与海洋污染防治研究, E-mail: liuruizhi@craes.org.cn; 李捷(1972-),通信作者, 博士, 教授, 主要研究方向为环境生态学, E-mail: jli2001@sina.cn
