不同级别的非增生性糖尿病视网膜病变和黄斑水肿患者的脉络膜厚度变化
2017-12-27
不同级别的非增生性糖尿病视网膜病变和黄斑水肿患者的脉络膜厚度变化
胡云龙贾万程刘刚张淑萍
目的观察国际临床分级下的不同级别非增生性糖尿病视网膜病变(NPDR)和黄斑水肿患者的黄斑中心凹下脉络膜厚度(SFCT)的变化。方法横断面观察研究。利用相干光断层扫描仪的增强深度成像功能对89例(138只眼)糖尿病患者进行扫描。根据国际分级标准将其分为无明显糖尿病视网膜病变(DR)、轻度NPDR、中度NPDR、重度NPDR 4组,并将NPDR眼分为伴糖尿病性黄斑水肿(DME)和不伴糖尿病性黄斑水肿两组,测量出各组患者的SFCT,并与健康人对照组的SFCT值进作对比。结果无明显DR、轻度NPDR、中度NPDR、重度NPDR 4组平均SFCT分别为(265.80±66.15)μm、(304.23±70.29)μm、(295.32±84.32)μm、(249.91±72.38)μm;无明显DR眼的SFCT较正常人无显著差异,轻度NPDR眼的SFCT较无明显DR眼显著增厚,中度NPDR眼较轻度NPDR眼无显著差异,重度NPDR眼的SFCT较中度NPDR眼显著变薄,伴DME眼较不伴DME眼显著变薄。结论伴随着DR的发生和加重,SFCT先增厚,然后变薄,伴DME眼比不伴DME眼更薄。
相干光断层扫描;脉络膜厚度;糖尿病视网膜病变
糖尿病视网膜病变(diabetic retinopathy,DR)的主要特征是微动脉瘤的形成,毛细血管无灌注或低灌注,视网膜的局部缺血,最终导致新生血管形成和/或黄斑水肿。脉络膜血管来自眼动脉分支睫状后短动脉,血流量占据眼球血供的85%[1,2],主要营养脉络膜、视网膜外5层及筛板前视神经,特别是黄斑中心凹,完全由脉络膜血管营养。因此其血管系统的正常结构与功能对于视网膜显得尤为重要。脉络膜厚度在血管病变,血流灌注异常时可发生改变, 因此测量黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)能直观反映视网膜组织代谢及功能情况,其厚度可能与DR病变程度和类型相关。近来,增强深度相干光断层扫描(enhanced depth imaging- optical coherence tomography,EDI-OCT)的发展让人们可以直接观察测量脉络膜的结构,与吲哚菁绿血管造影、多普勒血流仪或B型超声相比,具有无需造影剂,可重复性好,成像精确直观等特点[3]。现今脉络膜厚度在DR中的变化尚未明确,国内研究尚少,我们应用该技术观察测量了一组糖尿病患者的脉络膜厚度,并进行了讨论。现报告结果如下。
资料与方法
一、一般资料
2016年6~10月在上海市奉贤区两个社区筛查的糖尿病患者中随机选取89例(138只眼)纳入研究,作为观察对象。其中,男性36例(58只眼),女性53例(80只眼);年龄范围42~79岁,平均年龄(61.98±7.02)岁,平均屈光度(0.40±0.93)D。根据DR和黄斑水肿严重程度的国际临床分级标准(2002年)[4],将研究对象眼分为无明显DR、轻度非增生性糖尿病视网膜病变(non-proliferative DR,NPDR)、中度NPDR、重度NPDR 4组,并将NPDR眼根据有无黄斑水肿分为伴糖尿病性黄斑水肿(diabetic macular edema,DME)和不伴DME两组。轻、中、重NPDR眼3组分别伴有DME 2只眼、6只眼、15只眼。各组主要临床资料见表1。同时选取于我院体检的相同年龄段的健康正常人40例(40只眼)作为对照组,其中男性20例(20只眼),女性20例(20只眼);年龄范围50~79岁,平均年龄( 61.20±8.02)岁,平均屈光度(0.09±1.66)D。
二、检查项目
采用电脑验光仪RM-8000(Topcon公司)测量每位受检者的屈光状态。所有受检者在散瞳状态下接受直接检眼镜和裂隙灯显微镜配90 D前置镜的眼底检查。使用DRS眼底相机分别以视乳头、黄斑中心凹、黄斑中心凹颞侧1.0~1.5个视乳头直径为中心拍摄3张照片,拍摄范围45°~55°,协助诊断分级并保存资料。
OCT检测:使用Speetralis HRA+OCT(Heidelberg公司)以长度为8.8 mm的扫描线穿过黄斑中心凹区分别进行水平和垂直方向扫描,并利用系统自带软件分别测量两个方位的视网膜色素上皮层外界和巩膜层内界之间的垂直距离,取其平均值作为最终结果,以增加可靠性。所有检查及测量均由同一位有经验的医师操作。
三、纳入和排除标准
观察组纳入排除标准:患者均为社区登记的2型糖尿病,符合医学伦理学要求,均知情同意。排除以下:(1)增生性糖尿病视网膜病变;(2)既往接受过DR相关治疗的患者,包括眼后段手术、玻璃体腔药物注射、视网膜激光光凝;(3)有其它眼底病变如黄斑前膜、玻璃体视网膜牵拉、年龄相关性黄斑变性(玻璃膜疣>20 μm或融合玻璃膜疣)等;(4)高度近视或远视;(5)固视不良、屈光间质混浊影响眼底照相和OCT扫描成像。对照组纳入排除标准:40例体检者知情同意参加本研究,包括左眼20例,右眼20例。排除以下:(1)高血压、糖尿病等全身疾病史;(2)眼部疾病和手术外伤史;(3)矫正视力≤0.8;(4)屈光度数≥±2.00 D;(5)检眼镜或OCT检查有异常者。
四、统计学方法
利用SPSS20.0软件对性别比和眼别比进行卡方检验,对各组屈光度和年龄进行单因素方差分析,对各组SFCT数据进行独立样本t检验,P<0.05表示差异有统计学意义,具有显著性。
结 果
一、一般资料比较
所有组别的年龄(F=1.87)、屈光(F=1.44)、性别比(χ2=6.86)、眼别比(χ2=0.88)差异无统计学意义(P>0.05)。见表1。
二、受试者眼部一般情况。见图1。
三、黄斑中心凹下脉络膜厚度比较
NPDR眼总体SFCT与健康人对照组比较,稍微升高,但差异无统计学意义(t=1.10,P>0.05)。无明显DR组SFCT与健康人对照组比较,稍微降低,但差异无统计学意义(t=-0.18,P>0.05)。轻度NPDR组SFCT与无明显DR组比较,明显升高,差异有统计学意义(t=2.41,P<0.05)。中度NPDR组SFCT与轻度NPDR组比较,稍微降低,但差异无统计学意义(t=-0.47,P>0.05)。重度NPDR组SFCT与中度NPDR组比较,明显降低,差异有统计学意义(t=-2.27,P<0.05)。统计轻、中、重3组NPDR眼分别伴有DME 2只眼、6只眼、15只眼。不伴DME组、伴DME组的SFCT分别为(215.55±23.90)μm、(334.59±127.15)μm。不伴DME组SFCT与无明显DR组比较,明显升高,差异有统计学意义(t=2.29,P<0.05),伴DME组SFCT与不伴DME组比较,明显降低,差异有统计学意义(t=-2.66,P<0.01)。见表2。

表1 各组主要临床资料统计

图1~5 由上至下依次为无明显DR组、轻度NPDR组、中度NPDR组、重度NPDR组和伴DME组的EDI-OCT图像和以黄斑为中心的眼底像
讨 论
脉络膜由大量的血管和黑色素细胞构成,形成向视网膜逐渐分化的小叶结构,内向外可分为玻璃膜、脉络膜毛细血管网层、脉络膜中血管层、脉络膜大血管层和脉络膜上腔5层[5],脉络膜血管参与多种眼部及全身疾病的病理改变[6]。目前,常用的检测脉络膜方法有吲哚菁绿血管造影、激光多普勒血流仪和B型超声3种。但3种技术都无法显示脉络膜的剖面结构。近年来频域OCT 的轴扫描速度极大增加,特别是增强深度成像功能出现后, 扫描深度进一步增加,能突破脉络膜外层限制,达到浅层巩膜。利用自带软件测量,精确度可达1 μm,为观察脉络膜血管结构以及定量测量脉络膜厚度提供新的手段。
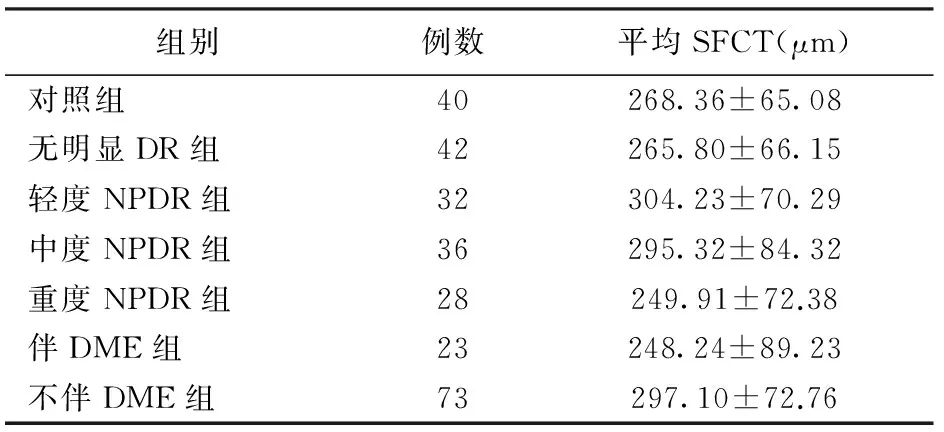
表2 各组患者平均SFCT值统计
本研究中使用EDI-OCT测量了不同国际临床分级的NPDR患者的SFCT值并进行比较,同时与正常人对照比较。结果发现糖尿病患者较正常人的脉络膜厚度无显著差异,这与Vujosevic等[7]研究结果相同,说明此时尚无脉络膜血管的病变,当发展为轻度NPDR后显著增厚,但病情进一步加重为中度NPDR时,脉络膜厚度稍下降,但无统计学差异。当发展为重度NPDR时,脉络膜厚度显著下降,较正常人稍薄,但差异已无显著性。同时在伴黄斑水肿的患者中,脉络膜厚度也较无黄斑水肿患者明显下降。这可能是由于DR早期,脉络膜血管结构破坏,通透性增加,液体渗漏导致脉络膜水肿增厚,但随着病程的变长,病情的加重,脉络膜血管损害加重,导致脉络膜组织严重破坏,缺血缺氧,最终致使血管组织坏死,脉络膜主要由血管构成,因而厚度变薄,同时脉络膜对黄斑区提供氧气和营养的能力减弱,刺激内皮细胞释放血管内皮生长因子,血管渗透性增强,导致黄斑水肿的出现。在本研究中,轻、中、重3组NPDR眼分别含伴有DME 2只眼、6只眼、15只眼,提示黄斑水肿眼随病情加重而增多,而这一过程伴随着脉络膜的变薄。McLeod等[8]在病理层面上发现了DR中脉络膜血管存在萎缩现象,Adhi等[9]发现PDR和DME患者的脉络膜血管层变薄。与本研究结果相符。Regatieri等[10]研究发现NPDR患者和正常人脉络膜厚度值无显著差异。与本研究结果相符。而本次研究对NPDR患者进行了更细致的分级,发现脉络膜在DR病变初期增厚,并随着病情加重而变薄,在重度NPDR期已经显著变薄。
本次研究健康人对照组的SFCT与国内曾婧等[11]的研究基本一致。本次研究的所有患者的SFCT观测与统计均由同一名医师操作,以减少偏倚。运用系统软件手工测量脉络膜厚度的方法可重复性良好[12,13]。两个切面测量取均值,减小了选择性误差,提高了准确性。所有组别的年龄、屈光度、性别比、眼别比差异均无统计学意义,同时排除了PDR患者、既往接受过DR治疗的患者、有其它眼底病变的患者、高度屈光不正患者、固视不良、屈光间质混浊影响眼底照相和OCT扫描成像患者,尽可能避免了其他影响因素。本研究存在一定局限性,如样本量较小、仅测量了黄斑中心凹下的脉络膜厚度等,并不能完全代表脉络膜组织血管的变化。同时观察人群和OCT检查设备的不同,结果间也存在一定的差异性,可能对研究结果产生影响。完善研究尚需要更先进的软硬件对不同位置的脉络膜厚度及体积进行测量分析。
综上所述,EDI-OCT 能精确测量和显示糖尿病患者脉络膜厚度和细微结构,帮助了解DR的病理改变,以指导医生诊断和治疗疾病。然而现今研究多为小样本且结果多有矛盾,显示脉络膜形态功能在DR发展中的作用机制较复杂,仍需要更先进的技术进行更大样本的探究。另外,影响脉络膜厚度的其他因素(如眼轴、糖化血红蛋白等)在糖尿病组和健康对照组中的相关性也需要加入考虑。
[1] Yu DY,Cringle SJ. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Prog Retin Eye Res,2001,20:175-208.
[2] Aim A,Anders B. Ocular and optic nerve blood flow at normal and increased intraocular pressures in monkeys. Exp Eye Res,1973,15:15.
[3] Margolis R,Spaide RF.A pilot study ofeEnhanced depth imaging optical coherence tomography of the choroid in normal eyes.Am J Ophthalmol,2009,147:811-815.
[4] Wilkinson CP,IiiFLF,Klein RE,et al. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales.Ophthalmology, 2003,110:1677-1682.
[5] Hogan MJ,Alvarado JA, Weddell JE. Histology of the Human Eye. Saunders Company,Philadelphia,1971:387.
[6] Spaide RF,Koizumi H,Pozzoni MC .Enhanced depth imaging spectral-domain optical coherence tomography.Am J Ophthalmol,2008,146:496-500.
[7] Vujosevic S, Martini F, Cavarzeran F,et al. Macular and peripapillary choroidalthickness in diabetic patients. Retina, 2012,32 :1781-1790.
[8] Mcleod DS,Lutty GA.High-resolution histologic analysis of the human choroidal vasculature.Invest Ophthalmol Vis Sci,1994,35:3799-3811.
[9] Adhi M, Brewer E, Waheed NK,et al. Analysis of morphological features and vascular layers of choroid in diabetic retinopathy using spectral-domain optical coherence tomography.JAMA Ophthalmol, 2013,131:1267-1274.
[10] Regatieri CV, Branchini L, Carmody J,et al. Choroidal thickness in patients with diabetic retinopathy analyzed by spectral- domain optical coherence tomography. Retina,2012,32: 563-568.
[11] 曾婧, 丁小燕, 李加青,等. 中国人黄斑区脉络膜厚度值及其影响因素分析. 中华眼底病杂志,2011, 27:450-453.
[12] Chhablani J,Barteselli G,Wang H,et a1.Repeatability and reproducibilitv of manual choroidal volume measurements using enhanced depth imaging optical coherence tomography.Invest Ophthalmol Vis Sci,2012,53:2274-2280.
[13] Rahman W,Chen FK,Yeoh J,et al.Repeatability of manual subfoveal ehoroidal thickness measurements in healthy subjects using the technique of enhanced depth imaging optical coherence tomography.Invest Ophthalmol Vis Sci,2011,52:2267-2271.
Choroidalthicknesschangesinnon-proliferativediabeticretinopathyandmacularedemaofdifferentgrades
HuYunlong.
MedicalCollege,NantongUniversity,Nantong,Jiangsu226001;JiaWancheng,LiuGang,ZhangShupin.ShanghaiJiaotongUniversity,ShanghaiSixthPeople'sHospitalSouthBranch,Shanghai201400,China
ObjectiveTo observe the changes of subfoveal choroidal thickness (SFCT) in patients with non-proliferative diabetic retinopathy (NPDR) and macular edema of different clinical grades.Methodscross-sectional observation study. A total of 138 eyes of 89 diabetics were scanned with enhanced depth imaging optical coherence tomography(EDI-OCT). No obvious diabetic retinopathy(DR), mild non-proliferative DR(NPDR), moderate NPDR and severe NPDR were divided to form4 groups. NPDR eyes were further divided into two subgroups: eyes with diabetic macular edema (DME) and eyes without DME. Measurement with SFCT was compared to that in healthy control subjects.ResultsIn patients with no obvious DR, mild NPDR, moderate NPDR and severe NPDR, SFCT were (265.80±66.15)μm,(304.23±70.29)μm,(295.32±84.32)μm,(249.91±72.38)μm respectively.There was no significant difference between the no significant DR eyes and the normal eyes. SFCT was significantly larger in mild NPDR eyes than in no significant DR eyes. There was no significant difference between moderate NPDR eyes and mild NPDR eyes.Severe NPDR eyes were significantly thinner than moderate NPDR eyes. Eyes with DME had significantly thinner SFCT than eyes without DME.ConclusionsWith the occurrence and exacerbation of diabetic retinopathy, SFCT thickened at the beginning and then thinned. SFCT was thicker in eyes with DME than in those without.
Optical coherence tomography; Choroidal thickness; Diabetic retinopathy
[JClinOphthalmol,2017,25:397]
10.3969/j.issn.1006-8422.2017.05.005
226001 南通大学医学院(胡云龙);上海交通大学附属第六人民医院南院眼科(贾万程、刘刚、张淑萍)
贾万程(Email:wchengjia109@163.com)
[临床眼科杂志,2017,25:397]
(收稿:2017-02-16)
