新型骨软骨支架辅助Mosaicplasty技术和携带增强基因的ADSCs对大面积骨软骨缺损的修复效果*
2017-12-27
(贵州省遵义市第一人民医院 骨科,贵州 遵义 563003)
新型骨软骨支架辅助Mosaicplasty技术和携带增强基因的ADSCs对大面积骨软骨缺损的修复效果*
阮世强,邓江,徐林,黄文良,田仁元
(贵州省遵义市第一人民医院 骨科,贵州 遵义 563003)
目的考察新型骨软骨支架辅助Mosaicplasty技术和携带增强基因的脂肪间充质干细胞(ADSCs)对大面积骨软骨缺损修复效果。方法复制比格犬软骨全层缺损模型,使用多枚骨软骨支架以Mosaicplasty术填充大部分缺损后,不用内固定,作为E组;于骨软骨支架内及残留间隙处缓慢由深至浅注入骨形态发生蛋白2(BMP-2)-ADSCs复合体作为D组;植入丝素蛋白(SF)/壳聚糖(CS)/纳米羟基磷灰石(nHA)支架作为C组;植入SF/CS/nHA支架和BMP-2-ADSCs复合体作为B组;植入SF/CS/nHA支架与BMP-2-ADSCs联合富血小板血浆(PRP)凝胶复合体作为A组。分别于术后4、8及16周各组随机取2、2和4只比格犬在轻度麻醉状态下,进行组织外观观察,处死16周的比格犬,检测病变软骨部位的胶原蛋白Ⅰ和Ⅱ,体外检测病变软骨的极限应力、应变值和相应弹性模量值。结果与E组比,A~D组的软骨缺损表面平整,软骨愈合较好,与B~D组比较,A组恢复最好。膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ表达、标本中心相应弹性模量值、标本交界极限应力和应变值差异有统计学意义(P<0.05),E组最低,A组最高。结论植入SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体对于大面积软骨缺损修复效果较好,值得临床推广。
仿生支架;镶嵌移植术;骨软骨缺损;富血小板血浆;组织工程
随着社会的老龄化加快,各种难以避免的关节损伤逐渐增多,关节内损伤引起的软骨损伤或缺损。成人软骨几乎不能够依赖自身修复,特别是较大面积的骨软骨缺损,从而造成骨性关节炎发生,甚至导致关节功能障碍的严重后果,给患者及社会造成很大的负担。因此,如何实现大面积骨软骨修复成为临床面临的巨大挑战。利用组织工程修复骨软骨缺损已取得重大进展,但至今没有一种与骨软骨更为匹配的作为“金标准”的支架系统,尤其是对于大面积的软骨缺损。因此,构建一种优良的种植体是目前急需解决的难题。目前支架材料的研究已经取得了较大成果,但国内外尚未研制出一种界内公认的理想的骨软骨支架材料,特别是对大面积骨软骨缺损,主要存在的问题是材料的安全性、生物力学性能、可降解性、组织相容性以及降解产物对细胞的影响还需进一步的研究加以明确。大量的研究表明,丝素蛋白(silk fibroin,SF)、壳聚糖(chitosan,CS)和纳米羟基磷灰石(nano hydroxyapatite,nHA)无毒无味,具有良好的生物学特性和理化性质。SF是从蚕丝中提取的天然生物材料,可应用于人工韧带、软骨、骨或神经组织等方面[1]。但SF降解较慢、干燥时易碎裂[2]。CS是天然的高分子聚合物,结构与软骨基质糖氨多糖相似,降解产物为氨基葡萄糖单体,目前已被广泛应用于生物医学领域[3],但CS韧性差,降解速度慢。nHA与天然骨中的无机成分相似,被认为是骨缺损修复的理想材料[4],但简单合成的nHA材料成型后强度低、孔隙度小[5],引入到复合材料中可使材料在力学和生物学方面具有很大的应用潜力[6]。因此,或许可将2种及2种以上材料共混制备复合支架材料可以弥补各自的不足,利用各种材料的互补特性来满足组织工程对支架的要求[7]。然而,至今仍旧没有一种可以作为“金标准”的支架材料,因此找到一种更加适合作为骨组织支架的材料是骨组织工程研究中急需解决的难点之一。
本课题组在前期研究单一孔径的SF/CS和SF/CS/nHA支架中取得较好的实验结果。然而单一孔径支架依旧无法满足骨与软骨的渐进式结构,尤其是对大面积的软骨缺损。本课题组利用离心与冷冻干燥相结合的方法,在成功制备梯度孔径的骨软骨SF/CS/nHA支架的基础上,拟结合骨软骨镶嵌移植术将支架植入大面积骨软骨缺损,再将携带目的基因骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)的脂肪间充质干细胞(adipose-derived stem cells,ADSCs)与可注射型富血小板血浆(platelet-rich plasma,PRP)凝胶混合后注入支架和支架周围间隙,进一步解决残留的骨软骨柱间隙的整合问题,以期实现重建大面积骨软骨缺损的修复,同时探明支架材料的降解、生长因子控释以及支架在体内骨软骨的形成机制,为制备与骨软骨重建更匹配、更接近生理代谢特征的种植体提供实验依据。
1 材料与方法
1.1 主要材料和设备
1.1.1 主要设备S-3400N型扫描电镜(日本日立集团),7560型电子显微镜(日本日立集团),FACS Calibur型流式细胞仪(美国B-D公司),VLP200型真空干燥机(美国Savant公司),RF-5301PC型荧光分光光度计(日本岛津公司),TE2000-S型荧光倒置显微镜(日本尼康公司),Ⅱ/03型倒置显微镜(德国Leica公司),超净工作台(丹麦Heto Holten公司),Forma 3141型二氧化碳CO2培养箱(美国Forma Scientific公司),-80℃W-86L728J型超低温冰箱(海尔集团),-150℃MDF-1155ATN型超低温冰箱(日本三洋电机),GDS8000型全自动数码成像与分析系统(美国Gen Genius Syngene),UHQc型超纯水制备系统(英国莱特莱德公司),Sanyo-MSE型超声细胞破碎仪(日本三洋电机),LC50RX型液氮罐(美国ICI公司)。
1.1.2 实验对象及分组选用健康成年比格犬40只(购自北京市兴隆试验动物养殖中心,合格证号:SCXK(京)2006-0001),雌雄各半。随机分为 A、B、C、D、E 5组,每组8只。A组:植入SF/CS/nHA双相支架与BMP-2-ADSCs联合PRP凝胶复合体;B组:植入SF/CS/nHA双相支架和BMP-2-ADSCs复合体;C组:植入SF/CS/nHA双相支架;D组:注入BMP-2-ADSCs复合体;E组:空白对照组。
1.2 离心-冷冻干燥法制备梯度孔径SF/CS/nHA骨软骨支架
SF脱胶、溶解及提纯得2%的SF溶液,将2%SF溶液、2%CS溶液和nHA适当比例混合,倒入准备好的铸模槽内,于-20℃条件下5000r/min离心15min,放入-80℃中冷冻3 h,采用冷冻干燥72 h制成固体材料,支架扫描电镜检测显示平均孔径为85.67 μm,孔隙率为(91.25±2.35)%,吸水膨胀率(135.65±4.56)%。力学检测显示压缩强度为(2.0±0.2)MPa。将制备成功的固体材料乙醇灭菌消毒,PBS缓冲液冲洗,放置4℃冰箱备用。
1.3 含BMP-2基因重组腺相关病毒(rAAV)的构建
通过基因重组技术构建腺相关病毒rAAV-BMP-2-EGFP,逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)进行鉴定;重组腺相关病毒(recombinant adeno-associated virus,rAAV)反复感染获得高滴度重组腺相关病毒;氯化铯密度梯度离心法纯化重组腺相关病毒,测定滴度置入-150℃冰箱冷冻保存。
1.4 PRP凝胶制备
以氯胺酮15 mg/kg和地西泮1 mg/kg,于比格犬耳后3~5 cm处肌内注射(简称肌注),基础麻醉,固定四肢后碘伏消毒皮肤,使用头皮针采集静脉血30 ml。采用二次离心法提取PRP,加入凝血酶及10%氯化钙注射液制备成PRP凝胶。
1.5 比格犬细胞分离、扩增及病毒转染,构建复合凝胶
比格犬麻醉后备皮、消毒、铺巾,切取颈背部皮下脂肪组织约20 g,充分剪碎,离心后接种于预置DMEM培养基(含10%FBS)的100 mm培养皿中,于37℃、5%CO2饱和湿度下行原代培养,每天于倒置相差显微镜下观察细胞形态及增殖情况。台盼蓝试验检测细胞活力。经体外培养即可获得约第2、3代的ADSCs。ADSCs培养扩增3代后,将携带BMP-2的ADSCs以5×106个/ml密度的悬浊液2 ml与PRP凝胶进行混合,即得。
1.6 梯度孔径SF/CS/nHA支架体外培养
ADSCs培养扩增3代后与SF/CS/nHA支架体外培养,将携带BMP-2的ADSCs与PRP凝胶混合后,注入SF/CS/nHA支架体外培养,即得。
1.7 复制骨软骨全层缺损模型及各组处理
比格犬肌注速眠新0.1 ml/kg麻醉,取膝关节正中切口,显露股骨滑车及股骨髁。用特制10 mm直径空心钻钻取深5 mm的骨软骨缺损,填塞止血。使用多枚骨软骨支架以Mosaicplasty术填充大部分缺损后,不用内固定,作为E组;于骨软骨支架内及残留间隙处缓慢由深至浅注入BMP-2-ADSCs复合体作为D组;植入SF/CS/nHA支架作为C组;植入SF/CS/nHA支架和BMP-2-ADSCs复合体作为B组;植入SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体作为A组,所有组别均植入或注入至关节面,冲洗关节腔后,逐层关闭切口。
1.8 指标检测
1.8.1 大体观察分别于术后4、8及16周各组随机取2、2和4只比格犬在轻度麻醉状态下,取标本进行相关指标检测,并处死动物。
1.8.2 PCR检测病变软骨的胶原蛋白Ⅰ和胶原蛋白Ⅱ取16周比格犬病变软骨部位约20 mg组织杨平,用组织剪将其充分剪碎,置于匀浆机中,加入1 ml Trizol试剂,用匀浆机打匀,加入氯仿300 μl,离心,吸取上清液,加入等体积异丙醇,离心,去上清,加入75%乙醇,离心,去上清液,挥发剩余乙醇,用20 μl Nuclease free water溶解。按RT-PCR试剂盒说明书逆转录合成cDNA,以磷酸甘油醛脱氢酶GAPDH为内对照,通过RT-PCR对比分析胶原蛋白Ⅰ和胶原蛋白Ⅱ。胶原蛋白Ⅰ、胶原蛋白Ⅱ和GAPDH的上下游引物序列及退火温度(见表1)。PCR 反应体系:上下引物各 0.1 μmol,dNPT 1 μl,25 mmol/L MgCl23 μl,Taq DNA 聚合酶 3 μl,cDNA模板 3 μl,10 μl PCR 缓冲液 5 μl,总反应体系为50 μl。PCR反应参数:预变性94℃2 min后,进入PCR扩增循环,变性94℃ 30 s,退火52℃ 1 min,延伸70℃ 2 min,40个循环后,70℃再延伸7 min,经凝胶图像分析仪进行分析,计算与GAPDH条带的灰度比值,进行目的基因表达的定量分析。

表1 胶原蛋白Ⅰ、胶原蛋白Ⅱ和GAPDH引物序列
1.8.3 力学测试取16周的比格犬软骨标本,采用AG1000A型电子式万能力学试验仪(日本岛津)检测各组标本极限应力、应变值和相应弹性模量值。试验前将所有标本置于4℃的Ringer液中1 h,试验过程用Ringer液滴注保持湿润。
1.9 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 标本组织学观察
E组:4、8周时缺损底部大量纤维细胞团增生,未完全修复,16周软骨缺损局部表面凹陷明显,缺损仍遗留,与周围正常软骨界限清楚;D~B组:4、8周时支架开始降解,8周可见散在软骨细胞样细胞生成,16周可见软骨缺损内充填以白色纤维样组织,软骨表面略不平整,偶见中心部分凹陷,间隙明显缩小。A组:4、8周时可见明显软骨样细胞生成,形成软骨,16周,软骨缺损处色泽与正常软骨相似,软骨表面平整,与周围正常软骨连接紧密、界限消失,硬度较正常软骨无差异修复组织与周围软骨愈合较好,无明显间隙存在。见图1。
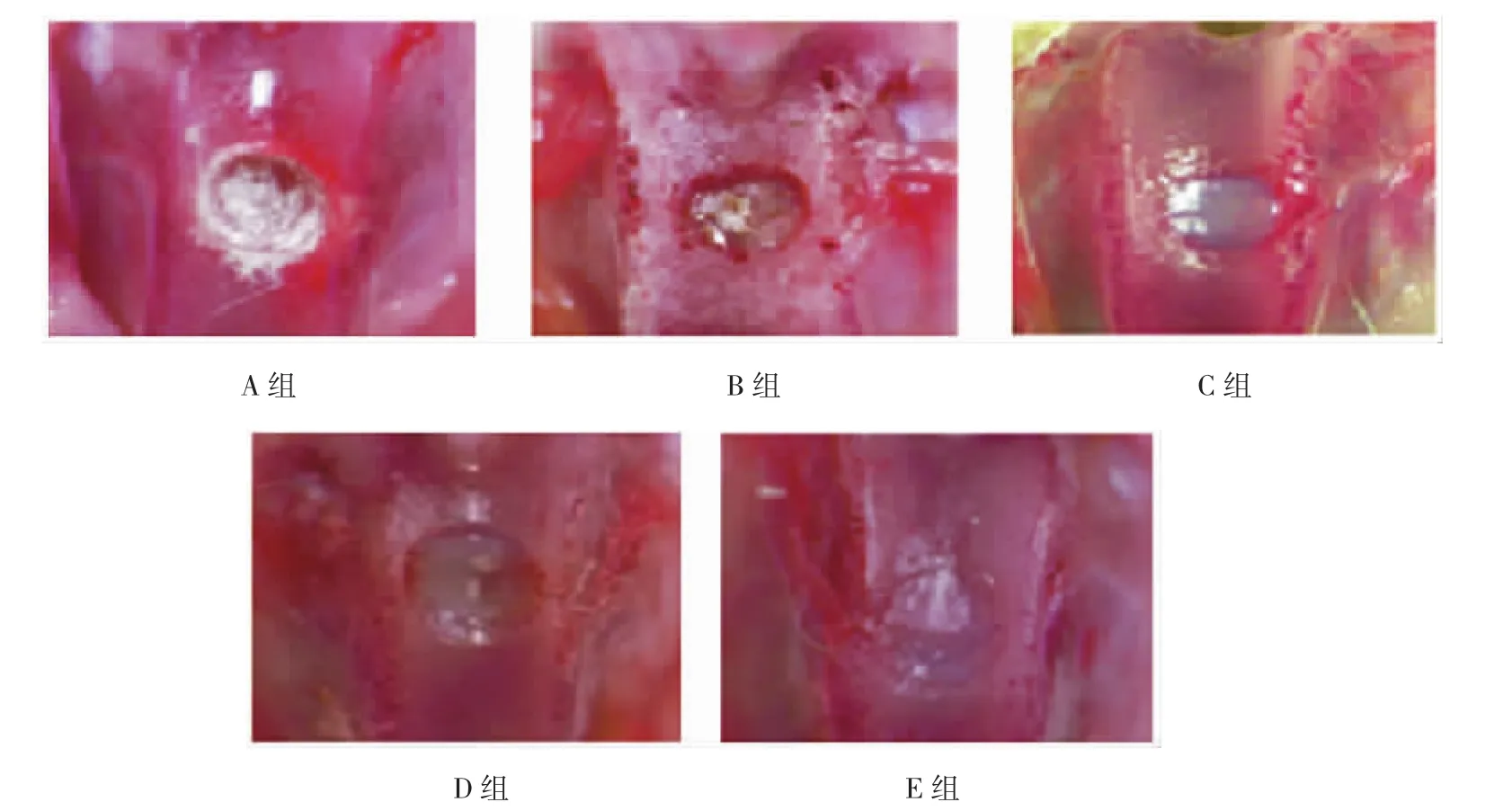
图1 不同组比格犬膝关节恢复16周组织标本
不同组病变膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ相对表达量的比较,不同组病变膝关节胶原蛋白Ⅰ和Ⅱ相对表达量差异有统计学意义(均P=0.000),与A组比较,B组膝关节胶原蛋白Ⅰ和Ⅱ表达均降低(P=0.000),与B组比较,C组膝关节胶原蛋白Ⅰ和Ⅱ表达均降低(P=0.000),C组和D组膝关节胶原蛋白Ⅰ和Ⅱ表达相当(P>0.05),与D组比较,E组膝关节胶原蛋白Ⅰ和Ⅱ表达均降低(P=0.000),见表 2 和图 2~3。
表2 不同组病变膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ相对表达量的比较 (±s)
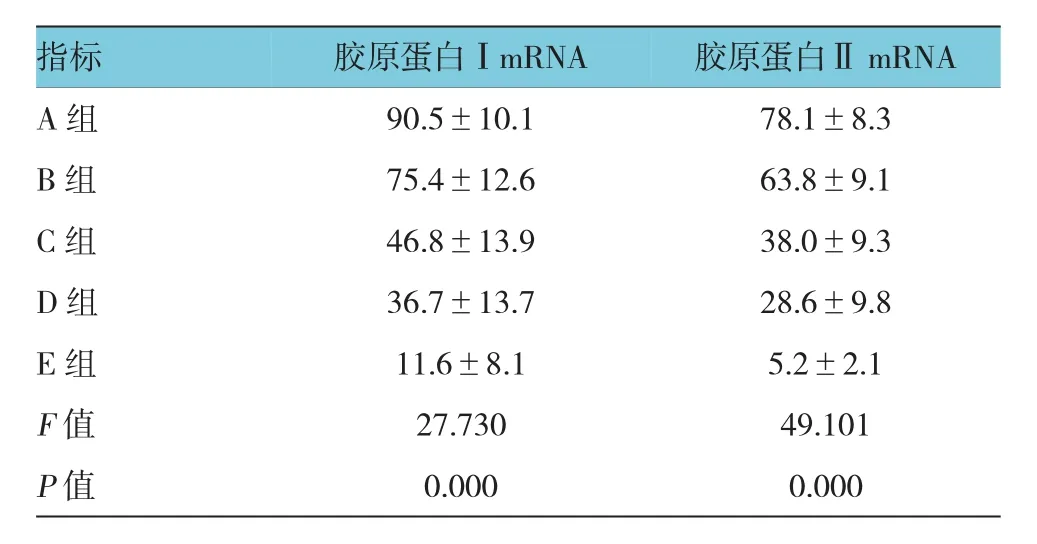
表2 不同组病变膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ相对表达量的比较 (±s)
A组 90.5±10.1 78.1±8.3 B 组 75.4±12.6 63.8±9.1 C 组 46.8±13.9 38.0±9.3 D组 36.7±13.7 28.6±9.8 E 组 11.6±8.1 5.2±2.1 F值 27.730 49.101 P值 0.000 0.000
2.2 不同组标本中心极限应力、应变值和相应弹性模量值
不同组标本中心极限应力和应变值存在E~A的顺序逐渐增高的趋势,但差异无统计学意义(P>0.05),与A组比较,D组弹性模量降低(F=12.102,P=0.004),与B组比较,D组弹性模量降低(F=6.785,P=0.021),见表 3。

图2 不同组病变膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ表达

图3 各组病变膝关节胶原蛋白Ⅰ和胶原蛋白Ⅱ表达水平比较
2.3 不同组标本交界极限应力、应变值和相应弹性模量值
不同组标本交界相应弹性模量值存在E~A的顺序逐渐降低的趋势,差异无统计学意义(P>0.05),极限应力和应变值差异有统计学意义(均P<0.05)。A、B、C及D组与E组比较,极限应力和应变值均升高,差异有统计学意义(P<0.05)。见表4。

表3 不同组标本中心极限应力、应变值和相应弹性模量值

表4 不同组标本交界极限应力、应变值和相应弹性模量值
3 讨论
自体骨软骨镶嵌移植成形术(Mosaicplasty)是目前新兴的治疗软骨缺损的手术方法[8-9],其采用自体非负重区骨软骨柱进行镶嵌式移植,有研究证实与其他软骨修复方法如软骨下钻孔、微骨折或打磨成形术等相比,可以修复透明软骨缺损,而其他方法则只能恢复纤维软骨覆盖。但Mosaicplasty技术本身也存在着不足,如镶嵌的骨软骨柱之间及其与周围和基底部骨和软骨组织的“整合”不良;骨软骨柱供体来源有限,无法应用于大面积骨软骨缺损;单枚支架直径过大不利于细胞和组织的生长替代;由于缺损常为不规则状,故Mosaicplasty技术目前多使用于形状规则的骨软骨柱,不可避免地遗留许多缺损间隙即“死区”,无法达到正常的透明软骨覆盖,而仅能代之以纤维组织填充,从而极大影响骨与软骨尤其是软骨面之间的整合[10]。
由于骨软骨缺损在软骨缺损的同时存在部分软骨下骨缺损,在修复软骨的同时,需修复软骨下骨缺损。早期有研究将单一孔径支架作为支架材料植入缺损区,但远期新生组织常常缺乏正常软骨由浅层向深层的渐进式结构,这便使处于表面的关节软骨缺乏正常的代谢及生物力学支持,后期出现缺损中心区域细胞的退变,致使软骨碎裂、塌陷[11-12]。因此,利用双层孔径支架材料构建组织工程骨软骨修复关节软骨缺损的新理念便应运而生,随着双层支架研究的增多和深入,显示骨软骨修复中固有的缺陷,即软骨与软骨下骨区域结合部形成一个截然分开的界线,干细胞在软骨与骨交界区定向分化不均一,或修复后产生一个较明显的“条带”区等[13-14],这种整合欠佳因素,可能会导致远期出现分层现象。由于骨与软骨结构的这种特殊性,只有选择合适的骨软骨支架才能使种子细胞在体内增殖形成骨软骨组织,完成缺损的修复。因此,在原有的单孔径SF-CS-nHA支架基础上,改进单纯冷冻干燥方法,制备成梯度式孔径SF/CS/nHA三维支架材料,再复合携带目的基因的种子细胞,构建基因增强组织工程骨种植体。PRP是全血经过离心而得到的血小板浓缩物所形成的凝胶,其浓缩血小板被激活后可以释放出多种促进细胞增殖分化的高浓度生长因子,包括转化生长因子-β1、β2(TGF-p1,p2)、血小板源性生长因子(PDGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)和成纤维细胞生长因子(FGF)[15],其中以转化生长因子-β1和血小板源性生长因子含量最高,并且PRP凝胶能够形成由纤维蛋白构成的三维网状支架,有利于种子细胞营养代谢,且由自体全血制备而成,无免疫排斥,而且PRP作为一种可注射支架已在口腔外科及整形外科等领域得到了广泛的应用[16]。
本研究结果显示,BMP-2-ADSCs复合体、SF/CS/nHA支架、SF/CS/nHA支架和BMP-2-ADSCs复合体、SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体4种材料移植到兔膝关节全层软骨缺损模型,第16周时,大部分的软骨缺损基本修复,Ⅰ型和Ⅱ型胶原均有表达,提示生物材料有不同程度地吸收,SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体吸收最好。本结果与早前的研究类似,即将SF-CS-nHA支架材料与BMSCs混合进行体外培养,最后将其移植至长约2 cm桡骨全段骨缺损模型进行动物体内实验,缺损区影像与正常骨组织已无区别,骨髓腔完成再通,骨小梁和梭形的骨细胞,支架材料完全降解,结果表明SF-CS-nHA支架可较好地修复兔桡骨大段骨缺损[17]。原因在于,Mosaicplasty技术填充大部分缺损面积,以PRP凝胶作为一种可注射支架,将PRP凝胶与基因转染BMP-2-ADSCs的复合物注射入骨软骨支架及不规则缺损的间隙内,以组织工程学方法消除“死区”,整合骨软骨柱间隙,降低种子细胞过快流失,同时,PRP凝胶释放的细胞因子可进一步促进种子细胞增殖、成骨及成软骨分化[18],有利于大面积骨软骨损伤的修复。SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体吸收最好,另一方面原因与BMP-2相关:BMP-2是目前所知的具有最强异位成骨能力的细胞因子,可加速ADSCs向成骨样细胞分化成骨细胞,并诱导形成骨组织,体外研究显示ADSCs转染BMP-2,2 d后可检测碱性磷酸酶分泌增加,碱性磷酸酶是BMP-2向成骨样细胞分化的早期标志物;本研究结果显示,裸鼠肌肉内注入BMP-2转染的ADSCs可在早期发现肌肉内的骨组织[19-20]。
综上所述,植入SF/CS/nHA支架与BMP-2-ADSCs联合PRP凝胶复合体对于大面积软骨缺损修复,表现出较好的生物相容性和理化特性,生物材料基本吸收,值得临床推广。
[1]LEVENGOOD S L,ZHANG M.Chitosan-based scaffolds for bone tissue engineering[J].J Mater Chem B Mater Biol Med,2014,2(21):3161-3184.
[2]JIAO Y H,LI M Z.Research progress of crosslinking methods of silkworn silk fibroin materials[J].Modem Silk Sci Techn,2011,26(6):242-246.
[3]VELEIRINHO B,COELHO D S,DIAS P F,et al.Nanofibrous poly (3-hydroxybutyrate-co-3-hydroxyvalerate)/chitosan scaffolds for skin regeneration[J].Int J Biol Macromol,2012,51(4):343-350.
[4]CHIU C K,FERREIRA J,LUO T J,et al.Direct scaffolding of biomimetic hydroxyapatite gelatin nanocomposites using aminosilane cross-linker for bone regeneration[J].J Mater Sci Mater Med,2012,23(9):2115-2126.
[5]WLODARSKI K H,WLODARSKI P K,GALUS R.Bioactive composites forbone regeneration review[J].Ortop Traumatol Rehabil,2008,10(3):201-210.
[6]VENKATESAN J,KIM S K.Nano-hydroxyapatite composite biomaterials for bone tissue engineering-a review[J].J Biomed Nanotechnol,2014,10(10):3124-3140.
[7]NAIR M B,KRETLOW J D,MIKOS A G,et al.Infection and tissue engineering in segme-ntal bone defects-a mini review[J].Curr Opin Biotechnol,2011,22(5):721-725.
[8]REVERTE-VINAIXA M M,JOSHI N,DIAZ-FERREIRO E W,et al.Medium-term outcome of mosaicplasty for grade III-IV cartilage defects of the knee[J].J Orthop Surg(Hongkong),2013,21(1):4-9.
[9]MA X,SUN Y,CHENG X,et al.Repair of osteochondral defects by mosaicplasty and allogeneic BMSCs transplantation[J].Int J Clin Exp Med,2015,8(4):6053-6059.
[10]JACOB R P.Mosaicplasty and amic technique as single time surgery for cartilage repair[J].Journal of Bone and Joint Surgery,2008,90(8):464-465.
[11]GUO X,WANG C,DUAN C,et al.Repair of osteochondral defectswith autologouschondrocytesseeded onto bioceramic scaffold in sheep[J].Tissue Eng,2005,10(11):1830-1840.
[12]WANG X,GROGAN S P,RIESER F,et al.Tissue engineering ofbiphasic cartilage constructs using various biodegradable scaffolds:an in vitro study[J].Biomaterials,2004,25(17):3681-3688.
[13]DORMER N H,BERKLAND C J,DETAMORE M S.Emerging techniques in stratified designs and continuous gradients for tissue engineering of interfaces[J].Ann Biomed Eng,2010,38(6):2121-2141.
[14]KON E,DELCOGLIANO M,FILARDO G,et al.Novel nanocomposite multilayered biomaterial for osteochondral regeneration:a pilot clinical trial[J].Am J Sports Med,2011,39(6):1180-1190.
[15]PAN L,YONG Z,YUK K S,et al.Growth factor release from lyophilized porcineplatelet-rich plasma:Quantitative analysis and implications for clinical applications[J].Aesthetic Plast Surg,2016,40(1):157-163.
[16]WEN Y,GU W,CUI J,et al.Platelet-rich plasma enhanced umbilical cord mesench-ymal stem cells-based bone tissue regeneration[J].Arch Oral Biol,2014,59(11):1146-1154.
[17]叶鹏,马立坤,邓江,等.丝素/壳聚糖/纳米轻基磷灰石构建的骨组织工程支架[J].中国组织工程研究,2013,17(29):5269-5274.
[18]XIE X,WANG Y,ZHAO C,et al.Comparative evaluation of MSCs from bone marrow and adipose tissue seeded in PRP-derived scaffold for cartilage regeneration[J].Biomaterials,2012,33(29):7008-7010.
[19]LIU Y,ZHANG Z,ZHANG C,et al.Adipose-derived stem cells undergo spontaneous osteogenic differentiation in vitro when passaged serially or seeded at low density[J].Biotech Histochem,2016,91(5):369-376.
[20]SHIRAISHI T,SUMITA Y,WAKAMASTU Y,et al.Formation of engineered bone with adipose stromal cells from buccal fat pad[J].J Dent Res,2012,91(6):592-597.
Effect of new osteochondral scaffold-assisted Mosaicplasty technology genetically enhanced ADSCs on repair of large area osteochondral defect*
Shi-qiang Ruan,Jiang Deng,lin Xu,Wen-liang Huang,Ren-yuan Tian
(Department of Orthopaedics,the First People's Hospital of Zunyi,Zunyi,Guizhou 563003,China)
ObjectiveTo investigate the effectofnew osteochondralscaffold-assisted Mosaicplasty technology and genetically enhanced adipose-derived stem cells(ADSCs)on repair of large area osteochondral defect.MethodsBeagle dog model of cartilage full-thickness defect was established.The defect was filled with multiple cartilage scaffolds through Mosaicplasty technology.No fixation was performed in group E.BMP-2-ADSCs was implanted in scaffold in group D.SF/CS/nHA was implanted in scaffold in group C.SF/CS/nHA combined with BMP-2-ADSCs was implanted in scaffold in group B.SF/CS/NHA and BMP-2-ADSCs combined with PRP gel complex was implanted in scaffold in group A.Morphological changes of tissue were observed at the 4th,8th,and 16th week post operation,and tissues were harvested at time point of the 16th week post operation.CollagenⅠand CollagenⅡmRNA were measured by PRC.Ultimate stress,strain value and the corresponding elastic modulus of the cartilage were determined.ResultsCompared with group E,cartilages in group A-D experienced better healing procedure with improvement of smooth surface.Group A witnessed dramatically improved cartilages when compared with group B-D (P<0.05).The expression levels of collagen proteinⅠ and collagenⅡ,ultimate stress,strain value and the corresponding elastic modulus were increased significantly in group A when compared with the remaining groups(P<0.05).ConclusionNew osteochondral scaffold filled with SF/CS/nHA,BMP-2-ADSCs and PRP gel complex through Mosaicplasty a technology can be therapeutic option for repair of large area cartilage defects.
biomimetic scaffold;mosaic transplantation;osteochondral defect;platelet-rich plasma;tissue engineerin
R683
A
10.3969/j.issn.1005-8982.2017.30.002
1005-8982(2017)30-0008-07
2017-05-28
贵州省科学技术项目(No:[2016]1420);国家自然科学基金(No:81660367)
邓江,E-mail:770694368@qq.com
(王荣兵 编辑)
