DcR3基因对胰腺癌裸鼠移植瘤化疗敏感性的影响*
2017-12-27肖华平谢辉罗春阳李庆方玉江
肖华平 ,谢辉 ,罗春阳 ,李庆 ,方玉江
(1.湘南学院附属医院肿瘤防治中心,湖南 郴州 423000;2.美国密苏里大学医学院Ellis Fischel肿瘤中心,密苏里州 哥伦比亚 65212)
基础研究·论著
DcR3基因对胰腺癌裸鼠移植瘤化疗敏感性的影响*
肖华平 1,谢辉 1,罗春阳 1,李庆 1,方玉江 2
(1.湘南学院附属医院肿瘤防治中心,湖南 郴州 423000;2.美国密苏里大学医学院Ellis Fischel肿瘤中心,密苏里州 哥伦比亚 65212)
目的探讨RNA干扰沉默诱骗受体-3(DcR3)对人胰腺癌细胞裸鼠移植瘤化疗敏感性的影响及其可能机制。方法取对数生长期的AsPC-1细胞1×106个/ml,接种于5周龄裸鼠右后肢腹股沟,当皮下肿瘤直径为8 mm左右,随机分为4组(n=10):对照组、化疗组、阴性质粒+化疗组、DcR3 siRNA+化疗组。观察DcR3 siRNA联合化疗药物对人胰腺癌AsPC-1细胞裸鼠移植瘤的治疗效果。应用ELISA和Western blot检测DcR3蛋白的变化;TUNEL分析肿瘤细胞凋亡;Western blot和RT-PCR检测FasL、Caspase-8和Caspase-3等凋亡因子的表达。结果化疗组、阴性质粒+化疗及DcR3 siRNA+化疗组均可抑制移植瘤的生长,与对照组比较,3组抑瘤率平均值分别为(35.87±4.58)%、(40.68±4.16)%和(90.25±2.53)%,4组间差异有统计学意义(F=47.736,P=0.000),DcR3 siRNA+化疗组抑瘤率较化疗组增加;对照组、化疗组、阴性质粒+化疗以及 DcR3 siRNA+ 化疗组移植瘤重量平均值分别为(0.95±0.03)、(0.63±0.04)、(0.67±0.02)和(0.17±0.06)g,4组间差异有统计学意义(F=85.531,P=0.000),DcR3 siRNA+化疗组瘤重较化疗组减轻;对照组、化疗组、阴性质粒+化疗组、DcR3 siRNA+化疗组凋亡率平均值分别为(6.3±2.21)%、(14.8±2.65)%、(14.5±3.06)%和(54.6±3.23)%,4组间差异有统计学意义(F=104.225,P=0.000),DcR3 siRNA+化疗组凋亡率较化疗组增加;DcR3 siRNA+化疗组的FasL、Caspase-8和Caspase-3蛋白表达较其他各组上升(P=0.000)。结论沉默DcR3可激活FasL/Caspase凋亡途径,促进细胞凋亡,增加胰腺癌细胞移植瘤对化疗的敏感性。
胰腺癌;诱骗受体-3;RNA干扰;凋亡;化疗敏感性
胰腺癌(pancreatic cancer,PC)由于具有症状隐匿、侵袭性强等特点,因此明确诊断较晚,手术切除率低及术后存活率低,化疗是其重要的治疗方法,然而至今单纯的化疗也不能延长患者的存活率。更为遗憾的是,至今还未找到在胰腺癌对化疗药物耐受机制中起重要作用的耐受基因。因此,研究如何增强胰腺癌对化疗的敏感性以及提高胰腺癌治疗效果有重要的临床意义。
本实验运用RNA干扰沉默诱骗受体-3(decoy receptor 3,DcR3),观察 DcR3siRNA对人胰腺癌AsPC-1细胞裸鼠移植瘤化疗增敏的效果,并探讨其相关机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞系及培养人胰腺癌细胞株AsPC-1(美国密苏里大学Ellis Fischel cancer center Dr.Fang惠赠)培养条件为:含10%小牛血清PRMI 1640培养基,恒温37℃,5%二氧化碳CO2培养箱中培养。
1.1.2 DcR3 siRNA质粒的构建应用筛选siRNA的软件,选取DcR3靶序列:5'-CGCUGCAGCCUCUU GAUGGAGAUGUCC-3',由上海生物工程股份有限公司合成DcR3特异性siRNA序列:正向:5'-ACAC CCACCUACCCCUGGCDTDT-3';反向:5'-GCCAGGG GUAGGUGGGUGUDTDT-3'。同时将上述寡核苷酸序列打乱重新组合,设计5'-GACACACCACCUCCC CUGCDTDT-3'和5'-GGCGACGGGUGUGAGGUGU DTDT-3'作为阴性对照组。
1.1.3 实验试剂ELISA检测试剂盒(购自美国Bio-Techne 公司),FasL、Caspase-8、Caspase-3、β-action和DcR3抗体(购自美国Cell Signaling Technology公司),Alkaline phosph-atase结合抗-兔 /鼠 IgG二抗(购自美国Sigma公司),核蛋白提取试剂盒(购自美国Pierce公司),Trizol(购自美国Gibco公司),逆转录 RCR(reverse transcription PCR,RT-PCR)试剂盒(美国Thermo Fisher Scientific公司产品),TUNEL凋亡检测试剂盒(购自美国Promega公司)。
1.1.4 实验动物4~6周龄BALB/c nu/nu雄性裸小鼠,体重18~22 g,共40只,均购自中南大学动物学部[动物合格证号:SCXK(湘)2015-0006]。
1.2 方法
1.2.1 人胰腺癌裸鼠移植瘤动物模型的复制及动物实验将AsPC-1细胞按1×106个/ml每只分别接种于5周龄裸鼠右后肢腹股沟,以瘤体直径4 mm为成瘤标准,当裸鼠皮下肿瘤平均长径为8~10 mm。将移植瘤裸鼠随机分为4组(n=10)。第1组对照组,第8天后裸鼠皮下瘤内多点注射剂量100 μl的生理盐水,1次/2 d,共7次;第2组化疗组,8 d后腹腔注射吉西他滨100 mg/kg,1次/2 d,共7次;第3组阴性对照+化疗组,8d后腹腔注射吉西他滨100mg/kg,同时裸鼠皮下瘤内多点注射0.5 ml按10 μg/kg的阴性质粒和脂质体配成的复合物,1次/2 d,共7次;第4组DcR3 siRNA+化疗组,即8 d后裸鼠皮下瘤内多点注射0.5ml按10μg/kg的重组质粒DcR3 siRNA和脂质体配成的复合物,并予腹腔注射吉西他滨100 mg/kg,1次/2 d,共7次。开始治疗后,每间隔4天测量并计算肿瘤体积,以每次肿瘤体积的均数绘制生长曲线,肿瘤体积的计算公式为VT(mm3)=ab2/2,a和b分别为长径和短径。荷瘤28 d后脱颈处死裸鼠,剥离肿瘤,称重。并计算抑瘤率(inhibitory rate,IR),抑瘤率(IR)(%)=[(VA-VB)/VA]×100%,A和B分别为对照组和实验组。
1.2.2 ELISA法检测实验各组移植瘤中DcR3的蛋白量应用Pierce公司试剂盒提取细胞蛋白,进行ELISA实验。首先用浓度100μl/孔的抗DcR3 mAb包被ELISA板,置37℃,4h;再用5%小牛血清置37℃封闭40 min,封闭时将封闭液加满各反应孔,封闭结束后用洗涤液满孔洗涤3遍,每遍3 min;将稀释好DcR3纯标品和待测样品加入酶标反应孔中,每样品至少加双孔,每孔 100 μl,置于 37℃,40~60 min,用洗涤液满孔洗涤3遍,每遍3 min;最后将生物素标记的抗DcR3抗体加入板中,室温孵育1 h,每孔加入底物TMB 100 μl的置37℃避光放置10 min,加入终止液显色,A492下读数。
1.2.3 TUNEL检测实验各组肿瘤细胞的凋亡将肿瘤组织连续切片,置45~50℃孵育箱内48 h,用4%多聚甲醛固定细胞40min后PBS冲洗1次。加入含0.1%Triton X-100的PBS,冰浴孵育3 min,PBS冲洗1次。然后用100μl 20 μg/ml Proteinase K溶液在室温下处理20 min,增加细胞膜的通透性后,用PBS冲洗3次;制备50μl的TUNEL反应混合液:用2 μl TdT酶+48 μl生物素标记的Biotin-dUPT。加50 μl TUNEL反应混合液于玻片上,在暗湿盒中反应37℃×1h。PBS冲洗3次,用抗荧光淬火封片液封片后荧光显微镜下观察。使用的激光波长范围为450nm,发射波长范围为515nm(绿色荧光)。阳性细胞的细胞核发绿光,观察10个200倍镜下视野,每个视野计数200个细胞,计数其中阳性细胞数,取其平均数为凋亡指数。
1.2.4 Western blot检测实验各组FasL、Caspase-8和Caspase-3的蛋白表达肿瘤组织加入细胞裂解RiPA缓冲液裂解细胞,提取总蛋白。测定浓度后各取100 μg蛋白样本进行电泳,通过电转印法将蛋白从聚丙烯酰胺凝胶上转移至硝酸纤维素滤膜(PVDF)上,5%脱脂奶常温封闭1 h,加入一抗(FasL、β-action:1∶1 000;Caspase-8和 Caspase-3:1∶500),于4℃过夜,TBST洗膜后加入相应的二抗(1∶1 000)常温孵育1 h,最后NBT/BCIP显色,相对蛋白的表达量=目的蛋白灰度值/β-action灰度值。
1.2.5 RT-PCR检测实验各组DcR3、FasL、Caspase-8和Caspase-3的基因表达将液氮冻存的肿瘤组织放入EP管中,用Trizol提取各组细胞的总RNA,各取1 μg RNA逆转录为cDNA,取2 μl cDNA以FasL、Caspase-8和 Caspase-3的引物(FasL引物:正向 5'-GGTTGCCTTGGTAGGATTGG-3',反向 5'-CCT TGAGTTGGACTTGCCTGTT-3',产物长度 196 bp;Caspase-8引物:正向5'-TACTACCGAAACTTGGAC C-3',反向 5'-GTGAAAGTAGGTTGTGGC-3',产物长度为515 bp;Caspase-3引物:正向5'-ATGGAGAAC AATAAAACCT-3',反向 5'-CTAGTGATAAAAGTAG AGTTC-3'产物长度为834bp)以及GAPDH的引物(正向 5'-TGACTTCAACAGCGACACCCAC-3',反向5'-AACTGTGAGGAGGGGAGATTC-3',产物长度为277bp)进行PCR扩增,分别检测各组中的FasL、Caspase-8、Caspase-3和内参GAPDH的mRNA表达水平。PCR 反应条件为:94℃变性 45 s;60℃(FasL)、50.6℃(Caspase-8)、50℃(Caspase-3) 退火 60 s,进行30个循环,72℃延伸5 min。最后取扩增产物在1.5%琼脂糖凝胶上电泳,产物条带用凝胶成像系统照相并进行灰度分析,目的片段的相对表达量=目的基因的灰度值/GAPDH的灰度值。
1.3 统计学方法
数据处理采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验,两组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌AsPC-1细胞裸鼠移植瘤的生长以及抑制率
根据所测得的移植瘤长短径,计算出移植瘤的体积,从而得到4组移植瘤生长曲线,结果显示,与对照组比较,化疗组、阴性质粒+化疗组、DcR03 siRNA+化疗组都能够抑制肿瘤生长,3种治疗方法的抑瘤率平均值分别为(35.87±4.58)%、(40.68±4.16)%和(90.25±2.53)%,4组间差异有统计学意义(F=47.736,P=0.000),DcR3 siRNA+ 化疗组抑瘤率较化疗组增加(见图1A)。
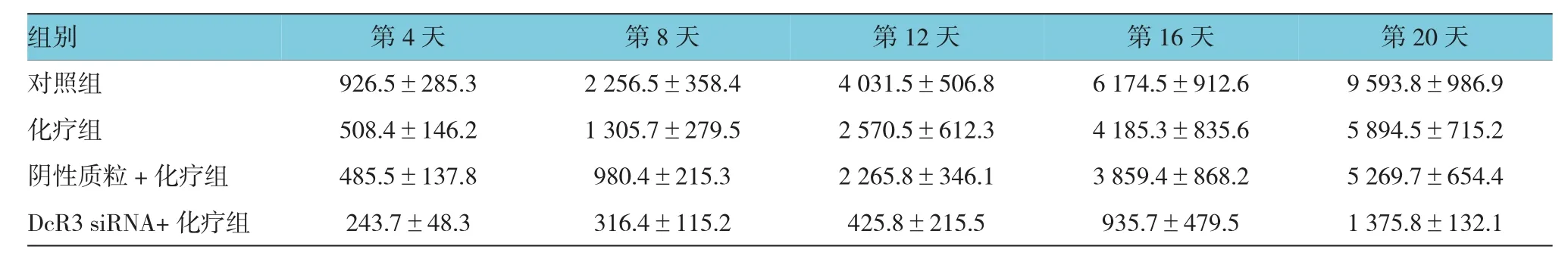
DcR3 siRNA+化疗组与化疗组治疗后第4、8、12、16及20天的移植瘤体积比较,采用重复测量设计的方差分析,结果:①不同时间的肿瘤体积有差异(F=64.631,P=0.000);②DcR3 siRNA+ 化疗组与化疗组的肿瘤体积有差异(F=81.632,P=0.000),与化疗组比较,DcR3 siRNA+化疗组肿瘤体积较小,相对抑制肿瘤效果较好;③DcR3 siRNA+化疗组与化疗组的肿瘤体积变化趋势有差异(F=23.585,P=0.016)。见附表和图1A。
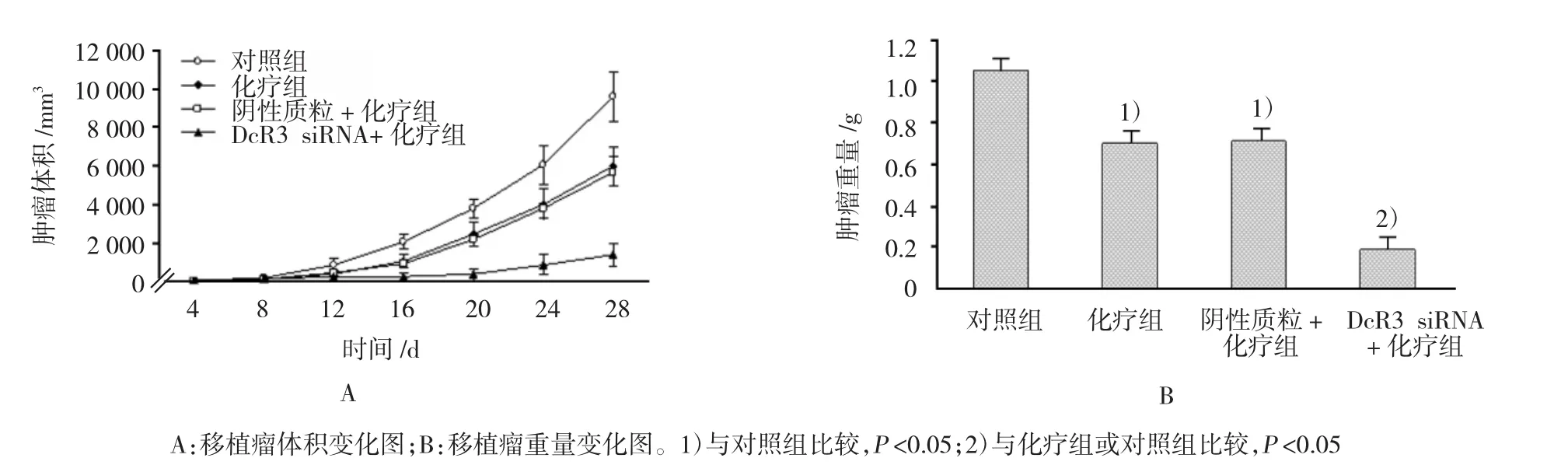
图1 DcR3 siRNA联合化疗对AsPC-1细胞裸鼠移植瘤的生长抑制作用
附表 治疗后各组荷瘤小鼠的平均肿瘤体积的比较 (n=10,±s)
附表 治疗后各组荷瘤小鼠的平均肿瘤体积的比较 (n=10,±s)
对照组 926.5±285.3 2 256.5±358.4 4 031.5±506.8 6 174.5±912.6 9 593.8±986.9化疗组 508.4±146.2 1 305.7±279.5 2 570.5±612.3 4 185.3±835.6 5 894.5±715.2阴性质粒+化疗组 485.5±137.8 980.4±215.3 2 265.8±346.1 3 859.4±868.2 5 269.7±654.4 DcR3 siRNA+ 化疗组 243.7±48.3 316.4±115.2 425.8±215.5 935.7±479.5 1 375.8±132.1
处死裸鼠后对照组、化疗组、阴性质粒+化疗组以及DcR3 siRNA+化疗组肿瘤重量分别为(0.95±0.03)、(0.63±0.04)、(0.67±0.02)和(0.17±0.06)g,4组间差异有统计学意义(F=85.531,P=0.000),DcR3 siRNA+化疗组瘤重较化疗组减轻(见图1B)。
2.2 DcR3在胰腺癌AsPC-1细胞裸鼠移植瘤中的表达
DcR3 siRNA+化疗组DcR3蛋白量少于其他各组,与单独化疗组比较,两者间DcR3的蛋白量差异有统计学意义(F=96.478,P=0.000)(见图 2A);Western blot检测各组DcR3蛋白的表达进一步证实,在AsPC-1细胞裸鼠移植瘤中注射DcR3 siRNA能降低DcR3蛋白表达(见图2B)。


图2 DcR3蛋白在AsPC-1细胞裸鼠皮下移植瘤中的表达
2.3 肿瘤细胞凋亡情况
对照组、化疗组、阴性质粒+化疗组、DcR3 siRNA+化疗组凋亡率平均值分别为(6.3±2.21)%、(14.8±2.65)%、(14.5±3.06)%和(54.6±3.23)%,4组间差异有统计学意义(F=104.225,P=0.000),DcR3 siRNA+化疗组凋亡率较化疗组增加(见图3)。


图3 各组移植瘤组织中肿瘤细胞凋亡变化
2.4 FasL、Caspase-8和Caspase-3凋亡因子的表达
Western blot显示,DcR3 siRNA+化疗组的FasL、Caspase-8和Caspase-3蛋白表达水平平均值均高于其他各组,4组间差异有统计学意义(FFasL=61.652,P=0.000;FCaspase-8=79.378,P=0.000;FCaspase-3=68.849,P=0.000),DcR3 siRNA+ 化疗组 FasL、Caspase-8和Caspase-3蛋白表达水平较化疗组增加(见图4A~C)。RT-PCR进一步证实沉默DcR3后可以上调FasL、Caspase-8和Caspase-3的表达,其上调的效应与Western blot结果一致(见图4D~F)。



图4 FasL、Caspase-8及Caspase-3在AsPC-1细胞裸鼠皮下移植瘤中的表达
3 讨论
DcR3是PITTI等[1]在1998年发现的肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)超家族成员,是一种分泌型的可溶性的蛋白分子,在它的氨基酸序列中缺少明显的跨膜结构,其配体包括FasL、LIGHT和LTβR。研究发现,DcR3通过竞争性抑制Fas和FasL的结合,以及阻断LIGHT和LTβR及HVEM/TR2的相互作作用,从而阻断FasL和LIGHT介导产生的细胞凋亡,被认为与肿瘤的发生、发展以及免疫逃逸密切相关[2-4]。ZHOU等[5]报道DcR3在胰腺癌中呈高表达,并通过竞争FasL与Fas的结合在胰腺癌耐受化疗的特性中扮演着重要的角色;CHEN等[6]报道,DcR3能够阻挡FasL诱导的抑制胰腺癌细胞生长的作用,也提示胰腺癌细胞的DcR3表达高并且远高于结肠癌中DcR3的表达。提示胰腺癌对化疗药物耐受是否与其的DcR3蛋白过度表达存在着联系。因此,大家也许能够运用基因敲除的方法减少胰腺癌细胞上DcR3的表达从而增加FasL与Fas的结合,使死亡信号顺利传递以达到提高化疗药物对胰腺治疗效果的目的。
研究证明,凋亡与肿瘤细胞的化疗敏感性有关,诱导肿瘤细胞凋亡是放疗和化疗的主要目的之一,凋亡指数低的细胞对化疗药物耐受性高、化疗效果差,因此诱导肿瘤凋亡已作为提高恶性肿瘤化疗敏感性的重要方面。DcR3是TNFR超家族成员,DcR3通过与不同的凋亡配体相互作用调节细胞凋亡。LIANG等[7]对肝癌细胞研究发现,当沉默DcR3后,可以增加TRAIL诱导的肿瘤细胞凋亡,从而增加肝癌细胞的化疗敏感性;ZHANG等[8]研究提示,采用siRNA沉默胶质瘤中DcR3高表达,可以抑制胶质瘤细胞的生长和增加胶质瘤细胞的凋亡。在本实验中DcR3 siRNA+化疗组FasL的蛋白表达较其他各组上升。说明沉默DcR3表达后能增加FasL表达。TUNEL分析结果显示,DcR3siRNA+化疗组的肿瘤细胞凋亡数目高于其他组。以上结果说明,沉默DcR3表达后可以通过增加FasL与Fas的结合,使死亡信号顺利传递来提高胰腺癌的化疗敏感性。
DcR3调节细胞的凋亡是通过与FasL竞争性的结合而阻断凋亡信息传导来实现的[9]。FasL凋亡信号传导与Caspase的激活密切相关,本实验发现,DcR3 siRNA+化疗组中的Caspases-8和Caspases-3都存在上调现象。Caspases-8是FasL途径凋亡通路的启动基因,其下游就是Caspases-3,Caspases-3被认为是线粒体凋亡途径的最终执行者[10]。本实验结果提示,沉默DcR3增加化疗诱导的细胞凋亡可能是通过激活FasL/Caspase途径来实现。
总之,在体内沉默DcR3基因的表达能提高人胰腺癌细胞的化疗药物治疗效果。其机制可能为沉默DcR3基因可激活FasL/Caspase凋亡途径,促进细胞凋亡所致。提示DcR3→FasL→Caspases通路在人胰腺癌细胞对化疗敏感性起着至关重要的作用,有望成为人胰腺癌细胞基因治疗新的靶点之一。
[1]PITTI R M,MARSTERS S A,LAWRENCE D A,et al.Genomic amplification of a decoy receptor for Fas ligand in lung and colon cancer[J].Nature,1998,396(6712):699-703.
[2]XIU Z,SHEN H,TIAN Y,et al.Serum and synovial fluid lev-els of tumor necrosis factor-like ligand 1A and decoy receptor 3 in rheumatoid arthritis[J].Cytokine,2015,72(2):185-189.
[3]LIU W,ZHAN C,CHENG H,et al.Mechanistic basis for functional promiscuity in the TNF and TNF receptor superfamilies:structure of the LIGHT:DcR3 assembly[J].Structure,2014,22(9):1252-1262.
[4]ZHANG Y,LI D,ZHAO X,et al.Decoy receptor 3 suppresses FasL-induced apoptosis via ERK1/2 activation in pancreatic cancer cells[J].Biochem Biophys Res Commun,2015,463(9):1144-1151.
[5]ZHOU J,SONG S,LI D,et al.Decoy receptor 3 (DcR3)overexpression predicts the prognosis and pN2 in pancreatic head carcinoma[J].World J Surg Oncol,2014,12:52.
[6]CHEN J,GUO X Z,LI H Y,et al.Dendritic cells engineered to secrete anti-DcR3 antibody augment cytotoxic T lymphocyte response against pancreatic cancer in vitro[J].World J Gastroenterol,2017,23(5):817-829.
[7]LIANG C,XU Y,LI G,et al.Downregulation of DcR3 sensitizes hepatocellularcarcinoma cellsto TRAIL-induced apoptosis[J].Onco Targets Ther,2017,10(2):417-428.
[8]ZHANG Y,HUANG S,LENG Y,et al.Effect of DcR3-specific siRNA on cell growth suppression and apoptosis induction in glioma cells via affecting ERK and AKT[J].Onco Targets Ther,2016,9(10):5195-5202.
[9]LIU W,RAMAGOPAL U,CHENG H,et al.Crystal structure of the complex of human FasL and its decoy receptor DcR3[J].Structure,2016,24(11):2016-2023.
[10]YUAN J,NAJAFOV A,PY B F.Roles of caspases in necrotic cell death[J].Cell,2016,167(7):1693-1704.
Effect of Decoy receptor 3 on chemosensitivity in nude mice model of pancreatic cancer*
Hua-ping Xiao1,Hui Xie1,Chun-yang Luo1,Qing Li1,Yu-jiang Fang2
(1.Cancer Center,the Affiliated Hospital of Xiangnan University,Chenzhou,Hunan 423000,China;2.Ellis Fischel Cancer Center,University of Missouri School of Medicine,Columbia,Missouri 65212,USA)
ObjectiveTo investigate the effect of Decoy receptor 3 (DcR3)on chemosensitivity of human pancreatic cancer cells and potential mechanisms.MethodsPancreatic cancer AsPC-1 cells in log-growth phase (1×106cells)were subcutaneously injected in nude mice.Expression of DcR3 was blocked through small interfering ribonucleic acid (siRNA).Seven days post injection,tumor-bearing mice were then randomly divided into 4 groups (n=10 group):control group,chemotherapy group,sham siRNA+chemotherapy group and DcR3 siRNA+chemotherapy.Xenograft of human pancreatic cancer AsPC-1 cells was measured among the groups.Expression level of DcR3 was determined by ELISA and Western blot.Apoptosis rate was detected by TUNEL analysis.Expression levels of FasL protein,Caspase-8,and Caspase-3 were measured by Western blot and RT-PCR.ResultsTumor weight(gram)in chemotherapy group,sham siRNA+chemotherapy group and DcR3 siRNA+chemotherapy group was significantly decreased when compared with control group(0.63± 0.04 vs 0.95±0.03,P=0.000,0.67±0.02 vs 0.95±0.03,P=0.000,0.17±0.06 vs 0.95±0.03,P=0.000),respectively.Silencing of DcR3 expression dramatically reduced weight of tumor when compared with sham siRNA+chemotherapy group (0.17±0.06 vs 0.67±0.02 vs 0.95±0.03,P=0.000).Inhibitory rate of tumor growth in chemotherapy group,sham siRNA+chemotherapy group and DcR3 siRNA+chemotherapy group increased when compared with control group [(35.87±4.58)%vs (0.00±0.00)%,P=0.000,(40.68±4.16)%vs(0.00±0.00)%,P=0.000,(90.25±2.53)%vs(0.00±0.00)%,P=0.000],respectively.Silencing of DcR3 expression dramatically increased inhibitory rate of tumor growth when compared with sham siRNA+chemotherapy group [(90.25±2.53)%vs(0.67±0.02)%vs(40.68±4.16)%,P=0.000].Apoptosis rate in chemotherapy group,sham siRNA+chemotherapy group and DcR3 siRNA +chemotherapy group were significantly increased when compared with control group[(14.8±2.65)%vs(6.3±2.21)%,P=0.000,(14.5±3.06)%vs(6.3±2.21)%,P=0.000,(54.6±3.23)%vs (6.3±2.21)%,P=0.000],respectively.Silencing of DcR3 expression dramatically reduced weight of tumor when compared with sham siRNA+chemotherapy group[(54.6±3.23)%vs(14.5±3.06)%,P=0.000].The expression levels of FasL,Caspase-8,and Caspase-3 in DcR3 siRNA+chemotherapy group were downregulated when compared with the remaining 3 groups(P=0.000).ConclusionSilencing of DcR3 gene can increase the chemosensitivity of human pancreatic cancer by promoting FasL/Caspase-mediated cells apoptosis.
pancreatic cancer;DcR3;small interfering ribonucleic acid;apoptosis;chemosensitivity
R735.9
A
10.3969/j.issn.1005-8982.2017.30.001
1005-8982(2017)30-0001-07
2017-05-04
湖南省自然科学基金(No:14JJ3136);郴州市科技局科研基金(No:CZ2013096)
李庆,E-mail:liqing0685@163.com
(王荣兵 编辑)
