锦州某奶牛养殖场乳房炎大肠埃希菌药敏试验及耐药基因检测
2017-12-26于长泳
于长泳
(辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
锦州某奶牛养殖场乳房炎大肠埃希菌药敏试验及耐药基因检测
于长泳
(辽宁省动物疫病预防控制中心,辽宁沈阳 110164)
为了解锦州某奶牛养殖场临床型乳房炎病原菌耐药情况。对该场进行患病乳样采集、主要病原菌分离鉴定、药物敏感性试验和耐药基因筛选。结果表明,该场乳房炎主要病原菌为大肠埃希菌,共得到乳房炎大肠埃希菌分离株36株;药物敏感性试验结果表明,分离株对磺胺类药物高度耐药、对头孢噻呋和头孢唑啉敏感;对分离株进行磺胺类药物耐药基因筛查结果表明,sul1、sul2、sul3基因的阳性率分别为76.0%、17.1%和0%,说明sul1基因为该场大肠埃希菌磺胺类药物主要耐药基因。
奶牛;乳房炎;大肠埃希菌;药敏试验;耐药基因
乳房炎是奶牛养殖业常发疾病之一,其主要临床表现为患病牛乳房红、肿、热、痛、泌乳机能障碍等,并同时伴有凝乳、乳汁结块、血乳及絮状物沉淀等,给养殖业带来巨大经济损失[1-3]。据报道,奶牛乳房炎在世界范围内发病率高达50%左右,我国每年约有10%~15%的奶牛因乳房炎而被淘汰[4]。
饲养管理、营养水平、遗传因素等均与奶牛乳房炎相关,但病原微生物感染仍是其最主要的致病因素之一[5]。已知超过150种病原微生物能够引起奶牛乳房炎,其中金黄色葡萄球菌、链球菌和大肠埃希菌为最主要的3种病原菌[6-7]。目前,抗菌药物治疗仍是奶牛乳房炎的首选治疗方案,但随着抗菌药物特别是广谱抗菌药物的长期使用,病原菌的耐药现象日益严重,给乳房炎治疗带来新的挑战[8]。
本试验对辽宁锦州某规模化奶牛养殖场进行乳房炎大肠埃希菌的分离鉴定,测试分离株对临床常用抗菌药物的敏感性,并对分离株产生耐药的分子机制进行研究,为该场奶牛乳房炎综合防控提供依据,并为乳房炎病原菌分子耐药机制研究提供基础。
1 材料与方法
1.1 材料
1.1.1 受试病牛 经驻场兽医确诊的乳房炎病牛43头,病牛伴有不同程度的乳房肿胀、触诊坚实、乳区疼痛感明显、泌水样乳、血乳、结块乳等乳房炎典型临床症状。其中33头为1乳区感染,其余10头为2乳区感染。
1.1.2 主要试剂 细菌基因组DNA提取试剂盒为博迈德生物科技有限公司产品;DNA凝胶回收纯化试剂盒为天根生化科技(北京)有限公司产品;营养肉汤(NB)、麦康凯营养琼脂粉为北京鼎国昌盛生物技术有限公司产品;肠杆菌科生化常规鉴定管为杭州微生物试剂有限公司产品;MH-B培养基为北京奥博星生物技术有限公司产品;DNA Marker DL 2 000 、2×TaqPCR master mix、TE buffer(×50)为宝生物工程(大连)有限公司产品。
1.1.3 主要仪器 恒温振荡培养箱(HEQ-D1C),广州天泉精密仪器设备公司;电热培养箱(长春立升,CDX-141)和立式高压蒸汽灭菌器(LDC-XX-03),浙江永靖医疗设备有限公司;梯度PCR扩增仪(T100 Thermal Cycler)和凝胶成像系统(Gel Dox XR+)为Bio-Rad公司产品;还有电动移液器(FIN-1330),微量可调单道、多道加样器。
1.1.4 标准品 氨苄西林(87.9%)、阿莫西林(88.1%)、头孢唑啉(99.6%)、头孢噻呋(85.1%)、多西环素(79.3%)、氟苯尼考(99.0%)、磺胺间甲氧嘧啶(85.1%)、磺胺甲基异恶唑(90.0%)标准品购于中国兽医药品监察所;大肠埃希菌标准株ATCC25922由辽宁省动物疫病预防控制中心提供;磺胺类药物耐药基因sul1、sul2、sul3阳性质粒由沈阳农业大学提供。
1.1.5 磺胺类药物耐药基因检测引物 根据文献报道及NCBI中已公布的磺胺类药物耐药基因序列,利用prime 9.0设计特异性检测引物,引物委托生工生物工程(上海)股份有限公司合成(表1)。
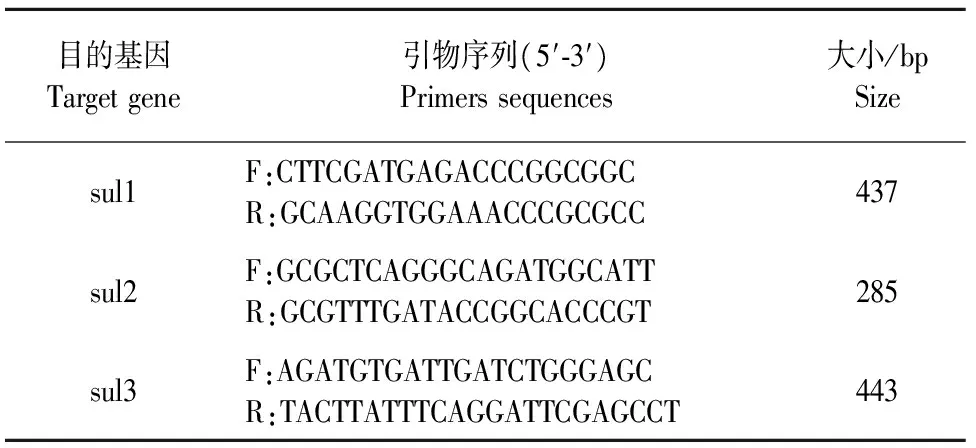
表1 PCR扩增引物
1.2 方法
1.2.1 病料采集 采样前用温水和软布将乳区洗净,之后用750 mL/L乙醇棉球和碘酊进行消毒。弃去头3把奶后,将乳样采集于50 mL灭菌离心管中。盖紧试管并做好标记,于4℃保温箱中保存并尽快送至实验室。
1.2.2 大肠埃希菌初步分离 按照麦康凯琼脂培养基粉说明书要求,制作麦康凯琼脂平皿培养基。将平皿倒置于37℃恒温培养箱中过夜培养18 h,观察无菌落生长的平皿为检菌合格,可用于病原菌分离试验。在洁净工作台中,用微量移液器向检菌合格的麦康凯琼脂平皿中移取乳房炎乳样200 μL,并用无菌的三角玻璃棒将乳样涂抹均匀,正置待乳样完全吸收后,倒置于37℃恒温培养箱中培养18 h。
1.2.3 大肠埃希菌生化反应鉴定 将初步分离的疑似大肠埃希菌分离株接种于检菌合格的5 mL营养肉汤中,于37℃振荡培养12 h。测定其吸光光度值,当OD600=0.4~0.6时为细菌到达对数生长期。将到达对数生长期的疑似大肠埃希菌分离株,按生化鉴定管说明书要求,分别接种于11个生化反应管内,密封并于37℃恒温培养箱中过夜培养。培养后根据反应结果,参照编码手册,对疑似分离株进行编码鉴定。并将确定的大肠埃希菌分离株于终浓度为30%的无菌甘油中,置-80℃保存备用。
1.2.4 大肠埃希菌分离株药物敏感性试验 使用CLSI(2015版)推荐的微量肉汤稀释法,测定8种受试抗菌药物对乳房炎大肠埃希菌分离株的最小抑菌浓度(MIC)。将保存于甘油中的乳房炎大肠埃希菌分离株,在无菌营养肉汤中培养至菌液浓度为1×108CFU/mL。用倍比稀释法,将受试药物稀释成浓度范围在0.125 μg/mL~256 μg/mL的12个浓度梯度。将菌液和药液加入96孔U底细胞培养板中,于37℃恒温培养箱中过夜培养。观察抑制分离株生长的最小药物浓度为该药物的MIC[9]。每个分离株重复3个平行,以大肠埃希菌标准株ATCC25922为质控菌。
1.2.5 乳房炎大肠埃希菌基因组DNA提取 大肠埃希菌甘油菌复苏培养方法同1.2.4。按照细菌基因组DNA提取试剂盒说明说操作要求,提取奶牛乳房炎大肠埃希菌分离株基因组DNA,并于10 g/L的琼脂糖凝胶中电泳检验提取效果。
1.2.6 大肠埃希菌分离株磺胺类药物耐药基因PCR检测 PCR扩增体系:100 μL反应体系中加入上、下游引物2.0 μL,灭菌双蒸去离子水44.0 μL,2×TaqPCR Master Mix 50.0 μL,模板DNA 2.0 μL。PCR反应条件为:94℃ 4 min;94℃ 30 s,(sul1 65 ℃、sul2 70 ℃、sul3 60 ℃)退火30 s,72 ℃延伸1 min,35个重复循环;72℃最终延伸7 min,4℃结束反应。反应产物经10 g/L琼脂糖凝胶电泳检测,并将阳性产物送至生工生物工程(上海)股份有限公司进行序列测定。
2 结果
2.1 奶牛乳房炎大肠埃希菌分离鉴定结果
经麦康凯鉴别培养基初筛,肠杆菌科生化鉴定反应管生化鉴定,从53份乳房炎病料分离到到疑似大肠埃希菌分离株50株,经生化反应管鉴定后,最终确定大肠埃希菌分离株36株。
2.2 大肠埃希菌分离株药物敏感性测试结果
36株乳房炎大肠埃希菌分离株对受试的8种抗菌药物已产生不同程度的耐药性。其中,分离株对磺胺甲基异恶唑耐药率最高,为61.1%(22/36)、磺胺间甲氧嘧啶次之,为55.6%(20/36);分离株对头孢唑啉和头孢噻呋较为敏感,耐药率分别为11.1%(4/36)和13.9%(5/36)(表2)。
2.3 大肠埃希菌分离株多药耐药分析
36株奶牛乳房炎大肠埃希菌分离株,仅1株对受试的8种抗菌药物均敏感。其余35株分离株,最少耐受1种抗菌药物,最多耐受5种抗菌药物。耐受0~5种抗菌药物的菌株占比分别为2.8%(1/3)、16.7%(6/36)、41.7%(15/36)、27.8%(10/36)、8.3%(3/36)及2.7%(1/36)。其中同时耐受2种抗菌药物的菌株最多,共15株,占比41.7%(图1)。
2.4 大肠埃希菌基因组DNA提取结果
使用细菌基因组DNA提取试剂盒提取36株奶牛乳房炎大肠埃希菌分离株基因组DNA。并经10 g/L琼脂糖凝胶电泳,电泳条件为电压110V,电泳30 min(图2)。
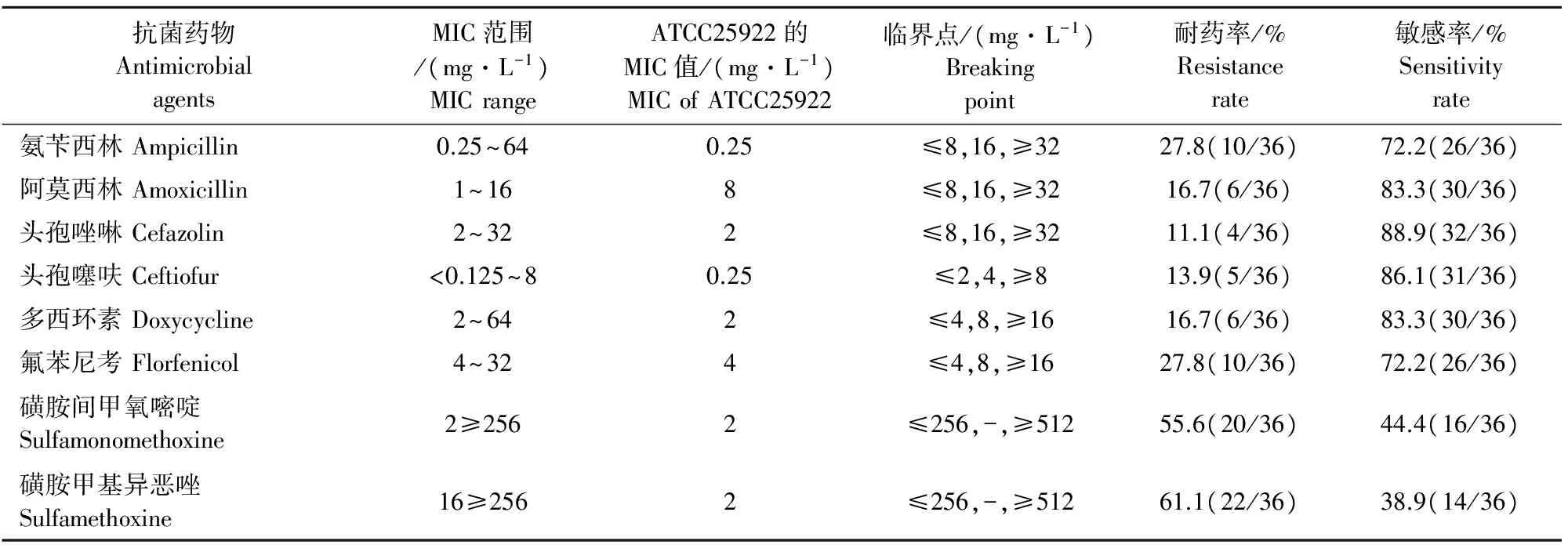
表2 36株奶牛乳房炎大肠埃希菌分离株药物敏感性测试结果
2.5 磺胺类耐药基因PCR筛查结果
使用特异性引物PCR扩增,产物经电泳及测序比对,在36株乳房炎大肠埃希菌分离株中共筛查到sul1基因阳性菌株19株、sul2基因阳性菌株6株,未检出sul3基因。sul1分离率为76.0%(19/35)、sul2分离率为17.1%(6/35)。其中有4株分离株同时检出sul1和sul2基因(图3~图5)。
3 讨论
奶牛乳房炎为奶牛养殖业多发疾病,严重制约产业发展,病原微生物感染是其最主要的致病原因 之一。目前抗菌药物仍是奶牛乳房炎的主要治疗手段,但病原菌对抗生素产生耐药性而导致的治疗失败现象日益严峻。同时多种奶牛乳房炎病原菌均为人兽共患病原菌,易对食品安全及人类健康造成威胁[10]。本试验结果表明,受试饲养场奶牛乳房炎大肠埃希菌分离株对磺胺类药物高度耐药(磺胺甲基异恶唑61.1%、磺胺间甲氧嘧啶55.6%),对头孢唑林、头孢噻呋、阿莫西林及多西环素敏感性较高。与国内其他地区报道有所差异,如张宝金等报道[2],宁夏地区奶牛乳房炎大肠埃希菌对氨苄西林耐药率较高,对多西环素及四环素中度耐药,对氟苯尼考、头孢噻肟、头孢唑林较为敏感;王礼伟等报道[1],新疆地区奶牛乳房炎大肠埃希菌对青霉素、磺胺类药物高度耐药,对四环素、氟苯尼考、头孢类药物高度敏感;刘耀川等报道[9],辽宁阜新地区奶牛隐性乳房炎大肠埃希菌分离株对磺胺类药物高度耐药;姚伟等报道[3],辽宁某大型奶牛养殖场乳房炎大肠埃希菌分离株对环丙沙星、头孢噻呋、氧氟沙星高度敏感,对磺胺类药物高度耐药。比较本试验数据与报道数据,多地区奶牛乳房炎大肠埃希菌均对磺胺类药物高度耐药,可能是由于磺胺类药物作为乳房炎治疗的常用药物,使用频率及使用量均较大,病原菌在药物的选择压力作用下,对其耐药性也逐渐增高所致。大部分报道表明,分离株多对头孢类药物特别是头孢噻呋敏感性较高,可能是因为头孢噻呋为较新的头孢菌素类抗菌药物,抗菌效果较好。

图1 大肠埃希菌分离株多药耐药情况
M.DNA标准DL 15 000 ;1~10.部分大肠埃希菌基因组DNA
M.DNA Marker DL 15 000 ; 1-10.Portion genomic DNA ofE.coliisolates
图2部分大肠埃希菌基因组DNA电泳图片
Fig.2 Electrophoresis of portion genomic DNA ofE.coliisolates
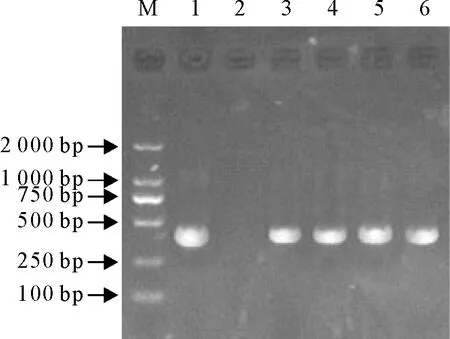
M.DNA标准DL 2 000;1.阳性对照;2.阴性对照;3~6.部分阳性结果
M.DNA Marker DL 2 000; 1.Positive control; 2.Negative control; 3-6.Portion positive results
图3部分sul1基因电泳图
Fig.3 Electrophoresis of portionsul1 gene
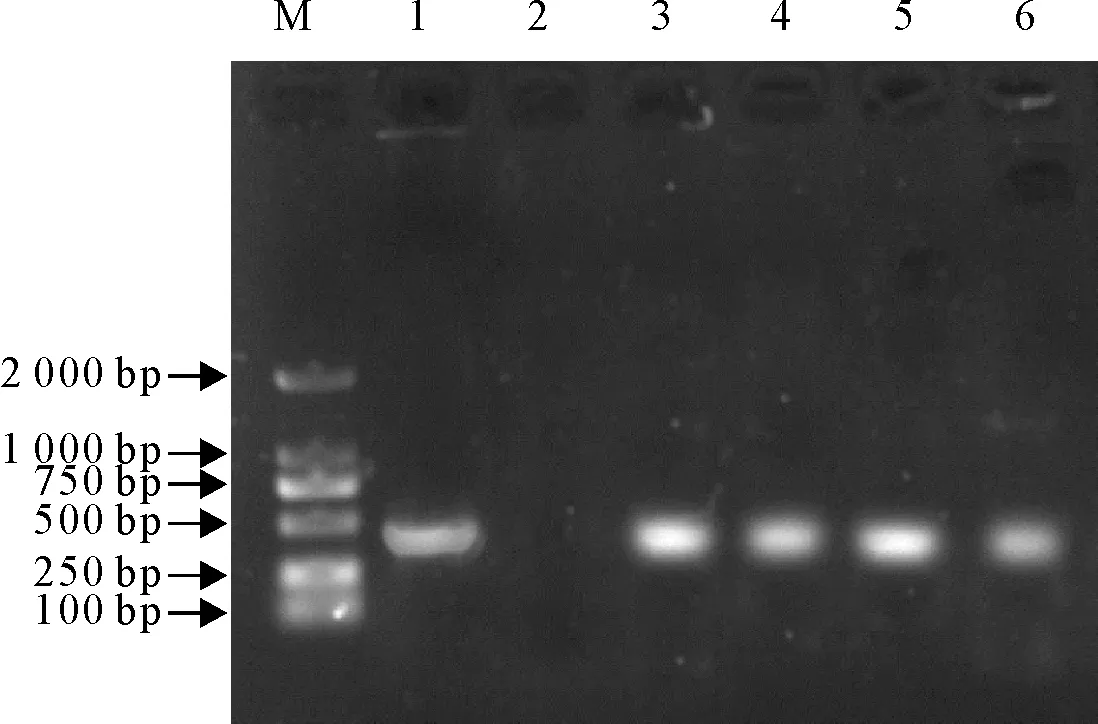
M.DNA标准DL 2 000;1.阳性对照;2.阴性对照;3~6.部分阳性结果
M.DNA Marker DL 2 000; 1.Positive control; 2.Negative control; 3-6.Portion positive results
图4部分sul2基因电泳图
Fig.4 Electrophoresis of portionsul2 gene
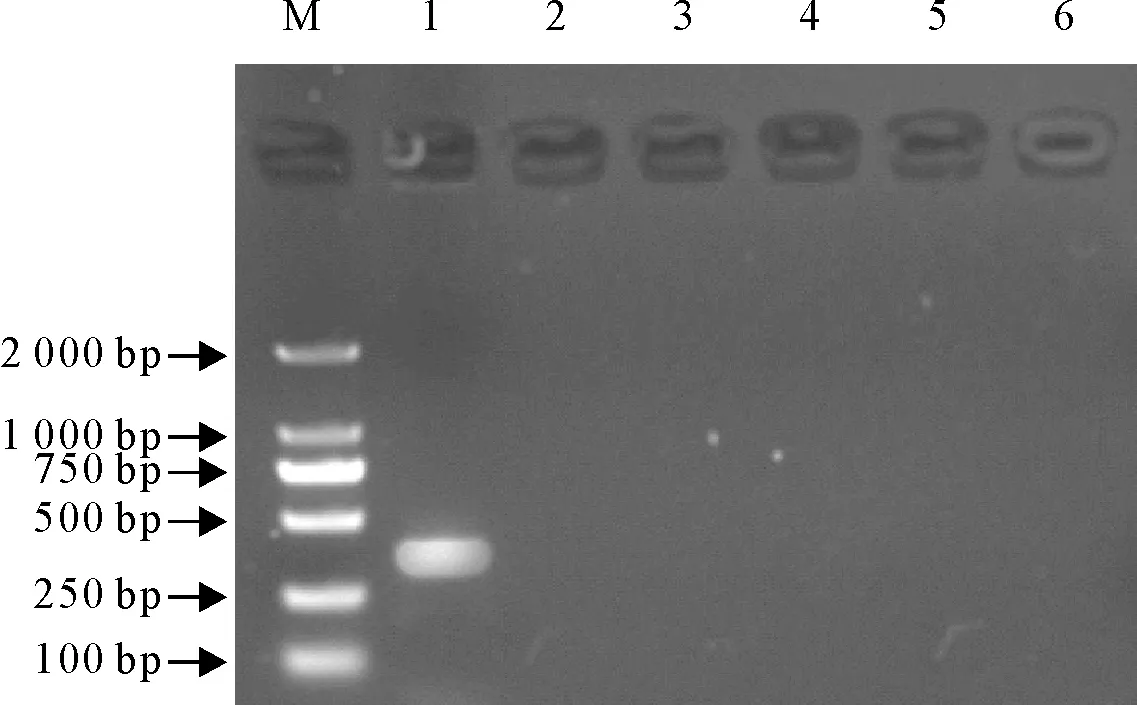
M.DNA标准DL 2 000 ;1.阳性对照;2~6.筛查结果
M.DNA Marker DL 2 000 ; 1.Positive control; 2.Negative control; 3-6.Screening results
图5sul3基因筛查电泳结果
Fig.5 Electrophoresis of portionsul3 gene
sul基因家族作为磺胺类药物耐药的主要分子机制,能够介导病原微生物对磺胺类药物产生不同水平的耐药[11-14]。本试验结果表明,锦州受试饲养场大肠埃希菌sul1、sul2、sul3基因检出率分别为76.0%、17.1%和0.0%,sul1基因检出率最高。陈绍辉等报道[11],吉林地区大肠埃希菌sul2基因检出率为100%;赵晓丽等报道[15],昆明地区大肠埃希菌sul1基因检出率为66.74%;刘开成等报道[10],青岛地区大肠埃希菌sul1、sul2、sul3基因的检出率为43.6%、25.53%和32.73%;吕文发等报道[7],吉林地区大肠埃希菌上述3种基因的检出率分别为37.4%、39.2%和0%;韦庆兰等报道[17],广东地区大肠埃希菌sul1、sul2及sul3基因的检出率分别为73.8%、74.6%及44.7%。地区间大肠埃希菌虽对磺胺类药物均表现较高水平的耐药性,但耐药基因的筛查结果有所不同,可能是由地区间耐药性传递差异导致。在部分磺胺类药物耐药的大肠埃希菌分离株中,并未检测到sul基因家族,提示可能存在其他耐药机制介导耐药,需进一步进行研究。建议该场根据药物敏感性试验结果,选用敏感药物进行乳房炎治疗,在保证治疗结果的同时降低病原菌耐药性产生速度。
[1] 王礼伟,施研进,屈勇刚,等.新疆石河子地区奶牛乳房炎大肠杆菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2014,41(1):203-206.
[2] 张金宝,马春芳,余 婷,等.宁夏地区奶牛乳房炎大肠杆菌毒理基因检测和耐药性分析[J].畜牧兽医学报,2016,47(1):177-182.
[3] 姚 伟,于学武,曹 东,等.辽宁地区奶牛乳房炎细菌性病原分离鉴定及大肠杆菌药敏试验[J].中国畜牧兽医,2016,43(11):3080-3084.
[4] 项开合,张乃生,肖连明,等.奶牛乳房炎的生物学防治[J].动物医学进展,2007,28(3):109-112.
[5] 张 宇,刘 磊,豆艳丽.奶牛乳房炎葡萄球菌的分离鉴定及耐药性分析[J].甘肃农业大学学报,2013,48(6):34-39.
[6] 倪春霞,蒲万霞,胡永浩,等.奶牛乳房炎病原菌的分离鉴定及耐药性分析[J].西北农业学报,2010,19(2):20-24.
[7] 韩 笑,刀筱芳,张焕容,等.奶牛隐性乳房炎主要病原菌分离鉴定及耐药性分析[J].动物医学进展,2015,36(7):131-134.
[8] 丁丹丹,张 震,邓立新,等.河南省奶牛隐性乳房炎主要病原菌分离鉴定与药敏试验[J].中国奶牛,2015(10):23-27.
[9] 刘耀川,张泽辉,王 庄,等.辽宁阜新地区奶牛隐性乳房炎调查及大肠埃希菌药敏试验[J].动物医学进展,2015,36(11):133-136.
[10] 刘开成,郑增忍,单 虎,等.不同地区猪源大肠埃希菌磺胺类药物耐药性研究[J].动物医学进展,2011,32(4):76-79.
[11] 陈绍辉,林雁春,曹海涛,等.吉林省部分地区猪源大肠杆菌磺胺耐药基因sul2的分布研究[J].江西畜牧兽医杂志,2008,16(6):8-10.
[12] 庄林林.三重LAMP检测禽源沙门氏菌、大肠杆菌磺胺耐药基因(sul1、sul2、sul3)研究[D].江苏:扬州大学,2016.
[13] 王 娜,杨晓洪,郭欣妍,等.磺胺类耐药菌种抗性基因sul1的表达规律[J].生态毒理学报,2015,10(5):75-81.
[14] 张 倩,刘功成,屈勇刚,等.石河子地区奶牛乳房炎大肠埃希菌的分离鉴定及耐药性分析[J].动物医学进展,2016,37(7):115-119.
[15] 赵晓丽,胡大春,杨 辉,等.产ESBLs大肠埃希菌磺胺耐药基因sulI的检测与分析[J].昆明医学院学报,2011(12):138-139.
[16] 吕文发,姜厚强,于 录.临床分离大肠杆菌磺胺敏感性及磺胺抗性相关基因的检测[J].吉林农业大学学报,2010,32(3):340-344.
[17] 韦庆兰,张济培,谭华龙,等.广东地区水禽源大肠杆菌耐药性和磺胺类耐药基因检测[J].中国家禽,2015,37(3):54-56.
PreventiveEffectofPanaxatriSetSaponinsonExpressionofRelatedProteininRatswithAcuteSciaticNerveInjury
SONG Xin-tian1,WANG Lin2,ZHANG Jing-ying1,MENG Ling-yi1,GAO Feng1,ZHANG Kun3
(1.JilinProvincialCenterforDiseaseControlandPrevention,Changchun,Jilin,130062,China; 2.JilinCertificationTrainingCenterforFoodandDrug,Changchun,Jilin,130061,China; 3.TheSecondHospitalofJilinUniversity,Changchun,Jilin,130000,China)
To investigate the effect of protein expression changes of acute injury of sciatic nerve in rats induced by PTS,the rat sciatic nerve crush injury model was established and were divided into PTS group,model control group and blank control group randomly,10 rats in each group,each group was administered by intraperitoneal injection,than PTS group was injected with PTS after injury,model control group was injected with same dose normal saline,blank control group was injected with same dose normal saline without sciatic nerve injury.30 days after sciatic nerve injury,the effects of PTS on the expressions of NF-M,MAP-2 and GAP-43 in the sciatic nerve of the injured side were observed by immunofluorescence chemical staining,and the effects of PTS on the injured lateral nerve were observed.The expressions of NF-M,MAP-2 and GAP-43 in the sciatic nerve of injured rats were significantly higher than that in the control group (8.21±1.25,11.90±1.14,0.278±0.042),and the mean optical densities (9.66±0.99,12.43±1.44,0.344±0.040) were significantly different (P<0.01).PTS can promote the expressions of NF-M,MAP-2 and GAP-43 in sciatic nerve injury rats.
panaxtrol saponin; sciatic nerve; protein expression; immunohistochemistry; rat
DrugResistanceTestandResistanceGeneDetectionofE.coliIsolatedfromDairyCowMastitisinaDairyFarminJinzhou
YU Chang-yong
(LiaoningCenterforAnimalEpidemicDiseasePreventionandControl,Shenyang,Liaoning110164,China)
S857.26
A
1007-5038(2017)12-0081-05
2017-04-17
于长泳(1978-),男,辽宁沈阳人,高级兽医师,双学士,主要从事动物疫病防控工作。*
Abstract:To investigate the drug resistance situation of pathogenic bacteria in clinical mastitis of dairy breeding farm in Jinzhou,the milk were sampled and the pathogenic bacteria were isolated,and drug sensitivity tests were carried out,and resistance genes were screened.The results showed that the main pathogen wasE.coli,36 strains were obtained.And drug sensitivity test showed that isolates were highly resistant to sulfanilamide and sensitive to ceftiofur and cefazolin.The isolation rate ofsul1,sul2 andsul3 resistance genes were 76.0%,17.1% and 0% respectively,suggesting thatsul1 gene was the main resistance gene of sulfonamides inE.coliisolates.
Keywords:dairy cow;mastitis;E.coli; drug sensitivity test; resistance gene
