牛传染性鼻气管炎病毒双重PCR检测方法的建立
2017-12-26李平安关平原
徐 娜,杨 帆,雷 宇,李平安,关平原*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
牛传染性鼻气管炎病毒双重PCR检测方法的建立
徐 娜1,2,杨 帆1,2,雷 宇1,2,李平安1,2,关平原1,2*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特 010018)
为建立牛传染性鼻气管炎病毒(IBRV)的双重PCR检测方法,根据GenBank中登录的IBRV gE和gB 基因序列,设计2对特异性引物。结果表明,建立的方法特异性强,对牛支原体、牛副流感病毒3型、牛病毒性腹泻病毒、巴氏杆菌、牛和羊布鲁菌进行检测,结果均为阴性。研究表明,所建立的双重PCR检测方法具有快速、敏感、准确等优点,可以用于IBRV的检测。
牛传染性鼻气管炎;gE、gB基因;双重PCR
牛传染性鼻气管炎(Infectious bovine rhinotracheitis,IBR)是牛的一种急性、热性、接触性传染病,其病原为牛传染性鼻气管炎病毒(Infectious bovine rhinotracheitis virus,IBRV),又名牛疱疹病毒Ⅰ型(BHV-Ⅰ)。该病在临床上表现多种病型,如上呼吸道粘膜炎症、脓疱性外阴阴道炎、龟头炎、结膜炎、犊牛脑膜脑炎、乳房炎、流产等[1]。该病早在20世纪50年代初在美国首次发现,Madin 1956年首次从患牛分离出病毒[2]。1958年Kendrick又从患有传染性脓疱性外阴-阴道炎的病牛中分离病毒,经研究证明,该病毒为IBRV[3]。我国1980年首次从新西兰进口奶牛检测到病毒并分离出来[4]。随后经血清学调查证明,我国大部分地区的牛群中均有 IBRV 感染,给我国养牛业造成了严重的影响。本研究以IBR的gE和gB基因为靶序列,建立了检测IBRV的双重PCR方法。为该病检验检疫提供有效实用
的检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒株及被检材料 IBRV、牛病毒性腹泻病毒(BVDV)、牛布鲁菌疫苗株(A19)、羊布鲁菌疫苗株(REV.1)均由金宇保灵生物药品有限公司惠赠;牛支原体、巴氏杆菌均由本课题组保存;牛副流感病毒3型(BPIV3)核酸由哈尔滨兽医研究所牛羊病课题组薛飞研究员惠赠;牛肺组织采集自呼和浩特市北亚清真食品厂屠宰场。
1.1.2 主要试剂 PremixTaq、DNA Marker 500、pMD-19T载体、DNA/RNA提取试剂盒等均购自宝生物工程(大连)有限公司;AxyPrep质粒DNA提取试剂盒和AxyPrep DNA凝胶回收试剂盒等购自呼和浩特市鸿之惠商贸有限公司。
1.1.3 引物 根据GenBank中登录的IBRV gE、gB基因序列(NC001847.1),用DNAstar进行同源性分析,利用Oligo6.24设计引物和探针,由上海生物工程技术服务有限公司合成。扩增长度分别为112 bp和78 bp(表1)。

表1 PCR引物
1.2 方法
1.2.1 重组质粒标准品的制备 取在牛肾细胞(MDBK)中增殖的BHV-1病毒液,提取病毒DNA。25 μL体系中加入12.5 μL Mix,9.5 μL ddH2O,模板1 μL,上、下游引物各1 μL。循环参数为:94℃ 5 min,94℃ 45 s,59.7℃ 45 s,72℃ 30 s,共30个循环;72℃ 8 min。目的片段长度分别为112 bp、 78 bp,PCR产物回收经试剂盒纯化后克隆于pMD19-T载体,转化至DH5α大肠埃希菌,选取经双酶切鉴定和通过序列测定分析验证的阳性重组质粒作为阳性标准品。测定重组质粒浓度,并根据公式换算成拷贝数[5]。标准品做10倍梯度稀释。
1.2.2 特异性试验 提取牛支原体、BPIV3、BVDV、巴氏杆菌、牛和羊布鲁菌的核酸作为模板,按优化后的反应体系和反应参数,进行特异性试验。取制备的标准品DNA模板作为阳性对照,同时设立阴性对照。
1.2.3 敏感性试验 取100拷贝/μL~109拷贝/μL 10个稀释度作为DNA模板进行双重PCR,观察PCR最低检出模板拷贝浓度。同时设立阴性对照。
1.2.4 临床样品检测 将采集的新鲜组织进行研磨,研磨后的组织加入裂解液进行裂解,以提取样品DNA。将30份牛肺样品采用所建立的方法进行检测。
2 结果
2.1 单重阳性标准品的制备
经质粒PCR鉴定,酶切鉴定以及测序,确定阳性标准品制备成功(图1、图2、图3)。

1.DNA标准DL 500;2.gE基因;3.gB基因 1.DNA Marker DL 500;2.gE gene;3.gB gene
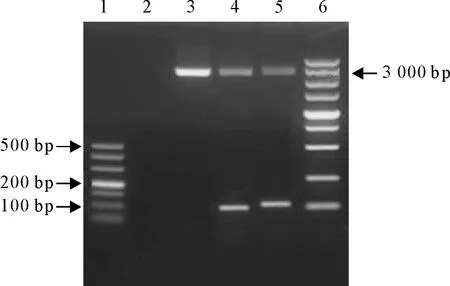
1.DNA标准DL 500;2.阴性对照;3.空载体;4.gB基因;5.gE基因;6.DNA标准DL 5 000
1.DNA Marker DL 500;2.Negative control;3.Empty vector;4.gB gene;5.gE gene;6.DNA Marker DL 5 000
图2 gB和gE基因酶切结果
Fig.2 Enzyme digestion results of gB and gE genes
2.2 双重阳性标准品的制备
以构建的重组质粒pMD-gE、pMD-gB为模板进行扩增,经质粒PCR鉴定、酶切鉴定以及测序,确定阳性标准品制备成功。将制备好的单重阳性标准品按体积比1∶1的比例混合,按照优化后的条件扩增目的片段(图4)。
2.3 双重PCR特异性试验结果
分别以IBRV、牛支原体等不同核酸为模板进行扩增。IBRV标准品DNA扩增出条带,而牛支原体、BVDV、BPIV、巴氏杆菌、牛和羊布鲁菌及阴性对照均未扩增出条带,与牛支原体、BVDV、BPIV3、巴氏杆菌、牛和羊布鲁菌均不发生交叉反应。表明所建立的双重PCR特异性强(图5)。
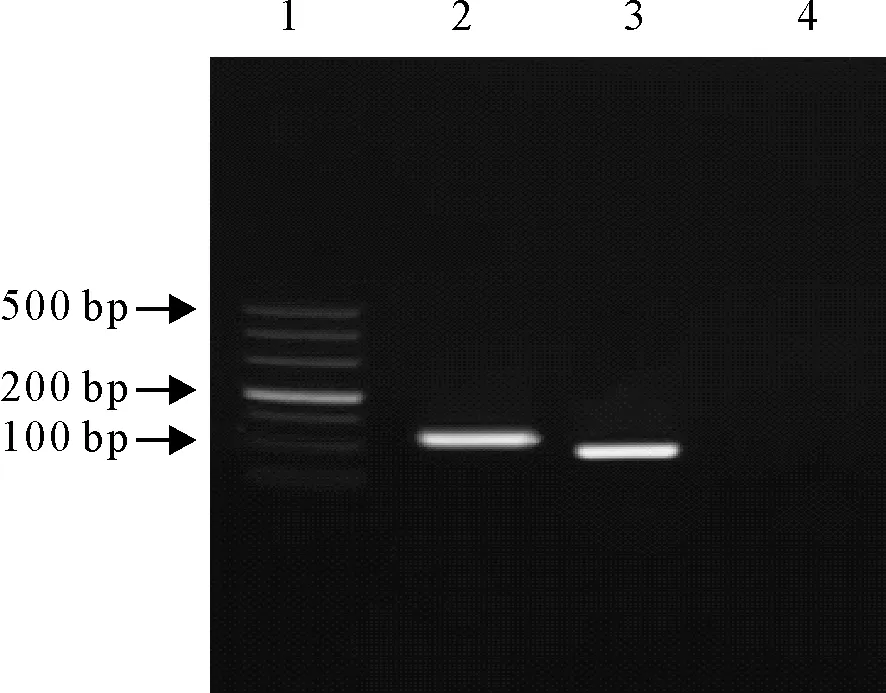
1.DNA标准DL 500;2.gE基因;3.gB基因;4.阴性对照
1.DNA Marker DL 500;2.gE gene;3.gB gene;4.Negative control
图3重组质粒PCR扩增结果
Fig.3 The PCR results of recombinant plasmids

1.DNA标准DL 500;2.阴性对照;3.双重PCR
1.DNA Marker DL 500;2.Negative control;3.Duplex PCR products
图4双重PCR扩增结果
Fig.4 The results of duplex PCR
2.4 双重PCR敏感性试验结果
将重组阳性质粒作梯度稀释,以109拷贝/μL~100拷贝/μL 10个不同稀释度模板进行双重PCR扩增,扩增结果显示,gB、gE基因在30个反应循环内最低检出浓度分别为2.3×103拷贝/μL、2.4×103拷贝/μL(图6)。
2.5 临床样品检测结果
将采集的30份牛肺样品使用建立的双重PCR方法进行检测。结果显示,在30份牛肺样品中检测到6份带有IBRV,将这6份带有IBRV的样品用wang J等建立的PCR方法进行检测,成功检测到IBRV,进一步验证了该检测方法的准确性[6]。
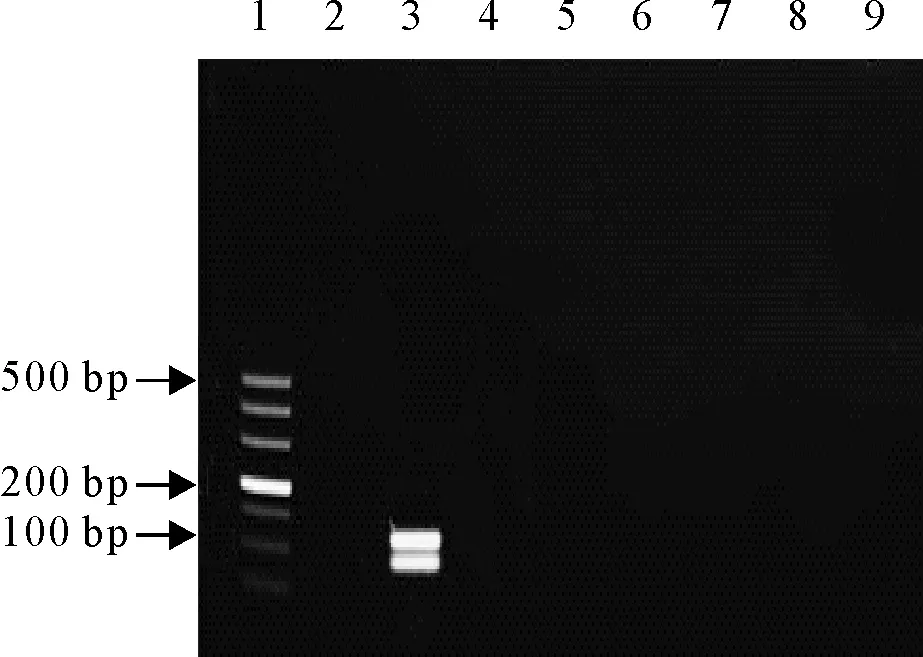
1.DNA标准DL 500;2.阴性对照;3.阳性对照;4~9.牛支原体、BVDV、BPIV3、巴氏杆菌、牛羊布鲁菌
1.DNA Marker DL 500;2.Negative control;3.Postive control;4-9.Bovine mycoplasma,bovine parainfluenza virus type 3,bovine viral diarrhea virus,Pasteurella,Burcella
图5双重PCR特异性结果
Fig.5 The specific results of the duplex PCR
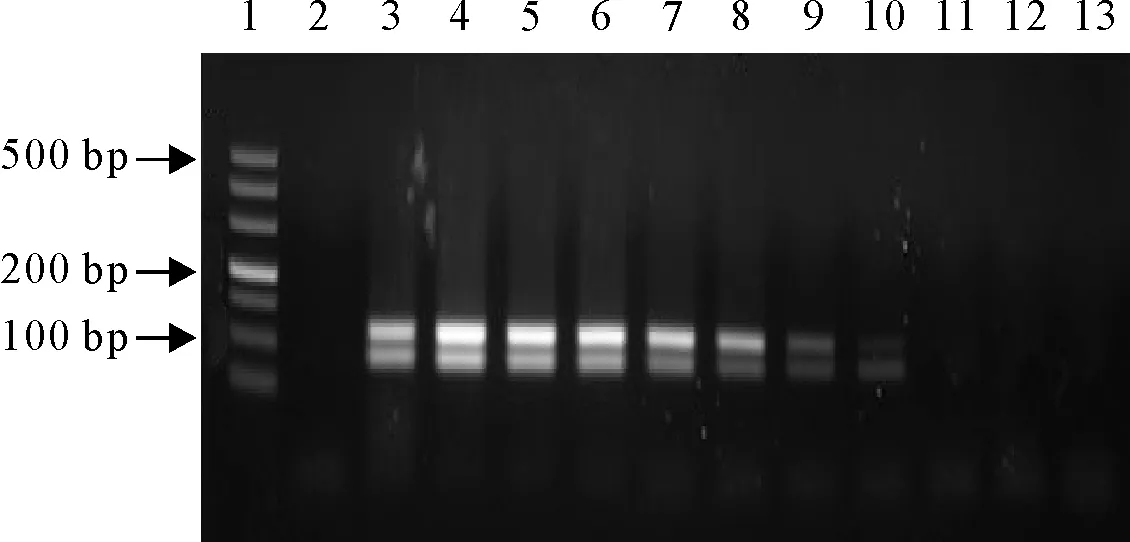
1.DNA标准DL 500; 2.阴性对照;3.阳性对照;4~13.2.3×109拷贝/μL~2.3×100拷贝/μL
1.DNA Marker DL 500;2.Negative control;3.Postive control;4-13.2.3×109copies/μL-2.3×100copies/μL
图6双重PCR敏感性结果
Fig.6 The sensitivity results of duplex PCR
3 讨论
随着我国农牧业的大力发展,不断从国外引进种牛和牛精液及胚胎,因其是我国进境动物检疫二类传染病,为必检项目。经血清学调查显示,在我国大部分地区都有不同程度感染IBRV。因此,建立一种快速、灵敏、适用诊断该病的方法十分重要。在检测的诸多方法中,PCR方法具有快速、灵敏、特异的特点,因此该方法已被广泛应用。目前国内外关于IBRV检测方法已有很多报道,结果表明IBRV感染在我国已经非常普遍,需引起重视并且采取措施加以防控[7-9]。而内蒙古作为中国养牛大省,经相关报道,内蒙古IBRV血清阳性率可高达92%,危害我省养牛业的发展[10]。
本试验建立的针对IBRV的gE、gB基因双重PCR的方法检测敏感度可达约2×103拷贝/μL;特异性强,与牛支原体、牛副流感病毒3型、牛病毒性腹泻病毒、巴氏杆菌、牛和羊布鲁菌均无交叉反应。因此,本实验所建立的双重PCR方法具有快速、稳定和精确的特点,可用于IBRV检的测。
由于疱疹病毒均含有gB、gE基因且较为保守[11],因此本试验根据IBRV gB、gE基因保守序列,设计2对特异性引物,建立荧光定量PCR检测方法,并为鉴别IBRV野毒株和gE基因缺失疫苗株的感染提供技术手段。
[1] 孟庆辉,刘彩侠,崔艳红.牛传染性鼻气管炎的研究概况[J].西北民族大学学报:自然科学版,2008(2):49-54.
[2] Madin S H,Mckercher D G,York C J.Isolation of the infectious bovine rhinotracheitis virus[J].Scinece,1956,124(3225):721-722.
[3] Kendrick J W,Gillespie J H,Mcentee K,et al.Infectious pustular vulvovaginitis of cattle[J].Cornell Vet,1958,48(4):458-495.
[4] 周泰冲,叶章明,黎少权,等.从新西兰进口奶牛中分离传染性鼻气管炎病毒[J].兽医科技杂志,1981(1):6-9.
[5] 邹思湘.动物生物化学[M].4版.北京.中国农业出版社,2005:324-328.
[6] Wang J,O’Keefe J,ORR D,et al.An international inter-laboratory ring trial to evaluate a real-time PCR assay for the detection of bovine herpesvirus 1 in extended bovine semen[J].Vet Microbiol,2007,126(1-3):11-19.
[7] Moore S,Gunn M,Walls D.A rapid and sensitive PCR-based diagnostic submission[J].Vet Microbiol,2000,75:145-153.
[8] Galeota J A,Flores E F,Kit S,et al.A quantitative study of the efficacy of a deletion mutant bovine herpesvirus-1 differential vaccine in reducing the establishment of latency by wildtype virus[J].Vaccine,1997,15:123-128.
[9] 祖立闯,朱远茂,王延辉,等.牛传染性鼻气管炎病毒重组gD蛋白间接ELISA方法的建立及应用[J].中国预防兽医学报,2008,30(7):537-543.
[10] 张鹏飞,霍 蕾,易建钢,等.内蒙古地区牛传染性鼻气管炎血清学调查[J].中国动物检疫,2007(4):42.
[11] Tirabassi R S,Townley R A,Eldridge M G,et al.Characterization of pseudorabies virus mutants expressing carboxy-terminal truncations of gE:evidence for envelope incorporation,virulence,and neurotropism domains[J].J Virol,1997,71(9):6455-6464.
DevelopmentofaNovelRT-LAMPAssayforDetectionofAfricanHorseSicknessVirus
JIANG Rui-jiao1,WU Xu-long1,ZHANG Peng-fei1,WANG Yin1,2,YANG Ze-xiao1,2,YAO Xue-ping1,2
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu,Sichuan,611130,China; 2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,Chengdu,Sichuan,611130,China)
The objective of the study was to establish a rapid,sensitive one-step reverse transcription loop-mediated isothermal amplification (RT-LAMP) assay for detecting African horse sickness virus (AHSV).Based on the AHSV VP7 gene conserved sequence,two pairs of optimal primers were designed.Through optimizing temperature,time and all components concentration in the reaction system,a rapid and specific detection of AHSV was established.The results showed that the method of LAMP manifested a highly efficient amplification for AHSV viral target gene when the reaction system was placed in 63℃ for 45min.Reaction products could be quickly and effectively detected by agarose gel electrophoresis and dye visual identification.The established method was used to detect other susceptible diseases,eventually the results were negative.It confirmed that the method has high specificity.What’s more,the detection limit was 10 copies/μL,which was approximately a 10-fold greater sensitivity than RT-PCR.Therefore,a specific,sensitive and rapid RT-LAMP detection was established,which is suitable for rapid detection with simple conditions.
African horse sickness virus; RT-LAMP; detection
EstablishmentofDuplexPCRforDetectionofInfectiousBovineRhinotracheitisVirus
XU Na1,2,YANG Fan1,2,LEI Yu1,2,LI Ping-an1,2,GUAN Ping-yuan1,2
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia,010018,China; 2.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDisease,MinistryofAgriculture,Hohhot,InnerMongolia,010018,China)
S855.3
A
1007-5038(2017)12-0005-04
2017-03-29
国家科技支撑计划项目(2015BA107B02)子课题(2015BA107B02-07)
徐 娜(1992-),女,内蒙古乌兰察布人,硕士研究生,主要从事动物传染病学研究。*
Abstract:To establish a sensitive detection protocol of infectious bovine rhinotracheitis virus(IBRV),the quantitative real-time PCR was developed with 2 pair of primers targeting the conserved region of IBRV gE and gB genes.The result showed that the established assay possessed high specificity for amplification of IBRV,but no amplifiction of bovine mycoplasma,bovine parainfluenza virus type 3,bovine viral diarrhea virus,Pasteurella,Burcella.This research established the PCR detection method that was of the advantages of rapid,sensitive,accurate and could be used for IBRV detection.
Keywords:Infectious bovine rhinotracheitis; gE and gB genes; duplex PCR
