激活素-卵泡抑素系统在病理性瘢痕中的表达
2017-12-26孙轶峰
侯 亮,张 扬,孙轶峰,高 旭,李 红*
(1.吉林铭医整形美容医院,吉林 长春130021;2.吉林大学药学院,吉林 长春130022)
激活素-卵泡抑素系统在病理性瘢痕中的表达
侯 亮1,张 扬2,孙轶峰1,高 旭1,李 红1*
(1.吉林铭医整形美容医院,吉林 长春130021;2.吉林大学药学院,吉林 长春130022)
目的探讨激活素-卵泡抑素系统(activin-FS)在病理性瘢痕组织中的表达。方法收集2014-06/2017-06吉林铭医整型美容医院整形外科组织标本,分为病理性瘢痕组46例(包括瘢痕疙瘩组25例和增生性瘢痕组21例)、非病理性瘢痕组30例和正常皮肤组27例。采用免疫组化(Immunohistochemistry,IHC)方法分别检测activin A及FS的蛋白表达情况;RNA酶保护试验(RNase protection assay,RPA)分析activin A的mRNA表达水平。结果免疫组化结果显示,activin A和FS在正常皮肤和病理性瘢痕的表皮基底层均有表达,且病理性瘢痕组较正常皮肤组染色程度加深(P<0.05)。RNA酶保护试验结果显示,正常皮肤组和非病理性疤痕组activin-A mRNA表达水平极低,而病理性瘢痕组表达则明显增多。结论activin-FS系统可能参与病理性瘢痕的发生发展。
病理性瘢痕;激活素;卵泡抑素;免疫组织化学;RNA酶保护试验
(ChinJLabDiagn,2017,21:2093)
瘢痕是在创伤愈合过程中必然生成的产物,在临床上包括病理性瘢痕和非病理性瘢痕。机体多数组织损伤均可通过瘢痕的产生来修复,而瘢痕疙瘩(keloid)和增生性瘢痕(hypertrophic scar)则是由于成纤维细胞过度增殖和胶原过度合成所致的结缔组织增生性疾病,为临床多见的病理性瘢痕。瘢痕发生时,增厚的瘢痕组织不仅严重影响美观,而且后期较易发生挛缩导致组织或器官移位变形,甚至关节功能障碍。因此病理性瘢痕的预防和治疗一直是整形外科亟待解决的问题之一,但其病因及形成机制尚不明确。目前认为病理性瘢痕与基因表达、细胞信号传导通路、胶原代谢以及细胞增殖等密切相关[1-3]。有研究表明,激活素A(activin A)及卵泡抑素(follistatin,FS)参与创伤修复过程,刺激成纤维细胞的增殖和合成胶原[4,5]。本研究通过免疫组化方法和RNA酶保护试验,检测activin A-FS系统在病理性瘢痕中的表达情况,旨在为探讨病理性瘢痕的发生发展提供理论依据。
1 材料与方法
1.1标本获取选取2014-06/2017-06吉林铭医整形美容医院整形外科手术患者,取自面部、前胸、肩背部、耳垂部及四肢等部位的组织标本。所有瘢痕组织标本均来自瘢痕修复手术切除的瘢痕组织;正常皮肤组织来自植皮术中供皮区剩余的皮肤组织;常规石蜡切片,HE染色经两位病理医师鉴别诊断;所有患者均获得知情同意。患者均无皮肤、免疫、传染等全身性疾病,瘢痕表面无感染和溃疡,术前均未行激素及免疫抑制剂治疗。病理性瘢痕组分为瘢痕疙瘩25例,年龄18-55岁;增生性瘢痕21例,年龄10-56岁。非病理性瘢痕组30例,年龄9-52岁。正常皮肤组27例,年龄17-54岁。
1.2主要试剂Activin-βA及FS山羊多克隆抗体(R&D Systems);HRP标记的免抗羊和DAB试剂盒(北京中杉金桥生物有限公司);Trizol(美国Gibco公司);RPA试剂盒和同位素α-32P-UTP(美国NEN公司)
1.3免疫组化染色常规制备石蜡切片,连续切成5 μl薄片,黏附于多聚赖氨酸处理的玻片上,在60℃烘箱中烤1.5 h,依次用二甲苯及梯度浓度乙醇水化,蒸馏水洗涤3次。将玻片置于含0.01 M柠檬酸钠(pH 6.0)的缓冲液中,加热处理8 min,PBST洗涤3次;滴加3%H2O2处理30 min,去除内源性的过氧化氢酶。PBST洗涤3次,每次5 min。分别滴加activin-βA(1∶200)或FS(1∶400),4℃孵育过夜,次日PBST洗涤3次,每次5 min;滴加羊抗鼠的二抗,室温孵育1 h后,PBST洗涤3次,每次5 min。滴加50 μl的DAB显色液,边染色边在显微镜下观察。染色结束后自来水冲洗,乙醇梯度脱水,二甲苯脱水干燥,并用中性树脂封片。每批标本均设已知阳性对照和PBS替代一抗的空白对照。每张切片随机选取5个完整且不重叠的高倍镜视野(×400),测定每个视野下阳性反应的累积光密度和所有细胞总面积,采用专业软件分析activin-A和FS蛋白的表达。
1.4RNA酶保护试验利用Trizol提取各组织总RNA。根据文献[6]方法进行RPA,重复独立试验2次。应用文献[7]中activin-βA的cDNA模板。磷酸甘油醛脱氢酶(GAPDH)作为内参照。带有基因表达条带的胶片经扫描后,自动读取基因表达强度的数值。
1.5结果分析与统计学处理应用 SPSS 12.0 软件进行统计学分析,结果均以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1免疫组化检测结果
如图1所示,activin A在正常皮肤(图1a)和病理性瘢痕(图1d)的表皮基底层均有表达;与正常皮肤组相比,病理性瘢痕组染色程度明显加深。FS亦呈现类似的表达情况(图1b和图1e)。病理性瘢痕组activin A和FS蛋白的平均光密度值分别与正常皮肤组相比,两者之间差异均具有统计学意义(P<0.05,表1)。
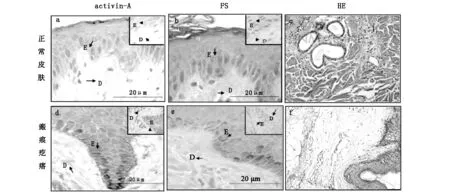
箭头D和E分别代表真皮层和表皮层
2.2RNA酶保护分析
内源性activin-βAmRNA表达情况如图2所示。activin-A mRNA在正常皮肤组和非病理性瘢痕组的表达均为极低水平,而病理性瘢痕组则显著增强。
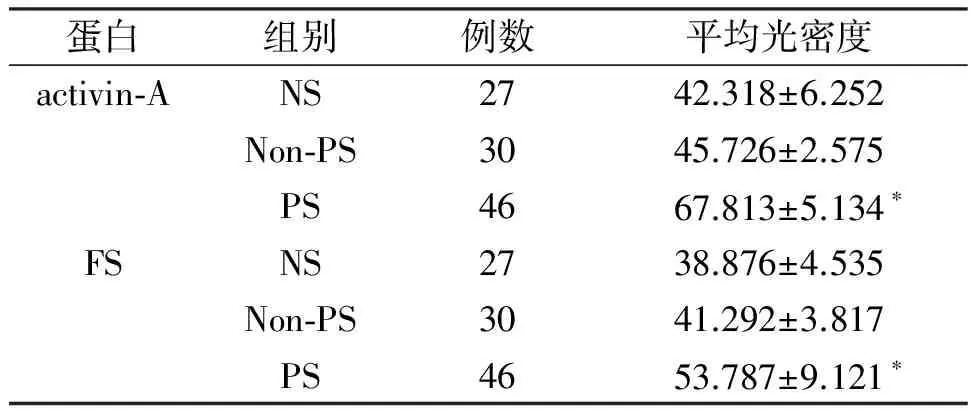
表1 不同组织中激活素A和卵泡抑素蛋白的平均光密度
*与正常皮肤组比较,P<0.05。NS:正常皮肤,Non-PS:非病理性瘢痕,PS:病理性瘢痕。
3 讨论
病理性瘢痕是由于全身以及局部因素的影响,引发异常的损伤修复过程,是创伤部位过度修复的结果。其形成涉及多种细胞、细胞因子、生长因子及细胞间的相互作用。近年来研究显示,转化生长因子(transforming growth factor β,TGF-β)超家族在病理性瘢痕的发病过程中起着重要的桥梁作用,其主要参与抑制免疫反应,调节细胞增殖分化和促进细胞外基`[8,9]。
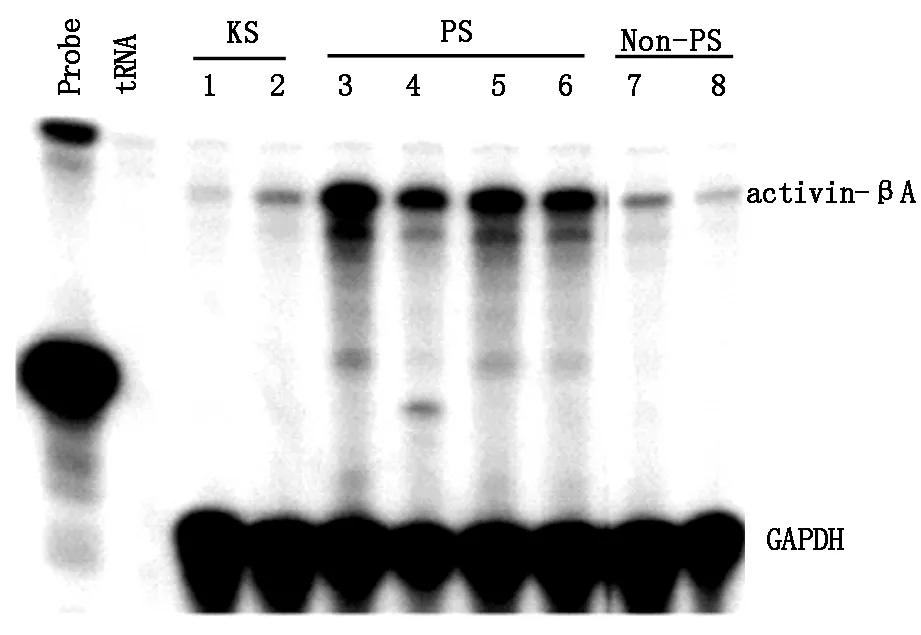
Lane 1,2:正常皮肤,Lane 3-6:病理性瘢痕,Lane 7,8:非病理性瘢痕
图2RNA酶保护试验测定不同组织中activin-βAmRNA表达情况
激活素A(activin A)是TGF-β超家族球蛋白成员之一,是一种由性腺分泌的大分子糖蛋白,其最早在雌猪卵泡液中被分离出来。activin A有3种不同类型的受体,它可在Ⅲ型受体的辅助下,与Ⅱ型受体结合,并与磷酸化的ActR I形成三元络合物,再使胞浆内的Smad 2和Smad 3磷酸化,最后将信号传递至细胞核,并在细胞核中调节目的基因的表达[10]。正常的activin A在维持细胞增殖、黏附、凋亡及分化过程中发挥着重要作用。近年来有研究发现,在诸多组织器官炎症[11]和纤维化[12,13]过程中activin A表达亦增高。卵泡抑素(follistatin,FS)是activin A 的特异性结合蛋白,拮抗activin A的生物活性,进一步抑制细胞内的Smad2/3的信号激活[10]。Munz等[14]发现,高表达activin A的转基因鼠真皮层明显增厚,且伤口愈合加快。而Wankell等在FS转基因鼠中观察结果正好相反[15]。
本研究通过免疫组化方法检测activin A在病理性瘢痕中的表达,发现其在瘢痕疙瘩及增生性瘢痕中的表达均高于正常皮肤和非病理性瘢痕。RNA酶保护性测定亦显示,病理性瘢痕activin-A mRNA表达水平较正常皮肤和非病理性瘢痕显著增强。FS亦显示相似的表达情况。值得注意的是,本实验观察到activin A和FS蛋白均在表皮基底层定位表达,由此可以设想,activin-FS系统能够调控表皮基底角质形成细胞的动力学过程,加速其迁移及上皮间质转化,从而参与创面修复及瘢痕形成[16]。
综上所述,activin A和FS在病理性瘢痕病变的发展中起到重要的作用。因此,通过特异干预两者的表达,必定对核内的转录产生影响,可能会成为病理性瘢痕潜在的治疗策略。
[1]Noguchi F,Nakajima T,Inui S,et al.Alteration of skin wound healing in keratinocyte-specific mediator complex subunit 1 null mice[J].PLoS One,2014,9(8):e102271.
[2]Seifert O,Mrowietz U.Keloid scarring: bench and bedside[J].Arch Dermatol Res,2009,301(4):259.
[3]Unahabhokha T,Sucontphunt A,Nimmannit U,et al.Molecular signalings in keloid disease and current therapeutic approaches from natural based compounds[J].Pharm Biol,2015,53(3):457.
[4]Ham S,Harrison C,Southwick G,et al.Selection of internal control genes for analysis of gene expression in normal and diseased human dermal fibroblasts using quantitative real-time PCR [J].Exp Dermatol,2016,25(11):911.
[5]Mukhopadhyay A,Chan SY,Lim IJ,et al.The role of the activin system in keloidpathogenesis[J].Am J Physiol Cell Physiol,2007,292(4):C1331.
[6]Werner S,Weinberg W,Liao X,et al.Targeted expression of a dominant-negative FGF receptor mutant in the epidermis of transgenic mice reveals a role of FGF in keratinocyte organization and differentiation[J].EMBO J,1993,12:2635.
[7]Hübner G,Hu Q,Smola H,et al.Strong induction of activin expression after injury suggests an important role of activin in wound repair[J].Dev Biol,1996,173(2):490.
[8]Lee WJ,Choi IK,Lee JH,et al.A novel three-dimensional model system for keloid study: organotypic multicellular scar model[J].Wound Repair Regen,2013,21(1): 155.
[9]Li Y,Liu H,Liang Y,et al.DKK3 regulates cell proliferation,apoptosis and collagen synthesis in keloid fibroblasts via TGF-β1/Smad signaling pathway[J].Biomed Pharmacother,2017,91:174.
[10]de Kretser DM,O'Hehir RE,Hardy CL,et al.The roles of activin A and its binding protein,follistatin,in inflammation and tissue repair[J].Mol Cell Endocrinol,2012,359(1-2):101.
[11]Jones KL,de Kretser DM,Patella S,et al.Activin A and follistatin in systemic inflammation[J].Mol Cell Endocrinol,2004,225(1-2):119.
[12]Gaedeke J,Boehler T,Budde K,et al.Glomerular activin A overexpression is linked to fibrosis in anti-Thy1 glomerulonephritis[J].Nephrol Dial Transplant,2005,20(2):319.
[13]Sugiyama M,Ichida T,Sato T,et al.Expression of activin A is increased in cirrhotic and fibrotic rat livers[J].Gastroenterology,1998,114(3):550.
[14]Munz B,Smola H,Engelhardt F,et al.Overexpression of activin A in the skin of transgenic mice reveals new activities of activin in epidermal morphogenesis,dermal fibrosis and wound repair[J].EMBO J,1999,18(19):5205.
[15]Wankell M,Munz B,Hübner G,et al.Impaired wound healing in transgenic mice over-expressing the activin antagonist follistatin in the epidermis[J].EMBO J,2001,20(19):5361.
[16]Kurinna S,Muzumdar S,Köhler UA,et al.Autocrine and paracrine regulation of keratinocyte proliferation through a novel Nrf2-IL-36γ pathway[J].J Immunol,2016,196(11):4663.
Expressionsofactivin-FSsysteminpathologicalscars
HOULiang1,ZHANGYang2,SUNYi-feng1,etal.
(1.JilinMoiiMedicalCosmetologyHospital,Changchun130021,China; 2.SchoolofPharmaceuticalScienceofJilinUniversity,Changchun130022,China)
ObjectiveThe aim of this study is to detect the expressions of activin-A and follistatin (FS) and investigate their relationship in pathogenesis and development of pathological scars.MethodsExperimental samples were obtained from the patients,who underwent burn and plastic surgery at Department of Plastic Surgery,Jilin Moii Medical Cosmetology Hospital,from June 2014 to June 2017,including 25 patients with keloid,and 21 patients with hypertrophic scars.Normal skin and non-pathological scars from additional 27 and 30 cases respectively were served as controls.The expression of activin-A and FS protein in pathological scars,non-pathological scars and normal skin were examined by immunohistochemistry (IHC)(P<0.05).The expression of mRNA in these tissues were performed by RNAase protection assay (RPA).ResultsIHC showed increased localization of both activin-A and FS in the basal layer of epidermis of pathological scars compared with normal tissue.Increased mRNA expression for activin A was observed in pathological scars by performing RPA.ConclusionThese findings emphasize the importance of the activin-FS system in biology and pathogenesis of pathological scars.
pathological scars;activin;follistatin;immunohistochemistry;RNAase protection assay
吉林省卫生计生青年科技骨干培养计划项目(编号:2017Q032)
*通讯作者
1007-4287(2017)12-2093-04
R619+.6
A
2017-08-14)
