基于CdTe量子点荧光猝灭-恢复法测定N-乙酰-L-半胱氨酸
2017-12-26韦春锦
赵 丹,韦春锦,曾 梅,王 芬
(中南民族大学 药学院,武汉 430074)
基于CdTe量子点荧光猝灭-恢复法测定N-乙酰-L-半胱氨酸
赵 丹,韦春锦,曾 梅,王 芬
(中南民族大学 药学院,武汉 430074)
以CdTe量子点作为荧光探针,Hg2+为猝灭剂,建立了一种基于荧光猝灭-恢复模式的N-乙酰-L-半胱氨酸(NAC)检测方法.考察了不同缓冲溶液、pH值、金属离子、Hg2+的浓度及反应时间对反应体系的影响,探讨了Hg2+对CdTe量子点荧光猝灭和NAC对CdTe量子点荧光恢复的机理.结果表明:在pH=7.8的B-R缓冲溶液中,当Hg2+的浓度为1.0×10-6mol/L、NAC的浓度范围为5.0×10-7~2.0×10-5mol/L时,NAC的浓度与量子点的荧光恢复程度之间呈良好的线性关系,可实现对NAC的快速定量分析.该检测方法较常规的方法操作简便、检测速度快、灵敏度高.
CdTe量子点;N-乙酰-L-半胱氨酸;Hg2+;荧光猝灭-恢复
量子点(QDs)是一种新型的荧光纳米材料,具有光稳定性好,生物相容性好、发射波长可调,发射光谱窄而对称,抗光漂白性强等优点,现已被广泛研究[1,2].又因其具有的独特的光学性质被广泛应用于生物标记、金属离子含量测定、细胞成像、疾病诊断等方面[3-6].近年来,基于量子点的猝灭-恢复体系的检测模式已引起很多人的关注.其机制为先加入猝灭剂使QDs荧光强度降低,称之为“光关闭”状态,再加入能与猝灭剂结合的“捕获剂”后,恢复QDs荧光.相较于传统的单向模式[7-11](单纯的荧光猝灭或荧光增强),“开关”模式的选择性好、灵敏性高,有利于干扰的排除和实际样品的检测.例如,徐琴等[12]建立了ZnS QDs-Ni2+-谷胱甘肽(GSH)的“开关”检测模式,实现了对实际样品中GSH的检测及作用机制的探究.黎舒怀等[13]利用了量子点“开关”技术,建立了一种测定诺氟沙星的方法.刘生燕等[14]建立了CdTe QDs-Cu2+-硫普罗宁的“开关”检测模式,通过电荷转移和配位作用产生的荧光可逆现象实现了硫普罗宁的快速灵敏检测.
N-乙酰-L-半胱氨酸(NAC)是L-半胱氨酸的衍生物,结构中含有亲核的-SH,能与亲电的氧化基团直接作用而发挥其抗氧化作用.NAC也具有强烈的黏液溶解作用,在治疗呼吸系统疾病方面发挥着重要作用[15].常规测定NAC的方法有高效液相色谱法[16]、容量法[16]、普鲁士蓝光度法[17]等,然而,采用荧光猝灭-恢复方法测定NAC的研究鲜见报道.
本实验以优质的水溶性CdTe QDs为荧光探针、Hg2+为猝灭剂、含巯基NAC作为恢复剂,建立了QDs- Hg2+-NAC荧光可逆体系,可实现对NAC的快速检测.该方法操作简单,选择性和灵敏度高.
1 实验部分
1.1 试剂与仪器
NAC、Tris、3-巯基丙酸(阿拉丁),β-巯基乙胺、L-半胱氨酸盐酸盐一水物(上海源叶生物科技有限公司),硝酸银(中国上海试剂一厂), CuCl2·2H2O、H3BO3、H3PO4、CH3COOH、KH2PO4、Na2HPO4·12H2O、HCl(国药集团化学试剂有限公司),Hg(CH3COO)2、HgCl2(贵州省铜仁化学试剂厂),GSH、L-Cys、L-Tyr、(L-Glu、L-Gly、L-Trp、L-Lys、L-Leu、L-His、L-Pro、L-Ser、L-Ala、L-Phe、L-Val、L-Ile、L-Met、L-Asp均产自Biosharp;乙酰半胱氨酸颗粒(海南赞邦制药有限公司),实验所用的CdTe量子点[18]为实验室自制,室温测定,实验用水为超纯水.
荧光光度仪(LS55型,美国PE),紫外可见分光光度仪(Lambda-35型,美国PE),电子天平(CP 214,上海奥豪斯仪器),超纯水机(艾科浦Aswo-0005-U,颐洋企业),实验室pH计(pH5J-3F,上海精密科学仪器).
1.2 实验方法
CdTe QDs自身的荧光强度(I0):比色皿中加入900 μL缓冲溶液和100 μL的CdTe QDs,测定体系的荧光.
CdTe QDs与Hg2+的相互作用(I1):比色皿中加入850 μL缓冲溶液、50 μL(1.0×10-6mol/L)的Hg2+溶液和100 μLCdTe QDs,测定体系的荧光.
CdTe QDs-Hg2+-NAC之间的相互作用(I2):比色皿中加入800 μL缓冲溶液、50 L(1.0×10-6mol/L)的Hg2+溶液、50 μL(4.0×10-5mol/L)NAC溶液和100 μL CdTe QDs,测定体系的荧光.计算猝灭率和恢复率的公式分别为:(I0-I1)/I0,(I2-I1)/I0.实验过程中激发和发射单色器狭缝均为10 ~ 15 nm,激发波长均为380 nm,所用量子点的浓度为5×10-7mol/L.
2 结果与讨论
2.1 CdTe QDs的光学性质
作为荧光探针的量子点,其光学性能对NAC的检测具有重要的意义. CdTe的荧光光谱和紫外吸收光谱结果见图1.如图1所示:CdTe QDs的第一激子吸收峰为535 nm,最佳发射波长为570 nm,其荧光发射峰窄且对称,说明所合成的CdTe QDs尺寸分布较窄,粒径均一,具有稳定的光学性质.
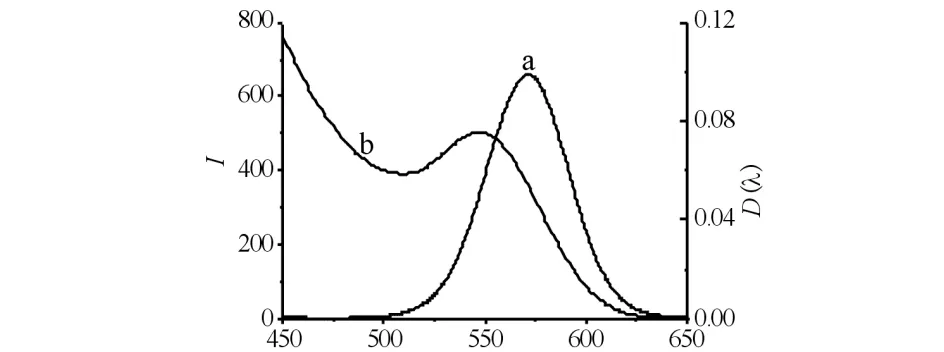
λ/nm图1 CdTe QDs的荧光光谱图(a)和紫外吸收光谱图(b)Fig.1 Fluorescence spectrum (a) and UV-vis absorption spectrum (b) of CdTe QDs
2.2 不同金属离子对CdTe QDs的猝灭作用
不同的金属离子对QDs荧光强度的影响结果见图2.如图2所示:常见金属离子Ag+、Cu2+、Hg2+对CdTe QDs的猝灭作用中Hg2+的猝灭效果最好;而不同阴离子对CdTe QDs的猝灭影响不大.在相同浓度(5×10-7mol/L)的金属溶液中,Hg(Ac)2的猝灭率最大,为62.6%,故后续实验选择Hg(Ac)2作为猝灭剂.量子点的荧光猝灭主要有能量转移、电子转移、表面吸附等方式[19].该体系中Hg2+对CdTe QDs的猝灭机制是以电子转移为主,汞离子存在空轨道,电子从QDs表面的空穴中转移到Hg2+,使Hg2+作为电子受体结合在QDs的表面[20],导致荧光猝灭.

金属离子图2 AgNO3、CuCl2、Hg(Ac)2、HgCl2对CdTe QDs的猝灭作用Fig.2 Euenching effects of AgNO3, CuCl2, Hg(Ac)2 and HgCl2 on CdTe QDs
2.3 CdTe QDs的恢复作用
采用金属离子(Hg2+)猝灭CdTe QDs的荧光,加入含巯基的小分子NAC恢复被猝灭的CdTe QDs的荧光,其猝灭和恢复结果见图3. 如图3所示:比较β-巯基乙胺、3-巯基丙酸、L-半胱氨酸盐酸盐一水物和GSH等几种常见的含巯基化合物与NAC对QDs-Hg2+猝灭体系的恢复作用. 4.0×10-5mol/L的β-巯基乙胺和3-巯基丙酸对量子点本身有干扰,且均毒性较大,故不以此作为恢复剂.相同浓度的L-半胱氨酸盐酸盐一水物对猝灭体系几乎无恢复作用,而GSH对猝灭体系的恢复作用较NAC强,由于GSH是由谷氨酸、半胱氨酸和甘氨酸组成的含Y-酰胺键和巯基的三肽,具有良好的Hg2+结合能力和较大的空间立体结构,有利于将猝灭剂拉离量子点表面,使猝灭体系的荧光得以恢复;但此浓度的GSH能使量子点本身的荧光增强,故也不以GSH作为恢复剂.而NAC的恢复作用明显且毒性低,是理想的恢复剂.
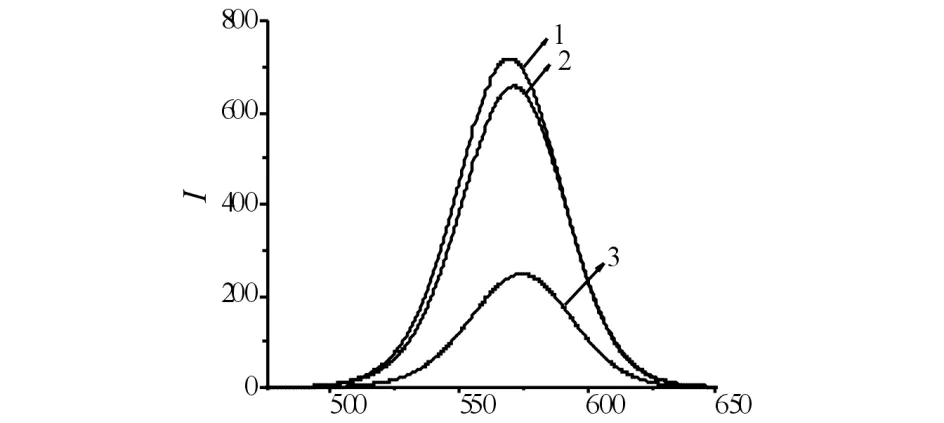
λ/nm1) QDs ; 2) QDs+Hg2++NAC ; 3) QDs+Hg2+ 图3 Hg2+和NAC对CdTe QDs的荧光猝灭-恢复作用Fig.3 Fluorescence ″turn off-on″ effect of Hg2+ and NAC on CdTe QDs
多种氨基酸对QDs-Hg2+猝灭体系的恢复结果见图4. 如图4所示:当固定Hg2+浓度为1.0×10-6mol/L时,用相同浓度4.0×10-5mol/L NAC和多种常见的氨基酸分别作用于猝灭体系,发现除了Cys外其他的氨基酸对猝灭体系的恢复效果不明显.Cys结构中含有-SH,对CdTe QDs的荧光也具有一定的恢复作用,但是其对猝灭体系的恢复效果远不如NAC好.NAC和L-Cys虽同为巯基化合物,但是L-Cys的分子结构相对简单,空间位阻效应较小,而NAC的结构比L-Cys复杂,-SH与QDs表面的Hg2+共价结合形成Hg-S键[14],产生的空间位阻,使Hg和QDs的距离增加,减弱电子转移而引起荧光恢复,所以NAC对猝灭体系的恢复效果最好.
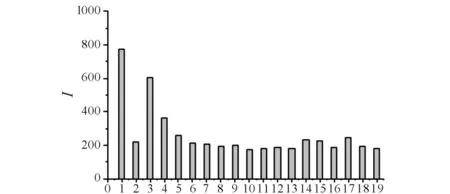
1) 基值 ; 2) 猝灭值 ; 3) NAC ; 4) Cys ; 5) Tyr ; 6) Glu ; 7) Gly ; 8) Trp ; 9) Lys ; 10) Leu ;11) His ; 12) Pro ; 13) Ser ; 14) Ala ; 15) Phe ; 16) Val ; 17) Ile ; 18) Met ; 19) Asp图4 NAC及不同种类氨基酸对CdTe QDs-Hg2+猝灭体系的恢复作用Fig.4 Restoration of CdTe QDs-Hg2+ quenching system in the presence of NAC and different kinds of amino acids
2.4 检测条件的优化
2.4.1 缓冲体系的影响
为筛选最佳的缓冲体系,考察了在生理pH值(pH=7.0, 8.0)下,Hg2+(2.0×10-7mol/L)作荧光猝灭剂,NAC(4.0×10-5mol/L)作捕获剂,PBS、B-R、Tris-HCl三种缓冲体系对CdTe QDs-Hg2+检测体系的影响,检测结果见图5. 如图5所示:B-R缓冲溶液相比于PBS、Tris-HCl缓冲溶液,具有更好的恢复作用,在pH=7.0、8.0时,荧光恢复率分别为45.1%、59.67%.故后续实验中选择B-R缓冲溶液.

图5 B-R、PBS、Tris-HCl缓冲溶液对CdTe QDs-Hg2+-NAC体系的影响Fig.5 Effect of B-R, PBS, Tris-HCl buffer on CdTe QDs-Hg2+-NAC system
2.4.2 缓冲体系的pH值的影响
缓冲体系的pH值变化影响CdTe QDs表面配体的存在形式.不同pH条件下,QDs初始荧光强度差别很大.CdTe QDs在pH 6.0 ~ 10.0光学特性良好、荧光性质稳定, pH值为6.0、7.0、7.5、7.8、8.0、8.3、9.0、10.0的B-R缓冲溶液对CdTe QDs-Hg2+-NAC体系的影响结果见图6. 如图6所示:Hg2+对体系的猝灭能力在pH 6.0~7.0内稍有上升,而在pH 7.0~10.0范围内呈现明显的下降趋势;NAC对CdTe QDs-Hg2+猝灭体系的恢复能力在pH 6.0 ~ 7.8范围内呈上升趋势,pH 7.8 ~ 10.0范围内下降,因此,在pH=7.8时荧光恢复率最大,为51.5 %.综合考虑猝灭率和恢复率,缓冲体系pH=7.8时检测结果最优.

图6 不同pH值下B-R缓冲溶液对CdTe QDs-Hg2+-NAC体系的影响Fig.6 Effect of B-R buffer under different pH values on CdTe QDs-Hg2+-NAC system
2.4.3 反应时间的影响
Hg2+与NAC相互作用的时间也是影响体系检测效果的一个重要因素.实验考察了Hg2+和NAC的不同作用时间对可逆荧光检测体系的影响,结果如图7所示.由图7可见:反应时间较短时,体系的恢复率逐渐上升;反应时间为12 min时,CdTe QDs、Hg2+和NAC三者间的相互作用达到相对的平衡,体系的荧光强度最高,恢复率最大,可达52.8%,继续延长反应时间,体系的恢复率逐渐下降.故本实验选择最佳反应时间为12 min.
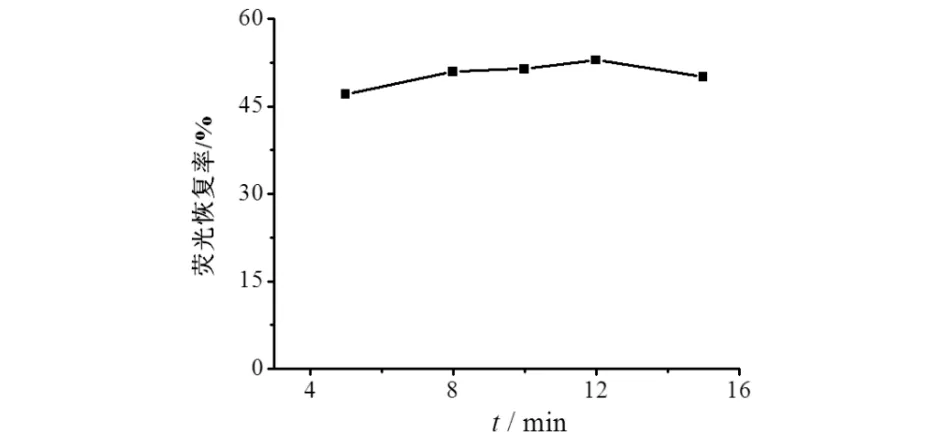
图7 不同反应时间对荧光恢复率的影响Fig.7 Effect of different reaction time on the fluorescence recovery rate
2.4.4 Hg(Ac)2浓度对猝灭-恢复体系的影响
Hg2+对CdTe QDs的荧光猝灭作用呈浓度依赖性,表现为浓度越大,猝灭作用越强,Hg2+的浓度是体系的荧光恢复中的重要参数.优化Hg2+浓度时,要保证Hg2+对QDs的良好猝灭作用和NAC对猝灭体系良好的恢复效果,结果见图8.如图8所示:固定NAC的浓度为4.0×10-5mol/L,Hg(Ac)2的浓度在2.0×10-7~ 1.3×10-6mol/L范围内变化时,Hg2+对QDs的猝灭率从35.1%逐渐增长到77.4%.
为保证其灵敏度,还考察了固定更低浓度的NAC(2.0×10-5mol/L)对1.0×10-6mol/L和1.3×10-6mol/L Hg2+猝灭的CdTe QDs荧光恢复作用,结果见表1.如表1所示:当Hg(Ac)2浓度为1.0×10-6mol/L该体系同时具有较好的猝灭率和恢复率,故以此浓度条件用于后续研究.
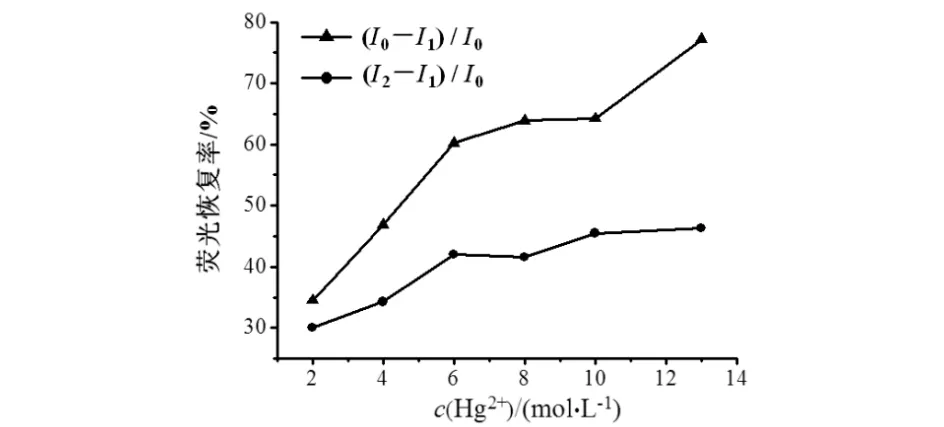
图8 不同浓度的Hg(Ac)2对QDs-Hg2+-NAC荧光猝灭-恢复的影响Fig.8 Effect of different concentration of Hg(Ac)2 on the flowrescence ″turn off-on″ of QDs-Hg2+-NAC

c[Hg(Ac)2]/(mol·L-1)基值猝灭率/%恢复率/%1.0×10-673863.049.41.3×10-673871.225.6
2.4.5 工作曲线
在最佳检测条件下(B-R缓冲溶液,pH=7.8,反应时间为12 min),实验先考察了NAC从5.0×10-7~ 2.0×10-5mol/L这个范围浓度对CdTe QDs本身的影响,结果表明:高浓度NAC对CdTe QDs本身有微弱的荧光增强作用,但在低浓度时几乎无影响.固定Hg(Ac)2的浓度为1.0×10-6mol/L,依次将NAC浓度从5.0×10-7mol/L增至2.0×10-5mol/L,探究NAC浓度变化对猝灭体系的恢复情况的影响,结果见图9.如图9所示:在5.0×10-7~ 2.0×10-5mol/L,QDs的恢复率从5.0%上升到44.1%,且具有良好的线性关系,其线性方程为:I2/I0=0.47008 + 0.01992c,相关系数R2=0.99845,标准偏差SD=0.00929,表明该体系可实现在5.0×10-7~2.0×10-5mol/L浓度范围内对NAC的定量分析.

图9 不同NAC浓度对检测体系荧光恢复的影响Fig.9 Effect of different concentration of NAC on the fluorescence recovery of detection system
2.4.6 样品分析
将一定量的L-His、L-Met、L-Trp、L-Leu、L-Ser溶解于超纯水中,分别测定其对猝灭体系的影响,结果发现5种氨基酸的浓度为4.0×10-2mol/L时对猝灭体系无影响.向加有混合样品的猝灭体系中加入不同量的乙酰半胱氨酸样品后,在荧光光度仪上测定样品中乙酰半胱氨酸的含量,结果见表2.由表2可知:回收率为99.6%~102.2%,结果令人满意.

表2 加样回收试验结果
3 结语
本文建立了一种基于CdTe QDs荧光猝灭-恢复模式快速测定NAC的新方法.以Hg2+为猝灭剂,通过电子转移作用猝灭CdTe QDs的荧光,以NAC为恢复剂,NAC中的巯基与Hg2+形成S—Hg键,可减弱QDs与Hg2+之间的电子转移作用,使QDs的荧光恢复,Hg2+具有良好的猝灭效果.最佳检测条件为:B-R缓冲溶液、pH=7.80、Hg2+(1×10-6mol/L)、反应时间12 min. QDs荧光恢复程度与NAC的浓度在5×10-7~ 2×10-5mol/L范围内呈现出良好的线性关系,说明该体系可应用于NAC的快速定量分析.
[1] 赵 丹, 李娇甜, 杨天鸣, 等. L-半胱氨酸修饰的水溶性掺杂型CdZnTe量子点的水热法制备和表征[J]. 中南民族大学学报(自然科学版), 2013,32(3): 50-53.
[2] 裴国凤, 王海波, 向荣华, 等. CdTe量子点双层加壳增强其化学和生物稳定性[J]. 中南民族大学学报(自然科学版), 2013, 32(4): 33-36.
[3] Luo Q Y, Lin Y, Li Y, et al. Nanomechanical analysis of yeast cells in cdse quantum dot biosynthesis[J]. Small, 2014, 10(4): 699-704.
[4] 周 杰,吴云华.Cds量子点/过氧化酶纳米杂化功能材料的制备及分析应用[J].中南民族大学学报(自然科学版),2008,27(1):5-8.
[5] He D X, Wang D X, Quan W J, et al. Applications of functionalized quantum dots in bioanalysis, imaging and targeting delivery[J]. Med Sci J Centr South China, 2015,43(5):481-486.
[6] 黄正喜,钱 雷,胡振龙,等.水溶型CdSe量子点的制备及与Schiff碱的相互作用拆分头孢氨苄对映体[J].中南民族大学学报(自然科学版),2013,32(4):7-10,15.
[7] 王蓓蓓, 商 欢,王 琪, 等. CdTe量子点作为荧光探针检测皮蛋中微量铜[J]. 食品科学, 2016, 37(2): 172-177.
[8] 何春萍, 谭 丽. CdTe量子点荧光猝灭法对银离子和钙离子的测定[J]. 怀化学院学报, 2011, 30(8): 11-15.
[9] 徐基贵, 张俊俊, 陈志兵, 等. CdTe量子点荧光猝灭法测定痕量铬(III)[J]. 分析试验室, 2011, 30(1): 26-28.
[10] 李满秀, 王丽娟, 薄 乐. 水溶性CdTe量子点荧光法测定青霉素的研究[J]. 分析科学学报, 2015, 31(3): 397-400.
[11] 陈志兵, 李梦瑶, 孙 莉, 等. CdTe量子点荧光猝灭法测定槲皮素[J]. 分析试验室, 2013(4): 17-19.
[12] 徐 琴, 魏焕平, 胡效亚. 基于ZnS量子点荧光猝灭-恢复方法测定还原型谷胱甘肽[J]. 分析化学研究简报, 2013, 41(7): 1102-1106.
[13] 黎舒怀, 陶慧林, 徐铭泽, 等. 新型量子点“开关”测定痕量诺氟沙星[J]. 分析化学研究简报, 2012, 40(9): 1450-1453.
[14] 刘声燕, 刘怡博, 王益林, 等. CdTe量子点 “开关” 测定硫普罗宁[C]//中国化学会光化学专业委员会.第十三届全国光化学学术讨论会论文集.西安:中国化学会,2013:95.
[15] 夏海玲, 李鲜峰, 肖 芸.N-乙酰半胱氨酸在几种肺部疾病中应用的研究进展[J].中国预防医学杂志, 2015(4): 312-317.
[16] 方红英,席建军,王福根,等. 2种测定N-乙酰半胱氨酸含量的方法比较[J]. 中国药房, 2012, 23(8): 731-732.
[17] 涂常青, 温欣荣. 普鲁士蓝光度法测定药物中乙酰半胱氨酸含量[J]. 化学研究与应用, 2015(6): 940-944.
[18] Li J, Yang T, Chan W H, et al. Synthesis of high-qualityN-acetyl-l-cysteine-capped CdTe quantum dots by hydrothermal route and the characterization through MALDI-TOF mass spectrometry[J]. J Phys Chem C, 2013, 117(37): 19175-19181.
[19] 王柯敏, 王益林, 李朝辉, 等. CdTe量子点荧光猝灭法测定铜离子的研究[J]. 湖南大学学报(自然科学版), 2005, 32(3): 1-5.
[20] Jalilehvand F, Leung B O, Izadifard M, et al. Mercury (II) cysteine complexes in alkaline aqueous solution[J]. Inorg Chem, 2006, 45(1): 66-73.
Fluorescent“Turnoff-on”SensorforDeterminationofN-acetyl-L-cysteineBasedonCdTeQuantumDots
ZhaoDan,WeiChunjin,ZengMei,WangFen
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China)
By using CdTe quantum dots as the fluorescence probe and Hg2+as the quencher, the recognition ofN-acetyl-L-cysteine based on the fluorescence “turn off-on” mode was established. The impact of different buffer solutions, pH value, metal ions, the concentration of Hg2+, and reaction time were discussed, and the mechanism of the fluorescence quenching by Hg2+and the recovery by NAC was investigated. The results showed that the concentration of NAC varied linearly with the fluorescence recovery within a concentration of 5.0×10-7~2.0×10-5mol/L[B-R buffer, pH=7.8,c(Hg2+)=1.0×10-6mol/L].Thus fast and quantitative recognition of NAC could be realized. Compared with traditional detection techniques, the reported method is simple, fast and highly sensitive.
CdTe QDs;N-acetyl-L-cysteine; Hg2+; fluorescence ″turn off-on″
2016-09-09
赵 丹(1981-),女,副教授,博士,研究方向:水溶性量子点的合成与应用研究,E-mail:wqzhdpai@163.com
湖北省自然科学基金资助项目(2016CFB615),中央高校基本科研业务费专项资金资助项目(CZW15017)
O657.32
A
1672-4321(2017)04-0017-05
