鞍区碰撞瘤
2017-12-26龚静苏艳艳雷松刘晓羽张尚福
龚静 苏艳艳 雷松 刘晓羽 张尚福
·临床病理报告·
鞍区碰撞瘤
龚静 苏艳艳 雷松 刘晓羽 张尚福
目的报道1例垂体腺瘤合并恶性蝾螈瘤的鞍区碰撞瘤患者,结合相关文献,总结其临床病理学特征、诊断与鉴别诊断、治疗及预后。方法与结果男性患者,59岁,因双眼视力下降、视野缺损伴头晕首次入院,头部MRI显示鞍区占位性病变。遂行鼻内镜下经鼻蝶入路垂体腺瘤切除术,手术部分切除肿瘤。术后3个月患者出现视力下降至失明伴头痛再次入院,头部CT显示鞍区和鞍上占位性病变,遂行开颅鞍区和鞍上肿瘤切除术。两次手术标本组织学形态观察,肿瘤组织由呈巢团状和梁索状排列的上皮细胞和弥漫性分布的梭形细胞组成,两种肿瘤成分单独或交错分布,首次手术标本中梭形细胞形态温和,核分裂象罕见,再次手术标本中梭形细胞密度增加,胞核深染,核分裂象易见,可见散在分布的胞质红染的横纹肌样分化。免疫组织化学染色,垂体腺瘤成分(上皮细胞区域)细胞角蛋白8、嗜铬素A、突触素和促甲状腺激素呈阳性,恶性蝾螈瘤成分(梭形细胞区域)CD56、CD57、钙视网膜蛋白呈阳性,S-100蛋白、结蛋白和肌细胞生成蛋白呈局灶性阳性。超微结构观察,垂体腺瘤区域胞质中粗面内质网丰富,可见圆形分泌颗粒,梭形细胞胞膜外缘可见不连续基膜。最终病理学诊断为鞍区碰撞瘤(无功能性促甲状腺激素腺瘤合并恶性蝾螈瘤)。患者再次手术后6个月死亡。结论垂体腺瘤合并恶性蝾螈瘤的鞍区碰撞瘤极为罕见,术前临床表现和影像学检查难以明确诊断,仍依靠对充分取材的手术标本进行组织学形态、免疫组织化学染色和超微结构观察。含有恶性蝾螈瘤成分的鞍区碰撞瘤预后较差。
垂体肿瘤; 腺瘤; 神经鞘肿瘤; 蝶鞍; 病理学; 免疫组织化学
垂体腺瘤是最常见的鞍区肿瘤,伴或不伴垂体激素分泌,功能性垂体激素分泌可以引起相应临床症状。恶性蝾螈瘤系恶性外周神经鞘膜瘤(MPNST)伴横纹肌样分化,是少见的恶性肿瘤,发生于颅内者更为罕见[1]。碰撞瘤(collision tumor)是指两种或以上相互独立的原发肿瘤相互碰撞或相互浸润形成的肿瘤,即两种或以上肿瘤成分同时发生于同一部位。鞍区碰撞瘤少见,多为垂体腺瘤合并节细胞瘤、颅咽管瘤等,而垂体腺瘤合并恶性蝾螈瘤尚未见诸报道。本文报告1例垂体腺瘤合并恶性蝾螈瘤的鞍区碰撞瘤患者并复习鞍区碰撞瘤相关文献,探讨其临床和病理学特征、诊断与鉴别诊断要点、治疗及预后。
病历摘要
患者 男性,59岁,主诉鞍区占位性病变切除术后3月余,失明7 d,于2015年9月14日入院。患者1年前无明显诱因出现双眼视力下降、视野缺损伴头晕,偶有头痛,且视力下降迅速,于2015年5月4日首次入院。体格检查:双眼颞侧视野偏盲,余无明显异常。实验室检查:内分泌功能测定,血清促甲状腺激素(TSH)18.46 mU/L(0.27~4.20 mU/L)、黄体生成素(LH)0.30 IU/L(1.70~8.60 IU/L)、卵泡刺激素(FSH)1.70 IU/L(1.50~12.40 IU/L),血清三碘甲状腺原氨酸(T3)1.18 nmol/L(1.30~3.10 nmol/L)、游离T3(FT3)3.16 pmol/L(3.60~7.50 pmol/L)、甲状腺素(T4)41.32 nmol/L(62~ 164 nmol/L)、游离 T4(FT4)5.94 pmol/L(12~22 pmol/L),其余各项指标均于正常值范围。影像学检查:头部MRI显示,鞍区团块状等T1、略长T2信号影(图1a,1b),大小约为3.40 cm×3.50 cm×4.40 cm,形状不规则,界限较清晰,视交叉上抬,鞍上池闭塞,第三脑室受压扩张;增强扫描病灶呈明显不均匀强化(图1c,1d),考虑垂体腺瘤可能性大。临床诊断为鞍区占位性病变,遂于2015年5月29日在全身麻醉下行鼻内镜下经鼻蝶入路垂体腺瘤切除术,手术部分切除肿瘤。术后病理学诊断为无功能性促甲状腺激素腺瘤伴纤维组织增生。术后3 d复查头部MRI显示蝶鞍扩大,其内可见稍长T1和T2信号影,大小为4.20 cm×3.50 cm×3.60 cm,边缘呈分叶状,与海绵窦分界不清,病灶内呈高低混杂信号影;增强扫描病灶呈明显不均匀强化,考虑垂体腺瘤术后改变(图1e)。术后未辅助放射治疗和药物化疗。患者术后3月余无明显诱因出现双眼视力进行性下降,迅速进展至失明,伴额顶部持续性胀痛并进行性加重,无发热、畏寒,无心慌、气促,无恶心、呕吐,无腹痛等。为求进一步诊断与治疗,再次至我院就诊。患者自发病以来,精神、睡眠、饮食尚可,大小便正常,体重无明显变化。
既往史、个人史及家族史均无特殊。
体格检查 患者体温36.8℃,脉搏60次/min,呼吸 20 次/min,血压 112/70 mm Hg(1 mm Hg=0.133 kPa);神志清楚,语言流利,对答切题;双眼盲,无光感,双侧瞳孔等大、等圆,直径约3 mm,对光反射消失;鼻唇沟对称,伸舌居中,无口角歪斜;四肢肌力和肌张力正常,共济运动和深浅感觉正常,生理反射存在,病理反射未引出,脑膜刺激征阴性。
辅助检查 实验室检查:内分泌功能测定,血清TSH 5.13 mU/L、LH 0.30 IU/L、FSH 1 IU/L、催乳素(PRL)0.16 nmol/L(0.18~0.86 nmol/L),生长激素(GH)和促肾上腺皮质激素(ACTH)于正常水平,血清T30.67 nmol/L、FT31.25 pmol/L、T433.36 nmol/L、FT44.43 pmol/L。影像学检查:头部CT显示,鞍区和鞍上混杂密度影,最大横截面积大小约4.40 cm×3.80 cm,鞍底下陷,鞍背骨质吸收(图2)。
诊断与治疗经过 临床诊断为鞍区和鞍上占位性病变。遂于2015年9月16日行鞍区和鞍上肿瘤切除术。术中可见肿瘤包绕双侧视神经和视交叉,严重压迫周围脑组织,呈灰白色,质地坚韧,血运丰富,触之易出血,无包膜,与周围脑组织粘连紧密。手术大部分切除肿瘤。两次手术标本均行组织病理学检查。(1)大体标本观察:首次手术标本为破碎组织多块,呈灰白、灰褐色,大小约2.50 cm×2.00 cm×0.50 cm,质地中等,无包膜。再次手术标本为不整形组织多块,呈灰白、灰红色,切面呈灰白、灰黄色,大小约6.50 cm×3.00 cm×2.00 cm,实性,质地中等,部分组织有包膜。两次手术标本均经4%中性甲醛溶液固定、常规脱水、石蜡包埋,制备4 μm组织切片,行HE染色和免疫组织化学染色。(2)HE染色:首次手术标本在光学显微镜下可见两种肿瘤成分混合交错(图3a),大部分区域为较均匀一致的圆形和多角形细胞,呈巢团状和梁索状排列,胞质丰富、呈嗜酸性或淡染,胞核圆形或卵圆形、染色质细腻呈“胡椒面”样,核仁不明显,核分裂象罕见(图3b);另一区域细胞呈长梭形束状排列,其间可见红染的胶原纤维样分隔,胞体纤长,胞质淡红,界限不清,胞核呈长梭形,大部分胞核浅染,核仁不明显,核分裂象罕见(图3c)。再次手术标本在光学显微镜下可见以梭形细胞为主的肿瘤组织(图4a),密度较大,可见坏死,胞核呈长梭形、略呈波浪状,染色质较深,核仁不明显,可见核分裂象(图4b),肿瘤细胞中可见上皮细胞呈小巢状和条索状分布,局灶可见胞质红染的肿瘤细胞,似横纹肌样分化(图 4c)。(3)免疫组织化学染色:采用EnVision二步法,检测用试剂盒购自丹麦Dako公司。检测用抗体包括S-100蛋白(S-100,1∶100)购自美国 Labvision-NeoMarkers公司,结蛋白(Des,1∶100)、胶质纤维酸性蛋白(GFAP,1∶100)、FSH(1∶100)、PRL(1∶100)和Ki-67抗原购自丹麦Dako公司,肌细胞生成蛋白(myogenin,1∶50)、钙视网膜蛋白(CR,1∶100)、嗜铬素 A(CgA,1∶100)、CD56(1∶100)、CD57(1∶100)、细胞角蛋白8(CK8,1∶100)、GH(1∶100)和ACTH(1∶100)购自北京中杉金桥生物技术有限公司,突触素(Syn,1∶50)、TSH(即用型)和LH(1∶100)购自福州迈新生物技术开发有限公司。结果显示,首次手术标本的两种肿瘤成分免疫表型不同,垂体腺瘤区域上皮细胞胞质表达CK8(图5a)、CgA(图5b)和Syn,激素免疫表型上皮细胞胞质表达TSH(图5c),不表达GH、PRL、ACTH、FSH和LH;梭形细胞胞质弥漫性表达CD56(图5d),局灶性表达Des(图5e),不表达S-100,Ki-67抗原标记指数约为2%。再次手术标本的免疫表型与首次相似,梭形细胞胞质弥漫性表达CD56、CD57(图6a)和CR,局灶性表达S-100(图6b)、Des和myogenin(图6c),不表达GFAP,Ki-67抗原标记指数约20%;上皮细胞胞质表达CK8(图6d)、CgA(图6e)和Syn,激素免疫表型上皮细胞胞质表达TSH(图6f)。(4)超微结构观察:再次手术标本的上皮细胞和梭形细胞区域分别行透射电子显微镜检查。石蜡包埋组织经二甲苯脱蜡、二甲苯/Epon 812包埋剂浸透、包埋、半薄切片定位、超薄切片,行醋酸铀和枸橼酸铅双重染色,于HITACHI H-7650型透射电子显微镜(日本Hitachi公司)下观察,结果显示,垂体腺瘤区域上皮细胞胞核呈圆形,核旁胞质中粗面内质网丰富,可见20~50 nm的圆形分泌颗粒(图7a);梭形细胞胞核不规则,胞膜外缘可见不连续基膜(图7b)。最终病理学诊断为鞍区碰撞瘤(无功能性促甲状腺激素腺瘤合并恶性蝾螈瘤,即恶性外周神经鞘瘤伴横纹肌样分化)。患者术后一般情况尚可,双眼视力未见好转,共住院42 d,未辅以放射治疗和药物化疗,随访至第2次手术后6个月,死亡。
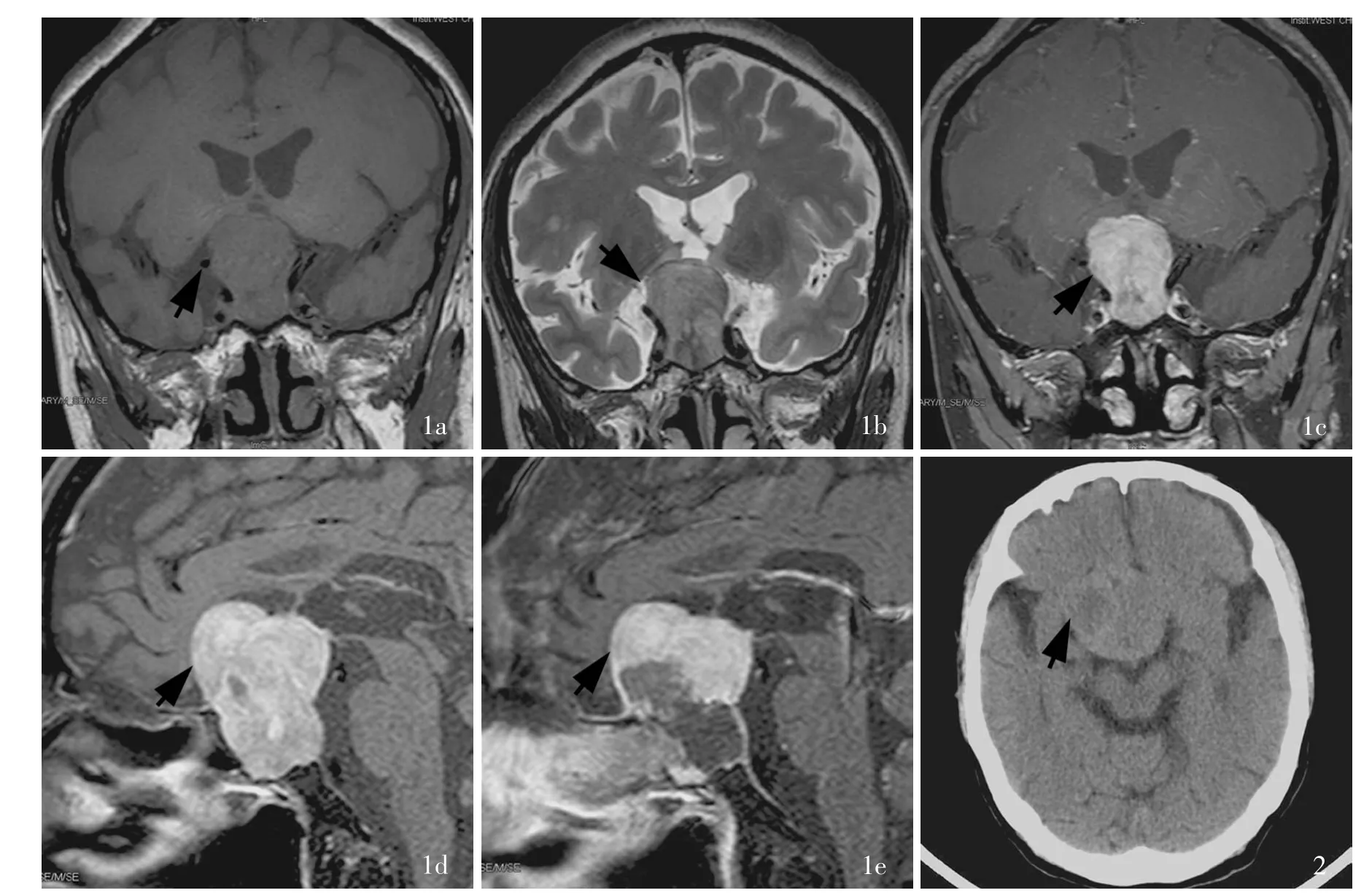
图1 首次手术前后头部MRI检查所见 1a 冠状位T1WI显示,鞍区实性占位,病变呈等信号(箭头所示) 1b 冠状位T2WI显示,鞍区占位,病变呈稍高信号(箭头所示) 1c 冠状位增强T1WI显示,病变呈不均匀强化(箭头所示) 1d 矢状位增强T1WI显示,病变呈不均匀强化(箭头所示) 1e 术后3 d矢状位增强T1WI显示,病灶前下部切除,上部未切除病灶仍呈不均匀强化(箭头所示) 图2 再次手术前头部横断面CT显示,鞍上混杂密度影(箭头所示)Figure 1 Head MRI findings before and after the first operation Coronal T1WI showed an isointense mass at the sellar region(arrow indicates,Panel 1a).Coronal T2WI showed a slightly hyperintense mass at the sellar region(arrow indicates,Panel 1b).Coronal enhanced T1WI demonstrated a mass with heterogeneous enhancement(arrow indicates,Panel 1c).Sagittal enhanced T1WI showed a mass with heterogenous enhancement(arrow indicates,Panel 1d).Sagittal enhanced T1WI 3 d after the first operation showed the lower part of lesion had been removed,while residual upper part demonstrated heterogenous enhancement(arrow indicates,Panel 1e).Figure 2 Axial CT before the second surgery showed a mixed density mass at the suprasellar region(arrow indicates).
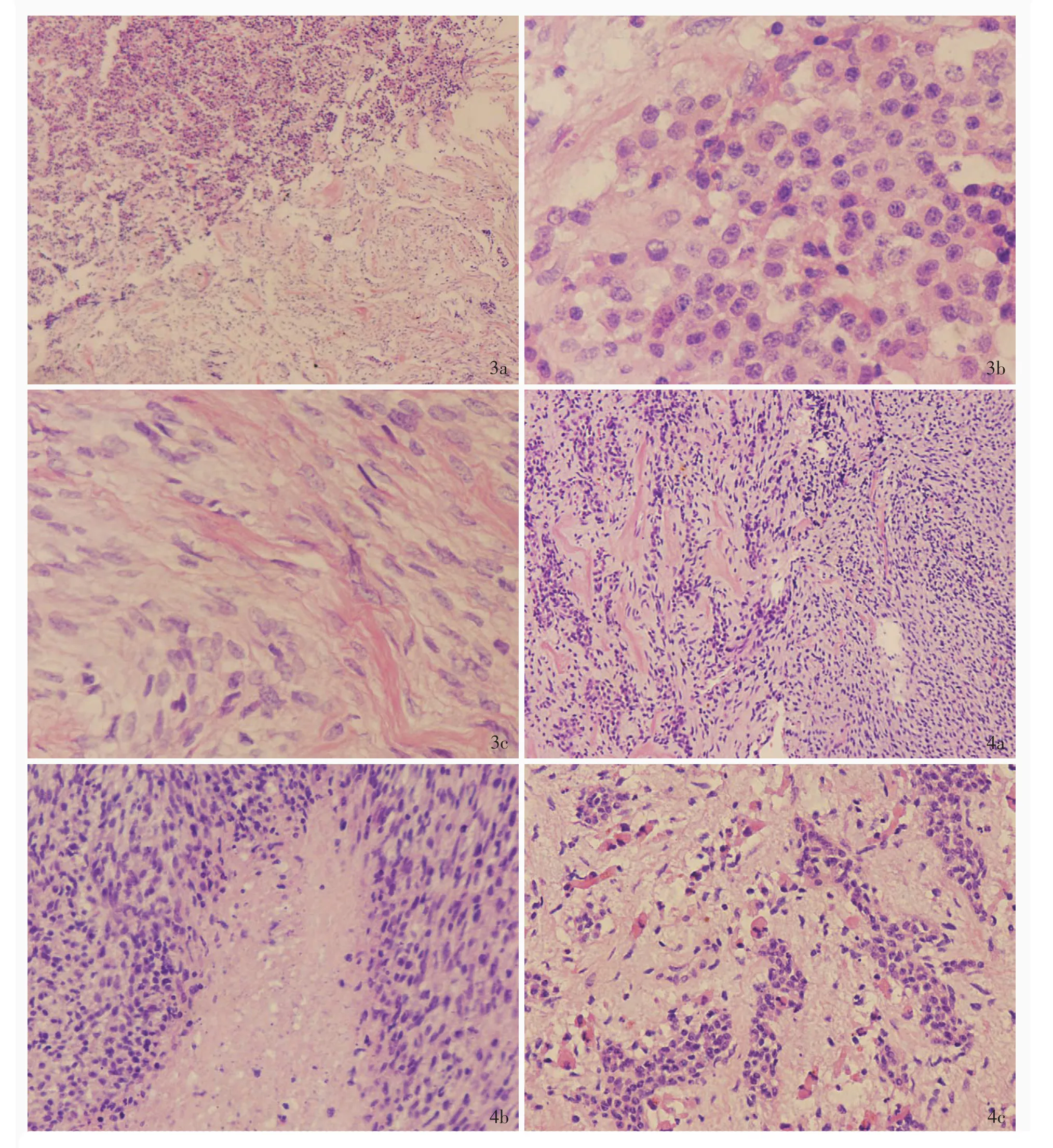
图3 首次手术标本光学显微镜观察所见 HE染色 3a 肿瘤组织由上皮细胞和梭形细胞两种成分组成 ×40 3b 上皮细胞呈巢团状排列 ×400 3c 梭形细胞呈束状排列,形态较温和 ×400 图4 再次手术标本光学显微镜观察所见 HE染色4a 肿瘤组织主要由梭形细胞组成,其间散在分布上皮细胞巢 ×100 4b 梭形细胞胞核深染,可见坏死 ×200 4c 可见胞质红染的横纹肌样分化散在分布于上皮细胞巢中 ×200Figure 3 Optical microscopy findings of the tumor after the first operation HE staining The tumor was composed of epithelial cells and spindle cells(Panel 3a). ×40 The epithelial cells were arranged in a nest-like pattern(Panel 3b). ×400 The spindle cells were arranged in a sheet pattern and showed a bland feature(Panel 3c). ×400 Figure 4 Optical microscopy findings of the tumor after the second operation HE staining The tumor was composed of spindle cells and scattered nests of epithelial cells(Panel 4a). ×100 The nuclei of spindle cells were dark and patchy necrosis can be observed(Panel 4b). ×200 Rhabdomyoblasts with hyperchromatic cytoplasm scattered among the epithelial nests(Panel 4c). ×200
讨 论
碰撞瘤是两种或以上不同组织学形态肿瘤混杂或相邻生长,颅内碰撞瘤少见,鞍区碰撞瘤更为罕见且具有相对独特的临床病理学特点。文献报道的鞍区碰撞瘤中一种常见类型为垂体腺瘤,另一种类型不尽相同,尤以垂体腺瘤合并节细胞瘤常见,约68例[2-3],垂体腺瘤合并转移癌19例[4],垂体腺瘤合并神经鞘瘤15例[3],垂体腺瘤合并颅咽管瘤14例[5],有学者将鞍区两种或以上组织学形态或免疫表型完全不同的垂体腺瘤碰撞也归为鞍区碰撞瘤,约60例[3,6],其余少见类型为垂体腺瘤合并浆细胞瘤[7]、脑膜瘤[8]、软骨瘤[9]和表皮样囊肿[10]。本文报道1例垂体腺瘤合并恶性蝾螈瘤的鞍区碰撞瘤患者,尚未见诸文献。无垂体腺瘤成分的鞍区碰撞瘤极为罕见,仅见1例软骨瘤合并颅咽管瘤[11]和1例颅咽管瘤合并毛细胞型星形细胞瘤的报道[12]。除两种肿瘤成分碰撞外,也可见垂体腺瘤与良性病变碰撞,称为碰撞性病变(collision lesion),目前仅有垂体腺瘤合并 Rathke囊肿[3]、蛛网膜囊肿[13]、胶样囊肿[14]和结节病[3]等报道,其中垂体腺瘤合并Rathke囊肿约34例[3],其余类型少见。
绝大多数文献报道的鞍区碰撞瘤和碰撞性病变均于术前诊断为“垂体腺瘤”,临床表现为垂体腺瘤和脑神经压迫症状,均无另一种类型肿瘤成分或良性病变的特殊症状[3]。功能性垂体腺瘤表现为相应激素分泌增加症状,如泌乳和肢端肥大等,实验室检查血清下丘脑-垂体激素水平升高,其他激素水平正常或偏低。不同类型碰撞瘤激素分泌类型不尽一致,如合并节细胞瘤时最常见分泌GH的垂体腺瘤[3]、合并颅咽管瘤时最常见分泌PRL的垂体腺瘤[5]。该例患者血清TSH水平升高,但甲状腺功能未受影响,故为无功能性促甲状腺激素腺瘤。脑神经压迫症状通常表现为进行性视力下降[5],偶有头痛,恶心、呕吐等颅内压增高症状[9]。眼科症状主要表现为视力下降、视野缺损,但眼底镜检查通常无异常[5]。
除少部分垂体腺瘤合并Rathke囊肿的碰撞性病变可于术前经影像学检出外[15],大部分鞍区碰撞瘤的两种肿瘤成分难以经影像学区分,通常表现为鞍区或鞍上占位性病变,头部MRI增强扫描呈均匀或不均匀强化[3],部分可见囊性变,如垂体腺瘤合并颅咽管瘤[5]。垂体腺瘤合并软骨瘤、脑膜瘤和颅咽管瘤可见钙化征象[8-9]。该例患者术前影像学检查亦不考虑碰撞瘤。
鞍区碰撞瘤的明确诊断依靠组织病理学检查。碰撞的肿瘤成分不同,因此具有不同的组织学形态特点。两种肿瘤成分可以相互交错,如果两种肿瘤成分仅黏附在一起,光学显微镜下仅见两种肿瘤成分的各自形态,而无混杂区域[5]。免疫组织化学染色显示不同肿瘤成分的免疫表型特点。超微结构观察对某些垂体腺瘤的分型具有诊断价值,如在3型无功能性垂体腺瘤中可见极度扩张的粗面内质网和滑面内质网[16]。该例患者恶性外周神经鞘膜瘤细胞(梭形细胞)可以观察到胞膜外缘不连续基膜。临床应警惕碰撞瘤,正确辨识不同肿瘤成分,不难作出正确的病理学诊断。但在某些特殊情况下,如因手术标本取样不足,病理科医师可能漏诊或误诊,应引起注意。鞍区碰撞瘤中垂体腺瘤成分通常最易辨识,另一种肿瘤成分则可能因手术标本取样不足而漏诊或误诊。Jin等[5]报告1例垂体腺瘤合并颅咽管瘤患者,首次手术为鼻内镜下经鼻蝶入路肿瘤切除术,仅采集到垂体腺瘤成分,但2个月后随访时发现术前诊断为垂体腺瘤的囊性变区域扩大,且症状复发,再次开颅切除肿瘤,并经病理学证实为颅咽管瘤成分。本文患者两次手术标本组织学形态亦不完全相同,首次手术标本主要成分为经典垂体腺瘤,第2种肿瘤成分为在部分区域散在分布的较少梭形细胞,且细胞形态较温和,免疫表型不典型,故首次诊断未认识到恶性蝾螈瘤的存在;再次手术标本中梭形细胞成分异型性更为显著,横纹肌样分化明显,核分裂象和Ki-67抗原标记指数均较高,结合两次手术标本的病理学结果方作出正确诊断。因此,鞍区碰撞瘤明确诊断的最重要一点是对多种肿瘤成分的全面认识。

图5 首次手术标本光学显微镜观察所见 免疫组织化学染色(EnVision二步法) ×200 5a 上皮细胞胞质表达CK8 5b 上皮细胞胞质表达CgA 5c 上皮细胞胞质表达TSH 5d 梭形细胞胞质弥漫性表达CD56 5e 梭形细胞胞质局灶性表达DesFigure 5 Optical microscopy findings of the tumor after the first operation Immunohistochemical staining(EnVision) ×200 The cytoplasms of pituitary adenoma were positive for CK8(Panel 5a),CgA(Panel 5b)and TSH(Panel 5c).The cytoplasms of spindle cells were diffusely positive for CD56(Panel 5d)and focally positive for Des(Panel 5e).

图6 再次手术标本光学显微镜观察所见 免疫组织化学染色(EnVision二步法) ×200 6a 梭形细胞胞质表达CD57 6b 梭形细胞胞质和胞核局灶性表达S-100 6c 横纹肌样分化胞核表达myogenin 6d 上皮细胞胞质表达CK8 6e 上皮细胞胞质表达CgA 6f上皮细胞胞质表达TSHFigure 6 Optical microscopy findings of the tumor after the second operation Immunohistochemical staining(EnVision) ×200 The cytoplasms of spindle cells were positive for CD57(Panel 6a).The nuclei and cytoplasms of spindle cells were focally positive for S-100(Panel 6b).The nuclei of rhabdomyoblasts were positive for myogenin(Panel 6c).The cytoplasms of epithelial cells were positive for CK8(Panel 6d),CgA(Panel 6e)and TSH(Panel 6f).
碰撞瘤应注意与单一肿瘤相鉴别。某些肿瘤可以具有不同的组织学形态,应注意不要误诊为碰撞瘤。本文患者应注意与恶性外周神经鞘膜瘤伴腺分化相鉴别:临床较为罕见,外周神经鞘膜瘤背景内可见散在或局灶性腺体结构,神经内分泌分化较常见,亦有恶性蝾螈瘤伴腺分化的报道[17],但腺体成分常散在或局灶性分布,该例患者存在单独垂体腺瘤区域表达TSH,并非腺分化,故诊断为碰撞瘤。此外,颅咽管瘤可伴星形胶质细胞增生,形成毛细胞型星形细胞瘤样形态,应注意与颅咽管瘤合并毛细胞型星形细胞瘤的碰撞瘤相鉴别。影像学检查具有一定的提示作用,碰撞瘤中毛细胞型星形细胞瘤成分囊壁强化征象明显[12]。病理学诊断困难时,可行BRAF基因融合和突变检测以判断毛细胞型星形细胞瘤成分[18]。
鞍区碰撞瘤经术后病理学检查方能明确诊断,外科手术是其主要治疗方法。因鞍区碰撞瘤术前多诊断为“垂体腺瘤”,大多数垂体腺瘤术式为鼻内镜下肿瘤切除术,但位于鞍上的较大肿瘤若采用经鼻内镜下肿瘤切除术只能部分切除肿瘤而造成明确诊断困难,需再次手术[5]。因此,神经外科医师应结合影像学结果进行详细的术前评估,避免再次手术。若碰撞瘤成分均为良性肿瘤,手术全切除,预后较好[3];若为垂体腺瘤与良性肿瘤相碰撞,某些类型垂体腺瘤如3型无功能性垂体腺瘤,具有侵袭性,复发率较普通腺瘤高[16];若其中1种肿瘤成分为恶性肿瘤时,如转移癌或恶性蝾螈瘤等,预后较差,故预后主要取决于恶性肿瘤成分[4]。
鞍区碰撞瘤临床少见,本文首次报道1例垂体腺瘤合并恶性蝾螈瘤的鞍区碰撞瘤患者,术前临床症状和影像学检查难以明确诊断,经术后病理学检查方明确诊断。病理学诊断时应仔细辨识不同形态肿瘤成分,结合免疫组织化学染色和超微结构观察进行综合分析,应注意与具有多种形态的单一肿瘤相鉴别。不同类型碰撞瘤预后差异较大,良性肿瘤碰撞瘤预后较好,恶性肿瘤碰撞瘤预后较差。

图7 透射电子显微镜观察所见 醋酸铀和枸椽酸铅双重染色 ×5000 7a 垂体腺瘤区域胞质内含有20~50 nm的圆形分泌颗粒(箭头所示)7b 梭形细胞区域胞膜外缘可见不连续基膜(箭头所示)Figure7 Transmission electron microscopy findings Uranyl acetate and lead citrate double staining ×5000 Round secretary granules with diameter ranged from 20 to 50 nm presented in the cytoplasm of pituitary adenoma cells (arrow indicates,Panel 7a).Discontinuous basal lamina could be seen at the outer side of spindle cell membrane(arrow indicates,Panel 7b).
[1]De Cauwer H,Bogers JP,Duwel V,den Hauwe V,Croese P,Van Marck E.An intracerebral intraparenchymatous triton tumor in a man with neurofibromatosis.J Neurol,2007,254:1009-1011.
[2]Kontogeorgos G,Mourouti G,Kyrodimou E,Liapi-Avgeri G,Parasi E.Ganglion cell containing pituitary adenomas:signs of neuronal differentiation in adenoma cells.Acta Neuropathol,2006,112:21-28.
[3]Koutourousiou M,Kontogeorgos G,Wesseling P,Grotenhuis AJ,Seretis A.Collision sellar lesions:experience with eight cases and review of the literature.Pituitary,2010,13:8-17.
[4]Sogani J,Yang W,Lavi E,Zimmerman RD,Gupta A.Sellar collision tumor involving metastatic lung cancer and pituitary adenoma:radiologic-pathologic correlation and review of the literature.Clin Imaging,2014,38:318-321.
[5]Jin G,Hao S,Xie J,Mi R,Liu F.Collision tumors of the sella:coexistence of pituitary adenoma and craniopharyngioma in the sellar region.World J Surg Oncol,2013,11:178.
[6]Budan RM,Georgescu CE.Multiple pituitary adenomas:a
[7]systematic review.Front Endocrinol(Lausanne),2016,7:1.Rivera J,Alves S,Bianchi CC,Al-Mutawa N,Guiot MC,Zeitouni A. An unusual collision tumor comprising a prolactinoma and a plasmocytoma originating from the sellar
[8]region.Pituitary,2010,13:189-193.Banik S,Hasleton PS,Lyon RL.An unusual variant of multiple endocrine neoplasia syndrome:a case report.Histopathology,
[9]1984,8:135-144.Sahli R,Christ E,Kuhlen D,Giger O,Vajtai I.Sellar collision tumor involving pituitary gonadotroph adenoma and chondroma:
[10]a potential clinical diagnosis.Pituitary,2011,14:405-408.Kaspera W,Bierzyńska-Macyszyn G,Majchrzak H.A case of parasellar tumor with double histological texture:chromophobe pituitary adenoma and epidermoid cyst.Neurol Neurochir Pol,
[11]1998,32:987-996.Belza J.Double midline intracranial tumors of vestigial origin:contiguous intrasellar chordoma and suprasellar
[12]craniopharyngioma.Case report.J Neurosurg,1966,25:199-204.Ge YN,Xing B,Yao Y,Deng K,Wang RZ.Combined craniopharyngioma and pilocytic astrocytoma:one case report.Zhongguo Lin Chuang Shen Jing Wai Ke Za Zhi,2016,21:319-320[.葛怡宁,幸兵,姚勇,邓侃,王任直.颅咽管瘤合并毛细胞星形细胞瘤1例.中国临床神经外科杂志,2016,21:319-320.]
[13]Güzel A,Er U,Tatli M,Uzunlar AK,Belen D,Bavbek M.Pituitary adenoma coexisting with a suprasellar arachnoid cyst.Turk Neurosurg,2007,17:138-141.
[14]Nomikos P,Buchfelder M,Fahlbusch R.Intra-and suprasellar colloid cysts.Pituitary,1999,2:123-126.
[15]Sumida M,Migita K,Tominaga A,Iida K,Kurisu K.Concomitant pituitary adenoma and Rathke's cleft cyst.Neuroradiology,2001,43:755-759.
[16]Moshkin O,Scheithauer BW,Syro LV,Velasquez A,Horvath E,Kovacs K.Collision tumors of the sella:craniopharyngioma and silent pituitary adenoma subtype 3.Endocr Pathol,2009,20:50-55.
[17]Thway K,Hamarneh W,Miah AB,Fisher C.Malignant peripheral nerve sheath tumor with rhabdomyosarcomatous and glandular elements:rare epithelial differentiation in a triton
[18]tumor.Int J Surg Pathol,2015,23:377-383.Bornhorst M,Frappaz D,Packer RJ.Pilocytic astrocytomas.Handb Clin Neurol,2016,134:329-344.(收稿日期:2017-09-08)
Collision tumor of the sellar region
GONG Jing,SU Yan-yan,LEI Song,LIU Xiao-yu,ZHANG Shang-fu
Department of Pathology,West China Hospital,Sichuan University,Chengdu 610041,Sichuan,China
Corresponding author:ZHANG Shang-fu(Email:zhangshangfu168@163.com)
ObjectiveTo summarize clinical and pathological features,diagnosis and differential diagnosis,as well as treatment and prognosis through analyzing one case of collision tumor in the sellar region(pituitary adenoma combined with malignant triton tumor).Methods and ResultsA 59-year-old male was admitted to hospital with decreased vision,vision field defect and dizziness. Head MRI demonstrated space-occupying lesion in the sellar region. Therefore,the patient underwent a transsphenoidal surgery with subtotal tumor resection.Three months later,the patient was admitted to hospital again with vision loss and headache.Head CT demonstrated space-occupying lesions in sellar/suprasellar region,therefore,the patient underwent saddle tumor resection.Histological findings revealed that the tumor was composed of two different types of tumors,one was pituitary adenoma with epithelial cells arranged in nest-like and trabecular pattern,and the other was diffused spindle cell tumor.The two tumors were distributed separately or mixed togenther.The morphology of spindle cell tumor was bland with scarce mitosis in the first surgery,whereas additional features including increased cell density,dark nuclei,frequent mitosis and scattering distributed rhabdomyoblasts were found in the second surgery.Immunohistochemically,the pituitary adenoma(epithelial cell region)cells were positive for cytokeratin 8(CK8),chromogranin A(CgA),synaptophysin(Syn)and thyroid stimulating hormone(TSH),while the malignant triton tumor cells(spindle cell region)were positive for CD56,CD57,calretinin(CR)and focally positive for S-100 protein(S-100),desmin(Des)and myogenin.Ultrastructural findings revealed abundant rough endoplasmic reticules and secretary granules in the cytoplasm of pituitary adenoma cells,and discontinuous basal lamina located outside the spindle cell membrane.The final pathological diagnosis was sellar collision tumor(non-functional TSH adenoma combined with malignant triton tumor).The patient died 6 months after the second surgery.ConclusionsCollision tumor of the sellar region with pituitary adenoma and malignant triton tumor is a rare tumor which can hardly be diagnosed by clinical and neuroimaging examination.The diagnosis relies on morphological characteristics,immunophenotype and ultrastructural features. The prognosis of collision tumor with malignant triton tumor component is poor.
Pituitary neoplasms; Adenoma; Nerve sheath neoplasms; Sella turcica; Pathology;Immunohistochemistry
10.3969/j.issn.1672-6731.2017.11.009
610041成都,四川大学华西医院病理科
张尚福(Email:zhangshangfu168@163.com)
