Bcl-2蛋白抑制钙信号的建模与全局动力学分析∗
2017-12-25牛帅帅建伟祁宏
牛帅帅建伟祁宏
1)(山西大学复杂系统研究所,太原 030006)
2)(山西大学数学科学学院,太原 030006)
3)(厦门大学物理系,厦门 361005)
Bcl-2蛋白抑制钙信号的建模与全局动力学分析∗
牛帅1)2)帅建伟3)†祁宏1)‡
1)(山西大学复杂系统研究所,太原 030006)
2)(山西大学数学科学学院,太原 030006)
3)(厦门大学物理系,厦门 361005)
Bcl-2蛋白,钙信号,分岔分析
1 引 言
钙离子(Ca2+)作为细胞内重要的信使分子,参与并控制着几乎一切重要的细胞活动过程[1],被认为是生物体的一种“生存因子”[2].在静息状态下,细胞内的大部分Ca2+储藏于内质网中,细胞质内的Ca2+浓度([Ca2+]Cyt)处在一个较低的水平.当细胞受到生理刺激时,Ca2+从位于内质网上的IP3R通道释放到细胞质中,同时可经心肌肌浆网钙泵(SERCA)返回到内质网中,因此[Ca2+]Cyt会以振荡的形式变化.Ca2+正是通过钙振荡的振幅、周期以及持续时间来控制各种生理活动[3].但钙信号是把双刃剑,当IP3R通道过量释放Ca2+时,细胞质中Ca2+会呈现高幅振荡[4−6]或持续提升[6−8],引发一系列灾难性事件,从而导致细胞死亡[9,10],因此Ca2+也被认为是细胞的“无情杀手”[2].
正因为Ca2+是一种生死攸关的信号分子,所以负责释放它的IP3R通道就成为细胞内的“信号中心”[11].实验表明细胞内存在多种直接或间接调控IP3R通道活性的蛋白[11,12],它们对钙信号的振幅和频率等发挥着复杂的调控作用,从而使得Ca2+振荡对不同刺激信号有丰富的编码行为,抗凋亡蛋白Bcl-2就是其中重要的一员[13].实验研究结果表明,Bcl-2抑制IP3R通道活性从而降低[Ca2+]Cyt的机制主要有两种:一种是2009年文献[14]中提出的Bcl-2可以直接结合在IP3R通道上,促使其构象发生改变,从而减少Ca2+的释放,称为直接机制;另一种是2014年文献[15]中提出的Bcl-2可为多巴胺-cAMP调节的磷蛋白(DARPP-32)与钙调神经磷酸酶(CaN)提供结合平台,它们的结合可以促使pDARPP-32去磷酸化,从而减缓它对蛋白磷酸酶1(PP1)的抑制作用,导致IP3R通道去磷酸化,最终削弱它释放Ca2+的能力.简言之,第二种机制是Bcl-2及其相关蛋白构成一个负反馈环改变IP3R通道的磷酸化状态,间接减少它所释放的Ca2+,称为间接机制.
可以看出,相比于直接机制,间接机制非常复杂,仅依靠实验现象很难全面理解各种信号之间复杂的相互作用关系,所以该间接机制如何具体调控钙信号,依然是一个有待探讨的重要问题.如果利用数学建模的方法,特别是分岔理论[16],定量研究它们之间的相互作用过程,就可以更系统且深入地理解该机制[17].因此,基于间接机制,建立了Bcl-2调节钙信号的数学模型,利用数值模拟方法定量研究Bcl-2对钙信号的抑制作用,通过分岔理论对模型进行系统地分析,以期能够全面理解Bcl-2间接抑制钙信号相关的信号通路,并预测一些实验结果,为治疗钙信号失调引起的相关疾病提供一些潜在的思路.
2 模型和方法
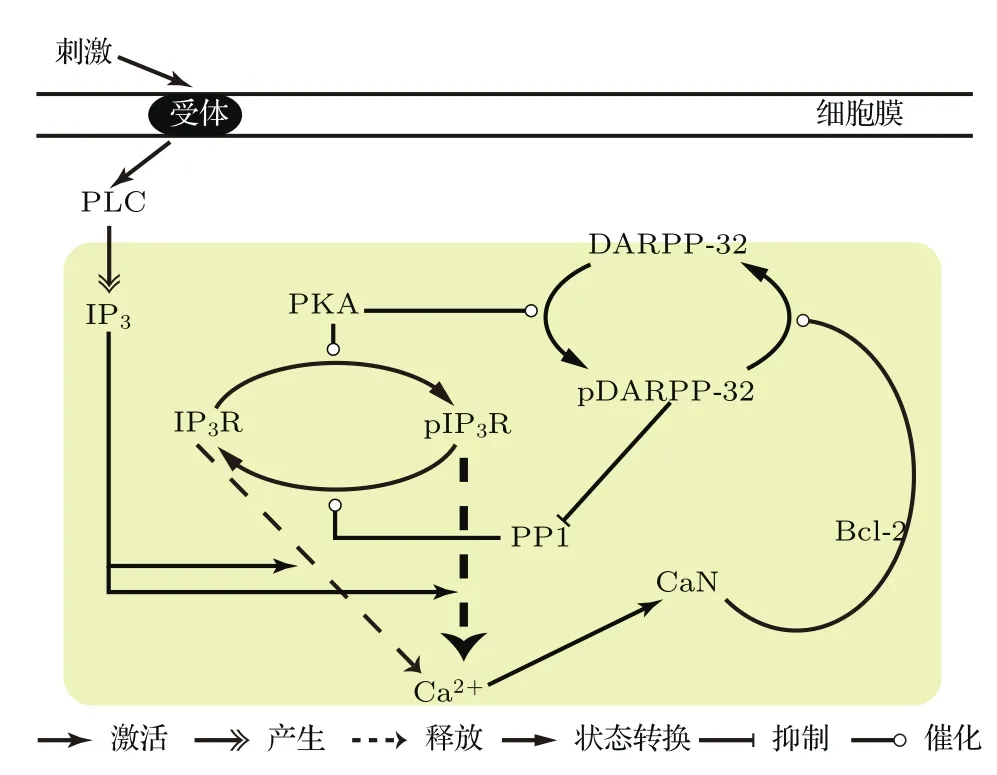
图1 (网刊彩色)Bcl-2及其相关蛋白调节Ca2+释放机制图外界刺激使细胞膜上的受体激活磷脂酶C(PLC)并产生IP3,IP3结合到IP3R通道使Ca2+释放.虚线粗箭头表示pIP3R比IP3R释放Ca2+能力更强Fig.1.(color online)Mechanism of Bcl-2 and its related proteins on Ca2+release.An extracellular signal molecule binds to its receptor and activates phospholipase C(PLC).The latter stimulates the formation of IP3,which binds to IP3R channel and modulates Ca2+release.The bold dashed arrow depicts that the release of Ca2+from pIP3R is stronger than IP3R.
基于文献[15]总结的机制构建模型,但只考虑图1中黄色部分,用IP3的浓度([IP3])来反映刺激的大小,其取值范围为0—1µM.该模型包含3个模块:[Ca2+]Cyt变化、IP3R通道的磷酸化与去磷酸化、Bcl-2及其相关蛋白构成的负反馈环.
2.1 Ca2+模块
采用Li-Rinzel模型刻画[Ca2+]Cyt的变化[18].在一个封闭的细胞中,[Ca2+]Cyt的变化主要由三个因素决定:1)Ca2+通过IP3R通道从内质网释放到细胞质中,记为Jchan;2)Ca2+从内质网渗漏到细胞质中,记为Jleak;3)位于内质网上的SERCA钙泵将细胞质中的Ca2+泵回到内质网中,记为Jpump.Li-Rinzel模型的另一个动力学变量h是与Jchan相关的IP3R通道开通的比例,因此该模型表示为
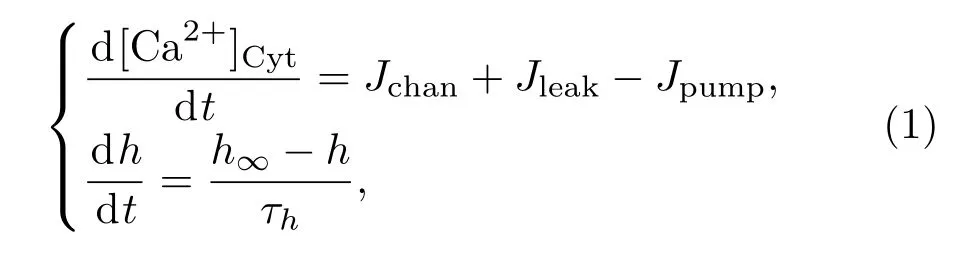
其中,

2.2 IP3R通道磷酸化与去磷酸化模块
IP3R通道(本文指IP3R-1蛋白,其第1755位氨基酸为丝氨酸)有磷酸化(pIP3R)和非磷酸化(IP3R)两种状态,且前者释放Ca2+的能力更强[15].若把每摩尔IP3R通道释放Ca2+的最大速率记为k,pIP3R与IP3R释放Ca2+的速率比记为α(1<α≤9),那么Li-Rinzel模型中IP3R通道释放Ca2+的最大速率u1可以表示为
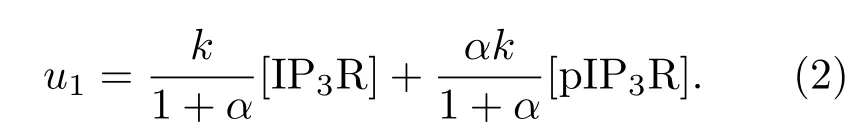
此外,IP3R两种状态之间的转换是由两种酶催化的:蛋白激酶A(PKA)可使其磷酸化成为pIP3R,而PP1则可使pIP3R去磷酸化成为IP3R.磷酸化与去磷酸化的过程可用米曼方程描述[19],pIP3R的浓度变化可表示为
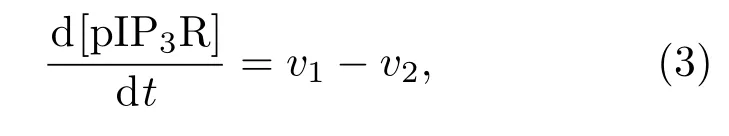
其中,
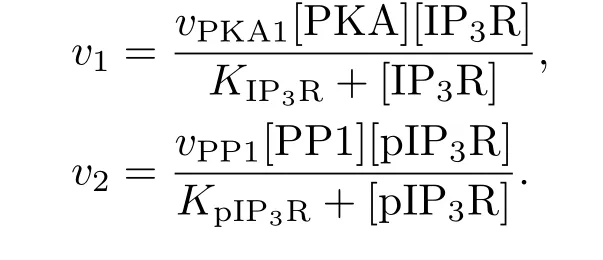
2.3 Bcl-2及其相关蛋白构成负反馈环模块
细胞质中的Ca2+可以激活CaN,它有4个Ca2+结合位点,两个对Ca2+亲和系数高,另外两个对Ca2+亲和系数低[20],两者相差上百倍,所以可以只考虑CaN与前两个Ca2+结合的情况.该过程可用质量作用定律来描述[21],活化的CaN(CaN∗)的浓度变化可以用以下方程来描述:

此外,CaN与CaN∗满足质量守恒

由于Ca2+与CaN的结合与解离过程要比[CaN∗]的变化快很多,因此可以用准稳态假设[21]得到
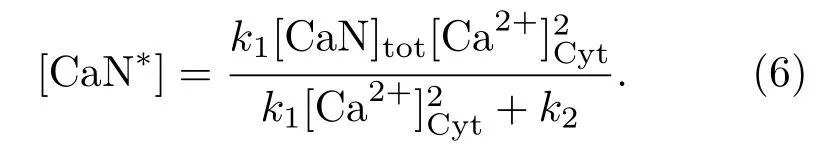
CaN∗可以通过Bcl-2使pDARPP-32去磷酸化成为DARPP-32,其反应速率为

其中vCaN∗表示该过程的最大反应速率,可用希尔方程[22]描述Bcl-2对它的调节

PKA还可使DARPP-32磷酸化,其反应速率为
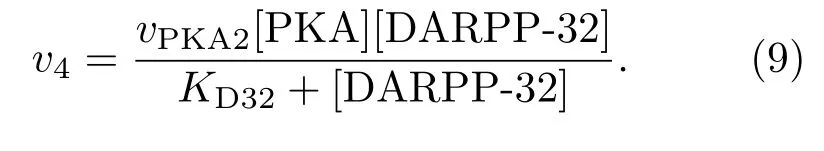
pDARPP-32对PP1有抑制作用,该作用可以体现在PP1使pIP3R去磷酸化的最大速率,则有

综上所述,Bcl-2蛋白调节Ca2+的动力学模型为

3 结果与分析
3.1 参数拟合确定
Li-Rinzel模型中各参数的具体意义见文献[18],由该模型默认参数得到的Ca2+振荡的最大振幅约为0.5µM(1 M=1 mol/L),周期为10—14 s,由于要拟合文献[15]实验中Ca2+振荡的振幅与周期,对Li-Rinzel模型中相关参数取值进行了幅度和周期的标量变换(见表1).对于其他两个模块中的各参数值,α和[IP3]是可调的,各蛋白质浓度的值均来源于文献[23—26],反应速率参数较难从文献中获取,仅查得k1和k2的值[25],其余参数值由对文献[15]中实验结果的拟合得到(见表2).

表1 Li-Rinzel模型中的参数Table 1.Parameters in Li-Rinzel model.
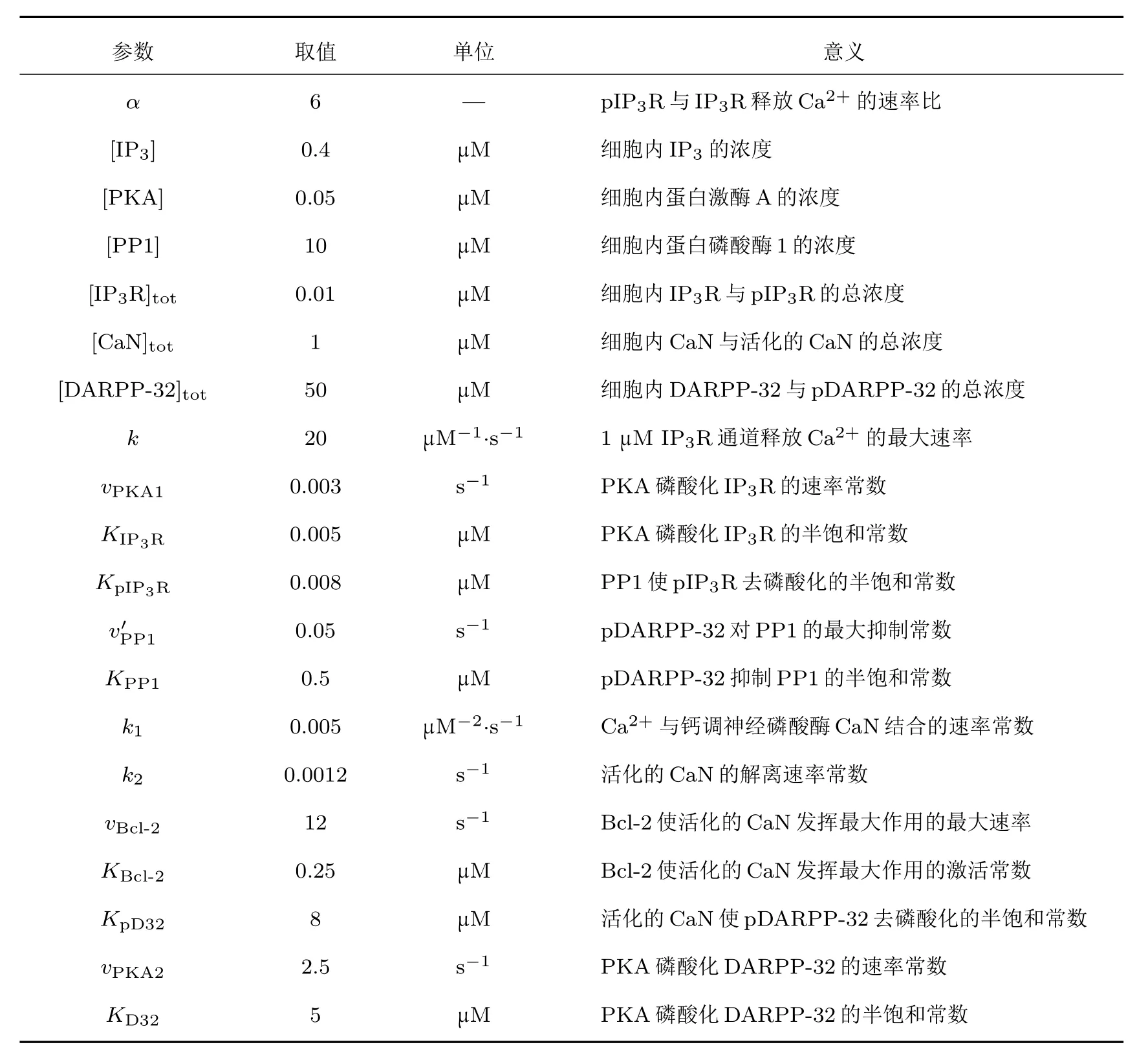
表2 模型中的参数值Table 2.Parameters in the model.
3.2 [Ca2+]Cyt时间序列
图2所示为标准参数下Bcl-2取不同浓度(其值在生理学范围[27])时[Ca2+]Cyt随时间变化的曲线.当Bcl-2浓度低(0.1µM,图2(a))时,[Ca2+]Cyt的振幅和峰值均高;而当Bcl-2浓度高(0.3µM,图2(b))时,[Ca2+]Cyt的振幅和峰值均低.无论是[Ca2+]Cyt的振幅还是周期,数值模拟结果都与实验结果(文献[15]Fig.1B)高度符合.当Bcl-2浓度继续升高(0.5µM,图2(c))时,[Ca2+]Cyt呈现衰减振荡.这意味着[Bcl-2]取不同的值,[Ca2+]Cyt既可能呈现周期性的变化,即极限环振荡,也有可能呈现衰减振荡至稳态.
3.3 [IP3]和[Bcl-2]单参数分岔分析
从以上时间序列仅能得到某一特定[IP3]下,即某一特定刺激强度时,细胞质钙信号的信息,而分岔分析可以更全面地了解系统的行为.因为IP3对钙振荡起着决定性的作用[28],所以很多钙信号模型以[IP3]作为分岔参数[29−32]研究系统的动力学行为.为探讨Bcl-2对细胞质钙信号的调节作用,分别选取[IP3]和[Bcl-2]为分岔参数,进行分岔分析(图3).图中,黑色实线是稳定的平衡点(表示Ca2+不振荡,其值为[Ca2+]Cyt的稳态值),红色虚线是不稳定的平衡点,它们的交点为霍普夫分岔点(Hopf bifurcation,HB,表示系统在稳定态与振荡态之间的转换);绿色和橙色实心点分别表示稳定极限环的最大值和最小值(分别对应Ca2+振荡的峰值和谷值),绿色和橙色空心圈分别表示不稳定极限环的最大值和最小值.
图3(a)—(c)为Bcl-2取不同浓度(0,0.25,0.4µM)时,以[IP3]为分岔参数得到的结果.可以看出,当[Bcl-2]=0µM时,回归到原始的Li-Rinzel钙信号振荡模型,这时,钙信号在振荡区域的振幅随[IP3]的增加而变大;但我们的模型表明,当[Bcl-2]=0.25µM时,钙信号的振幅随[IP3]的增加基本不变,当[Bcl-2]=0.4µM时,钙信号的振幅随[IP3]的增加主要呈现减小的行为.比较不同浓度的Bcl-2的结果时发现,高浓度的Bcl-2会抑制钙信号的振幅.

图2 不同[Bcl-2]对应的[Ca2+]Cyt时间序列图 (a)[Bcl-2]=0.1µM;(b)[Bcl-2]=0.3µM;(c)[Bcl-2]=0.5µMFig.2.Time series of[Ca2+]Cytfor different[Bcl-2]as(a)[Bcl-2]=0.1 µM,(b)[Bcl-2]=0.3 µM,(c)[Bcl-2]=0.5 µM.

图3 (网刊彩色)[IP3]对[Ca2+]Cyt的分岔图 (a)[Bcl-2]=0µM,(b)[Bcl-2]=0.25µM,(c)[Bcl-2]=0.4µM;[Bcl-2]对[Ca2+]Cyt的分岔图 (d)[IP3]=0.3µM,(e)[IP3]=0.4µM,(f)[IP3]=0.6µMFig.3.(color online)The one-parameter bifurcation diagram for[IP3]:(a)[Bcl-2]=0µM,(b)[Bcl-2]=0.25µM,(c)[Bcl-2]=0.4µM;the one-parameter bifurcation diagram for[Bcl-2]:(d)[IP3]=0.3µM,(e)[IP3]=0.4 µM,(f)[IP3]=0.6µM.
图3(d)—(f)为IP3取 不 同 浓 度(0.3, 0.4,0.6µM)时,以[Bcl-2]为分岔参数得到的结果.可以看出,当[IP3]=0.3µM时,随着[Bcl-2]的增加,钙信号的振幅在接近稳定点前,主要呈现基本不变的行为;当[IP3]=0.4µM时,随着[Bcl-2]的增加,钙信号的振幅先呈现基本不变趋势,然后线性减小,最后变成稳定点;当[IP3]=0.6µM时,钙信号的振幅随[Bcl-2]的增加主要呈现减小趋势.所以,正如实验所观察到的[15],Bcl-2对细胞质钙信号确实有抑制作用,但我们的模型同时表明,当[IP3]低时钙信号的振幅呈现出对Bcl-2的鲁棒行为.
3.4 α单参数分岔分析

图4 (网刊彩色)α对[Ca2+]Cyt的分岔图 (a)[Bcl-2]=0.1 µM;(b)[Bcl-2]=0.3µMFig.4.(color online)The one-parameter bifurcation diagram for α:(a)[Bcl-2]=0.1 µM;(b)[Bcl-2]=0.3 µM.
本模型的参数中,α为最重要的一个,它表示pIP3R与IP3R释放Ca2+的速率比.文献[15]中仅提到前者释放Ca2+的能力更强,但强多少并未定量检测.在标准参数(表1)中将其假设为6,因此有必要通过参数敏感性分析来检验该参数是否可靠.图4(a)和图4(b)分别为Bcl-2取0.1和0.3µM时,以α为分岔参数得到的结果.结果显示α的改变并不会显著地影响细胞质钙信号的振荡,证明该参数有很强的鲁棒性,其取值是合理的.
从以上模拟结果可以看出,本文的理论模型可以很好地重复和验证实验结果,且具有很好的鲁棒性.所以,接下来利用该模型进行了一系列预测.
3.5 [IP3]和[Bcl-2]双参数分岔分析
从以上单参数分岔分析我们发现,Bcl-2不仅可以调节Ca2+振荡的幅度,而且影响极限环产生的条件(即能产生振荡的[IP3]的区域).通过对[IP3]和[Bcl-2]的双参数分岔分析,得到了系统产生极限环振荡的参数区域(图5阴影部分),图中灰色线为左Hopf分岔点,黑色线为右Hopf分岔点.在非振荡区域系统稳定,其稳定吸引子为相应参数组合下系统的稳定平衡点.结果表明,当[Bcl-2]较小时,系统有两个Hopf分岔点,且Bcl-2对系统的影响较小;当[Bcl-2]较大时,系统在[IP3]的取值范围内,只有一个Hopf分岔点;当[Bcl-2]很大时,极限环振荡消失.这表明Bcl-2对细胞质钙信号有很重要的调节作用,在生物学相关实验中需要注意它的使用量.
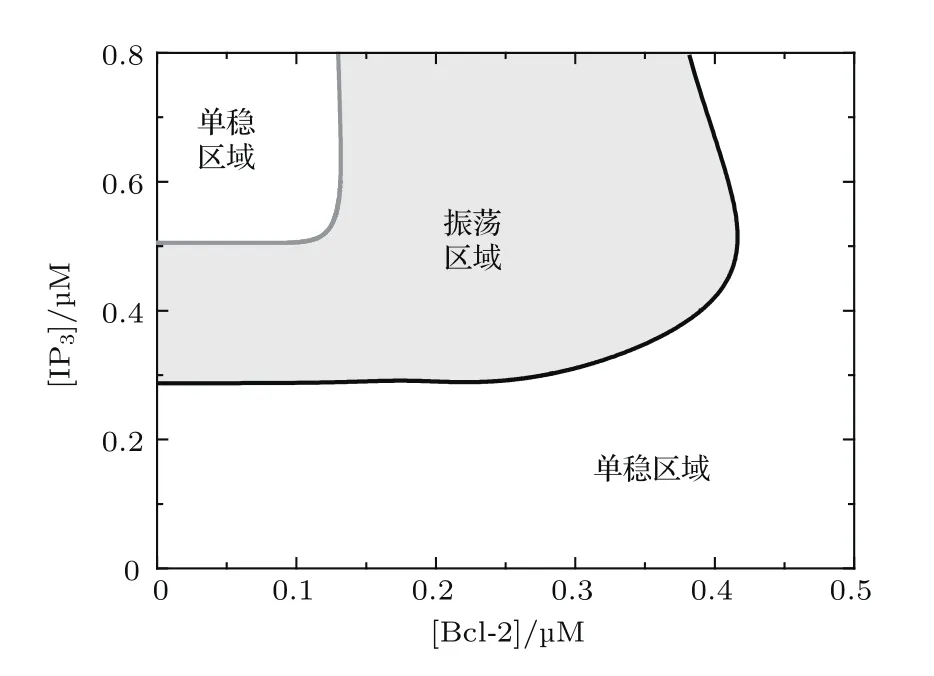
图5 [IP3]和[Bcl-2]双参数分岔图 图中灰色部分表示Ca2+持续振荡区域,白色部分表示Ca2+稳定区域Fig.5.Two-parameter bifurcation diagram for[IP3]and[Bcl-2].In the grey region,sustained oscillations of Ca2+occur,while in the white region,the level of Ca2+is stable.
3.6 [PP1]单参数分岔分析
Bcl-2间接抑制钙信号最终是通过PP1使pIP3R去磷酸化实现的,因此PP1起着关键且更直接的作用,但是文献[15]并未对PP1调节钙信号进行分析,可以借助模型定量预测PP1对钙信号的影响.图6(a)和图6(b)分别为Bcl-2取0.1和0.3µM时,以[PP1]为分岔参数得到的结果.该结果表明,PP1可以显著地抑制细胞质钙信号,而且其调节钙信号的方式与Bcl-2极其相似(图3(e)和图3(f)).这对生物学家有两方面的启示:一是重视PP1在抑制细胞质钙信号方面的作用,二是在检测Bcl-2间接抑制钙信号的实验中可以建立PP1与Bcl-2的定量关系,用PP1代替Bcl-2,这样可以节约实验成本,简化实验设计,加快实验进程.
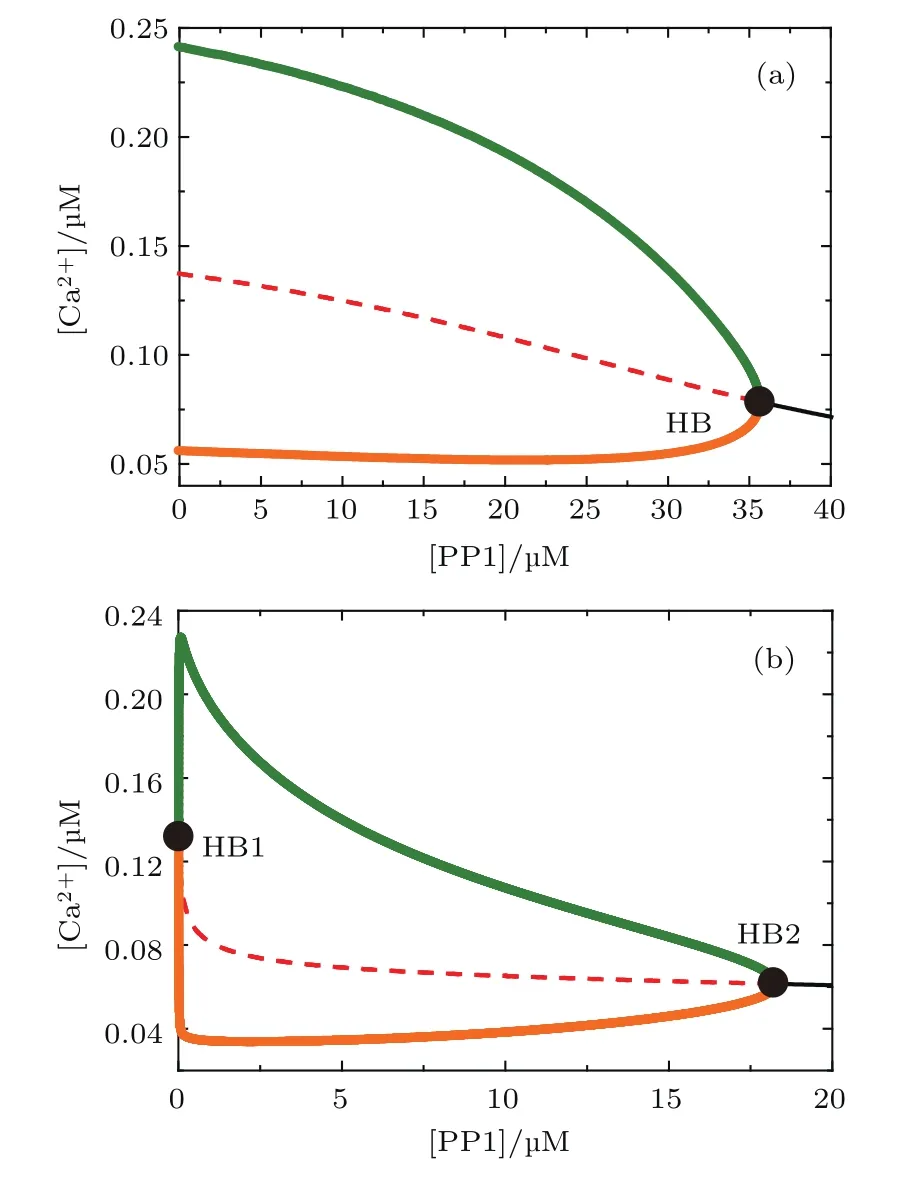
图6 (网刊彩色)[PP1]对[Ca2+]Cyt的分岔图 (a)[Bcl-2]=0.1µM;(b)[Bcl-2]=0.3µMFig.6.(color online)The one-parameter bifurcation diagram for[PP1]:(a)[Bcl-2]=0.1µM;(b)[Bcl-2]=0.3µM.
3.7 [PKA]单参数分岔分析
从模型机制图中可以发现,除了文献[15]中提出的Ca2+通过Bcl-2作用于DARPP-32进而降低IP3R通道释放Ca2+构成的负反馈环之外,还存在一个由PKA引发的一致前馈环(coherent feedforward loop)[33]:PKA一方面直接促进IP3R磷酸化,另一方面通过增加pDARPP-32对PP1的抑制作用从而减弱PP1对pIP3R的去磷酸化.选取不同的IP3和Bcl-2的浓度组合,以[PKA]为分岔参数得到了3种具有代表性的分岔图(图7).图3(d)—(f)和图7结果对比显示,PKA与Bcl-2的分岔图形状正好相反,说明了PKA和Bcl-2在Ca2+的释放中起着相反的作用.当[IP3]和[Bcl-2]均较高时(图7(c)),PKA对钙信号的振幅有促进作用,这与已发表的实验结果相一致[34,35].但是随着[IP3]和[Bcl-2]的减小,钙信号振幅对PKA呈现越来越强的鲁棒性(图7(a)和图7(b)),这种情况还未见实验报道.

图7 (网刊彩色)[PKA]对[Ca2+]Cyt的分岔图(a)[IP3]=0.4µM且[Bcl-2]=0.1µM;(b)[IP3]=0.4µM 且[Bcl-2]=0.3µM;(c)[IP3]=0.6µM且[Bcl-2]=0.3µMFig.7.(color online)The one-parameter bifurcation diagram for[PKA]:(a)[IP3]=0.4µM and[Bcl-2]=0.1µM;(b)[IP3]=0.4µM and[Bcl-2]=0.3µM;(c)[IP3]=0.6µM and[Bcl-2]=0.3µM.
4 结 论
Ca2+在细胞命运抉择中起着关键作用,而Bcl-2蛋白是钙信号的主要抑制因子之一[13−15],所以对其进行定量研究有重要的意义.本文针对最新的生物学重要实验成果,建立了Bcl-2调控钙信号的数学模型,模型结果与实验结果符合得很好.但是对于这一复杂的调控机制,实验仅能给出部分定性信息.进一步采用单参数分岔分析的方法全面系统地从理论角度证明了Bcl-2对细胞质钙信号确实具有抑制作用.
在对模型进行鲁棒性检验之后,预测了一些有生物学意义的结果.双参数分岔分析表明Bcl-2对IP3能产生振荡的区域有很大影响,预示着它可以改变细胞对刺激强度的响应;且当[Bcl-2]很大时,极限环振荡消失.因此Bcl-2不仅会影响细胞的钙信号动力学,而且会改变细胞命运.
此外,人体内约1/3的蛋白质可被蛋白激酶磷酸化,而磷酸酶可将其去磷酸化,而且大部分癌基因所编码的蛋白质为蛋白激酶,所以蛋白激酶和磷酸酶的平衡在很大程度上决定着细胞的命运[36,37].PKA和PP1就是一对调控IP3R通道磷酸化和去磷酸化的蛋白激酶和磷酸酶[38].本文利用单参数分岔分析分别预测了PKA和PP1对细胞质钙信号的影响,发现PKA对钙信号的促进作用有一定的局限性,特别是随着[IP3]和[Bcl-2]的减小,PKA对钙信号的影响越来越弱.而PP1可以有效地抑制钙信号,而且预测其调节钙信号的方式与Bcl-2极其相似.这些结果表明,在对该信号通路进行干预时需要注意PKA和PP1的用法和用量.
本文的模型表明,IP3对钙信号振幅有促进作用,Bcl-2对钙信号振幅的影响整体呈现抑制作用,PKA和Bcl-2对钙信号有相反的作用.当不同浓度的IP3,Bcl-2和PKA相互组合时,它们对钙信号振幅有复杂的调控作用:有时呈现鲁棒性,有时呈现促进作用,有时呈现抑制作用.这些复杂而丰富的调控作用使得Ca2+振荡对不同刺激信号有丰富的编码行为,恰好说明了Ca2+能成为细胞内重要的信使分子,参与并控制许多细胞活动过程的原因.
根据模型的动力学讨论,Bcl-2蛋白通过钙信号调控细胞命运的机制如下:高浓度的Bcl-2会加快pDARPP-32的去磷酸化,减小后者对PP1的抑制作用,使更多的PP1促进pIP3R的去磷酸化,降低pIP3R的浓度,从而减少内质网Ca2+的释放,有利于细胞存活.相反,低浓度的Bcl-2使pDARPP-32去磷酸化的过程减慢,后者可以充分发挥对PP1的抑制作用,使得PP1不能很好地将pIP3R去磷酸化,从而增加内质网Ca2+的释放,引起细胞凋亡.
本研究的局限之处在于:一方面,Bcl-2通过抑制IP3R通道活性降低[Ca2+]Cyt的机制有两种,为了研究清楚间接机制而未考虑直接机制,事实上两者之间存在一定程度的耦合,这是以后将要研究的问题;另一方面,Bcl-2蛋白作为细胞中一个关键的抗凋亡蛋白,也可与其他促凋亡蛋白,如PUMA,Bax等结合[39],从而影响它与IP3R的结合效率;此外,Ca2+信号动力学也受其他多种信号分子,如p53蛋白的调控[40].总之,细胞生理活动是一个极其复杂的过程,本文的研究仅是为了深刻揭示Bcl-2间接抑制[Ca2+]Cyt的机制,并不能完全反映实际的情况.
虽然本文的研究有一定的局限性,但是它不仅能够使人们更系统、深入地了解Bcl-2蛋白抑制钙信号的机制,而且可以揭示该信号通路中相关的蛋白如何通过调节钙信号决定细胞的命运,因此可为因钙信号失调而导致的多种疾病,如癌症[41,42]、阿尔兹海默症等[10]提供有用信息.
[1]Berridge M J,Bootman M D,Roderick H L 2003Nat.Rev.Mol.Cell Biol.4 517
[2]Orrenius S,Zhivotovsky B,Nicotera P 2003Nat.Rev.Mol.Cell Biol.4 552
[3]Parekh A B 2011Trends Biochem.Sci.36 78
[4]Gerasimenko J V,Gerasimenko O V,Palejwala A,Tepikin A V,Petersen O H,Watson A J 2002J.Cell Sci.115 485
[5]Scorrano L,Oakes S A,Opferman J T,Cheng E H,Sorcinelli M D,Pozzan T,Korsmeyer S J 2003Science300 135
[6]Florea A M,Splettstoesser F,Dopp E,Rettenmeier A W,Büsselberg D 2005Toxicology216 1
[7]Boehning D,Patterson R L,Sedaghat L,Glebova N O,Kurosaki T,Snyder S H 2003Nat.Cell Biol.5 1051
[8]Piacentini R,Gangitano C,Ceccariglia S,Fà A D,Azzena G B,Michetti F,Grassi C 2008J.Neurochem.105 2109
[9]Kim I,Xu W,Reed J C 2008Nat.Rev.Drug Discov.7 1013
[10]Qi H,Shuai J W 2016Med.Hypotheses89 28
[11]Prole D L,Taylor C W 2016J.Physiol.594 2849
[12]Foskett J K,White C,Cheung K H,Mak D O D 2007Physiol.Rev.87 593
[13]Vervliet T,Parys J,Bultynck G 2016Oncogene35 5079
[14]Rong Y P,Bultynck G,Aromolaran A S,Zhong F,Parys J B,de Smedt H,Mignery G A,Roderick H L,Bootman M D,Distelhorst C W 2009Proc.Natl.Acad.Sci.USA106 14397
[15]Chang M J,Zhong F,Lavik A R,Parys J B,Berridge M J,Distelhorst C W 2014Proc.Natl.Acad.Sci.USA111 1186
[16]Lu B Y,Yue H 2010Acta Biophys.Sin.26 406(in Chinese)[鲁保云,岳红 2010生物物理学报 26 406]
[17]Li X,Liu F,Shuai J W 2016Acta Phys.Sin.65 178704(in Chinese)[李翔,刘锋,帅建伟 2016物理学报 65 178704]
[18]Li Y X,Rinzel J 1994J.Theor.Biol.166 461
[19]Ferrell J E,Ha S H 2014Trends Biochem.Sci.39 496
[20]Li H,Rao A,Hogan P G 2011Trends Cell Biol.21 91
[21]Yi M,Zhao Q,Tang J,Wang C 2011Biophys.Chem.157 33
[22]Goldbeter A 1991Proc.Natl.Acad.Sci.USA88 9107
[23]Parys J,Bezprozvanny I 1995Cell Calcium18 353
[24]Svenningsson P,Nishi A,Fisone G,Girault J A,Nairn A C,Greengard P 2004Annu.Rev.Pharmacol.Toxicol.44 269
[25]Shin S Y,Choo S M,Kim D,Baek S J,Wolkenhauer O,Cho K H 2006FEBS Lett.580 5965
[26]Neves S R,Tsokas P,Sarkar A,Grace E A,Rangamani P,Taubenfeld S M,Alberini C M,SchaffJ C,Blitzer R D,Moraru I I 2008Cell133 666
[27]Lindner A U,Prehn J H,Huber H J 2013Mol.Biosyst.9 2359
[28]Alzayady K J,Wang L,Chandrasekhar R,Wagner L E 2016Sci.Signal.9 ra35
[29]De Young G W,Keizer J 1992Proc.Natl.Acad.Sci.USA89 9895
[30]Shuai J W,Jung P 2003Proc.Natl.Acad.Sci.USA100 506
[31]Qi H,Li L X,Shuai J W 2015Sci.Rep.5 7984
[32]Sneyd J,Han J M,Wang L,Chen J,Yang X,Tanimura A,Sanderson M J,Kirk V,Yule D I 2017Proc.Natl.Acad.Sci.USA114 1456
[33]Alon U 2007Nat.Rev.Genet.8 450
[34]Dyachok O,Gylfe E 2004J.Biol.Chem.279 45455
[35]Chaloux B,Caron A Z,Guillemette G 2007Biol.Cell99 379
[36]Ceulemans H,Bollen M 2004Physiol.Rev.84 1
[37]Bononi A,Agnoletto C,de Marchi E,Marchi S,Patergnani S,Bonora M,Giorgi C,Missiroli S,Poletti F,Rimessi A,Pinton P 2011Enzym.Res.2011 329098
[38]Tang T S,Tu H P,Wang Z N,Bezprozvanny I 2003J.Neurosci.23 403
[39]Luna-Vargas M P,Chipuk J E 2016Trends Cell Biol.26 906
[40]Giorgi C,Bonora M,Sorrentino G,Missiroli S,Poletti F,Suski J M,Ramirez F G,Rizzuto R,Di Virgilio F,Zito E 2015Proc.Natl.Acad.Sci.USA112 1779
[41]Roderick H L,Cook S J 2008Nat.Rev.Cancer8 361
[42]Monteith G R,Prevarskaya N,Roberts-Thomson S J 2017Nat.Rev.Cancer.17 367
Modeling of Bcl-2 protein suppressed calcium signaling and its global dynamics analysis∗
Niu Shuai1)2)Shuai Jian-Wei3)†Qi Hong1)‡
1)(Complex Systems Research Center,Shanxi University,Taiyuan 030006,China)
2)(School of Mathematical Sciences,Shanxi University,Taiyuan 030006,China)
3)(Department of Physics,Xiamen University,Xiamen 361005,China)
9 June 2017;revised manuscript
18 July 2017)
Calcium ion(Ca2+)is a signal for both life and death in cells.Either directly or indirectly,Bcl-2 protein can regulate Ca2+release from IP3R channel,thereby determining the cell fate.In this work,based on recent experimental results,a mathematical model is constructed to describe the signaling pathway of Ca2+release regulated by Bcl-2 indirectly.The model output fits nicely to the experimental data.The model demonstrates that Bcl-2 can suppress Ca2+signaling.After the robustness test of the model,the roles of some key components in the signaling pathway are predicted.Twoparameter bifurcation analyses of[IP3]and[Bcl-2]are conducted to show that Bcl-2 has a crucial role in the oscillatory region of Ca2+signaling.Single-parameter bifurcation analyses of[PP1]and[PKA]reveal that the PP1 can inhibit Ca2+from signaling potently,while PKA only promotes Ca2+signaling to some extent.Our model also indicates that the different combinations of concentrations of IP3,Bcl-2 and PKA generate complex regulations on Ca2+signaling.This work not only plays a guiding role in relevant biological experiments,but also provides some insights into the treatment of diseases caused by disruption of Ca2+homeostasis.
Bcl-2 protein,calcium signaling,bifurcation analysis
PACS:87.18.Vf,87.10.Ed,82.40.BjDOI:10.7498/aps.66.238701
*Project supported by the National Natural Science Foundation of China(Grant Nos.11504214,31370830,11675134).
†Corresponding author.E-mail:jianweishuai@xmu.edu.cn
‡Corresponding author.E-mail:hongqi@sxu.edu.cn
(2017年6月9日收到;2017年7月18日收到修改稿)
钙离子(Ca2+)是生物体内一种“生死攸关”的信号分子,Bcl-2蛋白可以直接或间接调节IP3R通道释放Ca2+的能力,借此决定细胞命运.本文基于新近的实验成果,针对Bcl-2蛋白间接调控Ca2+的信号通路建立数学模型,得到了与实验数据相符合的结果,从理论上证明了Bcl-2蛋白对钙信号有抑制作用.在对模型进行鲁棒性检验之后,本文对该信号通路中一些关键组分的作用进行了预测.以[IP3]和[Bcl-2]为双分岔参数分析的结果表明Bcl-2对刺激强度能产生Ca2+振荡的区域有重要影响.以蛋白磷酸酶1[PP1]和蛋白激酶A[PKA]为单分岔参数分析的结果揭示:PP1可以有效地抑制钙信号,而PKA对钙信号的促进作用有一定的局限性.模型结果表明,不同浓度组合的IP3,Bcl-2和PKA会对钙信号发挥复杂的调控作用.本文不仅对相关生物学实验有一定的指导作用,而且可为治疗因钙信号失调而导致的疾病提供思路.
10.7498/aps.66.238701
∗国家自然科学基金(批准号:11504214,31370830,11675134)资助的课题.
†通信作者.E-mail:jianweishuai@xmu.edu.cn
‡通信作者.E-mail:hongqi@sxu.edu.cn
