T2WI直方图鉴别诊断脑胶质母细胞瘤与单发转移瘤的价值
2017-12-22张国琴张思静高翠华阮秀杭江新青魏新华
张国琴,陈 鑫,张思静,高翠华,阮秀杭,江新青,魏新华
(广州医科大学附属市一人民医院放射科,广东 广州 510180)
T2WI直方图鉴别诊断脑胶质母细胞瘤与单发转移瘤的价值
张国琴,陈 鑫,张思静,高翠华,阮秀杭,江新青,魏新华*
(广州医科大学附属市一人民医院放射科,广东 广州 510180)
目的探讨T2WI直方图鉴别诊断胶质母细胞瘤(GBM)与单发转移瘤瘤体中的价值。方法回顾性分析经手术病理确诊的GBM和单发转移瘤患者103例,其中GBM组57例,单发转移瘤组46例。所有患者术前均接受MR检查(T1WI、T2WI、T2-FLAIR和增强后T1WI)。采用Image J软件于肿瘤最大层面手动勾画瘤体边界,计算直方图相关参数,包括均数、标准差、中位数、峰度值和偏度值。采用独立样本t检验比较GBM与脑单发转移瘤的直方图各参数,评价差异有统计学意义参数的诊断效能。结果GBM组的均数、标准差及中位数均高于单发转移瘤组,差异有统计学意义(P均<0.05)。均数、标准差及中位数的ROC曲线下面积分别为0.772[95%CI(0.681,0.862),P<0.001]、0.719[95%CI(0.616,0.822),P<0.001]和0.767[95%CI(0.674,0.860),P<0.001]。以均数临界值为509.575,鉴别两种病变的敏感度为0.719,特异度为0.783;以标准差临界值为58.844,鉴别两种病变的敏感度为0.702,特异度为0.652;以中位数临界值为550.500,鉴别两种病变的敏感度为0.719,特异度为0.826。结论肿瘤瘤体T2WI直方图均数、标准差和中位数均可用于GBM和脑单发转移瘤的鉴别,其中以均数的鉴别诊断效能最佳。
磁共振成像;直方图;胶质母细胞瘤;肿瘤转移
颅内最常见的恶性肿瘤以胶质母细胞瘤(glioblastoma multiform, GBM)及脑转移瘤多见,其中单发转移瘤约占脑转移瘤的50%[1]。当存在明确的原发肿瘤并颅内多发占位性病变时,诊断脑转移瘤较容易,但当颅内仅表现为单个病灶时,脑GBM及单发转移瘤的鉴别诊断较困难,同时由于两者的治疗方法及预后有较大差别,故术前准确鉴别这两种病变极为重要。据报道[2],鉴别GBM及单发转移瘤的正确率低于60%,同时对于具有原发非颅内肿瘤的患者,其GBM的发生率也较高[3],对两者正确地鉴别较困难。多种方法如脑灌注成像[4]、扩散加权成像[5-6]、扩散张量成像[7]、MR波普成像[8]可用于GBM与脑转移瘤的鉴别,但均属于功能成像。基于MR常规序列定量分析对二者的鉴别诊断报道鲜见。本研究探讨MR常规序列T2WI直方图对脑GBM和脑内单发转移瘤的鉴别价值。
1 资料与方法
1.1 一般资料 分析2007年9月—2017年6月于我院经手术病理确诊的患者103例,其中脑GBM 57例(GBM组),男34例,女23例,年龄1~78岁,平均(46.0±17.0)岁;脑单发转移瘤46例(单发转移瘤组),其中男32例,女14例,年龄40~81岁,平均(59.0±10.0)岁,脑转移瘤的原发灶包括肺癌28例,乳腺癌6例,消化道癌来源5例,肝细胞癌1例,前列腺癌1例,黑色素瘤1例,不明来源4例。纳入标准:术前均接受MR常规检查,包括轴位T1W、T2W、FLAIR序列和增强T1WI;经手术及病理证实为脑GBM或脑转移瘤;脑转移瘤均为单发病灶。
1.2 仪器与方法 采用Siemens Verio 3.0T和Philips Achieva 1.5T MR扫描仪,其中54例(GBM组24例;脑转移瘤组30例)行3.0T MR扫描,50例(GBM组33例;脑转移瘤组17例)行1.5T MR扫描,分别选用12通道头线圈和8通道头线圈。采用常规自旋回波序列轴位T1W、T2W和FLAIR序列,矢状位T2W以及轴位、冠状位和矢状位增强T1W。3.0T MR扫描仪扫描参数:T1WI,TR 600 ms,TE 8.9 ms;T2WI,TR 3 500 ms,TE 97 ms;层厚5 mm,层间距1 mm,矩阵256×256;FLAIR序列,TR 8 000~8 400 ms,TE 116~120 ms。1.5T MR扫描仪扫描参数:T1WI,TR 499 ms,TE 15 ms;T2WI,TR 3 567 ms,TE 100 ms;层厚6 mm,层间距0.5 mm,矩阵256×256。FLAIR序列,TR 6 000 ms,TE 120 ms。增强扫描参数同平扫T1WI,对比剂为Gd-DTPA,剂量0.1 mmol/kg体质量,采用高压注射器自肘静脉快速注射,流率2 ml/s,注射对比剂后即行轴位、矢状位和冠状位T1WI扫描。
1.3 图像分析 采用Image J软件进行图像分析。由2名分别具有5年及10年影像诊断经验的医师分析数据。选取瘤体最大层面,于T2WI手动勾画瘤体轮廓(图1),每个病灶均与T1W增强扫描的图像对比,明确瘤体边界。对所有图像均调整窗宽、窗位,保证各图像的窗宽、窗位一致。计算肿瘤瘤体的直方图参数,包括均数、标准差、中位数、峰度值及偏度值。

图1 采用Image J软件手动测量数据示意图
1.4 统计学分析 采用SPSS 20.0统计分析软件。采用组内相关系数(intra-class correlation coefficients, ICC)评估2名测量者的一致性(ICC>0.75为一致性较好)。采用Kolmogorov-Smirnov法和Levene法分别检验正态性和方差齐性,符合正态分布及方差齐性的数据以±s表示,比较采用独立样本t检验;不符合正态分布及方差齐性数据比较采用Wilcoxon检验。对差异有统计学意义的直方图参数绘制ROC曲线,确定鉴别脑GBM及脑单发转移瘤的最佳临界值,计算各参数的鉴别诊断效能(敏感度、特异度、阳性预测值及阴性预测值)。P<0.05为差异有统计学意义。
2 结果
2.1 测试者间一致性的评价 2名测量者评价GBM的直方图参数均数、标准差、中位数、峰度值及偏度值的ICC分别为0.86、0.84、0.82、0.81和0.66,评价脑单发转移瘤的ICC值分别为0.99、0.99、0.99、0.92和0.66,均具有较好的一致性,其中脑单发转移瘤的直方图各参数测量者间的一致性均较GBM高。
2.2 T2WI直方图参数比较 两组病变的直方图参数均符合正态分布及方差齐性。GBM组的均数、标准差及中位数大于单发转移瘤组,差异有统计学意义(P均<0.001),峰度值及偏度值差异无统计学意义(P均>0.05;表1,图2、3)。
2.3 诊断效能 均数、标准差及中位数鉴别脑GBM及单发转移瘤的诊断效能见表2、图4~6,其中均数具有最高的诊断效能,其曲线下面积为0.772,最佳临界值为509.575,其敏感度为0.719,特异度为0.783。
3 讨论
由于脑GBM和脑转移瘤的预后和治疗方法有很大的差别,故术前精确鉴别二者有重要的临床意义。直方图分析可反映整个瘤体的信号特点,可体现病变异质性。有研究[9-10]发现于T2WI上可更好地提取相关肿瘤的纹理特征。故本研究采用MR常规序列T2WI直方图鉴别GBM和脑单发转移瘤,结果发现肿瘤瘤体部分的T2W直方图参数(均数、中位数及标准差)可用于鉴别GBM和脑单发转移瘤,其中均数具有较高的敏感度和特异度。
表1 GBM组与单发转移瘤组的直方图参数比较(±s)
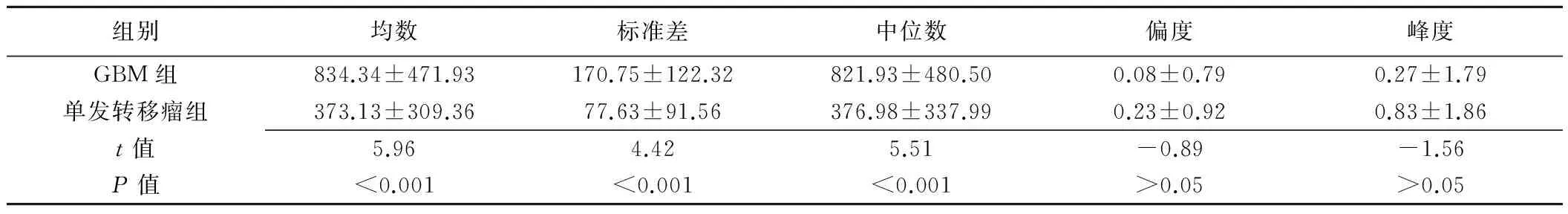
表1 GBM组与单发转移瘤组的直方图参数比较(±s)
组别均数标准差中位数偏度峰度GBM组834.34±471.93170.75±122.32821.93±480.500.08±0.790.27±1.79单发转移瘤组373.13±309.3677.63±91.56376.98±337.990.23±0.920.83±1.86t值5.964.425.51-0.89-1.56P值<0.001<0.001<0.001>0.05>0.05
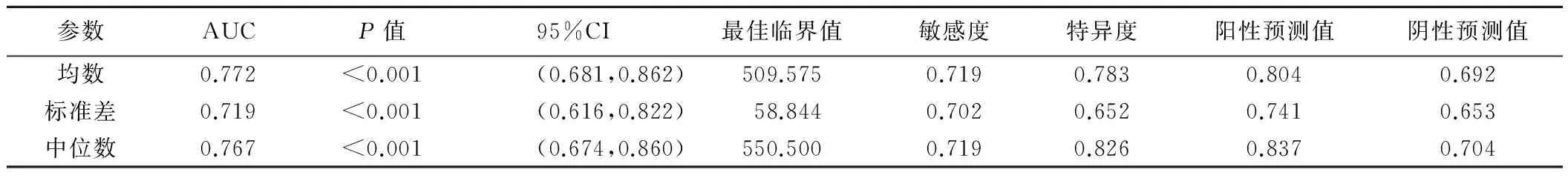
表2 T2WI直方图各参数的诊断效能
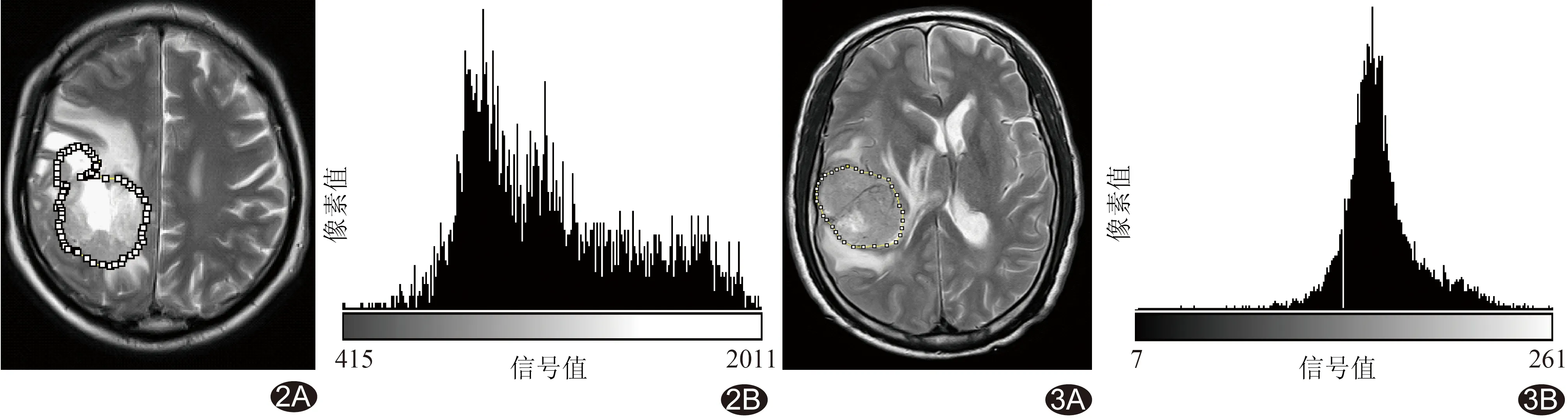
图2 患者男,58岁,高级别GBM MR T2WI图(A)和直方图(B),直方图示肿瘤在T2WI上信号值较高,高峰较为平缓,且信号值跨度较大 图3 患者男,58岁,脑单发转移瘤 A.MR T2WI可见转移瘤实性成分较多,囊变少见; B.直方图可见转移瘤瘤体信号较集中,高峰较为陡直
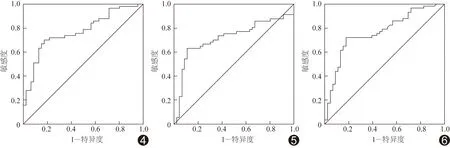
图4 均数的ROC曲线 图5 标准差的ROC曲线 图6 中位数的ROC曲线
直方图中的均数和中位数均用于反映数据集中趋势和平均水平。本研究发现脑GBM的均数和中位数均高于脑单发转移瘤,与张胜等[11]的研究结果不一致,考虑原因可能有:由于GBM的体积常大于颅内转移瘤[2];有研究[12]提出高级别GBM发生坏死、囊变、出血更常见,故本研究在手动采集数据时未避开坏死囊变区,而是作为ROI,但张胜等[11]未将坏死囊变区纳入ROI;另外MR常规序列T2WI信号表现与DWI、DCE等的信号特点不同,导致结果存在差异。
本研究发现均数的诊断效能较中位数更好,因为均数是对所有数据的整合分析,稳定性较好,而中位数虽然不受少数特大值与特小值的影响,但只是对于单个数据的分析,与Ma等[13]的研究结果相符。
直方图标准差、峰度及偏度可反映肿瘤实质区像素点间差异的大小、数据变异程度以及对称性。本研究发现GBM组的标准差大于单发转移瘤,差异有统计学意义。标准差主要描述病变特征值的平均值分散程度。随标准差的增大,大部分数据偏离平均值,反映病变不均匀。由于高级别GBM属于颅内原发肿瘤,血供丰富,更易发生坏死、囊变、出血等,导致瘤体不均匀,而转移瘤囊变坏死相比GBM少见,相对均匀,因此GBM的标准差较转移瘤大。Blanchet等[14]亦提到由于GBM常沿白质纤维束、脑脊液及脑膜生长使瘤体表现不均质。
本研究发现转移瘤和GBM T2WI的偏度、峰度值差异无统计学意义,与Falk等[15]的研究结果不一致,可能因本研究是基于二维直方图参数,并未囊括整个瘤体,另外本研究采用1.5T和3.0T MR扫描仪进行检查,可能有一定影响。虽然峰度与偏度两者间差异无统计学意义,但可发现脑转移瘤的峰度及偏度大于脑GBM,与Rahman等[16]的研究结果一致。另外本研究在ICC评价过程中发现脑GBM与脑单发转移瘤偏度的ICC值相近但低于0.75,可能因本研究所使用的软件的系统误差所致,或由于整个ROI在2名医师手动选择时不能完全一致所致。
本研究的局限性:样本量较少,尤其脑单发转移瘤的病例少于脑GBM病例,需大样本进行相关验证;仅分析瘤体最大层面的二维特征,未获取整个瘤体的三维特征,今后可进一步探讨三维特征的鉴别价值;瘤周水肿带对于高级别脑GBM及脑单发转移瘤具有鉴别价值[17-18],但本研究仅比较了瘤体部分直方图参数,未对瘤周水肿带进行分析。
总之,肿瘤瘤体部分的T2WI直方图参数(均数、标准差及中位数)可用于鉴别脑GBM和单发转移瘤,其中均数可较好地区分脑GBM和单发转移瘤,为临床鉴别诊断提供客观依据。
[1] Ranjan T, Abrey LE. Current management of metastatic brain disease. Neurotherapeutics, 2009,6(3):598-603.
[2] Georgiadis P, Cavouras D, Kalatzis I, et al. Improving brain tumor characterization on MRI by probabilistic neural networks and non-linear transformation of textural features. Comput Methods Programs Biomed, 2008,89(1):24-32.
[3] Jung BC, Arevalo-Perez J, Lyo JK, et al. Comparison of glioblastomas and brain metastases using dynamic contrast-enhanced perfusion MRI. J Neuroimaging, 2016,26(2):240-246.
[4] Cha S, Lupo JM, Chen MH, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging. AJNR Am J Neuroradiol, 2007,28(6):1078-1084.
[5] Lee EJ, terBrugge K, Mikulis D, et al. Diagnostic value of peritumoral minimum apparent diffusion coefficient for differentiation of glioblastoma multiforme from solitary metastatic lesions. AJR Am J Roentgenol, 2011,196(1):71-76.
[6] 宋莉,王霄英,谢晟,等.DWI以及ADC值测量在脑肿瘤鉴别诊断中的价值.中国医学影像技术,2005,21(3):354-357.
[7] Wang S, Kim SJ, Poptani H, et al. Diagnostic utility of diffusion tensor imaging in differentiating glioblastomas from brain metastases. AJNR Am J Neuroradiol, 2014,35(5):928-934.
[8] Halshtok Neiman O, Sadetzki S, Chetrit A, et al. Perfusion-weighted imaging of peritumoral edema can aid in the differential diagnosis of glioblastoma mulltiforme versus brain metastasis. Isr Med Assoc J, 2013,15(2):103-105.
[9] Drabycz S, Roldan G, de Robles P, et al. An analysis of image texture, tumor location, and mgmt promoter methylation in glioblastoma using magnetic resonance imaging. Neuroimage, 2010,49(2):1398-1405.
[10] 陈鑫,魏新华,杨蕊梦,等.常规MRI纹理分析鉴别脑胶质母细胞瘤和单发转移瘤的价值.中华放射学杂志,2016, 50(3):186-190.
[11] 张胜,李玉林,黄送.增强T1WI直方图在胶质母细胞瘤和脑单发转移瘤鉴别诊断中的应用.中国医学影像学杂志,2017,25(2):89-92.
[12] Alexander CG, Thomas J, Cummings RC, et al. Lymphomas and high-grade astrocytomas: Comparison of water diffusibility and histologic characteristics. Radiology, 2002,224(1):177-183.
[13] Ma JH, Kim HS, Rim NJ, et al. Differentiation among glioblastoma multiforme, solitary metastatic tumor, and lymphoma using whole-tumor histogram analysis of the normalized cerebral blood volume in enhancing and perienhancing lesions. AJNR Am J Neuroradiol, 2010,31(9):1699-1706.
[14] Blanchet L, Krooshof PW, Postma GJ, et al. Discrimination between metastasis and glioblastoma multiforme based on morphometric analysis of MR images. AJNR Am J Neuroradiol, 2011,32(1):67-73.
[15] Falk A, Fahlstrom M, Rostrup E, et al. Discrimination between glioma grades Ⅱ and Ⅲ in suspected low-grade gliomas using dynamic contrast-enhanced and dynamic susceptibility contrast perfusion MR imaging: A histogram analysis approach. Neuroradiology, 2014,56(12):1031-1038.
[16] Rahman R, Hamdan A, Zweifler R, et al. Histogram analysis of apparent diffusion coefficient within enhancing and nonenhancing tumor volumes in recurrent glioblastoma patients treated with bevacizumab. J Neurooncol, 2014,119(1):149-158.
[17] Wijnen JP, Idema AJ, Stawicki M, et al. Quantitative short echo time1H MRSI of the peripheral edematous region of human brain tumors in the differentiation between glioblastoma, metastasis, and meningioma. J Magn Reson Imaging, 2012,36(5):1072-1082.
[18] Lafitte F, Morel-Precetti S, Martin-Duverneuil N, et al. Multiple glioblastomas: CT and MR features. Eur Radiol, 2001,11(1):131-136.
ValueofT2WIhistogramanalysisindifferentialdiagnosisofglioblastomaandsolitarymetastaticbraintumor
ZHANGGuoqin,CHENXin,ZHANGSijing,GAOCuihua,RUANXiuhang,JIANGXinqing,WEIXinhua*
(DepartmentofRadiology,GuangzhouFirstPeople'sHospital,GuangzhouMedicalUniversity,Guangzhou510180,China)
ObjectiveTo investigate the value of T2WI histogram analysis in differential diagnosis of glioblastoma multiform (GBM) from solitary metastasis.MethodsData of 103 patients with pathologically confirmed GBM (GBM group,n=57) and solitary brain metastasis (solitary brain metastasis group,n=46) were retrospectively reviewed. All patients underwent conventional MR scanning, including axial T1WI, T2WI, FLAIR and contrast-enhanced T1WI before surgery. The histogram metrics, including mean, standard deviation (SD), median, kurtosis and skewness were calculated from ROI, which were manually placed on the maximal section of the solid part of tumors on T2WI by using Image J software. ROCs were generated to evaluate differential diagnostic performance of the histogram metrics with significant difference between both groups.ResultsThe values of mean, SD and median were significantly higher in GMB group than those in solitary brain metastasis group (P<0.05). The areas under ROC curve of mean, SD and median was 0.772 (95% CI [0.681, 0.862],P<0.001), 0.719 (95% CI [0.616, 0.822],P<0.001) and 0.767 (95% CI [0.674, 0.860],P<0.001), respectively; and the diagnosis cutoff value of mean, SD and median was 509.575, 58.844 and 550.500, respectively. The sensitivity of the three parameters was 0.719, 0.702 and 0.719, and the specificity was 0.783, 0.652, and 0.826, respectively.ConclusionThe value of mean, SD and median of T2WI histogram analysis can be helpful to differentiating GBM and solitary brain metastasis, of which the mean value is the best for differential diagnosis.
Magnetic resonance imaging; Histogram; Glioblastoma; Neoplasm metastasis
R739.4; R445.2
A
1003-3289(2017)12-1779-05
国家自然科学基金青年科学基金项目(81601469)。
张国琴(1994—),女,湖北宜昌人,在读硕士,医师。研究方向:神经影像学。E-mail: 463585193@qq.com
魏新华,广州医科大学附属市一人民医院放射科,510180。E-mail: weixinhua@aliyun.com
2017-09-25
2017-10-30
10.13929/j.1003-3289.201709134
