肝动脉化疗栓塞术治疗原发性肝细胞癌预后影响因素分析
2017-12-22廖玉波胡鸿涛郭晨阳马俊丽黎海亮郑州大学附属肿瘤医院河南省肿瘤医院放射介入科河南郑州450008
廖玉波,赵 妍,胡鸿涛,郭晨阳,马俊丽,蒋 丽,黎海亮(郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,河南 郑州 450008)
肝动脉化疗栓塞术治疗原发性肝细胞癌预后影响因素分析
廖玉波,赵 妍,胡鸿涛,郭晨阳,马俊丽,蒋 丽,黎海亮*
(郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,河南 郑州 450008)
目的分析肝动脉化疗栓塞术(TACE)治疗原发性肝细胞癌(HCC)的预后影响因素。方法回顾性分析326例接受TACE治疗的HCC患者的资料。采用Kaplan-Meier法计算患者1、2、3年累积生存率,分别以Log-rank检验及Cox比例风险模型进行预后相关单因素及多因素分析。结果患者1、2、3 年累积生存率分别为73.90%、40.20%、22.20%,中位生存期21个月。单因素分析显示,甲胎蛋白(AFP)、γ-谷氨酰转肽酶(GGT)、肿瘤最大径、肿瘤数目、肝功能Child-Pugh分级、巴塞罗那临床肝癌(BCLC)分期、门静脉癌栓、动静脉瘘、远处转移为影响HCC患者预后的相关因素(P均<0.05)。多因素分析显示,AFP、GGT、肿瘤最大径、肿瘤数目、BCLC分期、动静脉瘘为HCC患者预后的独立影响因素(P均<0.05)。结论影响TACE治疗HCC患者预后的独立因素包括AFP、GGT、肿瘤最大径、肿瘤数目、BCLC分期及动静脉瘘。
癌,肝细胞;化学栓塞,治疗性;预后
原发性肝细胞癌(hepatocellular carcinoma, HCC)发病率在男性恶性肿瘤中居第2位、在女性恶性肿瘤中居第3位,我国每年新增肝癌患者约占全球一半以上[1]。肝切除术是HCC的根治性疗法,但临床多数患者合并肝硬化或确诊时已出现远处转移,无法接受根治性手术治疗[2]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是目前非手术治疗HCC的首选疗法,可提高HCC患者的生存率、延长生存期[3]。本研究回顾性分析326例患者的资料,探讨TACE治疗HCC的预后因素及生存时间,以期为HCC的临床治疗方案选择和预后判断提供更多依据。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月—2014年12月于本院接受TACE治疗的326例HCC患者的资料,其中男267例,女59例,年龄23~87岁,平均(56.4±11.0)岁。患者均符合我国《原发性肝癌诊疗规范(2011年版)》诊断标准[4]。纳入标准:①无法接受肝切除手术;②肝功能Child-Pugh分级为A或B级;③美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0或1分;④术前1周完善相关影像学及实验室检查;⑤随访资料完整。排除标准:①TACE治疗前曾接受射频、微波、化疗及手术等其他治疗;②影像学或临床实验室检查资料不全;③合并其他恶性肿瘤;④存在心、肺、肾等重要脏器严重病变或意识障碍;⑤无法耐受及配合TACE治疗;⑥随访资料不完整。
1.2 TACE治疗 采用Siemens Zeego DSA系统为引导设备。通过Seldinger技术经皮穿刺股动脉,造影明确肿瘤供血动脉后,将微导管超选至肿瘤供血动脉,依据肿瘤部位、大小、患者肝功能情况,灌注阿霉素30~50 mg、顺铂30~90 mg、丝裂霉素4~10 mg,以10~20 ml超液化碘油混合栓塞,适量使用明胶海绵颗粒。术后观察病情变化及并发症情况,给予保肝、止血及对症治疗。
1.3 随访及疗效评估 TACE治疗后1个月内复查CT或MR平扫+动态增强扫描,如发现肿瘤残留,可再次行TACE治疗,每次治疗间隔4~6周,直至肝脏病灶完全被碘油沉积或患者无法耐受治疗为止。连续2个月复查无肿瘤复发,则改为每隔2~3个月复查1次。记录患者的生存期(自确诊HCC之日至死亡或随访截止),随访截止时间为2017年2月。
末次TACE治疗后1个月,根据实体肿瘤疗效评价标准(mRECIST)[5],进行疗效评价:完全缓解(complete response, CR),靶病灶动脉期强化显影消失;部分缓解(partial response, PR),所有靶病灶存活肿瘤同基线相比,最大径总和缩小≥30%;进展(progressive disease, PD),靶病灶存活肿瘤最大径总和增加≥20%或出现新发病灶;稳定(stable disease, SD):缩小未达PR或增加未达PD。以CR和PR为治疗有效。
1.4 统计学分析 采用SPSS 17.0统计学分析软件,采用Kaplan-Meier法绘制生存曲线并计算患者1、2、3年的累积生存率。以Log-rank检验进行预后因素分析,包括患者性别、年龄、TACE术前1周乙肝表面抗原(hepatitis B surface antigen, HBsAg)、甲胎蛋白(alpha fetoprotein, AFP)、γ-谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT)、肿瘤部位、肿瘤数目、肿瘤最大径、TACE治疗次数、巴塞罗那临床肝癌(Barcelona clinic liver cancer, BCLC)分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘、远处转移、肝硬化、腹水、糖尿病;并以Cox比例风险模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 生存分析 326例HCC患者中,至随访结束共死亡267例(267/326,81.90%)、删失59例(59/326,18.10%)。患者生存时间1~59个月,中位生存时间为21个月(图1)。1、2、3年累积生存率分别为73.90%、40.20%、22.20%。

图1 TACE治疗HCC患者的生存曲线
2.2 疗效 每例患者接受1~9次TACE治疗,平均(4.9±1.8)次。326例中,CR共48例(48/326,14.72%),PR共145例(145/326,44.48%;图2),SD共97例(97/326,29.76%),PD共36例(36/326,11.04%),有效率为59.20%(193/326)。
2.3 单因素分析 术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘及远处转移均为影响HCC患者预后的相关因素(P均<0.05,表1)。
2.4 多因素分析 术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、动静脉瘘为影响HCC患者预后的独立因素(P均<0.05,表2)。
2.5 并发症 TACE治疗后,278例患者出现不同程度肝区疼痛、恶心、发热等,经对症治疗后均好转;1例患者出现肝性脑病,给予降酶治疗、静脉输注精氨酸后好转。326例患者均未出现其他严重并发症,无治疗相关性死亡。
3 讨论
近年来,作为非手术治疗HCC的首选疗法,TACE的疗效已获得广泛认可[6]。目前TACE治疗HCC的预后影响因素较多,且结论尚未达成一致。本研究对TACE治疗HCC的预后影响因素进行分析,以期为准确评估病情、判断预后从而延长患者生存期提供有价值的参考依据。本研究通过单因素及多因素分析,发现TACE术前AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、肝功能Child-Pugh分级、门静脉癌栓、动静脉瘘及远处转移均为HCC预后影响因素(P均<0.05),且其中AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期、动静脉瘘为影响HCC患者预后的独立因素(P均<0.05)。
作为HCC的特异性标志物,AFP已被临床广泛应用于HCC的筛查与早期诊断。当肝细胞癌变时,相关基因被激活,HCC患者血清中AFP水平升高。AFP具备促进肝癌细胞增殖和抗凋亡诱导的生物学活性,其在HCC病情发展过程中具有关键作用,与患者预后密切相关[7-8]。本研究结果显示,TACE治疗后不同AFP水平的HCC患者预后差异有统计学意义(χ2=10.705,P=0.001),提示AFP水平对HCC早期诊断及预后评估具有重要意义。
既往研究[9]表明,肿瘤大小和数目是影响HCC患者预后的独立因素。肿瘤大小可反映肿瘤生长的速度,HCC病灶越大,肝脏组织代偿功能越差,TACE治疗时常规剂量越难以完全栓塞肿瘤,因此患者的总体生存率及治疗率均较低[10]。也有学者[11]认为,肝脏肿瘤体积较大且有完整假包膜形成时,由于病灶局限,预后相对较好。本研究结果显示,肿瘤最大径≤5 cm与>5 cm的HCC患者预后差异有统计学意义(P<0.001),肿瘤越小患者的预后越好,其术后生存时间越长。
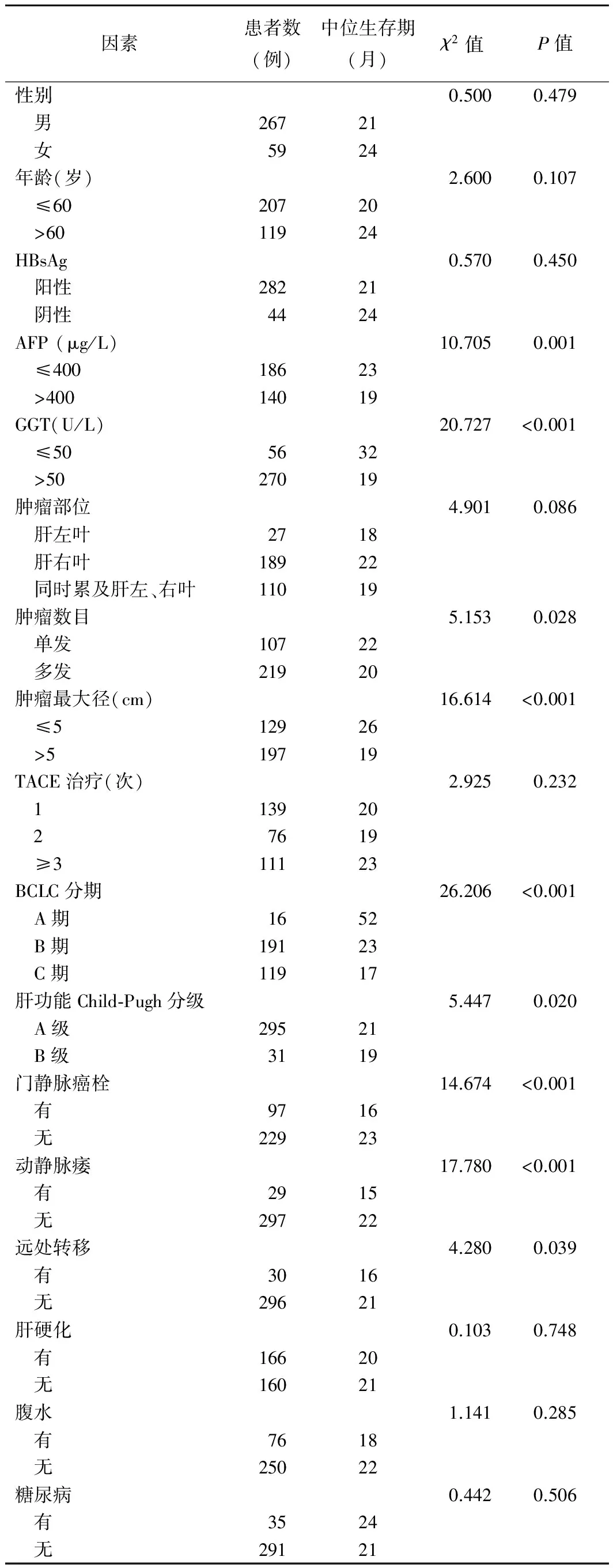
表1 TACE治疗HCC患者预后单因素分析
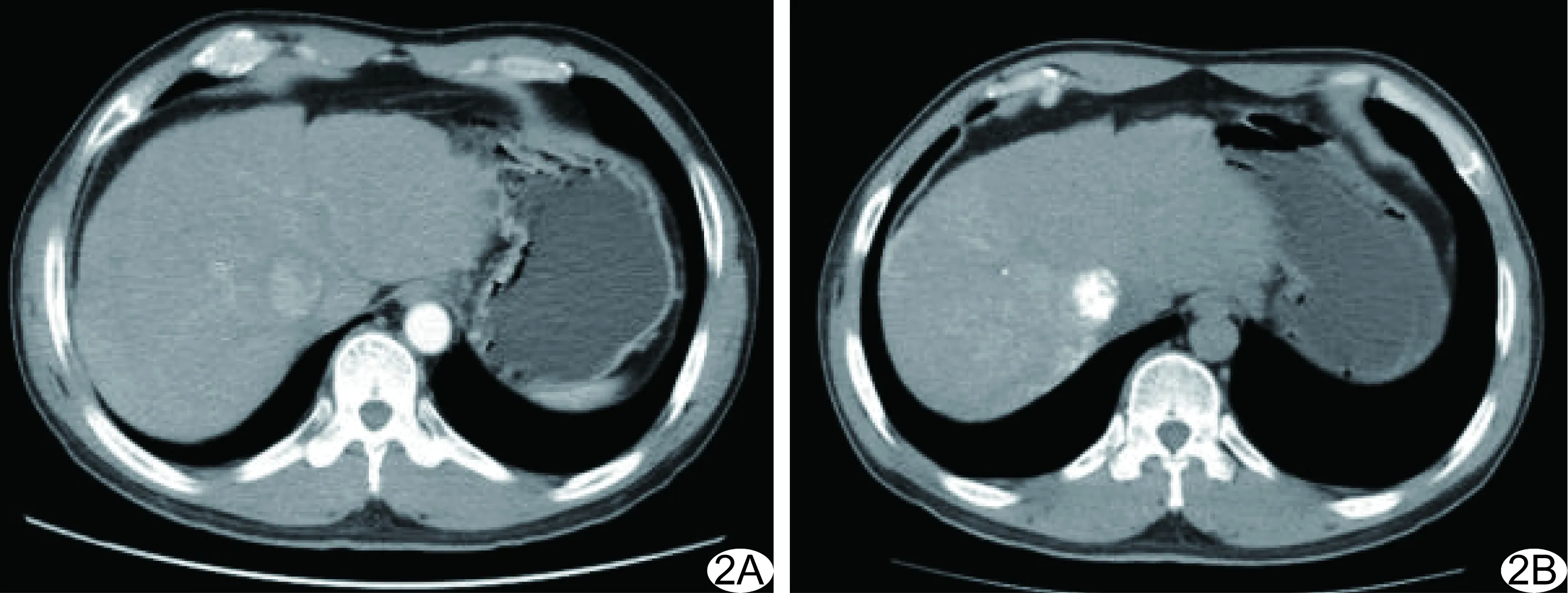
图2 患者男,48岁,原发性HCC A.TACE治疗前增强CT示肝右叶可见约2.9 cm×2.4 cm肿瘤,边界清晰; B.TACE治疗后1个月复查CT示碘油沉积致密,病灶大小约2.1 cm×1.9 cm,较前缩小

表2 TACE治疗HCC患者预后多因素回归分析
肝脏肿瘤数目的增多可增大其侵及血管及复发转移的风险。本研究中,单发与多发肿瘤患者的中位生存期分别为22个月和20个月,且二者预后的差异有统计学意义(P=0.028),提示肿瘤数目是HCC预后的重要因素,单发肿瘤患者TACE治疗预后较好。
BCLC分期是目前临床广泛应用的肝癌分期系统,其根据患者的一般情况、肝功能Child-Pugh分级及肿瘤特性进行分类,有助于较为准确地评估病情,从而进一步制定合理的治疗方案。在BCLC分期系统中,依据肿瘤分期标准提供不同的治疗方案:对肝功能较好的早期HCC患者首选根治性肝切除术,而对中晚期HCC患者则推荐TACE治疗。有研究[12]发现,BCLC分期越晚,患者生存率越低。本研究中,BCLC分期为A、B、C期的患者中位生存时间分别为52、23、17个月,提示BCLC分期越高,预后越差。
GGT主要由肝脏产生,是临床常用的血清标志物之一。有研究[13]认为血清GGT水平与肝功能Child-Pugh分级、肝硬化、肿瘤大小和ALT水平密切相关。Zhang等[14]研究表明,GGT水平是影响HCC患者生存的独立预后因素。本研究结果显示,GGT≤50 U/L与GGT>50 U/L的患者中位生存期分别为32个月和19个月,提示GGT水平是影响HCC患者预后的独立因素,即TACE术前GGT水平越低,预后越好。
有研究[15]表明,肝动静脉瘘在HCC患者中的发生率为28.8%~63.2%。动静脉瘘可影响肝功能,加重门静脉高压,引发上消化道大出血、大量腹腔积液及肝性脑病等。HCC合并动静脉瘘曾被认为是TACE治疗的禁忌证。近年来,随着血管介入治疗水平的进步,TACE治疗HCC合并肝动静脉瘘已成为临床一线治疗方案[16]。本研究结果显示,有、无动静脉瘘的患者中位生存期分别为15个月和22个月,动静脉瘘是HCC患者预后的独立影响因素。
既往研究[17]结果显示,肝功能Child-Pugh分级、门静脉癌栓和远处转移是影响HCC患者预后的独立因素。门静脉癌栓形成时,极易引发肝内扩散及远处转移;且癌栓阻塞门静脉可导致门静脉高压,严重损害肝功能。门脉癌栓越多、肝功能分级越差,术后患者预后越差、生存时间越短。本研究中,虽然单因素分析显示肝功能Child-Pugh分级、门静脉癌栓和远处转移与HCC患者的预后相关,但多因素分析表明其并非影响预后的独立因素。本研究结果与既往研究[17]结果有所不同,原因可能为:①入组标准存在差异;②TACE治疗过程中的操作方法与技术存在差异;③各因素之间存在交互作用。
总之,TACE治疗HCC可有效延长患者的生存期。AFP、GGT、肿瘤数目、肿瘤最大径、BCLC分期及动静脉瘘是影响TACE治疗HCC患者预后的独立因素。本研究为非随机性及回顾性研究,结果尚需今后大量前瞻性、随机对照试验进一步证实。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015,65(2):87-108.
[2] Zhang J, Jin H, Liu H, et al. MiRNA-99a directly regulates AGO2 through translational repression in hepatocellular carcinoma. Oncogenesis, 2014,3:e97.
[3] Varga M, Valsamis A, Matia I, et al. Transarterial chemoembolizationin hepatocellular carcinoma. RozhlChir, 2009,88(8):434-438.
[4] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版).临床肿瘤学杂志,2011,16(10):929-946.
[5] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1) . Eur J Cancer, 2009,45(2):228-247.
[6] ChengX, Sum P, Hu QG, et al. Transarterial (chemo) embolization for curative resection of hepatocellular carcinoma: A systematic review and meta-analyses. J Cancer Res Clin Oncol, 2014,140(7):1159-1170.
[7] Li M, Li H, Li C, et al. Alpha-fetoprotein: A new member of intracellular signal molecules in regulation of the PI3K/AKT signaling in human hepatoma cell lines. Int J Cancer, 2011,128(3):524-532.
[8] Page AJ, Cosgrove DC, Philosophe B, et al. Hepatocellular carcinoma: Diagnosis, management, and prognosis. Surg Oncol Clin N Am, 2014,23(2):289-311.
[9] Takayasu K, Arii S, Ikai I, et al. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology, 2006,131(2):461-469.
[10] 吕嘉玲,杜瑞明,刘鹏程,等.肝动脉化疗栓塞治疗原发性肝癌的预后因素分析.实用放射学杂志,2012,28(1):114-118.
[11] Kudo M. Multistep human hepatocarcinogenesis: Correlation of imaging with pathology. J Gastroenterol, 2009,44(19):112-118.
[12] 鄢毅权,李介秋,周光华.原发性肝癌的分期方法及比较.医学临床研究,2008,25(1):108-112.
[13] Faber W, Sharafi S, Stockmann M, et al. Long-term results of liver resection for hepatocellular carcinoma in noncirrhotic liver. Surgery, 2013,153(4):510-517.
[14] Zhang JB, Chen Y, Zhang B, et al. Prognostic significance of serum gamma-glutamyl transferase in patients with intermediate hepatocellular carcinoma treated with transcatheter arterial chemoembolization. Eur J Gastroenterol Hepatol, 2011,23(9):787-793.
[15] Vogl TJ,Nour-Eldin NE, Emad-Eldin S, et al. Portal vein thrombosis and arterio-portal shunls: Effects on tumor response after chemoembolization of hepatocellular carcinoma. World J Gastroenterol, 2011,17(10):1267-1275.
[16] Kunmar A, Ahuja CK, Vyas S, et al. Hepatic arteriovenous fistulae: Role of interventional radiology. Dig Dis Sci, 2012,57(10):2703-2712.
[17] 余梁,吕维富.经肝动脉化疗栓塞术治疗中晚期肝癌的预后因素分析.中国介入影像与治疗学,2015,12(1):14-17.
Prognosticfactorsoftranscatheterarterialchemoembolizationforprimaryhepatocellularcarcinoma
LIAOYubo,ZHAOYan,HUHongtao,GUOChenyang,MAJunli,JANGLi,LIHailiang*
(DepartmentofInterventionalRadiology,AffiliatedCancerHospitalofZhengzhouUniversity,HenanCancerHospital,Zhengzhou450008,China)
ObjectiveTo investigate the prognostic factors of transcatheter arterial chemoembolization (TACE) in the treatment of primary hepatocellular carcinoma (HCC).MethodsA retrospective analysis was performed on 326 HCC patients treated with TACE.Kaplan-Meiermethod was used to calculate the 1-year, 2-year and 3-year cumulative survival rates.Log-ranktest andCoxproportional hazards model were used to analyze univariate and multivariate prognostic factors, respectively.ResultsThe 1-year, 2- year and 3-year cumulative survival rate of HCC patient was 73.90%, 40.20% and 22.20%, respectively. The median survival time was 21 months. Univariate analysis showed that the alpha-fetoprotein (AFP), gamma-glutamyl transpeptidase (GGT), tumor size, tumor number, Child-Pugh grade, Barcelona clinic liver cancer (BCLC) stage, portal vein thrombosis, arteriovenous fistula and distant metastasis were factors affecting the prognosis of HCC patient (allP<0.05). MultivariateCOXregression analysis showed that AFP, GGT, tumor size, tumor number, BCLC stage, arteriovenous fistula were the independent prognostic factors of HCC patients (allP<0.05).ConclusionAFP, GGT, tumor size, tumor number, BCLC stage and arteriovenous fistula are independent prognostic factors of HCC patients treated with TACE.
Carcinoma, hepatocellular; Chemoembolization, therapeutic; Prognosis
2017年河南省医学科技攻关项目(201701032)。
廖玉波(1993—),女,河南驻马店人,在读硕士。研究方向:影像诊断。E-mail: liaoyb199306@163.com
黎海亮,郑州大学附属肿瘤医院 河南省肿瘤医院放射介入科,450008。E-mail: cjr.lihailiang@ vip.163.com
2017-04-27
2017-09-13
10.13929/j.1672-8475.201704027
R735.7; R816
A
1672-8475(2017)12-0729-05
