冠状动脉造影或经皮冠状动脉介入术前患者临床列线图预测术后发生对比剂急性肾损伤的风险
2017-12-22欧阳富盛郭保亮张水兴南方医科大学研究生院广东广州510515广东省医学科学院广东省人民医院放射科广东广州510080南方医科大学顺德医院放射科广东佛山528300暨南大学第一附属医院医学影像中心广东广州510630
欧阳富盛,郭保亮,张 斌,张 璐,张水兴*(1.南方医科大学研究生院,广东 广州 510515;2.广东省医学科学院 广东省人民医院放射科,广东 广州 510080;3.南方医科大学顺德医院放射科,广东 佛山 528300;.暨南大学第一附属医院医学影像中心,广东 广州 510630)
冠状动脉造影或经皮冠状动脉介入术前患者临床列线图预测术后发生对比剂急性肾损伤的风险
欧阳富盛1,2,3,郭保亮1,2,3,张 斌4,张 璐1,2,张水兴1,2*
(1.南方医科大学研究生院,广东 广州 510515;2.广东省医学科学院 广东省人民医院放射科,广东 广州 510080;3.南方医科大学顺德医院放射科,广东 佛山 528300;4.暨南大学第一附属医院医学影像中心,广东 广州 510630)
目的构建接受冠状动脉造影(CAG)或经皮冠状动脉介入(PCI)治疗患者术前临床指标的列线图,据此预测术后发生对比剂急性肾损伤(CI-AKI)的风险。方法收集245例接受CAG或PCI治疗患者的术前临床资料。采用LASSO回归方法筛选与CI-AKI相关的临床特征,据以构建列线图预测模型,计算CI-AKI风险分数。绘制ROC曲线,计算风险评分临界值。结果245例中,34例(34/245,13.88%)发生CI-AKI。LASSO回归分析显示性别、糖尿病史、乳酸脱氢酶水平、超敏C反应蛋白,饮酒年限、慢性肾脏病及其分期、脑卒中史、急性心肌梗死及收缩压是CI-AKI风险评分和预测模型的危险因素。CI-AKI列线图预测效能较好,其风险评分临界值为-1.953。结论列线图可用于术前预测患者接受CAG或PCI治疗后发生CI-AKI的风险。
对比剂急性肾损伤;列线图;冠状血管造影术;经皮冠状动脉介入治疗
对比剂急性肾损伤(contrast-induced acute kidney injury, CI-AKI)是冠状动脉造影(coronary angiography, CAG)和经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)术后常见并发症之一,与患者住院时间、费用和死亡率增加密切相关[1]。早期准确识别高风险患者有助于及时采取适当防治措施,降低发病率和死亡率[2-3]。CI-AKI风险预测模型可分为术前和术后型,以术后模型居多,其预测CI-AKI的准确率为61%~92%[4-6]。应用较为广泛的Mehran风险评分模型[7]预测准确率仅为69%,与Bartholomew评分模型预测结果相似[7-8],时效性差,且变量不易获取。Inohara等[6,9]提出具有7个或更多危险因素的术前预测CI-AKI模型,但上述预测因子缺乏定量信息。本研究旨在构建一种简便、准确的CI-AKI风险预测模型,为术前早期预测CI-AKI的发生提供依据。
1 资料与方法
1.1 一般资料 收集2015年1月—2017年1月在我院接受CAG或PCI治疗的615例患者,男462例,女153例,年龄31~89岁,平均(61.3±13.4)岁。纳入标准:①年龄≥18岁,CAG或PCI治疗后住院2~3天;②术前和术后1~3天均监测血清肌酐浓度(serum creatinine, Scr)。排除标准参照最新版欧洲泌尿生殖协会制定的对比剂安全使用指南[3]。共纳入245例,男167例,女78例,年龄36~86岁,平均(65.7±11.0)岁。为构建预测指标,根据术后是否发生CI-AKI分为CI-AKI组及非CI-AKI组:CI-AKI组34例,男18例,女16例,年龄39~86岁,平均(66.1±11.3)岁;非CI-AKI组211例,男149例,女62例,年龄43~86岁,平均(65.6±11.0)岁。根据AHA/ACCF指南[10]治疗所有患者,由6名专科医生根据介入操作规范行CAG和PCI治疗操作及使用非离子型低渗对比剂(优维显,370 mgI/ml),每例患者平均用量(122.1±76.3)ml。
记录患者相关临床资料,以性别、糖尿病史(diabetes mellitus, DM)、饮酒史、吸烟史、慢性肾脏病史(chronic kidney disease, CKD)、CKD分期、脑卒中史、是否急性心肌梗死(ayocardial infarction, AMI)为分类变量,其余为连续变量。根据术前Scr构建CI-AKI预测列线图,并验证术后48 h和72 h内CI-AKI的发生情况。
1.2 观察结局 以患者术后3天内发生CI-AKI作为阳性结局。判断标准为最新版欧洲泌尿生殖放射协会推荐的诊断标准,即注射对比剂后3天内Scr水平高于基线水平25%以上或绝对值升高44 μmol/L以上[3]。
1.3 筛选预测危险因素 采用LASSO逻辑回归方法筛选与CI-AKI相关的临床特征,构建列线图预测模型,并以C-index评估预测模型性能。对所选特征系数加权后建立线性拟合,计算CI-AKI风险分数。
1.4 统计学分析 采用3.2.3版本R软件进行统计学分析。将所有临床特征归一化。LASSO逻辑回归分析采用“glmnet”软件包,CI-AKI风险预测列线图采用RMS软件包,分别采用C-index和Hosmer-Lemeshow检验评估预测准确率及校准度。分类资料采用χ2检验;计量资料方差齐性采用独立样本t检验,方差不齐采用Mann-WhitneyU检验。绘制ROC曲线,计算风险评分临界值。P<0.05为差异有统计学意义。
2 结果
单因素分析显示性别(χ2=4.215,P=0.040)、超敏C反应蛋白(high-sensitivity C-reactive protein, Hs-CRP;t=-2.139,P=0.034)及CKD分期(t=-3.689,P<0.001)是发生CI-AKI的危险因素。
34例(13.88%)发生CI-AKI,其中第1天发生18例,第2天新增4例,第3天新增12例。LASSO回归模型显示,性别、DM、乳酸脱氢酶(lactate dehydrogenase, LDH)水平、Hs-CRP、饮酒年限、CKD、CKD分期、脑卒中史、AMI和收缩压(systolic blood pressure, SBP)为CI-AKI风险评分和预测模型的危险因素。计算CI-AKI风险积分:CI-AKI风险积分=0.2232×DM+0.2188×AMI+0.013×吸烟年限+0.0025×SBP-0.4489×性别-0.0001×LDH-0.0011×Hs-CRP-0.725×CKD-0.0013×CKD分期-0.1994×脑卒中史-2.0130。男性标记为1,女性标记为0;有DM、AMI、CKD及脑卒中史标记为1,无标记为0;CKD分期标记为0~3。ROC曲线下面积(area under the curve, AUC)为0.718,CI-AKI风险评分的临界值-1.953(图1)。根据临界值将患者分为高危组和低危组,风险评分≤-1.953为高危组,风险评分>-1.953的患者为低危组;其中高危组114例,低危组131例,术前根据临界值分组可简易判断患者是否为CI-AKI高危患者。列线图精度良好(C-index=0.718),范围0.01~0.80,预测CI-AKI发生的准确率为71.82%[95%可信区间(0.637,0.800);P=7.23×10-5],且校准度良好(χ2=5.829,P=0.120,图2、3)。
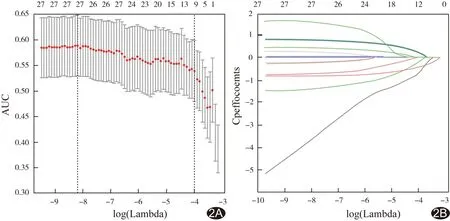
图2 LASSO逻辑回归模型实现预测变量选择图 A.LASSO模型中最佳惩罚系数λ的判定,使用10折交叉验证和最小准则; B.患者临床特征的LASSO系数曲线

图1 CI-AKI风险积分ROC曲线图
3 讨论
CI-AKI可致患者住院时间延长、院内并发症发生率增加及预后不良,而治疗手段局限,只有提前预防,才可有效遏制上述不良事件发生[10-11]。Inohara等[6,9]利用7个或更多临床指标构建模型预测CI-AKI风险,预测准确率分别为80%和86%,但其中部分临床指标不易获取。本研究选择可从病历中轻易获得的10项常见临床指标进行比较,单因素分析显示性别、Hs-CRP及CKD分期为CI-AKI发生的风险因素;采用LASSO回归方法筛选最相关的风险因素,模型的可解释性较好,预测准确率良好。LASSO回归模型显示性别、DM、LDH、Hs-CR、饮酒年限、CKD、CKD分期、脑卒中史、AMI和SBP为CI-AKI风险评分和预测模型的危险因素。
慢性肾病或糖尿病患者的CI-AKI发生率大幅度增高[12-13],发生机制可能是慢性肾病患者的肾小球滤过率下降,应用对比剂后,造成肾小管收缩、堵塞,肾小球滤过率进一步下降,导致肾小管损伤;糖尿病患者肾小球动脉及肾小球硬化、血液黏稠度增高促进CI-AKI发生。慢性肾病及糖尿病患者常伴有冠状动脉弥漫性、复杂性病变,致介入诊疗手术难度增加,CI-AKI发生的风险提高。研究[6-9]表明,高血压病及周围血管病变与CI-AKI发生显著相关,多数脑卒中史及多年饮酒患者存在不同程度的周围血管病变。本研究显示,入院时SBP为CI-AKI风险评分和预测模型的危险因素,而高血压病史、发病年限则并非危险因素。LDH升高提示冠状动脉心脏病患者可能已发生心肌梗死[14],心肌梗死时心肌电及血流动力学不稳定、心功能受损及左心室射血分数降低等可致血压减低及肾灌注损伤,使肾缺血、缺氧加重,增加CI-AKI发生的风险。Hs-CRP为敏感蛋白,机体发生组织损伤、心肌梗死或炎症反应时,其在血液中浓度明显增高。有研究[15]证实,各种炎症相关因子是CAG或PCI治疗后发生CI-AKI的重要因素,其中Hs-CRP是最为重要的危险因素。此外,有作者[16]发现女性是CI-AKI发生的危险因素,1年内死亡率明显高于男性,可能原因是女性较男性的血红蛋白水平及肾小球率过滤低,且血红蛋白水平、肾小球率过滤与卵巢激素对促红细胞生成素、肾素-血管紧张素及肾血流等影响有关。
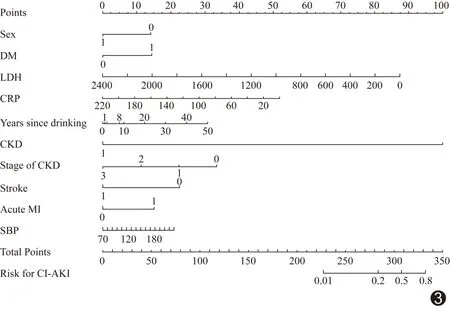
图3 CI-AKI预测列线图 (Point:分数;Sex:性别;DM:糖尿病史;LDH:乳酸脱氢酶;CRP:超敏C反应蛋白;Years since drinking:饮酒年限;CKD:慢性肾脏病史;Stage of CKD:慢性肾脏病分级;Stroke:脑卒中史;Acute MI:急性心肌梗死;SBP:收缩压;Total Points:总分数;Risk for CI-AKI:CI-AKI风险)
本研究构建了基于10项常见临床指标为预测因子的CI-AKI发生风险预测列线图,结果显示该预测模型的精度(C-index=0.718)和校准度良好;以CI-AKI风险积分高于-1.953预测CI-AKI发生的准确率为71.82%,术前可以此有效识别CI-AKI高危患者。根据模型预测结果,临床医生可提前对CI-AKI高危患者采取干预措施,如充分水化治疗(如生理盐水、碳酸氢钠)或联合药物预防等。采用多项干预措施可将多中心连续PCI患者的CI-AKI发生率降低20%[17]。有作者[18]发现对比剂用量无法显著影响CI-AKI发生的风险,提示在一定范围内减少对比剂用量并不能降低CI-AKI发生的风险,本研究结果与其相符。
本研究的局限性:①单中心回顾性研究,结果可能存在偏倚;②无法获取既往研究所提及的部分风险因素;③样本量较少,需进一步验证和重新校准。
[1] Mccullough PA, Adam A, Becker CR, et al. Epidemiology and prognostic implications of contrast-induced nephropathy. Am J Cardiol, 2006,98(6A):5K-13K.
[2] Zhang B, Liang L, Chen WB, et al. The efficacy of sodium bicarbonate in preventing contrast-induced nephropathy in patients with pre-existing renal insufficiency: A meta-analysis. BMJ Open, 2015,5(3):e006989.
[3] Stacul F, Van Der Molen AJ, Reimer P, et al. Contrast induced nephropathy: Updated ESUR Contrast Media Safety Committee guidelines. Eur Radiol, 2011,21(12):2527-2541.
[4] Allen DW, Ma B, Leung KC, et al. Risk prediction models for contrast-Induced acute kidney injury accompanying cardiac catheterization: Systematic review and meta-analysis. Can J Cardiol, 2017,33(6):724-736.
[5] Lu TM, Hsu CP, Chang CF, et al. Asymmetric dimethylarginine predicts the risk of contrast-induced acute kidney injury in patients undergoing cardiac catheterization. Atherosclerosis, 2016,254:161-166.
[6] Inohara T, Kohsaka S, Abe T, et al. Development and validation of a pre-percutaneous coronary intervention risk model of contrast-induced acute kidney injury with an integer scoring system. Am J Cardiol, 2015,115(12):1636-1642.
[7] Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: Development and initial validation. J Am Coll Cardiol, 2004,44(7):1393-1399.
[8] Bartholomew BA, Harjai KJ, Dukkipati S, et al. Impact of nephropathy after percutaneous coronary intervention and a method for risk stratification. Am J Cardiol, 2004,93(12):1515-1519.
[9] Maioli M, Toso A, Gallopin M, et al. Preprocedural score for risk of contrast-induced nephropathy in elective coronary angiography and intervention. J Cardiovasc Med, 2010,11(6):444-449.
[10] Jneid H. The 2012 ACCF/AHA focused update of the unstable angina/Non-ST-Elevation myocardial infarction (UA/NSTEMI) guideline: A critical appraisal. Methodist Debakey Cardiovasc J, 2012,8(3):26-30.
[11] 冉鹏程,刘玉品,刘波,等.3.0T BOLD-fMRI评价丹参注射液对大鼠对比剂肾病的保护作用:与病理对照研究.中国医学影像技术,2014,30(12):1788-1791.
[12] 张功霖.对比剂肾病的预防及危险分层的研究进展.中国介入影像与治疗学,2012,9(12):889-892.
[13] Weisbord SD, Chen H, Stone RA, et al. Associations of increases in serum creatinine with mortality and length of hospital stay after coronary angiography. J Am Soc Nephrol, 2006,17(10):2871-2877.
[14] Reinstadler SJ, Feistritzer HJ, Reindl M, et al. Combined biomarker testing for the prediction of left ventricular remodelling in ST-elevation myocardial infarction. Open Heart, 2016,3(2):e000485.
[15] Toso A, Leoncini M, Maioli M, et al. Relationship between inflammation and benefits of early high-dose rosuvastatin on contrast-induced nephropathy in patients with acute coronary syndrome: The pathophysiological Link in the PRATO-ACS study (protective effect of rosuvastatin and antiplatelet therapy on contrast-induced nephropathy and myocardial damage in patients with acute coronary syndrome undergoing coronary intervention). JACC Cardiovasc Interv, 2014,7(12):1421-1429.
[16] Xinwei J, Xianghua F, Jing Z, et al. Comparison of usefulness of simvastatin 20 mg versus 80 mg in preventing contrast-induced nephropathy in patients with acute coronary syndrome undergoing percutaneous coronary intervention. Am J Cardiol, 2009,104(4):519-524.
[17] Brown JR, Solomon RJ, Sarnak MJ, et al. Reducing contrast-induced acute kidney injury using a regional multicenter quality improvement intervention. Circ Cardiovasc Qual Outcomes, 2014,7(5):693-700.
[18] Silver SA, Shah PM, Chertow GM, et al. Risk prediction models for contrast induced nephropathy: Systematic review. BMJ, 2015,351:h4395.
Developmentofpreprocedurenomogramforpredictingcontrast-inducedacutekidneyinjuryaftercoronaryangiographyorpercutaneouscoronaryintervention
OUYANGFusheng1,2,3,GUOBaoliang1,2,3,ZHANGBin4,ZHANGLu1,2,ZHANGShuixing1,2*
(1.GraduateSchool,SouthernMedicalUniversity,Guangzhou510515,China; 2.DepartmentofRadiology,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China; 3.DepartmentofRadiology,ShundeHospitalofSouthernMedicalUniversity,Foshan528300,China; 4.MedicalImagingCenter,theFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China)
ObjectiveTo establish a preprocedure nomogram for predicting contrast-induced acute kidney injury (CI-AKI) after coronary angiography (CAG) or percutaneous coronary intervention (PCI).MethodsClinical data of 245 patients underwent CAG or PCI were collected. CI-AKI prediction nomogram integrated preprocedural predictors was established with clinical characteristics associated with CI-AKI which were selected with theLASSOregression model, and CI-AKI risk scores were calculated. The ROC curve was constructed to calculate the risk score cutoff.ResultsThe occurrency of CI-AKI was 13.88% (34/245). Sex, diabetes mellitus, lactate dehydrogenase level, high-sensitivity C-reactive protein, drinking years, chronic kidney disease (CKD), stage of CKD, stroke, acute myocardial infarction as well as systolic blood pressure were significant risk factors. The efficiency of CI-AKI nomogram was good, and the cutoff value of risk score was -1.953.ConclusionThe novel nomogram can be used to preprocedurally predict the risk of CI-AKI after CAG or PCI treatment.
Contrast-induced acute kidney injury; Nomogram; Coronary angiography; Percutaneous coronary intervention
国家自然科学基金面上项目(81571664、81171329)、广东省科技计划项目(2016A020216020、2014A020212244)、佛山市医学类科学攻关项目(2017AB003623、2017AB003683)。
欧阳富盛(1986—),男,广东佛山人,在读硕士,主治医师。研究方向:放射与介入诊断。E-mail: ouyangfusheng@21cn.com
张水兴,南方医科大学研究生院,510515;广东省医学科学院 广东省人民医院放射科,510630。E-mail: shui7515@126.com
2017-07-13
2017-11-14
10.13929/j.1672-8475.201707021
R692; R815
A
1672-8475(2017)12-0724-05
