颅内压及灌注压监测在弥漫性轴索损伤中的应用
2017-12-21蔡智基丁志君
林 晖,蔡智基,丁志君
·论 著·
颅内压及灌注压监测在弥漫性轴索损伤中的应用
林 晖,蔡智基,丁志君
目的探讨连续动态颅内压及灌注压监测在弥漫性轴索损伤救治过程中的应用价值。方法收集2012年1月—2016年4月福建医科大学附属宁德市医院神经外科及ICU病房收治的弥漫性轴索损伤(GCS 3~8分)患者45例,采用随机数字表法分为监测组和对照组,监测组22例行颅内压监测并依据监测结果控制颅内压,对照组23例未行颅内压监测。观察比较两组患者的预后、住院期间甘露醇用量及发生迟发性颅内出血和继发性脑梗死的发生率。结果监测组死亡及植物生存者发生率为9.10%,低于对照组(39.13%),差异有统计学意义(P<0.05),监测组预后较好;住院期间监测组的甘露醇用量平均628.64g,低于对照组的1 208.70g,差异有统计学意义(P<0.05);两组迟发性颅内出血和脑梗死的发生率差异无统计学意义(P>0.05)。结论持续颅内压及灌注压监测在弥漫性轴索损伤救治中能及时发现颅内压及灌注压的变化,指导治疗并改善患者的预后。
颅脑损伤; 轴索损伤; 颅内压; 灌注压
弥漫性轴索损伤是急重型颅脑损伤中的特殊类型,为颅脑损伤患者死亡、植物生存的常见原因,常合并多种颅内外重症,如创伤后脑肿胀、多发脑挫裂伤、失血性休克等,这些因素大大增加了疾病的复杂性与危险性。目前弥漫性轴索损伤的处理措施多以医师临床经验为主,通过减轻脑水肿、降低颅内高压以防止继发性损伤。但经观察,并不是所有的弥漫性轴索损伤都会出现颅内压升高[1],其程度与实际脑损伤的程度与分布有关[2](常需MRI T2像检测),单纯通过CT影像难以指导治疗;并且弥漫性轴索损伤患者常出现多种因素引起的瞳孔异常(脑干损伤、眼眶骨折、休克)及与颅内占位病变不相称的意识障碍。以往的临床体检观察+多次CT复查指导治疗的模式缺乏连续性和准确性,难以估计颅内损伤的进展演变。本研究以弥漫性轴索损伤患者为研究对象,旨在评价连续动态颅内压及灌注压监测在整个治疗中的临床意义及风险。
临床资料
1一般资料
选择2012年1月—2016年4月收治的45例诊断为弥漫性轴索损伤、格拉斯哥昏迷评分(GCS)3~8分的成年患者,年龄15~68岁,平均39岁;有明确头部外伤史。伤后24h入院,昏迷时间>6h。排除标准:(1)低氧、心源性及失血性休克原因;(2)CT、MRI扫描可见大脑皮质的髓质交界处、胼胝体、脑干有单发或多发无占位效应出血灶及脑弥漫性肿胀、蛛网膜下腔出血,中线结构无明显移位;(3)病程中因颅外因素(休克、肺栓塞等)死亡及入院时已具有占位效应的颅内出血灶。采用随机数字表法将45例患者分为颅内压监测组和对照组:(1)监测组22例,男性18例,女性4例;年龄17~68岁,平均37.7岁;入院时GCS平均6.4分,其中合并休克7例,入院时因眼眶骨折导致瞳孔异常9例。对照组23例,男性19例,女性4例;年龄15~61岁,平均34.0岁;入院时GCS平均6.2分,其中合并休克6例,入院时因眼眶骨折导致瞳孔异常4例,脑干原发伤引起瞳孔不等大1例。两组患者在性别、年龄、GCS评分、合并休克、入院时瞳孔异常等一般临床资料比较差异无统计学意义(P>0.05),具有可比性。
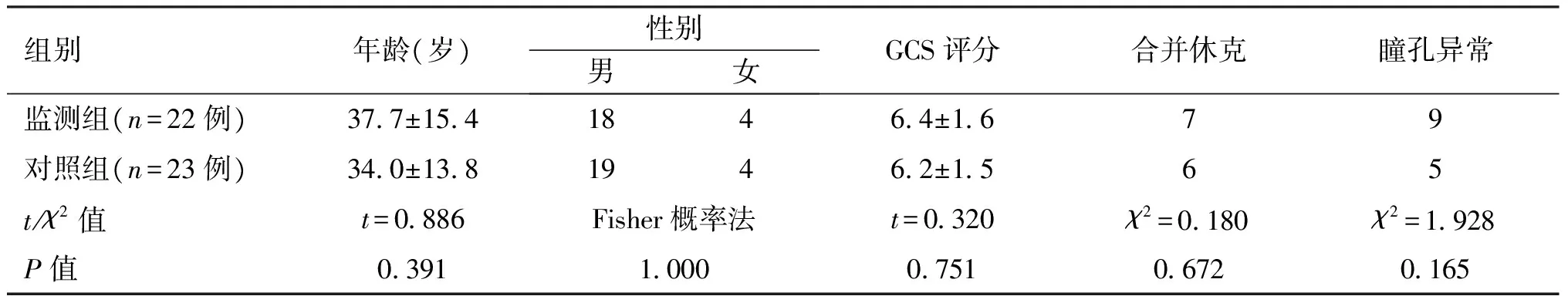
表1 两组患者一般资料比较
2治疗方法
入院后两组患者均入住重症监护病房,限制活动,头部抬高30°,保持颈部伸直,避免包裹压迫,监测心电图及血氧饱和度,控制血压和防止低氧血症,留置尿管、胃管及深静脉置管,持续监测神志、瞳孔,1次/h直至病情稳定。严重颌面创伤及GCS<8分者行气管切开以保障通气,伤后6、24h,第4、7、10天常规复查CT。
2.1监测组 入院时根据病情需要(GCS≤8分且CT检查异常)穿刺侧脑室额角留置Codman脑室型颅内压监测探头(美国强生公司)。术后设定目标:颅内压(ICP)<20mmHg,脑灌注压(CPP)50~70mmHg,术后保持脑室通畅引流,通过上述一系列护理措施、适宜的镇静镇痛处理以降低颅内压和保证脑灌注压,气管置管的患者甚至可以在呼吸机通气支持下强镇静和肌肉松弛、过度通气进一步降低颅内压。ICP<20mmHg时不采用渗透性治疗,ICP>20mmHg且血清渗透压<320mOsm/L、非低血压状态下给予甘露醇0.25g/kg静脉推注(20min)每6h一次;ICP>25mmHg并持续存在时行CT复查,有明显血肿占位者行手术治疗,未发现明显占位者予甘露醇治疗30min后静脉注射呋塞米20mg,同时加用白蛋白等减轻脑水肿;ICP>30mmHg时CT未发现颅内占位者考虑并发脑肿胀,予行去骨瓣减压手术。同步记录ICP和平均动脉压(MAP), 根据公式CPP=MAP-ICP,及时计算出脑灌注压。灌注压监测主要是防止低血压(收缩压<90mmHg),通过留置锁骨下静脉导管监测中心静脉压指导输注足够的等张液体保证血容量,同时有效控制颅内高压的措施也有利于改善脑灌注压,使之在50~70mmHg[3];颅内压探头留置颅内7~10d后拔除。
2.2对照组 基础治疗及护理措施同监测组,定期复查CT,病情稳定时适当镇静。存在多发脑挫裂伤、基底池受压及可疑脑肿胀的患者甘露醇0.25g/kg静脉推注(20min)每8h一次,若发现瞳孔及意识状态的变化复查颅脑CT;有明显血肿占位者行手术开颅,未发现明显占位者给予甘露醇0.25g/kg治疗每6h一次,进一步加强治疗可予呋塞米20mg交替推注,伤后10d根据腰椎穿刺结果逐步停用渗透性治疗。
3观察指标
两组患者伤后3个月随访格拉斯哥预后评分(GOS)、住院期间甘露醇用量、继发性脑梗死、迟发性颅内出血的发生率。
4统计学分析
应用SPSS 19.0统计软件进行分析。计量资料采用独立样本均数t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
结 果
1根据GOS评分标准,1~2级为预后不良,3~5级为预后良好。两组患者进行比较,监测组22例,预后不良2例(9.1%);对照组23例,预后不良9例(39.1%),差异有统计学意义(P<0.05),进行颅内压监测的患者意识恢复的概率较高。见表2。

表2 两组患者(GCS 3~8)GOS评分比较
χ2=5.494,P=0.019<0.05
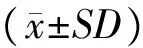
3并发症的比较:监测组发生迟发性颅内出血4例,对照组6例,均手术开颅;两组比较差异无统计学意义(P=0.491>0.05)。监测组发生脑梗死2例,对照组3例,两组比较差异无统计学意义(P=1.000>0.05)。
讨 论
弥漫性轴索损伤有别于局灶性脑损伤,组织学的表现主要是轴索肿胀、轴突断裂以及桥脑、中脑、胼胝体的点状出血。这些异常如轴突离断很多在损伤当时并未出现,而是在伤后几小时或几天演化而来。动物实验和人类的研究也显示轴索伤多为继发性[4],在这个环节中,引起继发性缺血脑损伤最常见的脑部因素和全身因素分别是颅内高压和低血压、低氧[5]。持续升高的颅内压可导致脑缺血,进而引起细胞膜钠-钾离子泵失活,细胞肿胀甚至死亡[6]。当颅内压持续>20mmHg时患者的病死率升高、预后差,故Luca等[7]学者认为在颅脑损伤的第一个24h内开始颅内压及脑灌注压监测可显著提高生存率,将相关效应的破坏性影响降到最低。本研究结果显示,监测组患者确实降低了预后不良率,分析原因如下:弥漫性轴索损伤后出现的颅内高压,除脑组织水肿及继发出血外,患者的头部位置[8]、颈部姿势、镇静程度均可能与之有紧密联系,持续的颅内压及脑灌注压的监测结合传统的神经重症观察,使治疗过程中目的明确,包括体位、镇静镇痛、渗透性治疗、血压调控均有明确指标可依从,减少治疗中的主观性和盲目性,及时发现和解决多种导致颅内高压的不利因素,同时留置的脑室引流也可显著降低颅内压[9],对减少继发性脑损伤具有重要意义。
在弥漫性轴索损伤的治疗中,甘露醇的渗透性治疗需要重点考虑,以往临床医师主要是根据CT显示及经验进行治疗,但其大量使用有引起急性肾小管坏死的危险,尤其是老年人、既往有肾脏疾病的患者。该研究表明通过颅内压监测指导甘露醇使用使治疗更为规范,其剂量的减少也降低了肾功能损害的风险。关于留置颅内压监测探头的感染风险,因为两组患者均未发生颅内感染,故未在此讨论。另脑室型颅内压探头监测的同时兼具引流脑脊液,压力的变化有可能增加迟发出血的概率,同时穿刺过程中也可能损伤出血,但通过对两组的比较并未发现监测组有更高的发生率,反而能更及时地发现问题。关于脑梗死,本研究试图通过监测颅内压及脑灌注压指导治疗来减少其发生,结果显示未有明显差异。考虑引起脑梗死的因素有多种[10],如血管损伤、广泛蛛网膜下腔出血造成的血管痉挛、低血容量及血液的高凝状态等等,脑的低灌注压并非单一因素。在脑血管自动调节功能受损时,即使脑灌注压>50mmHg也可能出现脑缺血,故脑灌注压的监测虽然简单可行,但仅限于因血压下降或颅内压升高引起的脑缺血评估,难以解释各种风险因素。
综上所述,弥漫性轴索损伤患者治疗的目标之一是尽量减少继发性伤害,而监控颅内压及脑灌注压来指导治疗可以减少继发性脑损伤和脑缺血,使临床处理更合理化和个体化,例如2个CT异常影像近似而颅内压力不同的颅内高压患者治疗力度是不同的[11]。同时,颅内压监测的优势还在于早期预警新损伤的出现、血肿扩大、水肿进展等,对于规范渗透性药物治疗剂量有较大的临床意义。但是对于脑保护,仅仅通过监测颅内压及脑灌注压是不够的,临床上需要更多的指标来进行监测及指导治疗[12],如颈内静脉氧饱和度监测、脑组织含氧量监测及脑微透析等进行辅助。最后,颅内压及灌注压监测本身只是一种监测手段,并不能取代训练有素的医师及护理人员的神经系统观察,只有在充分理解其指标意义的基础上结合临床及影像学资料指导治疗,才能改善患者的预后。
[1] Lee TT,Galarza M,Villanueva PA.Diffuse axonal injury (DAI) is not associated with elevated intracranial pressure (ICP)[J].Acta Neurochir(Wien),1998,140(1):41-46.
[2] Yanagawa Y,Sakamoto T,Takasu A,et al.Relationship between maximum intracranial pressure and traumatic lesions detected by T2*-weighted imaging in diffuse axonal inhury[J].J Trauma,2009,66(1):162-165.
[3] Bullock MR,Povlishock JT.Guidelines for the management of severe traumatic brain injury[J].J Neurotrauma,2007,24(S1):S1-106.
[4] Povlishock JT,Christman CW.The pathobiology of traumatically induced axonal injury in animal and humans: a review of current thoughts[J].J Neurotrauma,1995,12(4):555-564.
[5] 王任直,主译.尤曼斯神经外科学[M].5版.北京:人民卫生出版社,2009:4083-4085.
[6] Lafrenaye AD,McGinn MJ,Povlishock JT.Increased intracranial pressure after diffuse traumatic brain injury exacerbates neuronal somatic membrane poration but not axonal injury: evidence for primary intracranial pressure-induced neuronal perturbation[J].J Cereb Blood Flow Metab,2012,32(10):1919-1932.
[7] Luca L,Rogobete AF,Bedreag OH,et al.Intracranial pressure monitoring as a part of multimodal monitoring management of patients with critical polytrauma: correlation between optimised intensive therapy according to intracranial pressure parameters and clinical picture[J].Turk J Anaesth Reanim,2015,43(6):412-417.
[8] 胡惠贤,娄艳华,卢秋仪,等.床头抬高不同高度对颅内压的影响[J].广东医学,2015,36(24):3894-3895.
[9] 钱令涛,杨春春,王永志,等.脑室内颅内压监测在老年颅脑损伤中的意义[J].中国临床神经外科杂志,2014,19(3):172-174.
[10] 黄贤键,马宇强,高杰,等.创伤性大面积脑梗死的相关危险因素分析[J/CD].中华神经创伤外科电子杂志,2016,2(3):144-147.
[11] 魏俊杰,康德智,译.神经重症监测技术[M].北京:人民卫生出版社,2015:125-129.
[12] 周良辅,赵继宗.神经外科学[M].3版.北京:人民卫生出版社,2013:125-129.
Evaluationofintracranialpressuremonitoringandcerebralperfusionpressureinthetreatmentofdiffuseaxonalinjury
LINHui,CAIZhi-ji,DINGZhi-jun
(Department of Neurosurgery,Ningde Municipal Hospital of Fujian Medical University,Ningde,Fujian 352100,China)
ObjectiveTo investigate the clinical value of the continuous dynamic monitoring of intracranial pressure and cerebral perfusion pressure in the treatment of diffuse axonal injury.MethodsTotally 45 cases (GCS 3-5) of diffuse axonal injury hospitalized in our department and intensive care unit from Jan. 2012 to Apr. 2016 were collected and randomly divided into the monitoring group and control group. Twenty-two patients in the monitoring group
intracranial pressure monitoring,and the intracranial pressure was controlled based on the monitoring results,and 23 patients in the control group had no intracranial pressure monitoring. The prognosis,dose of mannitol and the incidence rate of delayed intracranial hematoma and cerebral infarction were compared between the two groups.ResultsThe incidence of death and plant survival in the monitoring group was 9.10%,less than those of the control group(39.13%) with statistical significance(P<0.05),and the prognosis in the monitoring group was better than that in the control group. The dose of mannitol in the monitoring group(628.64g) was less than that of the control group(1208.70g) with significant difference(P<0.05). About delayed intracranial hematoma and cerebral infarction,there was no significant difference between the two groups(P>0.05).ConclusionContinuous dynamic monitoring of intracranial pressure and cerebral perfusion pressure can detect the changes of pressure timely in the treatment of diffuse axonal injury,and then the appropriate treatment measures could be taken to improve the outcomes of patients.
brain injury; diffuse axonal injury; intracranial pressure; perfusion pressure
1009-4237(2017)12-0900-04
R 651.1
A
10.3969/j.issn.1009-4237.2017.12.006
352100 福建,福建医科大学附属宁德市医院神经外科
2017-04-01;
2017-04-21)
郭 卫)
