尿素与丙氨酸二肽相互作用的量子化学研究
2017-12-21宫利东卜聪明
宫利东, 卜聪明, 刘 翠
(辽宁师范大学 化学化工学院,辽宁 大连 116029)
尿素与丙氨酸二肽相互作用的量子化学研究
宫利东, 卜聪明, 刘 翠
(辽宁师范大学 化学化工学院,辽宁 大连 116029)
应用量子化学方法研究尿素与丙氨酸二肽形成复合物[urea-(Ala)2]的稳定结构、氢键、电荷分布以及相对稳定性.采用B3LYP/6-311++G(d,p)方法进行结构优化和频率计算,对获得的28种稳定结构进一步采用MP2/6-311++G(d,p)方法计算结合能,并进行基组重叠误差校正.结果表明:在urea-(Ala)2中主要存在着3种类型的氢键:其中,NU—HU…OA型是最主要的氢键类型,NU—HU…OA型和NA—HA…OU型氢键较强,对应的复合物结合能也较大,而CA—HA…OU型氢键较弱.通过Mulliken布局分析,发现复合物中参与形成氢键的原子所带电荷变化明显,而没有参与形成氢键的原子电荷几乎不变;而且复合物结合能的大小与形成氢键的原子之间的电荷转移量密切相关,电荷转移量越大,复合物的结合能越大.
尿素;丙氨酸二肽;分子间相互作用;氢键;电荷转移
通常情况下,蛋白质肽链经过卷曲、折叠等方式在水溶液中形成某些特定的折叠形态,不同结构的蛋白质具有不同的性质和功能.蛋白质受到物理或化学因素的影响,有序紧密结构可以变成无序松散结构,会导致生物活性受到影响乃至丧失,这种现象称为蛋白质变性(protein denaturation).尿素作为公认的蛋白质变性剂[1],尽管长期以来,无论在实验上还是理论上都一直在探讨其致蛋白质变性的微观机理,但仍存在争议[2-12].目前,主要2种理论观点:间接作用模型[3-4]和直接作用模型[5-10].间接作用模型认为尿素通过改变蛋白质的溶剂环境而使蛋白质变性.Idrissi等人[3]研究发现,不同浓度的尿素会对水的结构产生不同程度的影响.目前,大多数学者支持的是直接作用模型,认为尿素使蛋白质变性分为2步:第一步,尿素取代蛋白质第一溶剂层的水分子,与蛋白质骨架形成氢键,使得原来处于蛋白质内部的疏水基团获得更多的机会暴露在水溶剂中;第二步,尿素和水一起与蛋白质作用,最终导致蛋白质变性[5-10].最近也有研究结果发现,直接作用和间接作用共同完成蛋白质的变性过程[4,12].Das等人[4]通过动力学模拟发现在尿素水溶液中,尿素-蛋白质之间的相互作用强于蛋白质-蛋白质、蛋白质-水之间的相互作用,由此认为蛋白质变性是通过如下过程完成:水离开蛋白质的溶剂层,进而尿素到达蛋白质表面,溶解暴露在溶剂中的带电侧链,与骨架的O和—NH通过氢键结合,同时与非极性残基通过范德华力相互作用;最后,水跟随尿素到达蛋白质表面,溶解新暴露的蛋白质原子,导致蛋白质变性.然而,Hua等人[7]认为尿素使蛋白质变性主要是由于范德华作用.因此他们对Das等人的结论提出了质疑[5].最近,Steinke等人[12]研究发现溶液的离子强度以及pH值也会影响尿素与多肽之间的作用.本文将应用量子化学方法考察尿素与丙氨酸二肽这一常见的疏水基团的相互作用.
1 计算方法与模型分子
1.1 计算方法
应用Gaussian09程序,采用B3LYP/6-311++G(d,p)方法优化尿素-丙氨酸二肽形成的复合物结构,对优化获得的结构进行频率以及零点能计算,确保优化得到的结构为稳定结构.进一步对获得的稳定结构采用MP2/6-311++G(d,p)方法计算能量,并进行基组重叠误差(BSSE)校正,得到复合物体系的结合能.最后采用HF/STO-3G方法进行Mulliken布局分析,考察体系的电荷分布情况.
1.2 模型分子
丙氨酸是构成蛋白质体系的重要氨基酸之一,也是蛋白质中常见的非极性疏水基团.研究尿素与丙氨酸二肽形成的复合物的结构,可为进一步研究尿素与蛋白质之间的相互作用提供参考.丙氨酸二肽分子结构较简单,本文将丙氨酸二肽分子的端基采取甲基化处理.图1给出选取的丙氨酸二肽的6种稳定构象(C7eq、C7ax、C5、β2、αL、α′),它们仅是骨架二面角之间存在差异.根据尿素与丙氨酸二肽的相对位置以及形成的氢键类型的不同,最终优化得到28个Urea-(Ala)2)稳定结构.

图1 丙氨酸二肽分子的6个稳定构象Fig.1 The six stable structures of alanine dipeptide
2 结果与讨论
2.1 尿素与丙氨酸二肽的几何构型
C7eq是较稳定的丙氨酸二肽构象,在蛋白质二级结构中易形成β折叠.为方便讨论,以尿素与C7eq(Urea-C7eq)作用情况为例,分析Urea-(Ala)2的相互作用.图2 是得到的Urea-C7eq的6个稳定结构.可以看出丙氨酸二肽分子与尿素的结合位点有3处:—C=O、—N—H和—CH3.丙氨酸二肽酰胺O原子(O2和O18)与尿素H原子形成Ⅰ类型氢键,表示成OA…HU—NU;丙氨酸二肽中与C原子相连的H原子(—CH3中H原子和H10)与尿素O原子形成Ⅱ类型氢键,表示成CA—HA…OU;丙氨酸二肽中—N—H和尿素O原子形成Ⅲ类型氢键,表示成NA—HA…OU.这些氢键也标示在图2中.

图2 Urea-C7eq的稳定结构示意图Fig.2 The stable structures of Urea-C7eq
表1给出了28种Urea-(Ala)2构象的氢键长、氢键角.
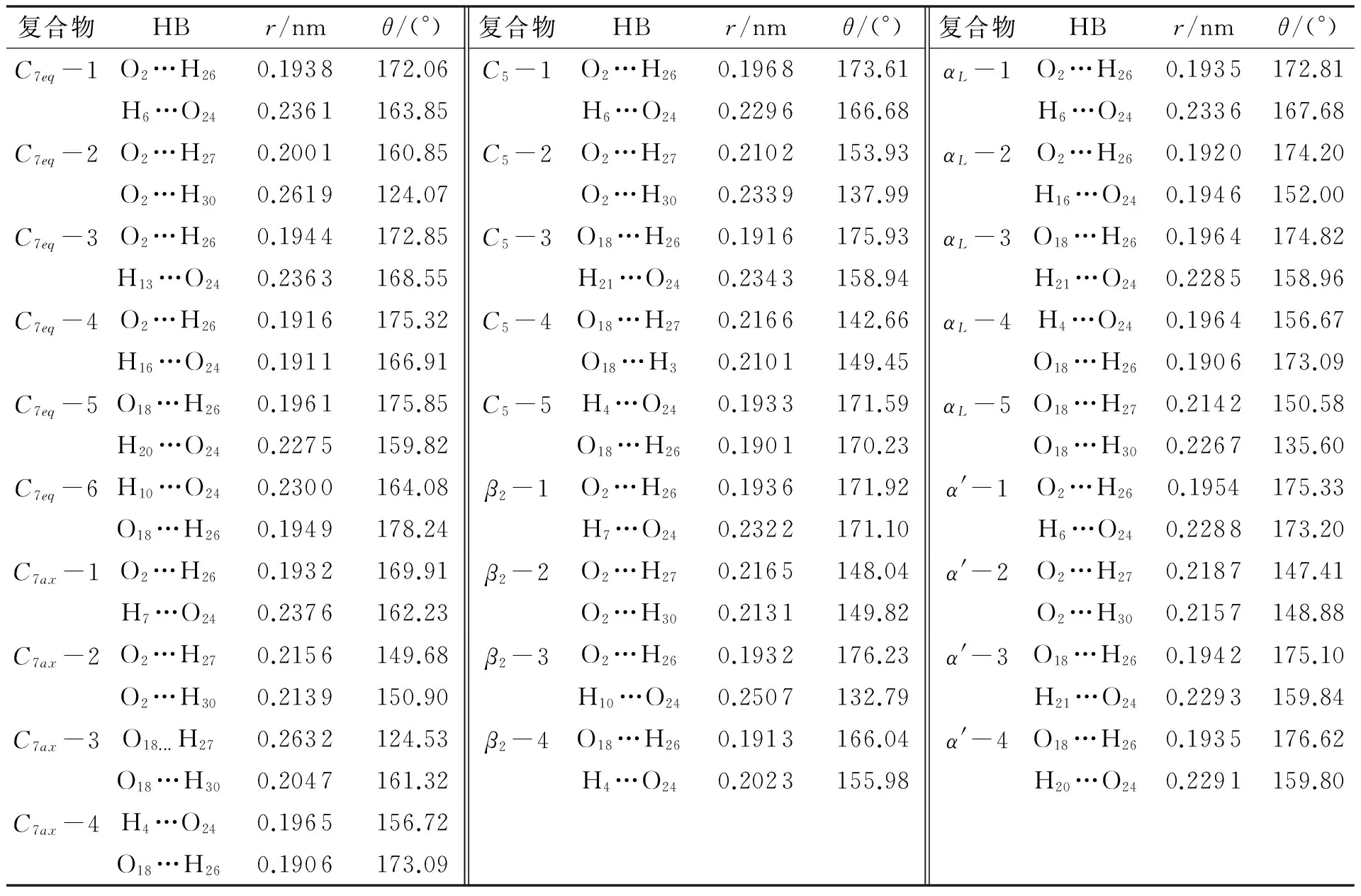
表1 尿素与丙氨酸二肽复合体系氢键键长r和键角θ
表中HB表示成键类型,其中的2个原子为形成氢键的原子,如C7eq-1 结构中的O2…H26,表示丙氨酸二肽的酰胺O原子(O2)与尿素的氨基H原子(H26)之间形成的氢键.丙氨酸二肽与尿素之间形成NU—HU…OA类型的氢键,由于氢键受体O原子位于二肽骨架的酰胺键上,且尿素中给体原子H与N原子相连,形成的氢键强度较大,氢键长度在0.20 nm左右,氢键角度也接近于170°,该类型氢键比较常见.当体系仅存在这一种类型氢键时,如结构C7eq-2,尿素的2个H原子(H27、H30)同时与二肽的O原子形成氢键:其中1个较强的氢键(O2…H27),氢键长为0.200 1 nm,氢键角为160.85°;另一个同类型氢键(O2…H30),强度较弱,该氢键长为0.261 9 nm,氢键角仅为124.07°.C7ax-3、C5-2、αL-5结构也属于这种情况.当丙氨酸二肽与尿素形成CA—HA…OU类型的氢键时,氢键强度相对弱一些,氢键长度一般在0.23 nm左右,如C7eq-1中H6…O24,氢键长为0.236 1 nm,氢键角为163.85°;C7eq-3中H13…O24,氢键长为0.236 3 nm,氢键角为168.55°.C7eq-5、C7eq-6 、C7ax-1、C5-3中也存在该类型的氢键.NA—HA…OU类型的氢键与NU—HU…OA类型的氢键相似,均为N-H…O型氢键,一般情况该氢键也较强,如结构C7eq-4的氢键长分别为0.191 6和0.191 1 nm,氢键角分别为175.32° 和166.91°,C7ax-4、C5-5、αL-2、β2-4结构中均形成这2种类型的氢键.但是由于空间位阻影响,该类型氢键并不常见.综上所述,当尿素与丙氨酸二肽分子相互作用时,二肽分子骨架上酰胺O原子与尿素H原子之间形成的NU—HU…OA型氢键的强度较大,是Urea-(Ala)2内的主要氢键形式.
2.2 尿素与丙氨酸二肽复合体系的结合能
结合能体现形成复合物的分子间相互作用强弱,反映不同复合物结构间的相对稳定性.本文的结合能计算公式如下:
ΔE=EU+EA-EUA.
(1)
其中,EU和EA分别为尿素、丙氨酸二肽单体的能量,EUA为尿素与丙氨酸二肽复合物的能量.结果见表2.结构C7eq-4、C7ax-4、C5-5、αL-2、β2-4、α′-2中形成的氢键均为NU—HU…OA和NA—HA…OU类型氢键,其结合能数值也是各自构象中最大的.当体系内包含CA—HA…OU类型氢键时,体系结合能明显降低,如结构C7eq-1、C7ax-1、C5-1、αL-1、β2-1、α′-1等结合能在各自构象内相对较低,这与氢键强弱呈现同样的趋势.

表2 丙氨酸二肽与尿素复合体系的结合能
2.3 电荷分析
通过对所有Urea-(Ala)2的电荷分布进行Mulliken布局分析,可以得到丙氨酸二肽的6种构象与尿素分子作用前后形成氢键的原子的电荷变化.这里同样仅以Urea-C7eq为例介绍电荷分布的变化情况.
表3列出尿素分子、丙氨酸二肽C7eq以及Urea-C7eq复合物中形成氢键的原子所带的电荷,其中第2列为单体C7eq及尿素分子的部分电荷分布,第3~8列为形成氢键后这些原子的电荷分布,加粗数据对应着复合物内形成氢键的原子所带电荷.对比尿素以及C7eq在形成氢键前后的原子的电荷变化,可以发现复合物中形成氢键的原子所带电荷变化明显,如尿素以及C7eq内酰胺O原子,在形成氢键后原子所带电荷数目变大,平均变化-0.022 6e(O24)和-0.020 8e(O2和O18);H原子形成氢键后电荷平均变化为0.042 0e(HU)和0.029 7e(HA),没有参与形成氢键的原子电荷几乎不变.形成氢键的原子转移电子数越大,形成的氢键越强,如C7eq-1内的2个氢键O2…H26和H6…O24.其中,O2和H26的原子电荷变化分别为0.019 4e和0.035 7e,氢键长和键角为0.193 8 nm和172.06°;而H6和O24的原子电荷变化为0.021 1e和0.017 6e,氢键长和键角为0.236 1 nm和163.85°.又如C7eq-4内形成氢键的尿素O原子电荷变化也很大(0.038 9e),因为该氢键的供体是与C7eq-4酰胺键相连的H原子,形成了较强的NA—HA…OU类型氢键.
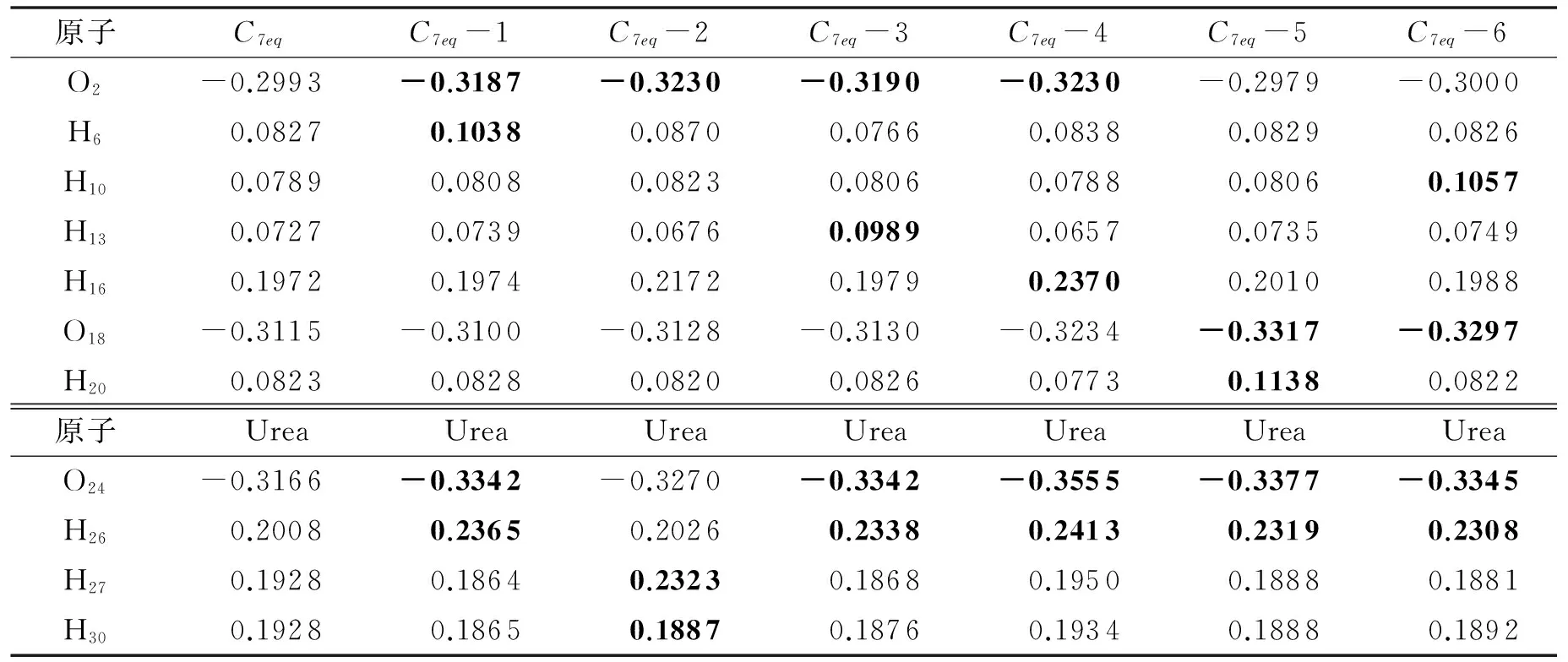
表3 Urea-C7eq体系中原子所带电荷(e)
3 结 论
通过量子化学方法MP2/6-311++G(d,p)//B3LYP/6-311++G(d,p)研究Urea-(Ala)2体系,结果表明:6种丙氨酸二肽与尿素形成的复合体系内,由N、H、O3种原子形成的氢键NU—HU…OA和NA—HA…OU在复合体系内比较常见,且强度较大,对体系的稳定性贡献较大.而CA—HA…OU类型氢键相对较弱.体系内形成的氢键强度越大,结合能越大,原子间电荷转移量越大.本文的研究以及此前我们对尿素与甘氨酸二肽体系的研究[13],为进一步发展ABEEM/MM可极化力场方法[14-15]探讨尿素致蛋白质变性提供参考.
[1] KOISHI T,YASUOKA K.Molecular insight into different denaturing efficiency of urea,guanidinium,and methanol:a comparative simulation study[J].J Chem Theory Comput,2013,9(6):2540-2551.
[2] ZHENG W W,BORGIA A,BROGIA MB,et al.Empirical optimization of interactions between proteins and chemical denaturants in molecular simulations[J].J Chem Theory Comput,2015,11(11):5543-5553.
[3] IDRISSI A,GERARD M,DAMAY P.The effect of urea on the structure of water:a molecular dynamics simulation[J].J Phys Chem B,2010,114(13):4731-4738.
[4] DAS A,MUKHOPADHYAY C.Urea-mediated protein denaturation:a consensus view[J].J Phys Chem B,2009,113(38):12816-12824.
[5] ZHOU R H,LI J Y,HUA L,et al.Comment on “urea-mediated protein denaturation:a consensus view”[J].J Phys Chem B,2011,115(5):1323-1326.
[6] DAS A,MUKHOPADHYAY C.Reply to the “comment on ‘urea-mediated protein denaturation:a consensus view’”[J].J Phys Chem B,2011,115(5):1327-1328.
[7] HUA L,ZHOU R H,THIRUMALAI D.Urea denaturation by stronger dispersion interactions with proteins than water implies a 2-stage unfolding[J].Proc Natl Acad Sci,2008,105(44):16928-16933.
[8] ALMARZA J,RINCON L,BAHSAS A,et al.Molecular mechanism for the denaturation of proteins by urea[J].Biochemistry,2009,48(32):7608-7613.
[9] STUMPER M C,GRUBMÜLLER H.Aqueous urea solutions:structure,energetics,and urea aggregation[J].J Phys Chem B,2007,111(22):6220-6228.
[10] O’BRIEN E P,DIMA R I,BROOKS B.Interactions between hydrophobic and ionic solutes in aqueous guanidinium chloride and urea solutions:lessons for protein denaturation mechanism[J].J Am Chem Soc,2007,129(23):7346-7353.
[11] BANDYOPADHYAY D,MOHAN S,GHOSH S K,et al.Molecular dynamics simulation of aqueous urea solution:is urea a structure breaker[J].J Phys Chem B,2014,118(40):11757-11768.
[12] STEINKE N,GENINA A,LORENZ CD,et al.Salt interactions in solution prevent direct association of urea with a peptide backbone[J].J Phys Chem B,2017,121(8):1866-1876.
[13] 宫利东,张慧.尿素与甘氨酸二肽相互作用的量子化学研究[J].辽宁师范大学学报(自然科学版),2016,39(4):497-501.
[14] 刘翠,贾彩楠,张婧,等.发展适合水溶液中氧化鸟嘌呤体系的极化力场[J].辽宁师范大学学报(自然科学版),2016,39(1):82-87.
[15] 杨忠志,袁军.NPT系综下应用ABEEM-7P水分子模型的动力学模拟[J].辽宁师范大学学报(自然科学版),2015,38(2):197-202.
Studiesoftheinteractionsbetweenureaandalaninedipeptidebyquantumchemicalcalculations
GONGLidong,BUCongming,LIUCui
(School of Chemistry and Chemical Engineering, Liaoning Normal University, Dalian 116029, China)
The structures,hydrogen bond,charge distributions and relative stability of the complexes formed by urea and alanine dipeptide [urea-(Ala)2] were studied by quantum chemical calculations.The B3LYP/6-311++G(d,p) method was employed to optimize the structures and calculate frequencies,and the binding energies of 28 stable structures were calculated at MP2/6-311++G(d,p) level with the basis set superposition error correction.Results show that there are mainly 3 types of hydrogen bonds in urea-(Ala)2,of which the NU—HU…OAis the most preferable.The bond strengths of NU—HU…OAand NA—HA…OUare stronger than that of CA—HA…OU,and the corresponding binding energies of the formers are bigger than the later ones.According to the Mulliken population analysis,evident charge transfer is observed between the hydrogen-bonding atoms,while almost no charge transfer between the other atoms.Moreover,the amount of binding energy of the complexes is in accordance with that of the charge transfer between the hydrogen-bonding atoms.
urea;alanine dipeptide;intermolecular interaction;hydrogen bond;charge transfer
O641.121
A
2017-08-25
国家自然科学基金资助项目(20703022;21603091)
宫利东(1975- ),男,吉林舒兰人,辽宁师范大学教授,博士,博士生导师.
1000-1735(2017)04-0496-06
10.11679/lsxblk2017040496
