绝热条件下磷酸三丁酯-正十二烷-硝酸体系放热反应行为
2017-12-20张春龙赵善桂
张春龙,曹 智,赵善桂,杨 柳,苏 哲,洪 哲,何 辉,*
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.环境保护部 核与辐射安全中心,北京 100082;3.原子高科股份有限公司,北京 102413;
绝热条件下磷酸三丁酯-正十二烷-硝酸体系放热反应行为
张春龙1,2,曹 智1,赵善桂2,杨 柳3,苏 哲1,洪 哲2,何 辉1,*
1.中国原子能科学研究院 放射化学研究所,北京 102413;2.环境保护部 核与辐射安全中心,北京 100082;3.原子高科股份有限公司,北京 102413;
本工作采用绝热加速量热仪重点研究了磷酸三丁酯(TBP)与HNO3以及30%TBP-70%正十二烷与HNO3的放热反应行为,并通过这两个系列测试结果的对比分析,确定了该研究条件下稀释剂对放热反应的影响。结果表明,HNO3浓度越高,TBP或TBP-正十二烷与HNO3发生的自放热反应的起始温度越低,放热量越高,造成的压力增加也越高。绝热条件下,与TBP和HNO3的化学反应相比,有稀释剂正十二烷存在的化学反应,其起始温度和活化能更低,同时释放热量更高,此化学反应更易发生。
核燃料;后处理;绝热;TBP;HNO3;放热反应
PUREX流程在核燃料后处理工艺近60年的发展历程中几乎不可替代。该流程使用的萃取剂磷酸三丁酯(TBP)具有对铀和钚的萃取选择性高、水中溶解度低和闪点高等优点。但TBP在使用过程中也存在一些问题,如TBP与浓HNO3、重金属硝酸盐共存体系中,在蒸发浓缩过程中会发生热分解,当超过一定温度时可能发生热失控反应,分解产生的大量气体会导致设备内超压,存在发生猛烈的爆炸危险,这就是所谓的“红油”爆炸。从1953年至今,一共发生了数起“红油”爆炸事故[1-2],造成不同程度的设备、建筑损坏及环境污染。
“红油”爆炸事故的主要因素可能是TBP-HNO3-稀释剂以及降解产物和金属离子等组分之间在高温等条件下发生的硝化、水解聚合等放热反应。在化学工业生产中硝化、水解和聚合等放热反应也是引发爆炸事故的主要反应类型。当放热反应在设备内产生热量速率远大于设备散热能力,或者不考虑体系对外散热时可将其简化为绝热反应。此类反应若在生产中失去控制,引起热量的积累,可导致严重的火灾或爆炸事故。对于后处理厂蒸发浓缩工艺,红油爆炸事故与绝热条件下的失控放热反应具有相似的特点。因此,研究绝热条件下TBP-HNO3放热反应很有必要,对于认识红油爆炸现象以及制定相关预防和控制措施具有指导意义。
绝热加速量热仪(ARC)是基于绝热原理设计的量热仪,在研究物质热稳定性能及安全评估方面具有诸多优势[3-4],比传统的差热分析、热重和差示扫描量热等方法进样量更大,测试灵敏度更高,并且能在测试过程中实时监测压力变化。关于绝热条件下红油爆炸相关的研究,文献[5]报道了绝热条件下30%(体积分数,下同)TBP-70%正十二烷-HNO3的放热反应,但由于没有进行TBP与HNO3放热反应研究,无法通过对比确定稀释剂正十二烷对该体系放热反应的影响。事实上关于稀释剂的影响效应不同文献一直有不同看法[6-7]。因此,本工作通过绝热加速量热仪重点研究TBP-HNO3以及30%TBP-70%正十二烷-HNO3的放热反应行为,并通过这两个系列测试结果的对比分析,以确定该研究条件下稀释剂对放热反应的影响。
1 实验部分
1.1 试剂与仪器
TBP,分析纯,国药集团化学试剂有限公司;正十二烷,分析纯,阿拉丁公司,进口分装。
30%TBP-70%正十二烷溶液由TBP和正十二烷按体积比30∶70混合得到。不同浓度的HNO3由质量分数65%~68%、浓度14.7 mol/L的浓HNO3在容量瓶中稀释得到,最后经自动滴定仪酸度分析,配制得到的HNO3溶液浓度分别为11.8、10.0、8.0、4.0、2.0 mol/L。
ARC-ES型绝热加速量热仪,英国THT公司,精度0.005 ℃/min,温度范围25~450 ℃,压力范围0~13.8 MPa。ARC仪器结构和测试原理参见文献[8-9]。
1.2 实验过程及测试条件
测试前对设备进行温度值校准和漂移测试。样品测试条件列于表1,测试起始温度为60 ℃,升温速率5 ℃/min,当探测到自加热速率达到0.02 ℃/min,停止加热,保持系统绝热。实验过程中对温度和压力变化进行监测。当体系温度和压力在缓慢上升或温度停止上升时,可结合温度变化速率判定主要反应是否已经结束,在升温速率降低到0.1 ℃/min时,认为反应结束,停止记录数据。
1.3 测试数据校正及动力学参数计算
1.3.1测试数据校正 由于样品反应产生的热量不仅加热样品自身,还要加热盛装样品的样品室,所以样品在绝热条件下的实际温升要比测量值大,实际升温速率比测量值高。ARC实验中样品的自加热温度与测量值之间的关系为[8,10]:
Δθad=θf-θ0=Φ·Δθad,s
(1)

(2)
式中:△θad为反应放热仅对样品加热时的绝热温升;△θad,s为实测绝热温升,下标s表示样品和样品球组成的反应系统,即反应放热加热样品和样品球组成的反应系统时的绝热温升;θ0、θf分别为样品的初始分解温度和最高分解温度;Ms为样品质量;Mb为样品室质量;Cvs为样品平均比热容;Cvb为样品球平均比热容;Φ为惰性因子或热惰性修正系数。 当Ms远大于Mb时,Φ≈1,在测试中反应产生的热量几乎全用于加热样品自身,加热样品室造成的热量损失忽略不计。反之,当Mb远大于Ms时,Φ>1,反应产生的热量不仅加热样品自身,还要加热盛装样品的样品室。一般情况下,样品室的质量Mb大于样品的质量Ms,所以修正是必要的。

表1 样品测试条件Table 1 Testing conditions of sample
1.3.2动力学参数计算 根据绝热加热量热仪的温升速率方程[8,10]:
(3)
可得:
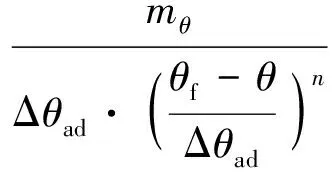
(4)
根据测试得到的初始分解温度、反应的最高温度以及不同时刻反应系统的温度和温升速率,由式(4)可求得不同温度下的速率常数k。由Arrhenius方程速率常数k的对数形式可得:
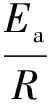
(5)
式中:mθ为温度θ时对应的温升速率,℃/min;Ea为表观活化能,kJ/mol;R为气体常数,8.314 J/(mol·K);A为指前因子,s-1。当反应级数n选取合适时,lnk-θ-1为直线,由直线的斜率和截距可求活化能Ea和指前因子A。
2 结果与讨论
2.1 纯TBP的绝热量热测试结果与分析
纯TBP的ARC量热实验结果示于图2。由图2可见,在小于225 ℃的温度范围内,样品没有发生自放热现象,说明在测试温度范围内TBP自身具有较好的热稳定性,不会发生自放热分解反应。
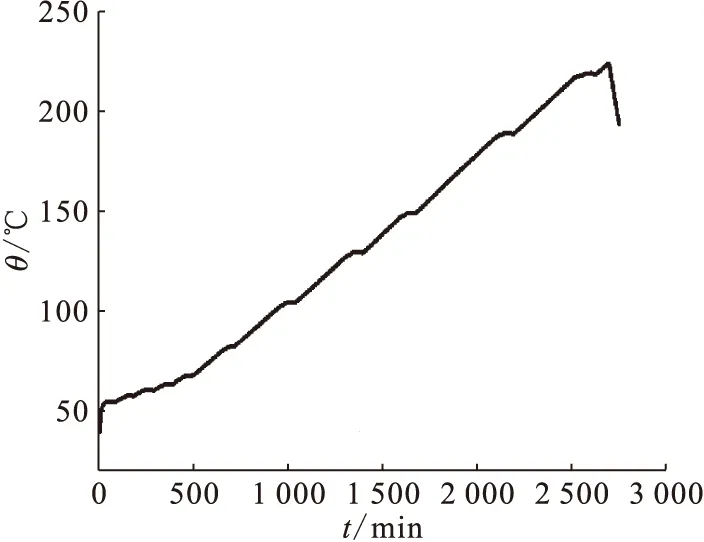
图2 纯TBP热稳定性ARC测试Fig.2 ARC test of thermal stability of pure TBP
2.2 纯TBP与不同浓度HNO3的绝热量热测试结果与分析
TBP与不同浓度HNO3溶液的ARC测试得到的升温曲线、压力曲线、升温速率曲线示于图3。
由图3(a)可见,测试过程中TBP与2.0 mol/L的HNO3在常温到150 ℃的范围内未观察到放热点,因此图中未显示相关数据点。TBP与4.0 mol/L HNO3在130 ℃时体系有微弱的放热现象,体系升温约3 ℃;当HNO3浓度为8.0 mol/L,自放热起始温度为105 ℃;继续增加HNO3浓度,即浓度分别为10.0、11.8、14.7 mol/L时,自放热起始温度分别为90.6、86.5、73.5 ℃。这说明HNO3浓度越高,TBP和HNO3发生自放热反应的起始温度越低,自放热反应越容易发生。
从图3(a)还可明显看出,当HNO3浓度为14.7 mol/L时,TBP与HNO3的放热反应异常剧烈,从73.5 ℃就开始反应,在约几个小时之后,温度急剧上升,出现了热失控反应。结合压力曲线(图3(b))可以看出,压力也出现了急剧上升,说明反应生成大量气体产物,而且随后出现了两次剧烈产气的过程,压力在很短的时间内从4 MPa跳升至8 MPa左右。升温速率曲线(图3(c))也显示该条件下最大升温速率大于100 ℃/min。因此,可以判断当HNO3浓度为14.7 mol/L时,TBP与HNO3的放热反应发生了热失控反应,具有爆炸的基本特征。
ARC从安全方面考虑,在设计上为了避免测试中出现危险情况,样品球一般能耐高温高压,并且进样量较少,所以虽然没有发生真正意义上的爆炸,但如果此种工况出现在后处理设施的常压容器中,势必会导致爆炸现象。另外,考虑到产生的气体产物中可能存在易燃易爆物质,因此可能产生的后果会更加严重。
当HNO3浓度为11.8、10.0、8.0 mol/L时,TBP与HNO3的放热反应也出现了急剧的温度上升,幅度和剧烈程度比14.7 mol/L有所降低,压力的增加过程没有出现瞬间升高的情况。但如果加入反应物的总量足够大的话,TBP与11.8、10.0、8.0 mol/L HNO3的放热反应可能也会导致爆炸。
TBP与不同浓度HNO3的ARC测试的实测数据、校正之后的数据以及动力学计算结果汇总列于表2。

c(HNO3),mol/L:1——14.7,2——11.8,3——10.0,4——8.0,5——4.0图3 TBP在不同浓度HNO3条件下的ARC测试得到的温度(a)、压力(b)和升温速率(c)曲线Fig.3 Temperature(a), pressure(b), and temperature rise(c) curves of TBP with ARC test in different concentrations of nitric acid
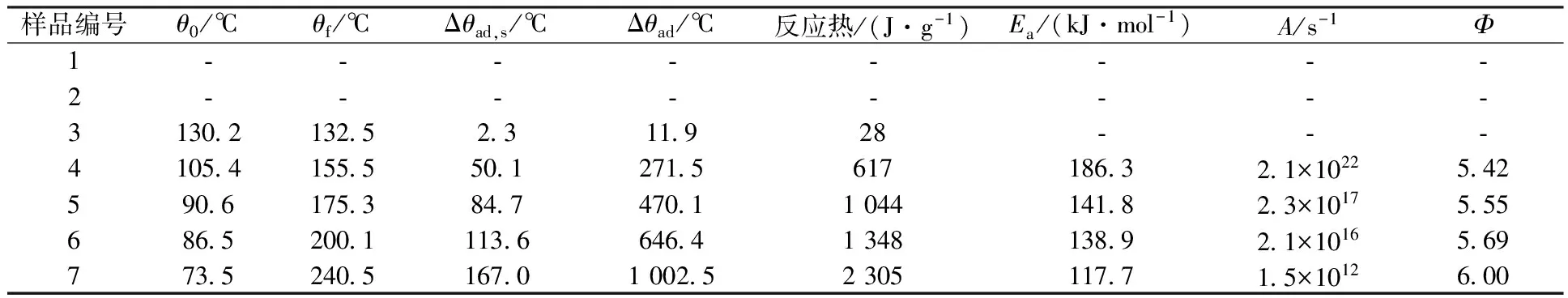
样品编号θ0/℃θf/℃Δθad,s/℃Δθad/℃反应热/(J·g-1)Ea/(kJ·mol-1)A/s-1Φ1⁃⁃⁃⁃⁃⁃⁃⁃2⁃⁃⁃⁃⁃⁃⁃⁃3130213252311928⁃⁃⁃4105415555012715617186321×10225425906175384747011044141823×101755568652001113664641348138921×1016569773524051670100252305117715×1012600
注:样品编号1—7同表1
从表2中反应热数据可见,HNO3浓度越高,放热反应放热量越大,越剧烈,与图3显示的特征一致;HNO3浓度为14.7 mol/L时,仅1.0 g左右的反应物,释放了2 305 J/g的热量,导致了样品室和样品温度升高了167.0 ℃,考虑到惰性因子Φ,经校正后计算得到造成的绝热温度升高为1 002.5 ℃。从表2中活化能数据可见,HNO3浓度越高,反应活化能越低,反应越容易进行。因此,对于后处理设施蒸发浓缩相关工艺运行来说,HNO3浓度越高,体系热稳定性越差,也越危险。
2.3 30%TBP-70%正十二烷与不同浓度HNO3的绝热测试结果与分析
30%TBP-70%正十二烷与不同浓度HNO3溶液的ARC测试得到的升温曲线、压力曲线、升温速率曲线示于图4。
由图4(a)可见,测试过程中30%TBP与2.0 mol/L HNO3在120.1 ℃时有微弱的放热现象,温度仅升高2.5 ℃;30%TBP与4.0 mol/L HNO3在110.7 ℃时出现放热现象,温度升高22 ℃;当HNO3浓度增加到8.0 mol/L,有明显的放热反应发生。继续增加HNO3浓度,放热反应更加剧烈,但体系能达到的最高温度相差不大。
测试过程中同时监测样品在样品球中的压力变化,如图4(b)所示,HNO3浓度越高,体系压力变化越大。当 HNO3浓度为14.7 mol/L,在150 ℃以后有两次剧烈产气的过程,结合温度和升温速率的急剧升高,该条件测试具有爆炸现象的基本特征。当HNO3浓度为11.8、10.0、8.0 mol/L时,30%TBP-70%正十二烷与HNO3的放热反应也出现了急剧的温度上升,幅度和剧烈程度呈逐渐降低的趋势,压力的增加过程虽未出现瞬间升高的情况,但增加的幅度也较明显。该系列测试与TBP-HNO3放热反应的测试结果类似,温度、压力和升温速率变化的趋势相似。
TBP-正十二烷与不同浓度HNO3的ARC测试的实测数据、校正之后的数据以及动力学计算结果汇总列于表3。
从表3反应热数据可见,HNO3浓度越高,放热反应放热量越大,越剧烈,与图4显示的特征一致;HNO3浓度为14.7 mol/L时,仅1.0 g左右的反应物,释放了1 927 J/g的热量,导致了样品室和样品温度升高了139.7 ℃,考虑到惰性因子Φ,经校正后计算得到造成的绝热温度升高为838.2 ℃。从表3活化能数据可见,HNO3浓度越高,反应活化能越低,反应越容易进行。与表2数据呈现的趋势一致。
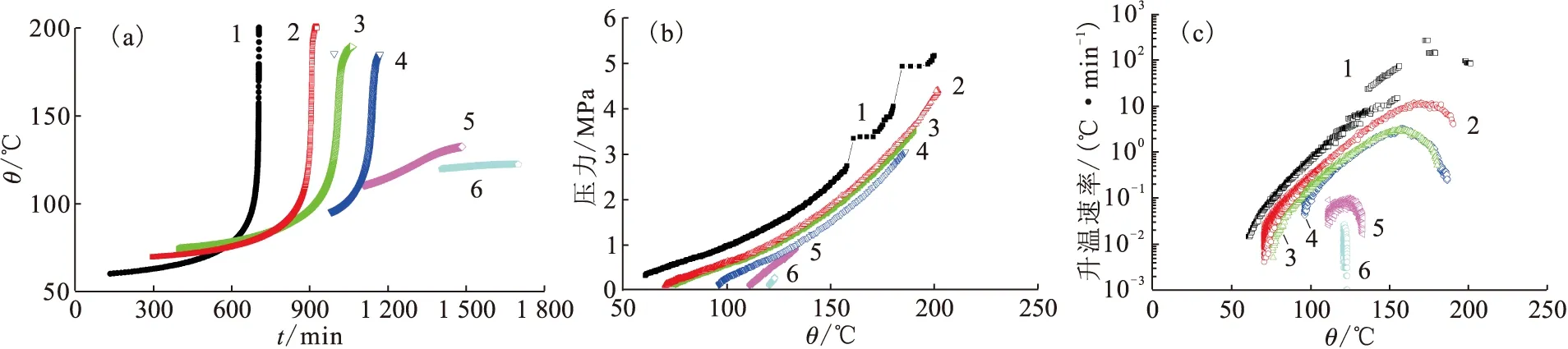
c(HNO3),mol/L:1——14.7,2——11.8,3——10.0,4——8.0,5——4.0,6——2.0图4 30%TBP-70%正十二烷在不同浓度HNO3条件下的ARC测试得到的温度(a)、压力(b)和升温速率(c)曲线Fig.4 Temperature(a), pressure(b), and temperature rise(c) curves of TBP-n-dodecane with ARC test in different concentrations of nitric acid
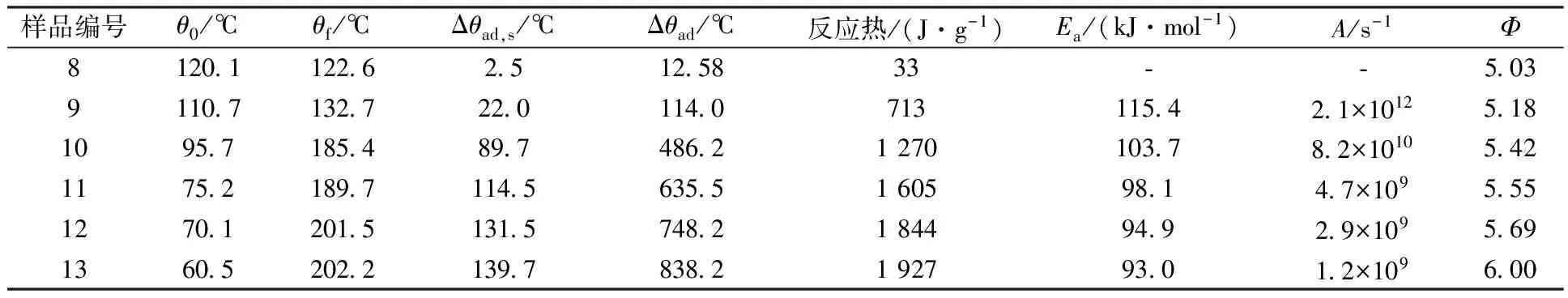
样品编号θ0/℃θf/℃Δθad,s/℃Δθad/℃反应热/(J·g-1)Ea/(kJ·mol-1)A/s-1Φ81201122625125833⁃⁃5039110713272201140713115421×101251810957185489748621270103782×101054211752189711456355160598147×10955512701201513157482184494929×10956913605202213978382192793012×109600
注:样品编号8—13同表1
该系列测试结果所示变化趋势与文献[5]的实验结果总体上一致,但本工作测试得到起始反应温度更低、反应放热量更大,并且压力曲线出现两次骤升的现象。可能的原因为:一是本工作ARC仪器的测试灵敏度更高,所以测试得到起始反应温度更低、反应放热量更大;二是本工作测试过程中惰性因子Φ值相对较小,测试过程中反应放热用于加热样品室而造成的热量损失相对较小,反应更加剧烈。
2.4 对比分析
对比TBP-HNO3和30%TBP-70%正十二烷-HNO3两个系列的ARC测试结果,可以得到以下结论。
(1) 两个系列测试结果的共同点:HNO3浓度越高,放热反应越剧烈,放热量更大,压力增加越明显,活化能越低,反应更容易进行。因此在后处理蒸发浓缩等相关工艺的运行中,要控制好HNO3浓度防止剧烈化学反应的发生。
目前后处理厂蒸发浓缩等相关工艺控制红油爆炸主要措施之一就是控制温度低于130 ℃[11],蒸发浓缩工艺运行温度在100 ℃左右。而两个系列监测到放热反应的起始温度基本上都低于130 ℃,甚至最低为60.5 ℃。当然,后处理厂蒸发浓缩等工艺设备实际运行时很难达到绝对的绝热条件,但当设备中放热反应产热量远远大于系统散热量或热量损失忽略不计时,系统就形成近似绝热的条件,事实上这也是很多事故发生的原因之一。因此,后处理蒸发浓缩工艺运行过程中要尽量避免出现绝热工况,防止热量的积累。
(2) 稀释剂正十二烷存在的体系,放热反应的起始温度更低,活化能也更低,放热分解反应更容易发生。反应释放能量更高,造成绝热温升更高(除14.7 mol/L HNO3条件以外)。说明正十二烷的存在加剧了放热反应。
(3) 纯TBP与HNO3反应引起的压力增加更大,这表明TBP与HNO3反应的气体产物生成量大于30%TBP-70%正十二烷与HNO3反应的气体生成量。
2.5 反应机理讨论
化学工业生产中常见的水解、硝化和聚合等放热反应都是多发事故反应类型。本工作研究的体系为强HNO3环境,可能同时存在水解和硝化等放热反应。在绝热条件下,这些放热反应产生的热量几乎全部用于加热反应产物自身,因此往往反应更加剧烈。
本工作所研究体系中,导致热失控的反应机理可能是:TBP自身水解反应会产生丁醇,丁醇易燃,化学性质不稳定;丁醇与HNO3反应产生硝酸丁酯,该物质是一种易燃物,闪点36 ℃,在HNO3或氮氧化物等强氧化剂作用下发生放热分解,释放大量热量;同时,硝酸丁酯极不稳定,能分解产生丁醛、氢气和亚硝酸等。这些放热反应和易燃或易爆产物都可能是导致热失控反应或爆炸的主要因素。
结合高效液相色谱、气相色谱和红外光谱等产物分析技术对反应机理进行预测将更具有说服力。本课题组已开展相关工作,并会在后续工作中对反应机理进行详细的阐述。
3 结 论
本工作使用绝热量热仪研究了绝热条件下TBP(或TBP-正十二烷)与HNO3的放热反应。获得了不同条件下放热反应的放热量、压力变化、起始反应温度、绝热温升等数据。确定了绝热条件下HNO3浓度、稀释剂等因素对放热反应的影响。得到结论如下:
(1) 没有HNO3存在时,TBP比较稳定,在测试温度范围内未监测到放热反应;
(2) 绝热条件下,HNO3浓度越高,TBP或TBP-正十二烷与HNO3发生的自放热反应的起始温度越低,放热量越高,造成的压力增加也越高;
(3) 绝热条件下,稀释剂正十二烷的存在加剧了放热反应,反应的起始温度更低,活化能也更低,放热分解反应更容易发生;释放能量更高,造成绝热温升更高(14.7 mol/L HNO3条件除外)。
总之,在核燃料后处理厂蒸发浓缩等相关工艺的运行过程中,要控制和避免溶剂与HNO3发生剧烈化学反应,同时还要尽量避免出现绝热工况,防止热量的积累,以保证核燃料后处理厂的安全运行。
[1] James N J, Sheppard G T. Red oil hazards in nuclear fuel reprocessing[J]. Nucl Eng Design, 1991, 130: 59-69.
[2] Usachev V N, Markov G S. Incidents caused by red oil phenomena at semi-scale and industrial radiochemical units[J]. Radiochem, 2003, 45(1): 1-8.
[3] 焦爱红,傅智敏.物质热稳定性分析实验方法及仪器比较[J].分析仪器,2008(2):52-57.
[4] 钱新明,刘丽,张杰.绝热加速量热仪在化工生产热危险性评价中的应用[J].中国安全生产科学技术,2005,1(4):13-18.
[5] Smitha V S. Reactive thermal hazards of tributyl phosphate with nitric acid[J]. Ind Eng Chem Res, 2012, 51: 7205-7210.
[6] Hyder M L. Safe handling of TBP and nitrates in the nuclear process industry(U), WSRC-TR-94-0372[R]. 1994. DOI: 10.2172/10104087.
[7] Gordon P L, O’Dell C, Watkin J G. Synthesis and energetic content of red oil[J]. J Hazardous Mater, 1994, 39(1): 87-105.
[8] Townsend D I, Tou J C. Thermal hazard evaluation by an accelerating rate calorimeter[J]. Thermochim, 1980, 37: 1-30.
[9] 傅智敏,黄金印,钱新明,等.加速量热仪在物质热稳定性研究中的应用[J].火灾科学,2001,10(3):149-153.
[10] 傅智敏,冯宏图,冯长根,等.用加速量热仪研究乳化炸药的热稳定性[J].安全与环境学报,2001,1(3):21-25.
[11] Robinson R N, Gutowski D M, Yenliscavich W. Control of red oil explosions, DFNSB/Tech-33[R]. Washington: Defense Nuclear Facilities Safety Board, 2003.
ExothermicReactionBehaviorofTBPWithNitricAcidandn-DodecaneUnderAdiabaticConditions
ZHANG Chun-long1,2, CAO Zhi1, ZHAO Shan-gui2, YANG Liu3, SU Zhe1, HONG Zhe2, HE Hui1,*
1.China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China;2.Nuclear and Radiation Safety Center, Ministry of Environmental Protection of the People’s Republic of China,Beijing 100082, China; 3.Atom-Hitech Company, Beijing 102413, China
The exothermic reaction behavior of TBP with nitric acid and 30%TBP-70% n-dodecane with nitric acid was studied by adiabatic accelerating calorimeter. The influence of the diluent on the exothermic reaction was determined by the comparison and analysis of the two series of test results. The results show that the higher the concentration of nitric acid, the lower the onset temperature of the self-exothermic reaction of TBP or TBP-n-dodecane and nitric acid, the higher the heat release and the pressure increase. Under adiabatic conditions, the presence of diluent n-dodecane exacerbates the exothermic reaction, resulting in lower reaction initial temperature, lower activation energy, and higher energy release.
nuclear fuel; reprocessing; adiabatic; TBP; HNO3; exothermic reaction
2017-09-18;
2017-10-15
张春龙(1984—),男,江苏徐州人,博士,工程师,核燃料循环与材料专业,E-mail: zhchlhy@163.com *通信联系人:何 辉(1972—),男,陕西武功人,博士,研究员,从事核燃料后处理研究,E-mail: hehui@ciae.ac.cn
TL249
A
0253-9950(2017)06-0403-06
10.7538/hhx.2017.39.06.0403
