种植密度对烤烟叶片碳同化能力及同化产物分配的影响
2017-12-20赵会杰张皓帆张鹏举许海良蒲文宣张锦韬汪耀富
赵会杰,张皓帆,李 华,张鹏举,许海良,蒲文宣,易 克,张锦韬,汪耀富*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.湖南中烟工业有限责任公司,湖南 长沙 410007)
种植密度对烤烟叶片碳同化能力及同化产物分配的影响
赵会杰1,张皓帆1,李 华1,张鹏举1,许海良1,蒲文宣2,易 克2,张锦韬2,汪耀富2*
(1.河南农业大学 生命科学学院,河南 郑州 450002; 2.湖南中烟工业有限责任公司,湖南 长沙 410007)
以烤烟品种K326为材料,设置D1(16 529株/hm2)、D2(18 182株/hm2)、D3(20 202株/hm2) 3个种植密度处理,于圆顶期对各处理烟株上、中、下3个部位叶片进行13C同位素标记,研究了烤烟不同部位叶片的碳同化能力差异和同化产物的分配特点,并探讨了种植密度对烤烟叶片碳同化能力差异和同化产物分配的调节效应。结果表明,烤烟不同部位叶片的13C同化能力表现为中部叶>上部叶>下部叶;同一叶片不同区段13C同化能力大小依次为叶中部>叶基部>叶尖部。上部叶的13C同化产物平均有19.71%运往根系,42.22%运往茎秆,38.07%留在叶片且大部分留在被标记的上部叶;中部叶的13C同化产物有33.42%运往根系,26.00%运往茎秆,40.58%留在叶片且大部分留在被标记的中部叶;下部叶的13C同化产物有33.67%运往根系,23.72%运往茎秆,42.61%留在叶片且大部分留在被标记的下部叶。上部叶的13C同化产物向茎秆的中部供应较多,中部叶和下部叶的13C同化产物向茎秆基部分配较多。随着种植密度增大,叶片的碳同化能力降低,向根、茎分配的同化产物量减少,尤其是在较高的种植密度(D3)下,各部位叶片的碳同化能力显著降低。综上,烟叶产量和品质形成的物质基础主要来源于烟叶生长期间自身的同化作用,种植密度对烤烟叶片的13C 同化能力具有显著影响,在设置试验条件下,18 182株/hm2左右的种植密度有利于提高烤烟叶片碳同化能力和协调同化产物的运输分配。
烤烟;13C标记; 种植密度; 碳同化能力; 同化产物分配
碳素同化是烤烟产量和品质形成的物质基础,而合理的碳同化产物运输分配是实现烤烟优质丰产的保证。种植密度是调节烤烟个体发育和群体发展的重要因素,因此,围绕密度与烤烟生长发育、烟田生态、光合作用的关系,前人已做了大量研究[1-5],但在与产量、品质形成密切相关的碳同化产物运输分配及其调控方面,目前研究较少。随着高纯度13CO2的获得和测定技术的发展,13C标记技术在土壤和植物营养研究中得到广泛的应用[6-13]。人们利用13C原位标记的方法研究了小麦[14-15]、玉米[16-17]、水稻[18-19]、苹果[20-21]、樱桃[22]等光合碳同化产物的分配及其调节,为生产上采取相应的调控技术提供了理论基础。与上述作物不同,烟草以叶片为收获对象,其碳同化产物的运输分配有其自身的特殊性,而且与烟叶产量和品质形成的关系更加直接。鉴于此,通过对烤烟不同部位叶片进行13C标记,研究了烤烟不同部位叶片的碳同化能力差异和烟草植株碳同化产物的分配特点,并设置不同的密度处理,探讨种植密度对烤烟叶片碳同化能力及碳同化产物分配的调节效应,旨在为烤烟的优质丰产提供理论依据。
1 材料和方法
1.1 试验条件与试验设计
试验于2015年在湖南省湘西自治州龙山县召市镇进行,试验地地势平坦,排灌方便,质地为壤土,有机质含量18.58 g/kg,碱解氮含量75.34 mg/kg,有效磷含量31.27 mg/kg,速效钾含量114.00 mg/kg。
以烤烟(Nicotianatabacum)品种K326为材料,采用随机区组试验设计,设3个种植密度处理:D1(16 529株/hm2,行距110 cm、株距55 cm)、D2(18 182株/hm2,行距110 cm、株距50 cm)、D3(20 202株/hm2, 行距110 cm、株距45 cm)。重复3次。施纯氮97.5 kg/hm2,磷、钾肥按照N∶P2O5∶K2O=1∶1.5∶2.5的比例施用。其中,氮肥用量的40%作为基肥,60%作为追肥。肥料种类为烟草专用复合肥(N∶P2O5∶K2O=12∶10∶25),并采用适量的尿素、过磷酸钙和硫酸钾调整氮磷钾比例。现蕾期打顶,单株留叶21片,每小区种植8行,行长10 m。田间管理按常规措施进行。
1.2 13C标记与样品采集
于烤烟圆顶期(7月15日),每个处理小区选取6株生长一致的烟株挂牌标记,作为13C标记烟株。将6个标记烟株分为3组,每组2株分别用于下部叶(自下而上第5位叶)、中部叶(第12位叶)和上部叶(第19位叶)13C标记。标记时间为上午9:30—10:30。
同化室(标记室)采用高透光率塑料薄膜制成,体积为0.032 m3(长×宽×高=80 cm×40 cm×10 cm)。将同化室套在叶片上,并置入一个盛有0.122 g Na13CO3的小烧杯,密封后立即向烧杯内注射1.5 mL 2 mol/L的HCl,然后再进行2次注射,间隔时间为20 min,使其逐步释放13CO2,同化时间1 h。
标记结束后立即进行第1次取样,每组选取1个标记株,将不同部位标记叶片置于105 ℃杀青10 min,然后置于70 ℃下烘干至恒质量。按照叶片长度将叶片切分为叶尖部、叶中部和叶基部3个长度相等的区段,分别记为叶尖部、叶中部和叶基部区段,测定干质量后用于制样和13C同位素的测定,标记株的13C丰度测定结果记为Fl。于标记后第7天进行第2次取样,选取每组的第2个标记株,整株取回后将上、中、下3个部位的叶片(沿主脉均切分为叶尖部、叶中部和叶基部3个等长区段)、茎秆(切分为茎顶部、茎中部和茎基部3个等长部分)和根系样品置于105 ℃杀青10 min,然后70 ℃烘干至恒质量。测定干质量后,用于制样和13C同位素的测定。每次取样时,同时取距离标记株5 m以外的未标记烟株3株,采用同样的方法制样,测定未标记烟株的自然13C丰度(记作Fnl),作为基础对照。将采集的样品粉碎,过0.25 mm筛,用于测定。
1.3 测定项目与方法
采用Delta V Advantage 同位素比率质谱仪(Isotope Ratio Mass Spectrometer)测定13C丰度,外部设备为Flash 2000 EA-HT 元素分析仪(Elemental Analyzer,Thermo Fisher Scientific,Inc., USA)。同时进行总碳含量测定。
参照Lu等[18-19]的方法,计算13C丰度(F)、同化前后叶片的13C丰度差(ΔF)、进入各组分的13C量、各组分中13C的分配比例(D)。
(1)F= [(δ13C+1 000)×RPBD]/[(δ13C+1 000) ×RPBD+1]×100%,式中,δ13C是植物的13C自然丰度,RPBD为碳同位素的标准比值(0.011 237 2)。
(2)ΔF=Fl-Fnl, 式中Fl为标记叶的13C丰度,Fnl为未标记叶的13C丰度。
(3)13Cs=ΔF×TC/100×1 000,式中,13Cs为13C的量(mg),TC为各组分所含的总碳量(g)。以标记后1 h 立即取样测得的13Cs代表叶片的13C同化能力;以标记7 d后取样测得的13Cs代表运输分配到不同器官的13C量,并以此为基础计算不同器官(组分)的13C分配比例。
(4)D=13Cs/Σ13Cs×100%,13Cs为某组分中13C量(mg),Σ13Cs为各组分13Cs之和(mg)。
1.4 烟叶经济性状分析
小区单收单烤,测定烟叶产量、产值、上等烟比例等经济性状。
1.5 数据处理
采用Microsoft Excel软件进行数据整理,采用SPSS 18.0统计软件进行单因素方差分析,并用Duncan氏法进行处理间差异显著性检验(α=0.05)。
2 结果与分析
2.1 种植密度对烤烟不同部位叶片13C同化能力的影响
表1表明,在烤烟圆顶期进行13CO2标记,3个种植密度下均以中部叶对13C的同化能力最强,其次是上部叶,下部叶的单叶同化量最低。种植密度对烤烟不同部位叶片的13C同化能力具有明显影响,表现为叶片13C同化量随着种植密度增大而降低,但D1、D2处理间中部叶的13C同化量差异不显著。

表1 烤烟植株不同部位叶片的13C同化能力
注:括号外不同字母表示同一部位叶片不同种植密度间差异达到5%显著水平,括号内不同字母表示同一种植密度下不同部位叶片间差异达到5%显著水平。
2.2 种植密度对烤烟叶片不同区段13C同化能力的影响
将同一片烟叶沿主脉分为叶尖部、叶中部和叶基部3个等长区段,由于各区段的宽度、面积和质量不同,所以采用不同区段13CO2标记前后的13C丰度差(ΔF)作为衡量其13C同化能力的指标。从表2可以看出,所有叶片均以中部区段同化13C的能力最高;尖部和基部区段相比,基部区段同化能力高于尖部,即同一叶片3个区段的13C同化能力大小依次为叶中部>叶基部>叶尖部。不同种植密度间比较,上部叶3个区段的13C同化能力均随着密度增大而降低;中部叶3个区段均以中等密度(D2)下13C同化能力最高,D1、D3处理间差异不显著;下部叶也表现为中等密度(D2)下13C同化能力最高,但仅叶中部13C同化能力表现为D1、D3处理间差异不显著,叶尖部和叶基部13C同化能力均表现为D1处理显著高于D3处理。

表2 烤烟叶片不同区段的ΔF
注:括号外不同字母表示同一部位叶片不同区段间差异达到5%显著水平,括号内不同字母表示同一叶片区段不同种植密度间差异达到5%显著水平。
2.3 种植密度对烤烟不同部位叶片13C同化产物分配的影响
2.3.1 上部叶 表3表明,采用13CO2标记上部叶片,其13C同化产物一部分运往根系,一部分运往茎秆,其余部分留在叶片。D1、D2、D3处理烤烟13C同化产物在根系中的分配比率分别为18.94%、18.74%、21.45%,平均为19.71%;在茎秆中的分配比率分别为46.49%、40.21%、39.96%,平均为42.22%;在叶片中的分配比率分别为34.57%、41.05%、38.59%,平均为38.07%。运往茎秆的13C同化产物以分配到茎中部的最多,其次是茎顶部,茎基部较少;分配到叶片的13C同化产物则绝大部分留在上部叶(标记叶)。随密度增大,向根、茎中分配的13C同化产物量减少,但在D3条件下,向根部运输的13C同化产物比例有所增大。

表3 上部叶13C同化产物在烟株不同部位的分配
注:同行不同字母表示不同密度处理间差异达到5%显著水平。由于不同部位之间的差异明显,仅对不同密度处理间的分配量差异进行了显著性分析。表4、5同。
2.3.2 中部叶 由表4可以看出,用13CO2标记中部叶片,D1、D2、D3处理烤烟13C同化产物在根系中的分配比率分别为34.52%、33.11%、32.62%,平均为33.42%;在茎秆中的分配比率分别为28.46%、25.30%、24.25%,平均为26.00%;在叶片中的分配比率分别为37.02%、41.59%、43.13%,平均为40.58%。运往茎秆的13C同化产物分配到茎基部最多,其次是茎中部,茎顶部最少;分配到叶片的13C同化产物则绝大部分留在被标记叶(中部叶)内。总体而言,随着种植密度增加,13C同化产物保留在叶片的比例增大,向根部和茎部运输的比例减小。

表4 中部叶13C同化产物在烟株不同部位的分配
2.3.3 下部叶 表5显示,用13CO2标记下部叶片,3个密度处理烤烟13C同化产物平均有33.67%运往根系,23.72%运往茎秆,42.61%留在叶片。D1、D2、D3处理13C同化产物在根系中的分配比率分别为32.79%、34.43%、33.79%,在茎秆中的分配比率分别为24.75%、23.23%、23.17%,在叶片中的分配比率分别为42.46%、42.34%、43.04%。运往茎秆的13C同化产物大部分积累在茎基部,运往茎中部和茎顶部的量很少;分配到叶片的13C同化产物绝大部分留在标记叶(下部叶)。随着种植密度的增加,向各部位运输分配的13C同化产物量减少,但种植密度对下部叶13C同化产物向各部位的分配比例影响较小。
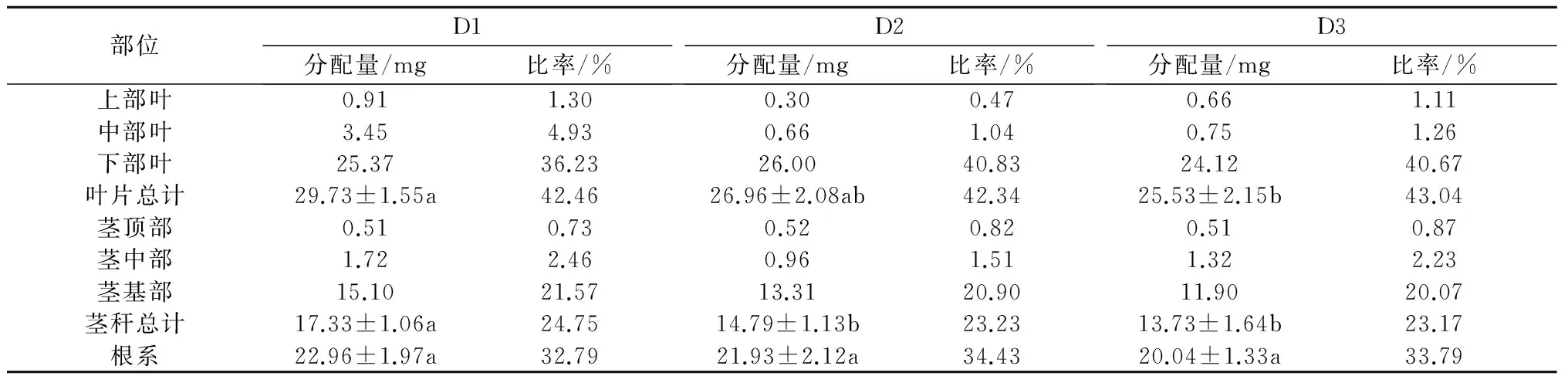
表5 下部叶13C同化产物在烟株不同部位的分配
2.4 种植密度对烤烟经济性状的影响
从表6可以看出,随种植密度增加,烟叶产量提高,但D2、D3处理差异不显著;高密度(D3)处理上等烟比例显著降低,中(D2)、低(D1)密度处理上等烟比例较高;产值则以D2处理最高,其次是D3处理。

表6 不同处理烤烟产量、产值及上等烟比例
注:同列不同字母表示处理间差异达到5%显著水平。
3 结论与讨论
烤烟的产量和质量与叶片光合能力及光合产物分配有着密切关系。因此,人们对烤烟叶片光合作用及其调控进行了大量研究。朱列书等[23]研究了不同基因型烟草的光合特性,结果表明,黄花烟草的净光合速率较高,烤烟和晒红烟的净光合速率相对较低;不同烤烟品种间也有差异。王艳丽等[24]研究了烤烟不同部位叶片的光合特性,结果表明,现蕾期下部叶的光合速率显著低于上中部叶。王瑞等[1]等研究表明,随着种植密度增大,烤烟叶片的光合速率降低,光合功能衰退加快。时向东等[2]则发现,种植密度对不同部位叶片的光合作用影响不一致,中、下部叶片的光合速率以18 150株/hm2处理最高,上部叶以13 500株/hm2处理最高。上述研究均采用经典的光合测定技术,根据叶室中的CO2浓度的变化来计算光合速率。本研究采用13CO2原位标记技术,用13CO2直接标记叶片,不仅可以直接测定一定时间内的13CO2同化量,而且可以分析13C同化产物的运输分配情况。试验结果表明,烤烟圆顶期以中部叶对13C的同化能力最强,其次是上部叶,下部叶的单叶同化量最低,这与朱列书等[23]测定的光合作用结果基本一致。造成不同部位叶片碳同化能力差异的原因较为复杂,可能与叶片的发育状态有关,圆顶期中部叶已经充分扩展,光合机构发育趋于完善,因此,其同化能力高于已经趋向成熟衰老的下部叶和刚刚达到或接近定长的上部叶。种植密度对烤烟叶片13C同化能力具有显著影响,种植密度较高(D3)时,各部位叶片的13C同化能力显著降低,而D1、D2处理中部叶13C同化能力差异不显著。表明种植密度过大会导致冠层环境的恶化,不利于个体和群体的协调发展,导致叶片的碳同化能力下降,这与王瑞等[1]、时向东等[2]的研究结果一致。此外,本研究还发现,同一叶片叶尖部、叶中部和叶基部3个区段的13C同化能力也存在明显差异,表现为叶中部13C同化能力最高,其次是叶基部,叶尖部13C同化能力最低。生产实践中发现,一般烟株以中部叶质量较好,而同一叶片则以中部区段质量较好,这与其碳同化能力强,碳同化产物供应充足密切相关。
较强的碳素同化能力可为作物产量形成提供充足的物质基础,但最终产量的高低还取决于碳同化产物的运输分配情况。关于植株体内碳同化产物的运输和分配,目前对以籽粒(或果实)为收获对象的作物研究较多,但对以叶片为收获对象的烟草研究尚不多见。闫川等[25]比较了大穗型和中穗型水稻品种13C同化产物的积累与分配特点,结果发现,大穗型品种不仅具有较强的13C同化能力,而且茎鞘物质向穗部的转移量、转运率明显高于中穗型品种,因此具有更高的增产潜力。一些研究表明,冬小麦在花前、开花期、灌浆期的光合碳同化产物,分别有18%~30%、32%~41%、70%以上转运到成熟籽粒中[26-28]。赵隽等[15]采用13C标记技术,研究了冬小麦体内碳同化产物的分配,结果表明,13C同化产物在挑旗期、开花期主要向茎秆和叶鞘分配,灌浆期则主要向籽粒分配;成熟期约有87.5%的灌浆期13C同化产物分配到籽粒中,约75.4%的开花期13C同化产物分配到籽粒中,而仅15.2%的挑旗期13C同化产物分配向籽粒,灌浆期13C同化产物对籽粒质量的贡献最大。于凤义等[29]利用14C示踪法研究玉米灌浆期功能叶光合产物在果穗不同部位籽粒间的分配,结果发现,采用14C标记功能叶半片叶时,14C-光合产物在果穗各行籽粒中的分布是不均匀的,14C-光合产物的量在一半果穗中较高,在另一半果穗中较低,有所谓的“半侧分布”现象。从上述结果可见,植株产生的碳同化产物遵循着优先分配给生长中心的原则[30],对于收获籽粒的粮食作物而言,生长后期以种子为生长中心,叶片的碳同化产物重点运往籽粒[31]。与粮食作物不同,烤烟以叶片为收获对象,其产量和品质形成与碳同化产物分配的关系有其自身的特殊性。本试验结果表明,上部叶的13C同化产物平均有19.71%运往根系,42.22%运往茎秆,38.07%留在叶片,而且大部分留在被标记的上部叶;中部叶的13C同化产物有33.42%运往根系,26.00%运往茎秆,40.58%留在叶片,而且大部分留在被标记的中部叶;下部叶13C同化产物有33.67%运往根系,23.72%运往茎秆,42.61%留在叶片,而且大部分留在被标记的下部叶。可见,就13C同化产物供应而言,中、下部叶片对根系发育的贡献较大,上部叶则对茎秆的贡献较大。总体而言,随着种植密度增大,向各部位运输分配的13C同化产物量减少,并对分配比例产生一定影响。由茎秆不同区段的13C同化产物分配比例可见,上部叶的13C同化产物向茎中部供应较多,中部叶和下部叶的13C同化产物向茎基部分配较多,符合植物体内就近供应的物质分配规律。上述结果还表明,烟草已定长的不同部位叶片之间相互供应碳同化产物的能力很小,这不仅符合植物体内物质分配的一般规律,而且意味着烟叶产量和品质形成的物质基础主要来源于烟叶生长期间自身的同化作用。因此,在生产实践中,要采用适宜的密度、施氮量等措施,构建合理的群体结构,协调个体发育和群体发展关系,从而增强叶片的光合碳同化能力,为产量和品质形成奠定良好的物质基础。
综上,烤烟圆顶期以中部叶的碳同化能力较强,其次是上部叶,下部叶的碳同化能力较弱;同一叶片不同区段相比,以叶中部的碳同化能力较高,叶基部次之,叶尖部较低;种植密度对不同部位叶片的碳同化能力有显著影响,适宜的种植密度能够增强叶片的碳同化能力,当密度达到20 202株/hm2时,叶片的13C同化能力显著降低,向各部位运输分配的碳同化产物量减少。上、中、下3个部位叶片的碳同化产物除了部分运往根、茎部位,主要分配于相应的被标记叶片。在本试验条件下,烤烟的种植密度以18 182株/hm2左右较为适宜,有利于增强烟叶的碳同化能力并协调碳同化产物的运输分配。
[1] 王瑞,刘国顺,倪国仕,等.种植密度对烤烟不同部位叶片光合特性及其同化物积累的影响[J].作物学报,2009,35(12):2288-2295.
[2] 时向东,朱命阳,赵会纳,等.种植密度对烤烟叶片生育期光合特性的影响[J].中国烟草学报,2012,18(6):38-42.
[3] 汪耀富,孙德梅,韩富根,等.密度和地膜覆盖对烟田冠层生理特性和土壤水分利用效率的影响[J].烟草科技,2003(12):27-30.
[4] 李海平,朱列书,黄魏魏,等.种植密度对烟田环境、烤烟农艺性状及产量质量的影响研究进展[J].作物研究,2008,22(5):489-490.
[5] 毛家伟,张翔,王宏,等.种植密度和氮用量对烟叶光合特性和产量质量的影响[J].干旱地区农业研究,2012,35(5):66-70.
[6] 沈其荣,殷士学,杨超光,等.13C标记技术在土壤和植物营养研究中的应用[J].植物营养与肥料学报,2000,6(1):98-105.
[7] 马晔,刘锦春.δ13C在植物生态学研究中的应用[J].西北植物学报,2013,33(7):1492-1500.
[8] Liu R,Clapp C E,Cheng H H.Usefulness of the carbon-13 tracer technique for characerizing terrestrial carbon pools[J].Nutrient Cycling in Agroecosystems,1997,49(1/2/3):261-266.
[9] Balesdent J,Mariotti A,Boisgontier D.Effect of tillage on soil organic matter carbon mineralization estimated from13C abundance in maize fields[J].Journal of Soil Science,1990,41:587-596.
[10] Bernoux M,Cerri C C,Neill C,etal.The use of stable carbon isotopes for estimating soil organic matter turnover rates[J].Geoderma,1998,82(1/3):43-58.
[11] Gebrekirstos A,Van Noordwijk M,Neufeldt H,etal.Relationships of stable carbon isotopes,plant water potential and growth:An approach to asses water use efficiency and growth strategies of dry land agroforestry species[J].Trees,2011,25(1):95-102.
[12] Miller J M,Williams R J,Farquhar G D.Carbon isotope discrimination by a sequence ofEucalyptusspecies along a subcontinental rainfall gradient in Australia[J].Functional Ecology,2001,15:222-232.
[13] 何春霞,李吉跃,孟平,等.树木叶片稳定碳同位素分馏对环境梯度的响应[J].生态学报,2010,30(14):3828-3838.
[14] 齐鑫,王敬国.应用13C脉冲标记方法研究不同施氮量对冬小麦净光合碳分配及其向地下输入的影响[J].农业环境科学学报,2008,27(6):2524-2530.
[15] 赵隽,董树亭,刘鹏,等.有机无机肥长期定位配施对冬小麦13C同化物分配及产量的影响[J].核农学报,2016,30(9):1805-1814.
[16] 何敏毅,孟凡乔,史雅娟,等.用13C脉冲标记法研究玉米光合碳分配及其向地下的输入[J].环境科学,2008,29(2):446-453.
[17] 安婷婷,汪景宽,李双异,等.用13C脉冲标记方法研究施肥与地膜覆盖对玉米光合碳分配的影响[J].土壤学报,2013,50(5):948-955.
[18] Lu Y H,Watanabe A,Kimura M.Input and distribution of photosynthesized carbon in a flooded rice soil[J].Global Biogeochemical Cycles,2002,16(4):1085-1093.
[19] Lu Y H,Watanabe A,Kimura M.Carbon dynamics of rhizodeposits,root- and shoot-residues in a rice soil [J]. Soil Biology & Biochemistry,2003,35(9):1223-1230.
[20] 李晶,姜远茂,魏绍冲,等.富士苹果秋梢连续摘心对13C和15N利用、分配的影响[J].园艺学报,2012,39(11):2238-2244.
[21] 门永阁,任饴华,许海港,等.苹果树不同部位新梢叶片13C同化物的去向[J].园艺学报,2014,41(6):1063-1068.
[22] 付莹,姜远茂,张世忠,等.短截修剪程度对‘红灯’甜樱桃13C和15N分配利用的影响[J].园艺学报,2015,42(1):104-110.
[23] 朱列书,赵松义,李伟.烟草不同基因型的光合特性研究[J].中国烟草科学,2006,27(1):5-7.
[24] 王艳丽,刘国顺,李海江,等.烤烟不同部位叶片的光合特性研究[J].中国农学通报,2014,30(10):92-98.
[25] 闫川,洪晓富,阮关海,等.大穗型水稻13C光合产物的积累与分配[J].核农学报,2014,28(7):1282-1287.
[26] 马冬云,郭天财,王晨阳,等.施氮量对冬小麦灌浆期光合产物积累、转运及分配的影响[J].作物学报,2008,34(6):1027-1033.
[27] 姜东,于振文,李永庚,等.高产小麦营养器官临时贮存物质积运及其对粒重的贡献[J].作物学报,2003,29(1):31-36.
[28] 杨俊峰,龚月桦,王俊儒,等.旱地覆膜对冬小麦花后14C-同化物转运分配的影响[J].核农学报,2007,21(1):70-74.
[29] 于凤义,张萍,周洪杰.玉米功能叶片碳同化物在果穗不同部位籽粒中的分配[J].核农学报,1994,10(1):35-38.
[30] 张立军,梁宗锁.植物生理学[M].北京:科学出版社,2012:184-186.
[31] 李合生.现代植物生理学[M].3版.北京:高等教育出版社,2012:186-190.
Effects of Planting Density on Carbon Assimilation Capability and Assimilation Product Distribution of Flue-cured Tobacco Leaves
ZHAO Huijie1,ZHANG Haofan1,LI Hua1,ZHANG Pengju1,XU Hailiang1,PU Wenxuan2,YI Ke2,ZHANG Jintao2,WANG Yaofu2*
(1.College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China; 2.China Tobacco Hunan Industrial Co.,Ltd.,Changsha 410007,China)
In present study,13C labelling method was used to evaluate the differences in carbon assimilation ability of leaves at different positions of flue-cured tobacco plants,the distribution characteristics of photosynthate,and the regulating effect of planting density.Three different treatments of planting density were designed and denoted as D1 (16 529 plants/ha),D2 (18 182 plants/ha) and D3 (20 202 plants/ha) .The leaves at upper,middle and lower positions of tobacco plants were labeled with13CO2respectively at round top stage.As shown in the results,at the same flue-cured tobacco plant,the highest13C assimilation capability was observed on middle leaves,followed by the upper and the lower leaves.In comparison with different areas of the same leaf,the highest capability of carbon assimilation was in the middle section,followed by the base and the top section.Averagely,19.71% of13C assimilation products of upper leaves were transported to root system,42.22% to stem,and 38.07% were left in leaves and most of them were left in upper labelled leaves.33.42% of13C assimilation products of middle leaves were transported to root system,26.00% to stem,and 40.58% were left in leaves and most of them were left in middle labelled leaves.33.67% of13C assimilation products made by lower leaves were transported to root system,23.72% to stem,and 42.61% were left in leaves and most of them were left in lower labelled leaves.In terms of assimilation product allocated to the stem,photosynthates of upper leaves were mainly distributed to middle part of stem,and photosynthates of middle and lower leaves were mainly distributed to base part of stem.The carbon assimilation capacity of leaves and the amount of assimilation product transported to root and stem both decreased along with the increase of planting density.Under the high planting density of D3,carbon assimilation capacity of leaves at all positions declined significantly.In conclusion,substance basis for the tobacco yield and quality mainly originates from the carbon assimilation by themselves during the growth of leaves.The planting density has a significant impact on the13C assimilative capacity of flue-cured tobacco leaves.Under this experimental conditions,the planting density around 18 182 plants/ha is conducive to improving the carbon assimilation capacity and coordinating the assimilation product distribution in flue-cured tobacco.
flue-cured tobacco;13C labeling; planting density; carbon assimilation capability; distribution of assimilation product
S572
A
1004-3268(2017)11-0035-07
2017-05-19
湖南中烟工业有限责任公司科技项目(KY2014JD0002)
赵会杰(1958-),男,河南尉氏人,教授,博士,主要从事作物栽培生理研究。E-mail:zhaohj303@163.com
*通讯作者:汪耀富(1964-),男,河南邓州人,教授,博士,主要从事烟草栽培生理研究。E-mail:yaofuwang@163.com
