氧化铝粉尘吸附脱除铝酸钠溶液中的腐植酸钠
2017-12-20刘桂华陈斌斌齐天贵周秋生彭志宏李小斌董文波
刘桂华,陈斌斌,齐天贵,周秋生,彭志宏,李小斌,董文波
氧化铝粉尘吸附脱除铝酸钠溶液中的腐植酸钠
刘桂华,陈斌斌,齐天贵,周秋生,彭志宏,李小斌,董文波
(中南大学 冶金与环境学院,长沙 410083)
通过测定溶液中有机碳含量的变化,结合X射线衍射光谱以及红外光谱分析及表面性质测定,研究氧化铝粉尘吸附脱除铝酸钠溶液中的腐植酸钠的影响因素及其作用机理。结果表明:500~800 ℃焙烧的氧化铝粉尘结晶差,在600 ℃下焙烧的氧化铝粉尘吸附脱除腐植酸效果最好;溶液碱浓度、吸附温度也显著影响吸附效果,45 ℃时的吸附量最大。同时,相对于500、700和800 ℃焙烧的产品,600 ℃焙烧的氧化铝粉尘表面疏水性较强、溶剂化能力较差;吸附过程中主要以物理吸附为主,也有化学吸附;吸附动力学与准二级模型吻合,化学吸附为控制步骤,表面吸附为主要的吸附形式。
氧化铝粉尘;焙烧;铝酸钠溶液;腐植酸钠;吸附
在拜耳法溶出铝土矿(特别是三水铝石)时,铝土矿中的部分有机杂质进入溶液中。其中大多数有机物(如腐植酸钠)在热碱液中会逐步降解生成一系列水溶性有机物,最后才生成低分子量的草酸钠、碳酸钠 等[1−3]。在铝酸钠溶液的循环中,有机物浓度不断增加,导致溶液的密度、黏度、比热和沸点增加,界面张力降低[4−5];也使得赤泥沉降速率降低、碱损失增加、泡沫增多、设备有效容积减少;还会使晶种分解(种分)的分解率降低,产品粒度变细、氢氧化铝产品染色;也难以制备高纯、高白氧化铝(氢氧化铝)[6−8]。因此,脱除溶液中有机物一直是国内外研究的热点和难点。
溶液中有机物可分为草酸钠或非草酸钠类,脱除溶液中草酸钠有比较成熟的方法。而脱除非草酸盐有机物的方法也有较多专利技术,如氧化法、煅烧法、沉淀法、吸附法等[9−12]。其中氧化法、煅烧法、沉淀法等存在成本高、脱除率低、运行成本高、流程复杂等弊端;而吸附法因工艺简单、运行成本低、易实施等优点而被广泛研究。目前,研究的吸附剂有活性炭、层状含镁化合物等。这些吸附剂原料较贵,难以循环利用,也容易引入杂质,因而没有在氧化铝企业中应用。中国氧化铝企业也曾在粗液中加入粉煤灰,除用作助滤剂外,也用于吸附有机物。而在实际运行过程中,该方法脱除有机物的效果并不好。上述吸附除有机物工艺难以工业应用的关键原因是吸附机理的不明确,工艺优化中吸附指标的改善不明显。
在氧化铝生产过程中,有较多的焙烧氧化铝粉尘,该粉尘不满足砂状氧化铝的质量要求,但该粉尘粒度细、表面积大、活性较高。若将该粉尘用于吸附脱除铝酸钠溶液中的有机物,然后洗涤或低温焙烧(或氧化)除去有机物,再循环使用,工艺不仅简单,不降低氧化铝回收率和有利于降低脱除有机物的成本[13−14],而且不引入杂质,可全资源化处理。因此,本文作者采用焙烧氧化铝粉尘作为吸附剂,以腐植酸钠代表其中有机物,研究各因素对吸附脱除溶液中有机物去除效果的影响规律,测定了焙烧氧化铝粉尘的表面性质、表征了吸附动力学过程、阐述了吸附机理。这些结果为强化吸附脱除溶液中有机物奠定了初步的理论基础,有利于吸附法脱除溶液中有机物工艺的优化。
1 实验
1.1 原料
用工业级氢氧化钠和工业级氢氧化铝配制合成的铝酸钠溶液;腐植酸钠是铝酸钠溶液中主要的非草酸钠类有机物,本文作者将腐植酸钠溶于水中配成1.0 g/L水溶液,然后与合成的铝酸钠溶液调配制成含有机物的铝酸钠溶液。腐植酸钠和分析试剂均为分析纯药品。吸附剂来自于河南某氧化铝厂氧化铝焙烧粉尘。粉尘的XRD谱如图1所示。

图1 氧化铝粉尘的XRD谱
由图1可知,焙烧氧化铝粉尘中主要物相为残存的Al(OH)3和Al2O3。氧化铝粉尘的粒度主要分布在1~20 μm间(见图2),其平均粒径(50)为4.071 μm,属微粉,与砂状氧化铝平均粒径(50)60~80 μm相去 甚远。
1.2 实验方法
准确量取500 mL含有机物的铝酸钠溶液于1000 mL平底烧瓶中,然后置于已设定温度的恒温水浴锅中,取样分析溶液中有机碳含量;加入一定量的吸附剂,慢速搅拌(150~180 r/min)。吸附一定时间后,取样进行过滤,移取部分滤液定容,分析其中有机碳的含量;固样在40 ℃真空干燥24 h,然后测定吸附后氧化铝粉尘的红外光谱。
1.3 分析方法
采用容量法测定溶液中氧化铝和苛性碱的浓度,用Mastersizer2000激光粒度分析仪测量吸附剂的粒度分布;粉尘中物相组成由X射线衍射分析仪(D/MAAX2500,日本株式会社理学公司)测定;吸附前后固相的红外光谱由傅里叶变换红外光谱仪(USA,Thermo Fisher)测定;用总有机碳测定仪(日本SHIMADZU公司)测定溶液中总有机碳(TOC)含量。在室温下利用CL200B型接触角测定仪(上海梭伦信息科技有限公司)采用悬滴法测定吸附剂的接触角,然后用Owens[15]二液法估算出相应的表面自由能。
2 结果与讨论
2.1 焙烧温度对氧化铝粉尘性质的影响
超细氧化铝粉尘易吸附水,故本研究中将该粉尘进行焙烧,主要目的是提高表面吸附性能。焙烧条件分别为500、600、700、800 ℃下活化焙烧30 min。然后用焙烧氧化铝粉尘吸附溶液中的有机物来考察氧化铝粉尘的吸附性能,焙烧产物粒度分布与XRD谱如图2所示。
由图2可以看出,在不同温度下焙烧得到的氧化铝粉尘粒度分布并没有明显的差别,粒度范围在1~10 μm间,平均粒径(50)为2.113~3.921 μm。与原样相比,除500 ℃焙烧后氧化铝粒度略微变细,其余样品的粒度分布曲线与原样基本相同。此外,由其XRD分析结果可知,500 ℃焙烧后产物中出现一水软铝石物相;600 ℃产品中一水软铝石特征峰很弱;700~800 ℃焙烧产品中无一水软铝石物相,-Al2O3的特征峰很弱。

图2 焙烧温度对氧化铝粉尘的粒度分布和XRD谱的影响
同时,500~800 ℃焙烧后产品主要物相为-Al2O3、-Al2O3、-Al2O3,特征峰弥散,结晶度差。
2.2 焙烧氧化铝粉尘吸附性能的变化规律
焙烧温度影响粉尘物相组成,也影响其中不同物相的含量,继而影响吸附效果。焙烧温度对焙烧氧化铝粉尘吸附有机物效果的影响结果如图3所示。
图3的结果表明,随着焙烧温度的升高,溶液中有机物的脱除率和有机物吸附量均呈先增大后减小的趋势。在500~600 ℃范围内,氧化铝粉尘吸附有机物量较大,600 ℃时有机物的脱除率最大,达17.2%,吸附量达到4.1 mg/g。
由图2的XRD谱分析结果可知,在焙烧温度为500 ℃时,其焙烧产物中会残留部分一水软铝石,而当温度为600 ℃时XRD中一水软铝石峰很弱,随着温度的进一步升高,焙烧产物为-Al2O3、-Al2O3、-Al2O3。高温下,氧化铝物相种类减少,结晶度提高,比表面减少,从而降低了氧化铝粉的吸附性能。由以上结果可知,600 ℃下焙烧的氧化铝粉尘对有机物吸附效果最好。

图3 焙烧温度对焙烧氧化铝粉尘吸附腐植酸钠量和脱除率的影响
2.3 碱浓度对焙烧氧化铝粉尘吸附性能的影响
在拜耳法生产氧化铝的过程中,不同工序中溶液的碱浓度不同。本研究中铝酸钠溶液的苛性碱浓度选取为70、150、220 g/L,分别模拟洗液、精制液及循环母液,探究碱浓度对吸附效果的影响,实验结果如图4所示。
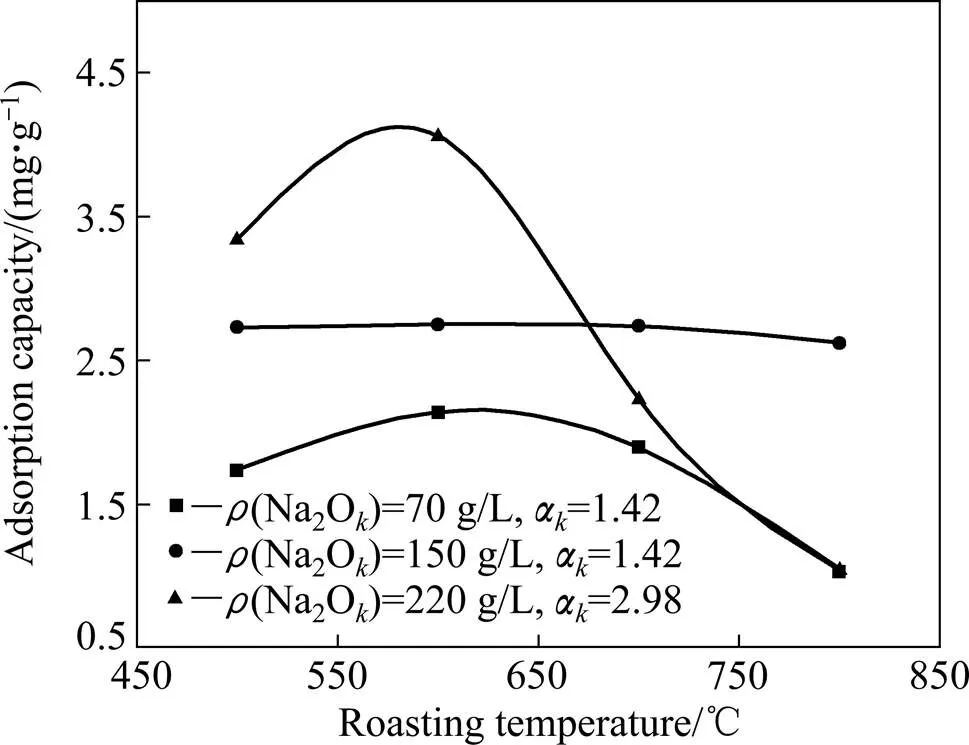
图4 溶液碱浓度对焙烧氧化铝粉尘吸附效果的影响
从图4可以看出,无论当铝酸钠溶液碱浓度是多少,随着焙烧温度的升高,溶液中有机物的吸附量呈先增大后减小的趋势;其中碱浓度为70 g/L和220 g/L时,这种趋势更明显。图中结果还表明:当焙烧温度小于600 ℃时,碱浓度越高,吸附量也越大;当焙烧温度在700~800 ℃时,中等碱浓度溶液中氧化铝粉尘吸附量较大。这说明氧化铝粉尘吸附有机物不仅与氧化铝粉尘性质有关,而且还与溶液中碱浓度有关,这需研究吸附动力学机理才可能明确其中原因。
2.4 时间对焙烧氧化铝粉尘吸附效果的影响
为提高吸附效率,研究了吸附时间对氧化铝吸附有机物效果的影响,以寻求最适宜的吸附时间。实验结果如图5所示。
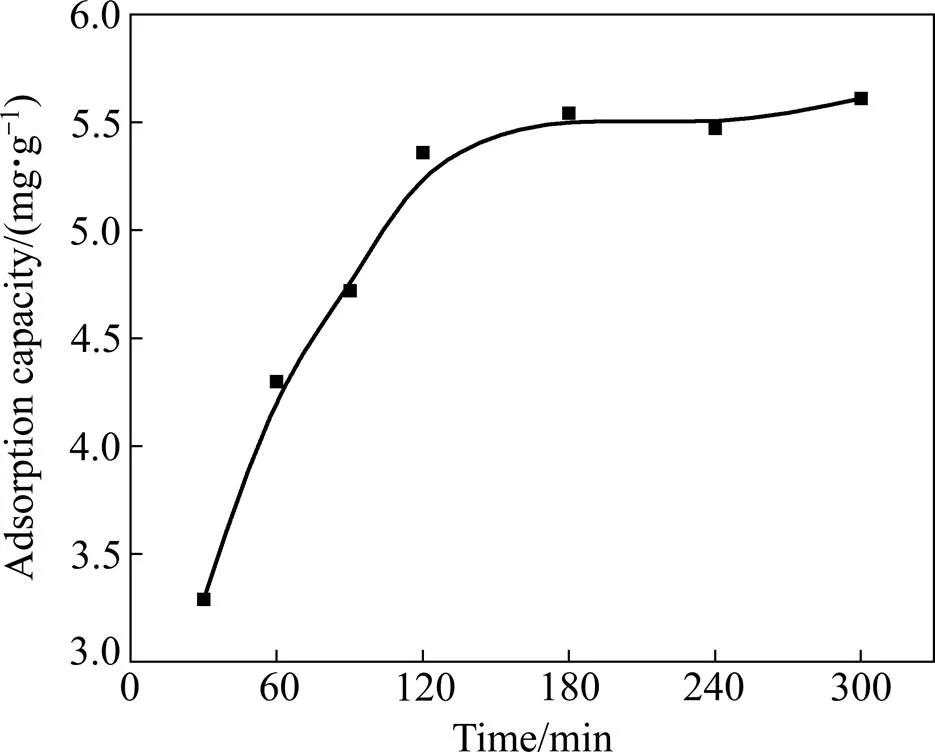
图5 时间对吸附效果的影响
由图5中可知,当吸附时间为30 min时,吸附量为3.29 mg/g;随着吸附时间延长为2 h时,有机物吸附量迅速上升达到5.36 mg/g。这主要是由于物理吸附而快速达到较大的吸附量。当吸附时间超过2 h后,吸附时间继续延长至3 h,吸附量随着吸附时间的延长而缓慢增加。这可能是吸附过程还存在化学作用,也可能因活性中心已覆盖,表面空位较少,而导致吸附速率较小。再延长吸附时间,吸附量趋于不变。因此,考虑效率与经济性,吸附时间2 h为最佳。
2.5 吸附温度对焙烧氧化铝粉尘吸附效果的影响
由以上可知,氧化铝粉尘作吸附剂时可能存物理吸附和化学吸附,而温度是影响物理吸附和化学吸附的主要因素。因此,本文作者采用600 ℃焙烧氧化铝粉尘(15 g/L)吸附溶液中的腐植酸钠,研究吸附温度对氧化铝吸附量的影响,实验结果如图6所示。
由图6可看出,随着吸附温度的升高,有机物吸附量呈现先增大后减小的趋势。当温度在30~45 ℃范围内,有机物吸附量随吸附温度升高而增加;吸附温度为45 ℃时,有机物吸附量达到5.36 mg/g。而当温度大于45 ℃时,吸附温度的升高会显著降低吸附效果。主要原因可能是:在一定温度范围内,物理吸附较快,不受温度影响;化学吸附较慢,随着温度的升高吸附速率加快。因此,由图6中可看出,低温时,可能主要为物理吸附,随着温度升高,物理吸附量减少,化学吸附量增加[16]。故温度在30~45 ℃时,吸附量一直呈现递增趋势;当温度达到45 ℃时,部分已吸附分子的能量达到解吸活化能,开始产生解吸现象,使得总体吸附效果出现下降趋势。综合考虑,吸附最佳温度为45 ℃。
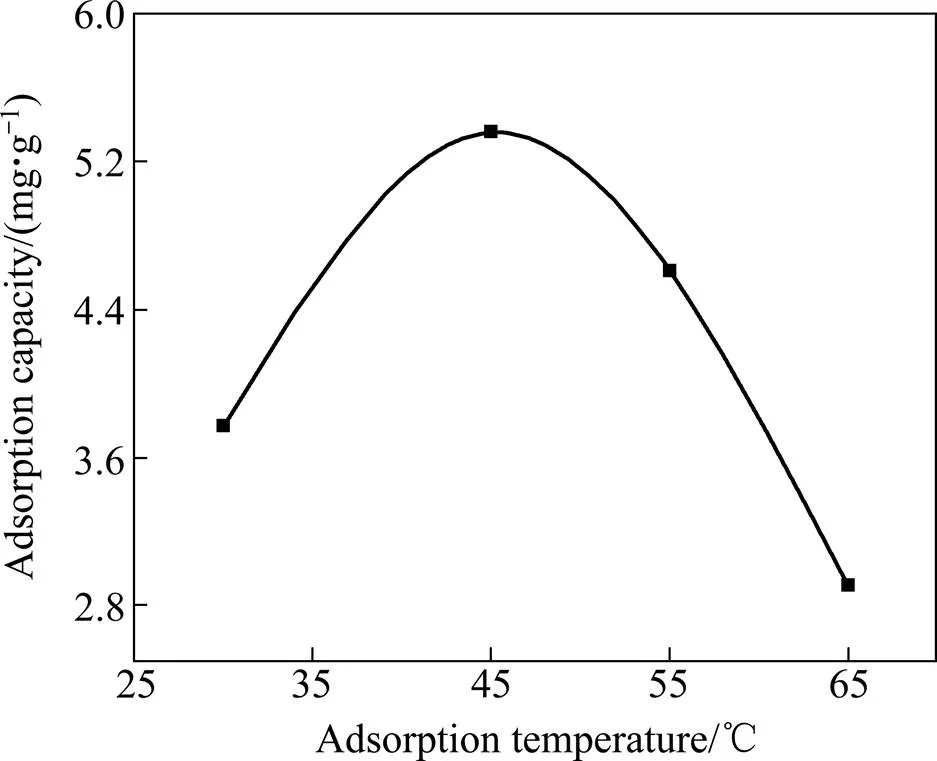
图6 温度对吸附效果的影响
2.6 焙烧氧化铝粉尘吸附有机物的机理
为深入解释各因素对氧化铝粉尘吸附效果的影响规律,本文作者测定了粉尘表面性质、吸附剂吸附前后FTIR变化规律和提出了吸附动力学方程。
2.6.1 焙烧氧化铝粉尘的表面性质

以甘油为测试介质时,500~800 ℃时,焙烧所得氧化铝粉尘的接触角随着焙烧温度的变化呈先增大而后略降低的趋势(见表1),600 ℃时其接触角最大,说明600 ℃焙烧所得氧化铝粉尘的疏水性最强。以二碘甲烷为测试介质时,数值变化规律与甘油测试结果相反,600 ℃时产品的接触角最小,疏水性最强,表面能最低。同时,表面张力中色散力和极性力较大,且色散力大于极性力,表明焙烧氧化铝粉尘吸附有机物最可能是物理吸附,也可以是化学吸附。500~800 ℃时,随着焙烧温度的升高,氧化铝粉尘的极性力与色散力之比(P/D)变化呈先下降后略微升高的趋势,600 ℃时氧化铝粉尘的极性力与色散力之比(P/D)最小为0.45,说明600 ℃时焙烧所得氧化铝粉尘的溶剂化趋势最小,表面极化能力较差。因此,焙烧氧化铝粉尘可能主要通过分子间相互作用(物理作用)吸附有 机物。
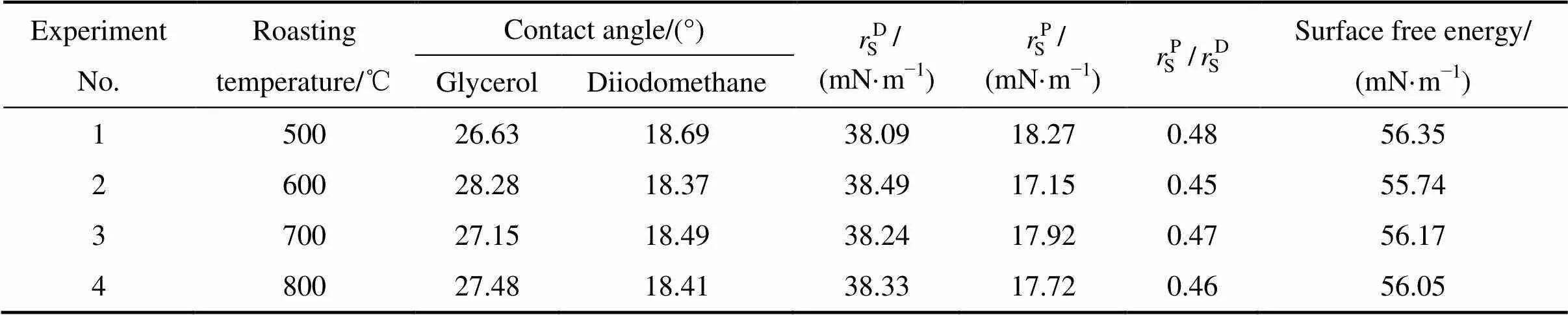
表1 焙烧温度对焙烧氧化铝粉尘的表面性质的影响
Testing temperature is 25 ℃.
2.6.2 吸附前后产物的FTIR
腐植酸钠、焙烧氧化铝粉尘以及吸附有机物后的氧化铝粉尘红外光谱图如图7所示。

图7 氧化铝粉尘吸附前后固相红外光谱
由图7可以看出,曲线b与曲线c相比,1642 cm−1处的特征峰没有发生位移;而曲线a与曲线c相比,在1385 cm−1的吸附峰没有发生位移,该峰是醇(或羧酸)中O—H弯曲振动峰,无新的化学键形成,是物理吸附所致[18];而曲线c在1523 cm−1处有一弱峰,可能是COO—中C=O特征峰,与曲线a在1582 cm−1相比较,波数变化了59 cm−1,形成了化学键,发生了化学吸附。这意味着焙烧氧化铝粉尘主要通过物理吸附吸附腐殖酸盐,也有化学吸附。
2.6.3 吸附动力学
吸附动力学研究可阐明吸附机理,有利于吸附工艺的优化[19]。首先,基于吸附平衡时吸附量e和时刻吸附量q值,以准一级模型ln(e−q)=lne−1进行拟合,ln(e−q)对作图,结果为曲线;若仅对吸附前期30~180 min 的5点进行线性拟合,相关系数2=0.882,不是线性的,说明吸附主要不是扩散步骤控制。然后,以准二级动力学模型/q=1/2e2+/e进行拟合。以/q对作图,各点线性拟合,拟合后相关系数2=0.998,/q=0.16467+3.772(见图8)。初始吸附速率=2e2=3.772。说明上述吸附过程符合二级模型,吸附过程受化学吸附机理的控制,这是吸附量易受温度影响的重要原因,也与FTIR分析结果一致。

图8 焙烧氧化铝粉尘吸附的准二级方程程合结果
再以Weber and Morris模型q=p1/2+分析吸附过程是否属内扩散过程,结果见图9。
图9中的结果表明,各点不呈线性关系,前四点进行拟合,q=0.36631/2+1.3345,相关系数2=0.988。直线都不经过原点,说明内扩散(孔道吸附)不是控制吸附过程的唯一步骤。吸附过程主要是表面吸附,这与氧化铝粉体表面极性力与极性力和色散力之比的变化规律有关。当然,非线性的拟合结果,还可能由于吸附初期和末期物质传递的差异,试验结果往往不能完全符合拟合直线通过原点的理想情况。
为进一步分析可能的吸附形式,对吸附腐植酸钠后的氧化铝粉尘过滤,并用95~98 ℃热水两次洗涤。发现洗涤前后颜色变化显著:氧化铝粉尘在吸附铝酸钠溶液中的腐植酸盐后,其表面呈黄褐色;洗涤后,粉尘颜色也逐渐变白。测定有机碳含量变化,可洗脱其中75%~85%的腐植酸钠。一方面,验证了氧化铝粉尘主要通过物理作用和以表面吸附形式吸附有机物,可通过吸附−洗涤而分离和富集腐植酸钠,方便氧化铝粉尘的再生。另一方面,也证明了少量腐植酸钠是通过化学吸附的方式进行吸附的,可通过低温焙烧再生氧化铝粉尘,并烧掉其中有机物;而该氧化铝粉尘可在高温溶出过程中溶解,因而无废渣排放。总之,上述研究结果为吸附法脱除溶液中有机物和富集有机物新技术开发提供较坚实的基础。
3 结论
1) 氧化铝粉尘在500~800 ℃间焙烧,主要以-Al2O3、-Al2O3、-Al2O3形式存在,结晶度差;600 ℃下焙烧得到的氧化铝粉尘吸附效果最佳。
2) 对于600 ℃下焙烧得到的氧化铝粉尘,随溶液中碱浓度升高,吸附量增多;随时间延长,吸附量先快速增多,然后达到一定量,再延长时间,吸附量不变;在30~65 ℃间吸附有机物时,45 ℃吸附量最大可达5.36 mg/g。
3) 500~800 ℃焙烧氧化铝粉尘中,600 ℃焙烧氧化铝粉尘表面疏水性较强、溶剂化能力较差;吸附过程中主要以物理吸附为主,有化学吸附;吸附与准二级模型吻合,吸附中化学吸附为控制步骤,主要通过表面吸附有机物。通过洗涤或焙烧可再生吸附剂。
[1] POWER G, LOH J. Organic compounds in the processing of lateritic bauxites to alumina: Part 1: Origins and chemistry of organics in the Bayer process[J]. Hydrometallurgy, 2010, 105(1/2): 1−29.
[2] POWER G, LOH J S C, WAJON J E, BUSETTI F, JOLL C. A review of the determination of organic compounds in Bayer process liquors[J]. Analytica Chimica Acta, 2011, 689(1): 8−21.
[3] POWER G, LOH J S C, NIEMELÄ K. Organic compounds in the processing of lateritic bauxites to alumina: Addendum to Part 1: Origins and chemistry of organics in the Bayer process[J]. Hydrometallurgy, 2011, 108(1/2): 149−151.
[4] POWER G, LOH J S C, VERNON C. Organic compounds in the processing of lateritic bauxites to alumina Part 2: Effects of organics in the Bayer process[J]. Hydrometallurgy, 2012, 127/128(18): 125−149.
[5] BUSETTI F, BERWICK L, MCDONALD S, HETTZ A, JOLL C A, LOH J, POWER G. Physicochemical characterization of organic matter in bayer liquor[J]. Industrial & Engineering Chemistry Research, 2014, 53(15): 459−462.
[6] BROWN N. Process for the production of aluminum hydroxide of improved whiteness: US, US6827923[P]. 2004−12−07.
[7] WHELAN T J, ELLIS A, KANNANGARA G S K, MARSHALL C P, SMEULDERS D, WILSON M A. Macromolecules in the Bayer process[J]. Reviews in Chemical Engineering, 2003, 19(5): 431−472.
[8] MARCIANO S, MUGNIER N, CLERIN P, CRUSTOL B, MOULIN P. Nanofiltration of Bayer process solutions[J]. Journal of Membrane Science, 2006, 281(1/2): 260−267.
[9] RUDOLF J. Process to remove organic impurities from Bayer process liquor using ozone: US, US 20030161769 A1[P]. 2003−01−14.
[10] BROWN N. Method for removing sodium oxalate from caustic aluminate liquors: US, US 4999170 A[P]. 1991−03−12.
[11] ARNSWALD W, KALTENBERG H G, GUHL E. Removal of organic carbon from bayer liquor by wet oxidation in tube digesters[M]//Berlin: Springer Cham, 2016: 127−154.
[12] WILLIAMS F S, PERROTTA A J. Adsorbent combinations for enhanced removal of sodium oxalate from bayer process spent liquor: US, US5728180[P]. 1998−03−17.
[13] 郭 瑾, 马 军, 刘 嵩, 江 进. 天然有机物在氧化铝表面的吸附机理研究[J]. 环境科学学报, 2006, 26(1): 111−117. GUO Jin, MA Jun, LIU Song, JIANG Jin. Adsorption mechanisms of NOM onto the surface of alumina[J]. Acta Scientiae Circumstantiae, 2006, 26(1):111−117.
[14] 闫翔云, 季洪海, 程福礼, 凌凤香. 焙烧温度对Al2O3微观结构和表面酸性的影响[J]. 石油炼制与化工, 2011, 42(11): 41−45. YAN Xiang-yun, JI Hong-hai, CHENG Fu-li, LING Feng-xiang. Effect of calcination temperature on the microstructure and surface acidity of alumina[J]. Petroleum Processing and Petrochemicals, 2011, 42(11): 41−45.
[15] 李小斌, 赵东峰, 章 宣, 刘桂华, 彭志宏, 周秋生. 赤泥主要物相的表面性质对其沉降性能的影响[J]. 中国有色金属学报, 2012, 22(1): 281−286. LI Xiao-bin, ZHAO Dong-feng, ZHANG Xuan, LIU Gui-hua, PENG Zhi-hong, ZHOU Qiu-sheng. Effect of surface property of main minerals in red mud on their sedimentation ability[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(1): 281−286.
[16] ABDELWAHAB N A, AL-ASHKAR E A, EL-GHAFFAR M A A. Preparation and characterization of eco-friendly poly(p-phenylenediamine) and its composite with chitosan for removal of copper ions from aqueous solutions[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(11): 3808−3819.
[17] 刘桂华, 刘 鹏, 周秋生, 齐天贵, 吴海文, 彭志宏, 李小斌. 一水硬铝石溶出预热套管结疤组成与表面性质间的关系[J]. 中国有色金属学报, 2016, 26(5): 1143−1150. LIU Gui-hua, LIU Peng, ZHOU Qiu-sheng, QI Tian-gui, WU Han-wen, PENG Zhi-hong, LI Xiao-bin. Relationship between composition of scale in pipe and surface property in preheating diasporic slurry process[J]. The Chinese Journal of Nonferrous Metals, 2016, 26(5): 1143−1150.
[18] 李 丽, 冉 勇, 傅家谟, 盛国英, 彭平安. 超滤分级研究腐殖酸的结构组成[J]. 地球化学, 2004, 33(4): 387−394. LI Li, RAN Yong, FU Jia-mo, SHENG Guo-ying, PENG Ping-an. Structural compositions of humic acids fractionated by tangential flow filtration[J]. Geochimica, 2004, 33(4): 387−394.
[19] LAN Li-hong, CHEN Jian-hua, LI Yu-qiong, YANG Zhuo, AI Guang-yong. Microthermokinetic study of xanthate adsorption on impurity-doped galena[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(1): 272−281.
(编辑 李艳红)
Removal of sodium humate from sodium aluminate solution byadsorption with alumina dust
LIU Gui-hua, CHEN Bin-bin, QI Tian-gui, ZHOU Qiu-sheng, PENG Zhi-hong, LI Xiao-bin, DONG Wen-bo
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
The removal of organics from sodium aluminate solution will significantly improve alumina quality and production efficiency. The removal of sodium humate with alumina dust was investigated by detecting total organic carbon, contact angle and analysis of X-ray diffraction and infrared spectra. The results show that roasted alumina dust is in poor crystallization in the range of 500~800 ℃ for 0.5 h. The alumina dust roasted at 600 ℃ performs the greatest adsorption capacity and adsorption rate. Moreover, the concentration of alkali soda and duration have remarkable effect on removal in sodium humate. A maximum adsorption capacity can be found at 45 ℃ within temperature range of 30~65 ℃. The results also indicate that alumina dust roasted at 600 ℃ is more hydrophobic and more difficult to be solvation relative to alumina dust roasted at 500, 700 and 800 ℃. The physisorption is predominant in addition to some occurrence of chemisorption. The adsorption kinetics mechanism satisfies second order equation, the adsorption is controlled by chemisorption and mainly occurs in the form of surface adsorption. All results provide an economical method for separation and richness of sodium humate from sodium aluminate solution.
alumina dust; roasting; sodium aluminate solution; sodium humate; adsorption
Project(51274242) supported by the National Natural Science Foundation of China; Project (2015CX001) supported by Innovation-driven Plan in Central South University, China
2016-10-12;
2017-04-06
LIU Gui-hua; Tel: +86-731-88830453; E-mail: liugh303@csu.edu.cn
10.19476/j.ysxb.1004.0609.2017.11.22
1004-0609(2017)-11-2356-07
TQ424.27
A
国家自然科学基金资助项目(51274242);中南大学创新驱动计划(2015CX001)
2016-10-12;
2017-04-06
刘桂华,教授,博士;电话:0731-88830453;E-mail:liugh303@csu.edu.cn
