白细胞介素-6/信号转导和转录激活因子3信号通路在大细胞肺癌NL9980细胞系增殖中的作用及机制
2017-12-20徐岩岩钟殿胜
于 涛,徐岩岩,宫 婷,邵 宜,刘 刚,钟殿胜
1.天津医科大学总医院肿瘤内科,天津300052;
2.天津医科大学总医院普通外科,天津300052
白细胞介素-6/信号转导和转录激活因子3信号通路在大细胞肺癌NL9980细胞系增殖中的作用及机制
于 涛1,徐岩岩2,宫 婷1,邵 宜1,刘 刚2,钟殿胜1
1.天津医科大学总医院肿瘤内科,天津300052;
2.天津医科大学总医院普通外科,天津300052
背景与目的:白细胞介素-6/信号转导和转录激活因子3(IL-6/STAT3)信号通路在很多恶性肿瘤中存在过度激活及表达,包括白血病、头颈部鳞状细胞癌多发性黑色素瘤、乳腺癌以及前列腺癌等,但其在大细胞肺癌中的研究少见。该研究旨在探索大细胞肺癌NL9980细胞系中IL-6/STAT3信号通路在细胞增殖中的作用及其机制。方法:将外源性IL-6设立5个浓度梯度(终浓度分别为0、1.0、5.0、10.0和20.0 ng/mL),分别对NL9980细胞系进行干预。运用噻唑蓝(MTT)法观察细胞增殖活力改变,并确立IL-6干预的最佳浓度。采用RT-PCR技术检测IL-6/STAT3相关基因及其下游调控基因Bcl-2、VEGF和CYCD1的mRNA表达量,并将IL-6/STAT3相关基因与下游基因做相关性分析。结果:外源性IL-6可促进NL9980细胞系的增殖,其最佳干预浓度为5 ng/mL(F=8.11,P<0.05)。信号通路相关基因IL-6及STAT3的mRNA表达量均以5 ng/mL组最高,分别为4.78±0.09和5.17±0.05(P<0.05);下游调控基因中,Bcl-2、VEGF及CYCD1的mRNA表达量均在5 ng/mL组最高,分别为4.52±0.14、4.12±0.12和3.98±0.17,其余浓度组与对照组相比,差异无统计学意义(P>0.05)。相关性分析表明,下游基因中Bcl-2、VEGF、CYCD1与IL-6(r=0.952,r=0.836,r=0.880)和STAT3(r=0.995,r=0.746,r=0.800)呈正相关性。结论:IL-6可促进大细胞肺癌NL9980细胞系的增殖,其机制可能是通过活化IL-6/STAT3信号通路并上调相关基因Bcl-2、VEGF和CYCD1的表达来实现的。
白细胞介素-6;信号转导和转录激活因子3;大细胞肺癌;机制
白细胞介素(interleukin,IL)-6可激活包括信号转导和转录激活因子3(signal transducers and activators of transcription 3,STAT3)信号通路[1]在内的多种信号通路,与肿瘤形成密切相关。STAT3是参与细胞生长、恶性转化、凋亡等重要生理病理过程的重要调节因子[2]。有研究认为,IL-6介导STAT3的持续激活与肿瘤血管生成、免疫抑制及肿瘤的侵袭和转移有关,并通过多途径影响肿瘤的发生、发展及形成[3]。己证实在多种人及鼠的恶性肿瘤中有STAT3的过度激活及表达,其中包括白血病、多发性骨髓瘤、头颈部鳞状细胞癌、多发性黑色素瘤、乳腺癌以及前列腺癌等。但目前IL-6/STAT3信号通路在大细胞肺癌中的研究报道鲜见。本研究通过外源性IL-6激活大细胞肺癌NL9980细胞系中的IL-6/STAT3信号通路,检测细胞中IL-6/STAT3信号通路相关基因及其下游调控基因的表达情况,探索IL-6/STAT3信号通路在大细胞肺癌发生、发展中的作用及其机制。
1 材料和方法
1.1 主要仪器和试剂
RPMI-1640培养基购自美国Gibco公司;细胞培养箱(HEPA class 100)购自美国ThermoForma公司;96孔板购自丹麦Corning公司;倒置相差显微镜(TS100)购自日本Nikon公司;空气摇床(420)购自美国Thermo Forma公司;全波长荧光酶标仪购自美国Molecular Devices公司;人重组IL-6细胞因子购自美国Peprotech公司;MTT购自美国Sigma公司;DMSO为国产分析纯,购自德州市富凯化工有限责任公司;DEPC购自美国BBI公司;总RNA提取试剂TRIzol Reagent购自美国Invitrogen公司;IL-6、STAT3、Bax和Bcl-2等实时定量聚合酶链反应(real-time polymerase chain reaction,RT-PCR)引物均由北京赛百盛基因技术有限公司合成;SYBR GREEN PCR Master Mix购自美国ABI公司。
1.2 细胞培养
人类大细胞肺癌细胞系NL9980由天津市肺癌转移与肿瘤微环境重点实验提供。所有细胞均用含10%小牛血清,l00 U/mL青霉素,1×10-4g/mL链霉素的RPMI-1640培养基在37 ℃、CO2体积分数为5%、饱和湿度的温箱中培养。细胞生长至对数生长期时及时传代。
1.3 噻唑蓝(MTT)检测细胞生殖活力
收集对数期细胞并调整细胞悬液浓度,取96孔板,每孔加入180 μL细胞悬液铺板,使得待测细胞密度至l×104个/mL,同时设置调零孔(仅含RPMI-1640培养基)。培养24 h后细胞贴壁,加入IL-6溶液,终浓度为0、1、5、10和20 µmol/L。每个浓度设5个复孔。置于37 ℃,CO2体积分数为5%的培养箱中培养72 h,倒置显微镜下观察IL-6的作用效果。每孔加入5 mg/mL的MTT 20 μL继续培养4 h,终止培养,小心吸去孔内培养液。每孔加入180 μL DMSO,置摇床上低速振荡10 min,使得结晶物充分溶解,用酶标仪检测各孔590 nm处的吸光度(D)值。
1.4 RT-PCR法检测IL-6、STAT3及Bcl-2、VEGF、CYCD1基因的mRNA表达
按照TRIzol说明书进行组织总RNA提取。根据在260 nm和280 nm处的D检测RNA的纯度,纯RNA的D260nm/D280nm比值应接近2.0(比值理想范围在1.6~2.1之间)。采用反转录法得到cDNA。采用Primer 5软件设计引物序列,引物均由北京赛百盛基因技术有限公司合成(表1)。按照SYBR GREEN PCR Master Mix试剂盒说明书,设置反应条件如下:50 ℃ 2 min(激活UDG酶,降解dUTP),共1个循环;95 ℃ 10 min(灭活UDG酶),共1个循环;95 ℃(变性、解链)15 s 60 ℃ 1 min(退火、延伸),共40个循环。对RT-PCR产物进行凝胶电泳,使用凝胶分析软件对电泳条带进行扫描成像。收集数据,采用ΔΔCt值比较法进行相对定量,ΔΔCt=[Ct目的基因(未知样品)-Ct PGK-1(未知样品)]-[Ct目的基因(校正样品)-Ct PGK-1 (校正样品)],平均相对含量=2–ΔΔCt×100%。

表 1 引物序列表Tab. 1 The primer sequences
1.5 统计学处理
2 结 果
2.1 不同浓度IL-6对NL9980细胞增殖活力的影响
MTT检测结果显示,各浓度值的外源性IL-6均对细胞有促增殖作用,其中最佳增殖浓度为5 ng/mL,促进率最大,此时D值最高为1.29±0.19 (F=8.11,P<0.05),继续增加IL-6浓度值,促进率并不随其浓度增加而升高(图1)。
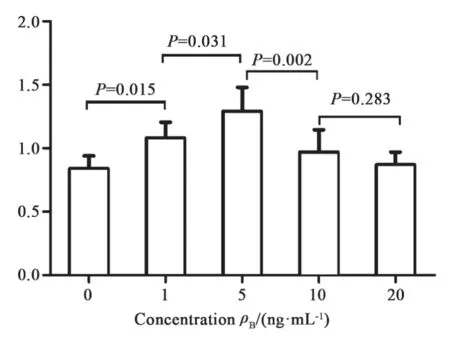
图 1 MTT法检测IL-6干预后细胞增殖力比较Fig. 1 Comparison of MTT assay for cell proliferation after IL-6 intervention
2.2 IL-6/STAT3信号通路相关基因表达
不同浓度IL-6干预细胞系后,内源性IL-6 mRNA的表达量分别为1.00±0.00、0.72±0.04、4.78±0.09、1.90±0.03和2.60±0.09,其中干预浓度为5 ng/mL时细胞系中内源性IL-6表达水平最高,与其他各处理组间差异有统计学意义(P<0.05);与之相对应的STAT3 mRNA表达量分别为1.00±0.00、1.01±0.08、5.17±0.05、1.17±0.07和0.87±0.07,以5 ng/mL干预时表达量最高,与其余各处理组之间差异有统计学意义(P<0.05),而其余各处理组之间差异均无统计学意义(P>0.05,图2)。
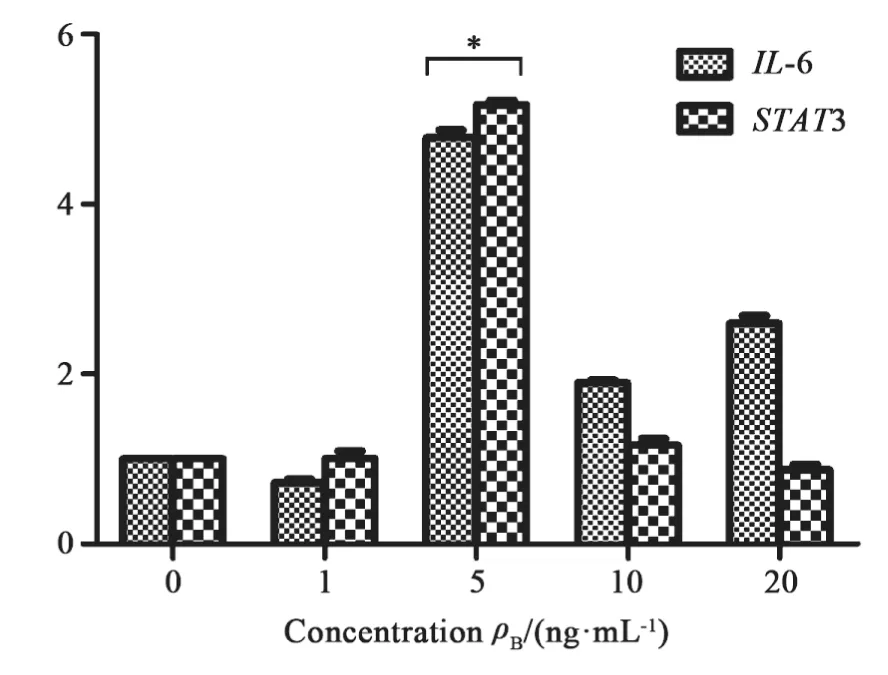
图 2 IL-6/STAT3信号通路相关基因表达Fig. 2 The related gene expression of IL-6/STAT3 signaling pathway
2.3 IL-6/STAT3信号通路下游调控基因表达情况及差异
RT-PCR结果显示,当IL-6干预浓度为5 ng/ mL时,IL-6/STAT3信号通路下游调控基因Bcl-2、VEGF及CYCD1的mRNA相对表达量均为最高峰值,分别为4.52±0.14、4.12±0.12和3.98±0.17,与各自组内对比差异有统计学意义(P<0.05),其余浓度组变化不显著(图3)。Bcl-2相对表达量在1和10 ng/mL组间差异无统计学意义(P>0.05),其余各组间差异均有统计学意义(P<0.05);VEGF表达量在对照组与1 ng/mL组间差异无统计学意义(P>0.05),其余各组间差异均有统计学意义(P<0.05);CYCD1表达量在5 ng/mL处理组与其他各组差异均有统计学意义,其余组间差异均无统计学意义(P>0.05)。

图 3 IL-6/STAT3信号通路下游调控基因相对表达量Fig. 3 The expression of downstream regulated genes in IL-6/STAT3 signaling pathway
2.4 信号通路基因与下游调控基因相关性分析
随着外源性IL-6干预浓度增高,下游基因表达水平随之升上。相关性分析表明,内源性IL-6与下游基因Bcl-2、VEGF和CYCD1之间存在正相关性(r=0.952,r=0.836,r=0.880),STAT3与下游基因Bcl-2、VEGF和CYCD1之间存在正相关性(r=0.995,r=0.746,r=0.800;表2)。

表 2 不同浓度IL-6处理NL9980细胞系后信号通路及调控基因间相关性分析Tab. 2 Correlation analysis of signaling pathway and regulatory genes in NL9980 cells treated with different concentrations of IL-6
3 讨 论
IL-6/STAT3信号通路在恶性胶质瘤、乳腺癌、前列腺癌等肿瘤的进展中起着活化作用[4-5]。有研究显示,STAT3在恶性肿瘤中是一种重要的调节递质,在22%~65%非小细胞肺癌中存在激活[6]。Juan等[7]在有关非小细胞肺癌的研究中发现,IL-6/STAT3信号通路的持续激活及其与NOX4/AKT等通路的交叉作用使其下游调控的靶基因表达增加,从而促进肿瘤细胞的增殖。
本研究结果显示,不同浓度的IL-6干预大细胞肺癌的细胞系,均可促进癌细胞的增殖,但以中间浓度组反应最显著,原因在于IL-6/STAT3信号通路是以IL-6与IL-6R的结合作为通路活化的始动因素,类似于抗原抗体复合物的结合,只有抗原抗体比例适合时,才能达到最高效率的结合效果。
Bcl-2基因是凋亡/抗凋亡家族中的一员,在调节细胞周期循环过程中起着重要作用[8],可阻断多种原因导致的细胞凋亡过程,影响细胞的生存,促进肿瘤细胞的增殖[9]。本研究发现,在外源性IL-6刺激下,IL-6/STAT3通路上调下游基因Bcl-2表达,Bcl-2 mRNA表达明显增加,NL9980细胞系表现为抑制细胞凋亡从而加速增殖。
研究显示STAT3在VEGF基因启动子区有结合位点,持续激活STAT3能诱导VEGF表达,导致肿瘤新生血管形成[10-11]。Yeh等[12]关于非腺癌细胞系的研究表明IL-6可介导STAT3活化,并上调VEGF基因的表达。本研究同样得到了类似结论,即外源性IL-6介导大细胞肺癌NL9980细胞系IL-6/STAT3通路活化,可促进其下游VEGF表达的上调。
Ting等[13]针对非小细胞肺癌的研究显示STAT3与CYCD1存在显著正相关,且此通路激活有助于癌变的发生。Bromberg等[14]在研究STAT3的过程中,通过点突变技术合成一种特殊的STAT3-C(持续激活的STAT3分子)并发现在表达STAT3-C的细胞中,CYCD1蛋白表达也升高。本研究同样证实CYCD1表达的增加可正向调控细胞周期,促进肿瘤细胞增殖。
本研究结果表明,IL-6可促进大细胞肺癌NL9980细胞系的增殖,其机制可能是活化IL-6/STAT3信号通路并上调相关基因Bcl-2、VEGF和CYCD1的表达来实现。针对该信号通路的靶向治疗,可能对大细胞肺癌起到积极的治疗作用,达到稳定、部分缓解乃至更加理想的治疗效果,从而为肿瘤降期后的外科手术治疗提供机会,改善大细胞肺癌综合治疗的效果和预后。
[1] KIM B G, YOO J Y, KIM T H, et al. Aberrant activation of signal transducer and activator of transcription-3 (STAT3)signaling in endometriosis[J]. Hum Reprod, 2015, 30(5):1069-1078.
[2] REAL P J, SIERRA A, DE JUAN A, et al. Resistance to chemotherapy via Stat3-dependent overexpression of Bcl-2 in metastatic breast cancer cells[J]. Oncogene, 2002, 21(50):7611-7618.
[3] NISHIHARA M, OGURA H, UEDA N, et al. IL-6-gp130-STAT3 in T cells directs the development of IL-17+ Th with a minimum effect on that of Treg in the steady state[J]. Int Immunol, 2007, 19(6): 695-702.
[4] LESINA M, KURKOWSKI M U, LUDES K, et al. Stat3/Socs3 activation by IL-6 transsignaling promotes progression of pancreatic intraepithelial neoplasia and development of pancreatic cancer[J]. Cancer Cell, 2011, 19(4): 456-469.
[5] PILATI C, ZUCMAN-ROSSI J. Mutations leading to constitutive active gp130/JAK1/STAT3 pathway[J].Cytokine Growth Factor Rev, 2015, 26(5): 499-506.
[6] JIANG R, JIN Z, LIU Z, et al. Correlation of activated STAT3 expression with clinicopathologic features in lung adenocarcinoma and squamous cell carcinoma[J]. Mol Diagn Ther, 2011, 15(6): 347-352.
[7] LI J, LAN T, ZHANG C, et al. Reciprocal activation between IL-6/STAT3 and NOX4/Akt signalings promotes proliferation and survival of non-small cell lung cancer cells[J].Oncotarget, 2015, 6(2): 1031-1048.
[8] DUAN Z, FOSTER R, BELL D A, et al. Signal transducers and activators of transcription 3 pathway activation in drugresistant ovarian cancer[J]. Clin Cancer Res, 2006, 12(17):5055-5063.
[9] SUZUKI M, SHIRAHA H, FUJIKAWA T, et al. Des-gammacarboxy prothrombin is a potential autologous growth factor for hepatocellular carcinoma[J]. J Biol Chem, 2005, 280(8):6409-6415.
[10] CARBAJO-PESCADOR S, ORDONEZ R, BENET M, et al.Inhibition of VEGF expression through blockade of Hif1alpha and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells[J]. Br J Cancer,2013, 109(1): 83-91.
[11] ZHAO D, PAN C, SUN J, et al. VEGF drives cancer-initiating stem cells through VEGFR-2/Stat3 signaling to upregulate Myc and Sox2[J]. Oncogene, 2015, 34(24): 3107-3119.
[12] YEH H H, LAI W W, CHEN H H, et al. Autocrine IL-6-induced Stat3 activation contributes to the pathogenesis of lung adenocarcinoma and malignant pleural effusion[J].Oncogene, 2006, 25(31): 4300-4309.
[13] AI T, WANG Z, ZHANG M, et al. Expression and prognostic relevance of STAT3 and cyclin D1 in non-small cell lung cancer[J]. Int J Biol Markers, 2012, 27(2): e132-e138.
[14] BROMBERG J, CHEN X. STAT proteins: signal tranducers and activators of transcription[J]. Methods Enzymol, 2001,333: 138-151.
Effects and mechanisms of IL-6/STAT3 signaling pathway in large cell lung cancer NL9980 cell lines
YU Tao1, XU Yanyan2, GONG Ting1, SHAO Yi1, LIU Gang2, ZHONG Diansheng1(1. Department of Oncology, Tianjin Medical University General Hospital, Tianjin 300052, China; 2. Department of General Surgery, Tianjin Medical University General Hospital, Tianjin 300052, China)
ZHONG Diansheng E-mail: landmark1059@163.com
Background and purpose:Interleukin-6/signal transducer and activator of transcription 3 (IL-6/STAT3) pathway is overactivated and overexpressed in many malignant tumors, including leukemia, head and neck squamous cell carcinoma, multiple melanoma, breast cancer, and prostate cancer. However, it is rare in the study of large cell lung cancer. The aim of this study was to investigate the effects and mechanisms of IL-6/STAT3 signaling pathway related genes and the downstream genes in large cell lung cancer NL9980 cell lines.Methods:Various concentrations of IL-6 were administered to 5 groups of NL9980 cell lines respectively (0, 1.0, 5.0, 10.0 and 20.0 ng/mL). The changes of proliferation of the NL9980 cell lines were detected by methylthiazol tetrazolium (MTT) assay. Real-time PCR was used to detect mRNA expression changes of the IL-6/STAT3 pathway related genes (including IL-6 and STAT3 genes) and the downstream genes Bcl-2, VEGF, CYCD1. Correlation test with IL-6/STAT3 was done.Results:IL-6 could promote the proliferation of NL9980 cells lines, and the optimal concentration was 5 ng/mL (F=8.11, P<0.05).Various concentrations of IL-6 were administered to NL9980 cell lines. Expressions of IL-6 and STAT3 genes showed obvious increases (4.78±0.09, 5.17±0.05, P<0.05), and the peak level was found in the 5 ng/mL group. The downstream genes Bcl-2, VEGF, CYCD1 also showed obvious increases (4.52±0.14, 4.12±0.12, 3.98±0.17), the peak level was found in the 5 ng/mL group, and other groups did not change signif i cantly (P>0.05). Correlation test showed Bcl-2,VEGF, CYCD1 genes were correlated with IL-6 (r=0.952, r=0.836, r=0.880) and STAT3 (r=0.995, r=0.746, r=0.800)positively.Conclusion:IL-6 could promote the apoptosis of NL9980 cells via activating IL-6/STAT3 signaling pathway and upregulating the downstream genes Bcl-2, VEGF, CYCD1.
Interleukin-6; STAT3; Large cell lung cancer; Mechanism
10.19401/j.cnki.1007-3639.2017.10.002
R734.2
A
1007-3639(2017)10-0770-05
钟殿胜 E-mail:landmark1059@163.com
2017-04-02
2017-07-30)
