非特异性精神发育迟滞患者外周血miRNA的差异表达及临床诊断价值
2017-12-20吕珍苏陆如平盛嘉玲
闫 妍 高 慧 吕珍苏 陆如平 盛嘉玲
中国.上海市民政第一精神卫生中心 201105 E-mail:yanyan19820407@163.com
非特异性精神发育迟滞患者外周血miRNA的差异表达及临床诊断价值
闫 妍 高 慧 吕珍苏 陆如平 盛嘉玲
中国.上海市民政第一精神卫生中心 201105 E-mail:yanyan19820407@163.com
目的:研究非特异性精神发育迟滞患者外周血miRNA的差异表达及其诊断价值。方法:检索国内外文献筛选与非特异性精神发育迟滞相关的10种miRNA,按照病历号随机选取30例非特异性精神发育迟滞患者作为病例组,同时按照体检号入组30例身心健康者作为对照组,入组后抽取静脉血5ml,运用实时荧光定量PCR技术检测病例组和对照成员10种miRNAs的表达水平。结果:①病例组与对照组比较年龄、性别、城乡、独生子女无统计学差异(P>0.05);②病例组与对照组比较miRNA-125b、miRNA-132、miRNA-222、miRNA-223和miRNA-363表达水平有统计学差异(P<0.05);③ROC分析发现,miRNA-222(AUC=0.786,P=0.043)、miRNA-223(AUC=0.833,P=0.008)对特异性精神发育迟滞有一定的诊断价值。结论:miRNA-222和miRNA-223的异常表达对非特异性精神发育迟滞有一定的诊断作用,可能与非特异性精神发育迟滞的发病机制有明显关联。
非特异性精神发育迟滞;微小RNA;实时荧光定量PCR;外周血
精神发育迟滞按照临床特征可分为非特异性精神发育迟滞(non—specific MR,NSMR)和智力低下伴有畸形(Specific MR,SMR)这两大类。SMR患者智力低下与畸形有明显关联,NSMR只是智力低下,不伴有畸形,目前确切的病因不明。目前认为,NSMR病因复杂,与环境和遗传基因有明显关联,其中遗传是最主要的因素[1-2]。MiRNA属于内源性非编码RNA家族。约21~25个核苷酸长度,其基因转录初级产物(pri-miRNA)在核内被RNaseⅢ内切酶家族的Drosha酶切割成约70nt的发夹状前体(pre-miRNA),转运出核后。又被Droer酶切割成约22nt的miRNA,形成成熟miRNA。MiRNA具有较强的发育时序特异性[3]和组织特异性[4],在精神疾病的发生发展过程中起着重要的作用[5]。本研究选取30例非特异性精神发育迟滞患者和30例健康对照者进行研究,分析miRNA在非特异性精神发育迟滞患者外周血中的差异表达,并进一步分析差异表达的miRNA对非特异性精神发育迟滞的诊断价值,以期为非特异性精神发育迟滞的研究提供参考。
1 对象与方法
1.1 对象
1.1.1 病例组 为2011年9月-2012年10月确诊为非特异性精神发育迟滞的患者,符合以下入组标准和排除标准。入组标准:由两名精神学专家及心理学专家等组成的小组进行病例讨论,精神发育迟滞的诊断要求符合ICD-10诊断标准,同时IQ小于60分。排除标准:①存在明确围生期脑损伤史;②存在明确脑缺氧、缺血、中枢神经系统感染及头颅外伤等病史;③染色体核型存在异常;④经体检、生化代谢及头颅影像学检查等发现已知遗传代谢性疾病及遗传眭神经变性疾病线索;⑤男性患儿存在脆性x综合征的典型临床表现;⑥母孕期间存在明确酗酒、吸毒等不良嗜好病史;⑦合并其他精神疾病;⑧合并其他重大躯体疾病。按照上述入组标准和排除标准入组非特异性精神发育迟滞30例。
1.1.2 对照组 为当地医院体检证实为身心健康的人员。入组30例,均为汉族。
本研究获得本院医学伦理委员会批准,所有受试者或受试家属(监护人)均签署知情同意书。
1.2 方法
1.2.1 总RNA的提取及逆转录 收集2 ml病人全血,放入抗凝管中。按照1:1比例,将血液缓慢加入Ficoll分离液中,2000rpm离心20min,收集单核细胞层。用PBS清洗单核细胞两遍,加入1ml Trizol,用移液器吸打几次。Trizol的用量应根据培养板面积而定,不取决于细胞数。Trizol加量不足可能导致提取的RNA有DNA污染。将匀浆样品在室温(15~30℃)放置5分钟,使核酸蛋白复合物完全分离。每使用1ml Trizol加入0.2ml氯仿,剧烈振荡15秒,室温放置5分钟。2~8℃13000×g离心15分钟。样品分为3层:底层为黄色有机相,上层为无色水相和一个中间层。RNA主要在水相中,水相体积约为所用Trizol试剂的60%。把水相转移到新管中,如要分离DNA和蛋白质可保留有机相,进一步操作见后。用异丙醇沉淀水相中的RNA。每使用1m L Trizol加入0.5ml异丙醇,室温放置10分钟。2~8℃13000×g离心10分钟,离心前看不出RNA沉淀,离心后在管侧和管底出现胶状沉淀。移去上清。用100%乙醇洗涤RNA沉淀。每使用1ml Trizol至少加1ml 100%乙醇。2~8℃不超过7500×g离心5分钟,弃上清。室温放置干燥或真空抽干RNA沉淀,大约晾5~10分钟即可,不要真空离心干燥,过于干燥会导致RNA的溶解性大大降低。加入25~200μl无RNase的水或0.5%SDS,用枪头吸打几次,55~60℃放置10分钟使RNA溶解.如RNA用于酶切反应,勿使用SDS溶液。RNA也可用100%的去离子甲酰胺溶解, -70℃保存。取1μl RNA加入99μl dd H2O中,测定A260和A280处的吸光光度值,A260/A280必须介于1.9~2.0之间才可以进行逆转录。
1.2.2 实时定量PCR验证筛选的miRNA 使用TaqmanmiRNAPCRAssays进行miRNA反转录和荧光定量PCR检测,具体操作按照试剂盒说明书进行,检测仪器为ABI 7900 HT荧光定量PCR仪,荧光定量PCR反应条件为:95℃10 min,然后95℃15 S、60℃1 min,40个循环。
1.3 统计处理
全部数据使用SPSS 20.0、MedCalc12.70统计软件进行统计分析和作图。以miRNA与内参U6之间阈值环(threshold cycle,Ct)之差计算ΔCT值,作为统计分析的指标。对照和病例组一般情况除年龄采用独立样本t检验外,其它变量采用卡方检验;病例组和对照组miRNA表达水平的比较采用独立样本秩和检验,对差异表达的miRNA进一步构建ROC曲线,分析其对特异性精神发育迟滞的诊断价值。所有统计分析均为双侧显著性检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 病例组与对照组一般情况的描述和比较
采用独立样本t检验比较病例组和对照组年龄,结果表明,病例组和对照组的年龄无统计学差异(t=0.279,P=0.782);运用卡方分析比较病例组和对照组性别、城乡、独生子女的分布,结果表明,病例组和对照组的性别、城乡、独生子女分布无统计学差异(P>0.05)。
表1 病例组和对照组一般情况比较(±s,n)
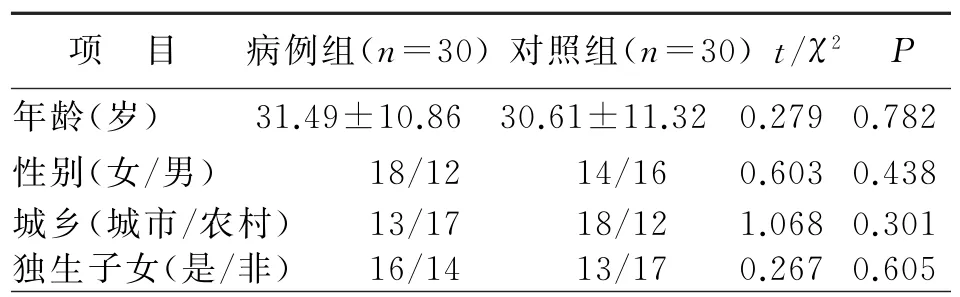
表1 病例组和对照组一般情况比较(±s,n)
项 目 病例组(n=30)对照组(n=30)t/χ2P年龄(岁) 31.49±10.86 30.61±11.32 0.279 0.782性别(女/男) 18/12 14/16 0.603 0.438城乡(城市/农村) 13/17 18/12 1.068 0.301独生子女(是/非) 16/14 13/17 0.267 0.605
2.2 特异性精神发育迟滞患者与正常人的miRNA表达水平比较
对筛选出的10种miRNA,采用两独立样本的秩和检验分析其在病例组和对照组间的差异,表2表明,miRNA-125b、miRNA-132、miRNA-222、miRNA-223和miRNA-363的表达有统计学差异(P<0.05),miRNA-1、miRNA-1207-5p、miRNA-1228-5p、miRNA-3141、miRNA-4507的表达无统计学差异(P>0.05)。
2.3 差异表达的miRNA对非特异性精神发育迟滞的预测价值
分别以非特异性精神发育迟滞患者外周血中差异表达的miRNA-125b、miRNA-132、miRNA-222、miRNA-223和miRNA-363为检测变量,试验分组为状态变量(对照组为0,病例组为1),构建ROC曲线,见表3和图1。miRNA-222和miRNA-223对非特异性精神发育迟滞有一定的诊断价值(P<0.05),miRNA-125b、miRNA-132和miRNA-363对非特异性精神发育迟滞的诊断价值不明显(P>0.05)。
表2 病例组与对照组miRNA表达水平比较(±s)
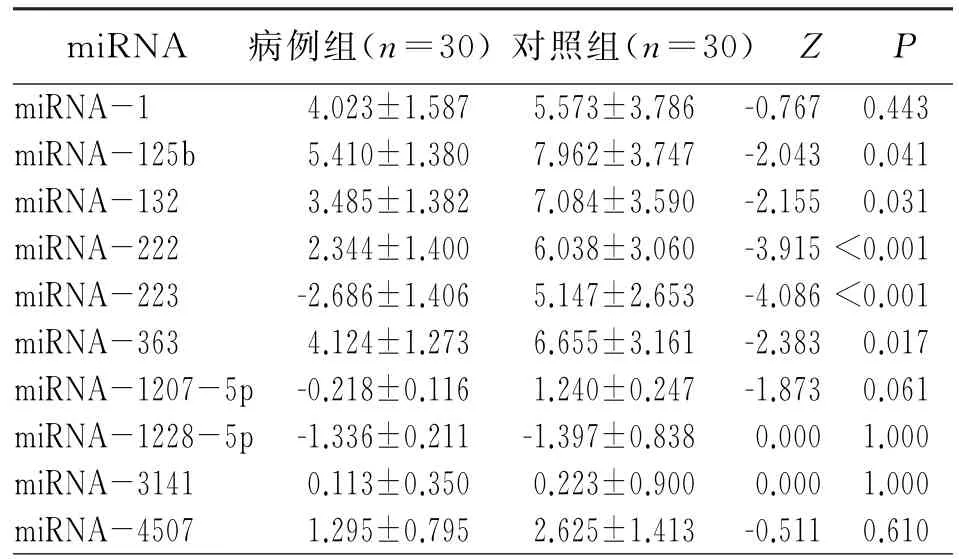
表2 病例组与对照组miRNA表达水平比较(±s)
miRNA 病例组(n=30)对照组(n=30)Z P miRNA-1 4.023±1.587 5.573±3.786-0.767 0.443 miRNA-125b 5.410±1.380 7.962±3.747-2.043 0.041 miRNA-132 3.485±1.382 7.084±3.590-2.155 0.031 miRNA-222 2.344±1.400 6.038±3.060-3.915<0.001 miRNA-223 -2.686±1.406 5.147±2.653-4.086<0.001 miRNA-363 4.124±1.273 6.655±3.161-2.383 0.017 miRNA-1207-5p-0.218±0.116 1.240±0.247-1.873 0.061 miRNA-1228-5p-1.336±0.211-1.397±0.838 0.000 1.000 miRNA-3141 0.113±0.350 0.223±0.900 0.000 1.000 miRNA-4507 1.295±0.795 2.625±1.413-0.511 0.610

表3 差异表达的miRNA对非特异性精神发育迟滞的预测价值
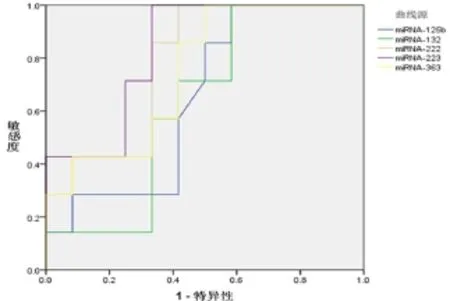
图1 非特异性精神发育迟滞患者外周血差异表达miRNA的ROC曲线
3 讨 论
精神发育迟滞(mental retardation,MR)是一组在中枢神经系统发育成熟(18岁)以前起病,依据目前研究发现生物、社会和心理因素是造成患者智力发育低于一般常人的主要因素,其中生物因素占79.2%[6]。MR是造成我国耳洞残疾的首要影响因素,该疾病不仅对我国人口素质提高不利,还给家庭、社会、国家带来沉重的负担。非特异性精神发育迟滞(NSMR)又称非特异性弱质,是指不伴随其它临床体征的单纯性智力低下。对NSM的患病程度进行过分析发现,NSMR存在着明显的遗传异质性,遗传占主要因素[7]。
miRNA在生物的各种生命过程中发挥着重要的调节功能,如调节细胞发育的时序调控过程,参与细胞增殖、分化和凋亡,同时在造血系统、神经系统的模式形成等过程中也扮演着重要的角色。miRNA在脑皮层发育过程中起着关键作用,大脑皮层发育过程中细胞增殖、传导通路的建立以及区域性分化均有miRNA参与并调控[8-9]。由此可见,miRNA在大脑发育过程中起着至关重要的调控作用。miRNA与神经细胞的分化也有着密切相关,miRNA可以从细胞分化的起始就调控祖细胞分化为特定的神经细胞,还能维持该神经细胞的特征。有研究表明,miRNA不仅参与多种神经功能调节[10],还与突触可塑性有关[11]。由于MiRNA在神经系统发育分化以及神经系统功能调节和突触可塑性方面起着重要作用,因此MiRNA表达和调控的异常可能与精神发育迟滞的发生发展有着密不可分的关系。脆性x综合征与脆性X智力低下蛋白(FMXP, Fragile X MentalRetardation Protein)的缺失有明显关联,外周血淋巴细胞FMRP免疫细胞化学检测是儿童脆性X综合征的一种可靠诊断和筛查方法[12]。研究发现,FMRP可以通过某些特殊的m RNAS来调节miRNA[13],如miRNA-1和miRNA -281。唐氏综合征即21三体综合征,对唐氏综合征的研究发现,与21号染色体来源有明显关联的miRNAs可能引起患者脑部神经生化的异常,21号染色体来源的miRNA失活可能是导致唐氏综合症的主要原因[14]。
本研究发现,非特异性精神发育迟滞患者外周血中的表达有统计学差异,在非特异性精神发育迟滞患者外周血中miRNA-125b、miRNA-132、miRNA-222、miRNA-223和miRNA-363显著上调。这5种miRNA与非特异性精神发育迟滞的发生和发展可能有明显关联。有研究发现,脆性X智力低下蛋白(FMRP)可以通过miRNA-125b、miRNA-132调节突触的结构与精神发育迟滞的发生有明显关联[15]。Chen等人选取464名非特异性X连锁精神发育迟滞患者进行研究发现,与正常对照者比较x染色体相关联miRNAs(miRNA-222、miRNA-223和miRNA-363)的核苷酸序列有明显改变,这些改变可能与患者智力低下有关[16]。赵林[17]等人,通过miRNA芯片扫描和选取部分差异表达的miRNA进行PCR验证发现,非特异性精神发育迟滞患者外周血中miRNA-664a-5p,miRNA-1207-5p,miRNA-3141,miRNA-1228-5p,miRNA-4505显著上调。本研究与正常对照者比较,非特异性精神发育迟滞患者外周血中miRNA-1207-5p,miRNA-3141和miRNA -1228-5p没有明显改变,可能与本研究选取的样本是成人,而上述研究选取的是儿童有关,具体机制有待进一步研究。
为了探究差异表达的miRNA对非特异性精神发育迟滞的诊断价值,本研究进一步构建ROC曲线,结果发现:miRNA-222和miRNA-223对非特异性精神发育迟滞有一定的诊断价值,当miRNA-222≤2.788CT时,约登指数的最大值0.583,此时的敏感度为58.3%,特异度为100.0%;当miRNA-223≤-2.275CT时,约登指数的最大值0.667,此时的为敏感度66.7%,特异度为100.0%。该研究结果进一步证实了,miRNA-222和miRNA-223在非特异性精神发育迟滞中可能扮演着重要的角色,具体作用机制有待进一步研究。
[1]陈洁,郭亦寿,赵梅兰.非特异性精神发育迟滞的遗传异质性[J].中华医学遗传学杂志,2000,17(3):185-187
[2]陈永芬.精神发育迟滞的病因分析[J].重庆医科大学学报,1994, 19(4):312-315
[3]Reinhart B J,Slack F J,Basson M,et al.The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans [J].nature,2000,403(6772):901-906
[4]Wheeler G,Ntounia-Fousara S,Granda B,et a1.Identification of new central nervous system specific mouse microRNAs[J].FEBS Lett,2006,580(9):2195-2200
[5]Miller B H,Wahlestedt C.MicroRNA dysregulation in psychiatric disease[J].Brain Res,2010;1338:89e99
[6]杨秋苑,祁蓓.546例精神发育迟滞儿童病因分析和健康教育策略[J].广东医学,2006,27(9):1366-1367
[7]胡应,张思仲,张思霖,等.315个原因不明精神发育迟滞家系的分离分析研究[J].中华神经精神科杂志,1992,25(3):157-157
[8]Sernpere L F,Freemantle S,Pitha-Rowe I,et a1.Expression profiling of mammalian microRNAs uncovers asubset of brain expressed microRNAs with possible roles in murine and human neuronal differentiation[J].Genome Biol,2004,5(3):R13
[9]Miska E A,Alvarez-Saavedra E,Townsend M.et a1.Microarray analysis of microRNA expression in the developing mammalian brain[J].GcnomeBiol,2004,5(9):R68
[10]Cheng H Y,Papp J W,Varlamova O,et a1.microRNA modulation of circadian-clock period and entrainment[J].Neuron, 2007,54(5):813-829
[11]Schratt G M,Tuebing F,Nigh E A,et a1.A brain specific MicroRNA regulates dendritic spine development[J].Nature, 2006,439(7074):283-289
[12]虞雄鹰,钟建民,张晓珍,等.FMRP检测在儿童脆性X综合征中诊断价值的实验评价[J].中国优生与遗传杂志,2009,17(3): 29-32
[13]Jin P,Zarnescu D C,Ceman S,Nakamoto M,Mowrey J,et al.Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway[J].Nat Neurosci,2004,7:113-117
[14]Knhn D E,Nuovo G J,Terry A V,et a1.Chromosome 21-derived MicroRNAs Provide an Etiological Basis for Aberrant Protein Expression in Human Down Syndrome Brains[J].J Biol Chem,2010,285(2):1529-1543
[15]Edbauer D,Neilson J R,Foster K A,et al.Regulation of synaptic structure and function by FMRP-associated microRNAs miR -125b and miR-132[J].Neuron 65:373-84.[Pub Med: 20159450
[16]Chen W,Jensen L R,Gecz J,et al.Mutation screening of brainexpressed X-chromosomal miRNA genes in 464 patients with nonsyndromic X-linked mental retardation[J].European journal of human genetics,2007,15(3):375-378
[17]赵林,张梁,孙欣羊,等.MicroRNA在非特异性精神发育迟滞患者外周血中的异常表达[J].中华行为与脑科学杂志,2014,23 (5):436-439
http://www.cjhp.com.cn/
The Differential Expression of MiRNA in Peripheral Blood of Patients with Non-specific Mental Retardation and Its Clinical Diagnostic Value
YAN Yan,GAO Hui,LV Zhensu,et al
First Mental Health Center of Shanghai Civil Ddministration,Shanghai 201105,China
Objective:To research the differential expression of miRNA in the peripheral blood of the non-specific mental retardation patients and analyze its diagnostic value for non-specific mental retardation.Methods:30 nonspecific mental retardation patients and 30 healthy controls were selected to measure the 10 miRNAs chosen from the domestic and international literature by real-time fluorescence quantitative PCR.Results:①There were no significant differences in age,gender,urban and rural between the control group and the case group(P>0.05).②Compared with contrals,the expression levels of miRNA-125b,miRNA-132,miRNA-222,miRNA-223 and miRNA -363 were significant different in patients with non-specific mental retardation(P<0.05);③ROC analysis showed that miRNA-222(AUC=0.786,P=0.043),miRNA-223(AUC=0.833,P=0.008)could be used to distinguish non-specific mental retardation patients from healthy controls.Conclusion:The abnormal expression of miRNA-222 and miRNA-223 may have some diagnostic value to non-specific mental retardation,which may be related to the pathogenesis of non-specific mental retardation.
Non-specific mental retardation;MiRNA;Real-time fluorescence quantitative PCR;Peripheral blood
R749.05
A
1005-1252(2017)01-0004-04
10.13342/j.cnki.cjhp.2017.01.002
2016-08-06)
