紫苏籽抗氧化肽的制备工艺研究
2017-12-19陈艺宾王惠敏叶南慧
胡 磊, 陈艺宾, 王惠敏, 孟 春, 洪 晶, 叶南慧
(福州大学生物科学与工程学院, 福建 福州 350116)
紫苏籽抗氧化肽的制备工艺研究
胡 磊, 陈艺宾, 王惠敏, 孟 春, 洪 晶, 叶南慧
(福州大学生物科学与工程学院, 福建 福州 350116)
采用碱提酸沉法从紫苏籽粕中提取蛋白质, 进行蛋白酶筛选, 发现紫苏籽蛋白经碱性蛋白酶酶解后有最好的抗氧化活性和水解度(DH). 在单因素试验的基础上, 采取响应面分析方法, 并建立数学模型, 确定最佳酶解工艺. 试验结果表明: 各因素影响紫苏籽粗蛋白酶解液DPPH自由基清除率的主次顺序是: 加酶量>酶解时间>pH值, 最佳条件是: 加酶量3 000 U·g-1, 酶解时间5.00 h, pH值9.80, 温度50 ℃, 此时DPPH自由基清除率为73.64%, 说明紫苏籽蛋白质酶解多肽拥有很高的抗氧化活性.
紫苏籽; 抗氧化肽; 酶解; 响应面分析法
0 引言
紫苏籽即紫苏(Perillafrutescens)的种子. 紫苏是我国传统药材, 《本草纲目》中明确记载, 紫苏具有润肺止咳、 下气消痰、 宽肠、 止痛、 安胎之功效. 近年来, 紫苏活性物质及其药理作用依然是科学家们研究的热点, 研究发现紫苏具有抗氧化、 防衰老[1]和抗菌、 抗病毒, 抗肿瘤、 抗炎、 抗过敏、 降血脂、 降血压等药理功能[2-3]. 紫苏茎叶及种子蛋白含量丰富, 尤其是种子, 高达20%. 其氨基酸种类齐全, 不仅含有8种人体必需的氨基酸, 还含有其他10种氨基酸, 是组成均衡的完全蛋白质[4]. 植物蛋白通常可以使用蛋白酶将其水解得到生物活性肽. 童波等[5]将紫苏籽粕提取蛋白分步水解, 可得到F值达79.25的低聚肽; 姜文鑫等[6]将紫苏籽粕分离蛋白通过碱性蛋白酶水解可得到对大肠杆菌等常见菌株均具有抑制作用的广谱抗菌多肽.
以脱脂后的紫苏籽粕碱提酸沉得到的蛋白为原料, 筛选最适蛋白酶进行酶解得到抗氧化肽, 并在单因素试验的基础上, 以DPPH自由基清除率为指标, 采取响应面分析法(response surface method, RSM)研究酶解时间、 加酶量及pH值对抗氧化活性强弱的影响. 通过Design-Expert V8.0.6 软件设计中心组合实验, 获取最佳酶解工艺, 为紫苏籽蛋白的综合利用及紫苏籽抗氧化肽的制备提供理论依据和参考.
1 材料与方法
1.1 主要材料与设备
紫苏种子, 购于福州种子市场.
723PCS 分光光度计, 购自郑州南北仪器设备有限公司; XZ-21K 高速冷冻离心机, 购自长沙湘智离心机仪器有限公司.
1.2 实验方法
1.2.1 制备紫苏籽抗氧化肽工艺流程
紫苏籽→脱脂→浸提→离心→取上清液→酸沉→冷冻干燥→紫苏籽粗蛋白干粉→按一定料液比溶解→调pH值→酶解→浸提→100 ℃灭酶10 min→离心→取上清液→紫苏籽抗氧化肽.
1.2.2 紫苏籽粗蛋白粉中蛋白含量的测定
采用《谷物和豆类氮含量测定和粗蛋白质含量计算凯氏法(GB/T 5511-2008)》[7]测定紫苏籽粗蛋白干粉中蛋白含量.
1.2.3 水解度的测定
对酶解液的DH值进行甲醛滴定法测定[8].
1.2.4 DPPH自由基清除率的测定
按照Hong等[9]报道的方法进行测定.
1.2.5 蛋白酶筛选实验
以紫苏籽粗蛋白为酶解底物, 选择不同性质蛋白酶为水解反应催化剂, 在各种酶的最适条件下进行实验, 按1.2.3和1.2.4的方法分别测定蛋白DH和多肽DPPH自由基清除率.
1.2.6 单因素实验
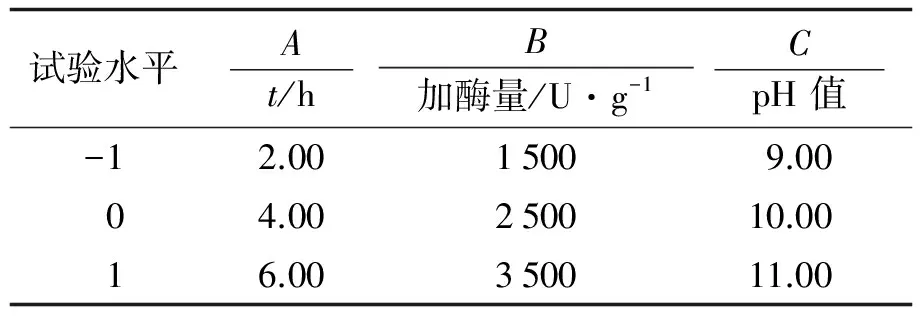
表1 酶解紫苏籽粗蛋白响应面分析因素水平表Tab.1 Experimental factors and levels used in response surface analysis of Perilla seed protein enzymolysis
酶解时间、 加酶量、 pH值和温度都会对蛋白酶解体系产生一定的影响. 准确称取一定量紫苏籽粗蛋白样品, 选取以上4 种因素的不同水平做单因素试验. 酶解步骤按节1.2.1, 蛋白DH和多肽DPPH自由基清除率测定分别按1.2.3和1.2.4的方法.
1.2.7 响应面法优化紫苏籽粗蛋白酶解工艺
根据中心组合设计, 采用软件Design-Expert V8.0.6 建立3因素3水平的试验, 确定紫苏籽粗蛋白酶解的最佳工艺. 以酶解液DPPH自由基清除率(Y/%)为考察指标, 酶解时间(A), 加酶量(B)及pH值(C)为自变量, 因素水平编码见表1.
2 结果与分析

图1 不同蛋白酶水解液DH和DPPH自由基清除率Fig.1 The DH and DPPH radical-scavenging activity of hydrolysate prepared by different proteases
2.1 粗蛋白含量测定结果
采用凯氏定氮法测得紫苏籽粗蛋白粉中总蛋白含量为(41.83±1.36)%.
2.2 蛋白酶筛选结果
酶的特异性及酶切位点存在差异, 所以蛋白酶种类不同酶解紫苏籽粗蛋白会获得不同一级结构的多肽, 其抗氧化活性也会存在差异[10]. 有学者采用2种或3种蛋白酶协同酶解蛋白制备生物活性肽, 但多酶酶解可能将原有抗氧化强的多肽进一步水解成抗氧化性较弱的寡肽和氨基酸. Zou等[11]对不同来源的42种抗氧化肽进行分析, 发现相对分子质量在1 000 u以下的3-6肽具有更好的自由基清除活性, 故不采用多酶协同酶解制备紫苏籽粕抗氧化多肽. 图1 为不同蛋白酶水解液DH和DPPH自由基清除率. 由图1可见, 紫苏籽粕蛋白Alcalase酶解产物具有最高的DH(25.18%)和DPPH自由基清除率(71.95%). Alcalase是一种丝氨酸蛋白酶, 对羧端疏水性氨基酸有较强的专一性, Adamson等[12]研究表明, 酪蛋白中Met、 Leu、 Glu等羧端肽键易被Alcalase裂解. 从抗氧化肽构效关系上看, 多肽若在其N端或其C端存在疏水性氨基酸具有更好的抗氧化活性[11]. 因而将碱性蛋白酶选为水解紫苏籽粕蛋白的最适酶.
2.3 紫苏籽粗蛋白酶解单因素试验结果
2.3.1 酶解时间对DH和DPPH自由基清除率的影响
在温度50 ℃、 底物质量浓度0.03 g·mL-1、 加酶量2 500 U·g-1、 pH值9.00条件下, 依次酶解 1.00、 2.00、 4.00、 6.00和8.00 h, 研究结果如图2(a)所示. 由图2(a)可见, 酶解时间由1.00 h增加至4.00 h时, DH和DPPH自由基清除率相对于前一水平显著升高(P<0.05), 然而, 酶解时间进一步延长, 相连水平均无显著差异(P>0.05). 其原因在于, 当酶解时间达到4.00 h后, 底物已基本反应, 酶解反应处于一种动态平衡中, 延长酶解时间, 也不会有很大的提升. 故选择最适酶解时间是4.00 h.
2.3.2 加酶量对DH和DPPH自由基清除率的影响
在温度50 ℃, 底物质量浓度0.03 g·mL-1, pH值9.00, 酶解时间4.00 h条件下, 控制加酶量分别为500、 1 500、 2 500、 3 500和4 500 U·g-1, 研究结果如图2(b)所示. 由图2(b)可见, 加酶量由500增至2 500 U·g-1时, DH和DPPH自由基清除率相对于前一水平显著提升(P<0.05), 然而, 进一步增加加酶量, 相连水平均无显著变化(P>0.05). 这是因为当酶与底物达到一种饱和状态后, 再增加加酶量也不会改变其酶解速率[13], 而且大量酶会增加酶与酶之间竞争性抑制, 对酶解反应产生不利影响, 同时无抗氧化作用的游离氨基酸及小肽段也会因为抗氧化肽继续被酶降解而增加[14]. 故选用2 500 U·g-1为酶的最佳添加量.
2.3.3 pH值对DH和DPPH自由基清除率的影响
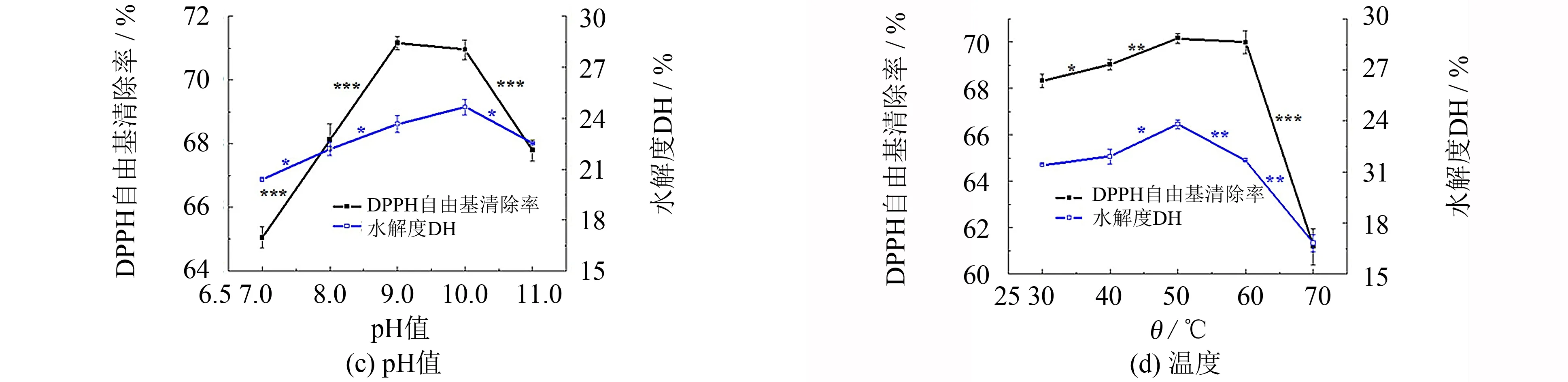
在温度50 ℃, 底物质量浓度0.03 g·mL-1, 加酶量2 500 U·g-1, 酶解时间4.00 h条件下, 调节 pH值分别为7.00、 8.00、 9.00、 10.00和11.00, 研究结果如图2(c)所示. 由图2(c)可见, 若pH值处于9.00~10.00之间, 则有最高的DH和DPPH自由基清除率, 这是由于过碱或过酸环境都会破坏酶的空间结构, 使其部分失活, 从而降低其催化效率. 因此, 将pH控制在9.00~10.00之间最合适.

注: ***表示P<0.001, 差异极显著; **表示0.001
2.3.4 温度对DH和DPPH自由基清除率的影响
在底物质量浓度0.03 g·mL-1, 加酶量2 500 U·g-1, pH 值9.00, 酶解时间4.00 h条件下, 控制温度分别为 30、 40、 50、 60和70 ℃, 研究温度的影响, 结果如图2(d)所示. 由图2(d)可见, 在50 ℃时, 有最高的DH和DPPH自由基清除率, 该情况可能与Alcalase的最适温度范围有关. 当温度较低时, 酶活受到抑制, 但是当温度上升, 体系内能也会随之增加, 加快酶促反应速率, 当温度持续升高就会改变酶结构, 抑制酶活性甚至使之失活[14]. 因此, 选择50 ℃为最适酶解温度.
2.4 紫苏籽蛋白酶解工艺的优化方案设计及结果分析
在单因素实验结果的基础上, 选择对DPPH自由基清除率影响较大的因素进行优化. 温度在30~60 ℃的范围内, DPPH自由基清除率变化范围小, 当温度升至70 ℃时, 清除率虽有显著降低, 但主要是高温使蛋白酶失活的结果, 故不作后续优化. 不同的pH值会影响蛋白在溶液中的溶解度, 确定最佳的酶解pH值很有必要, 故选择酶解时间(A)、 加酶量(B)及pH值(C)进行优化. 表2为响应面的设计及结果.
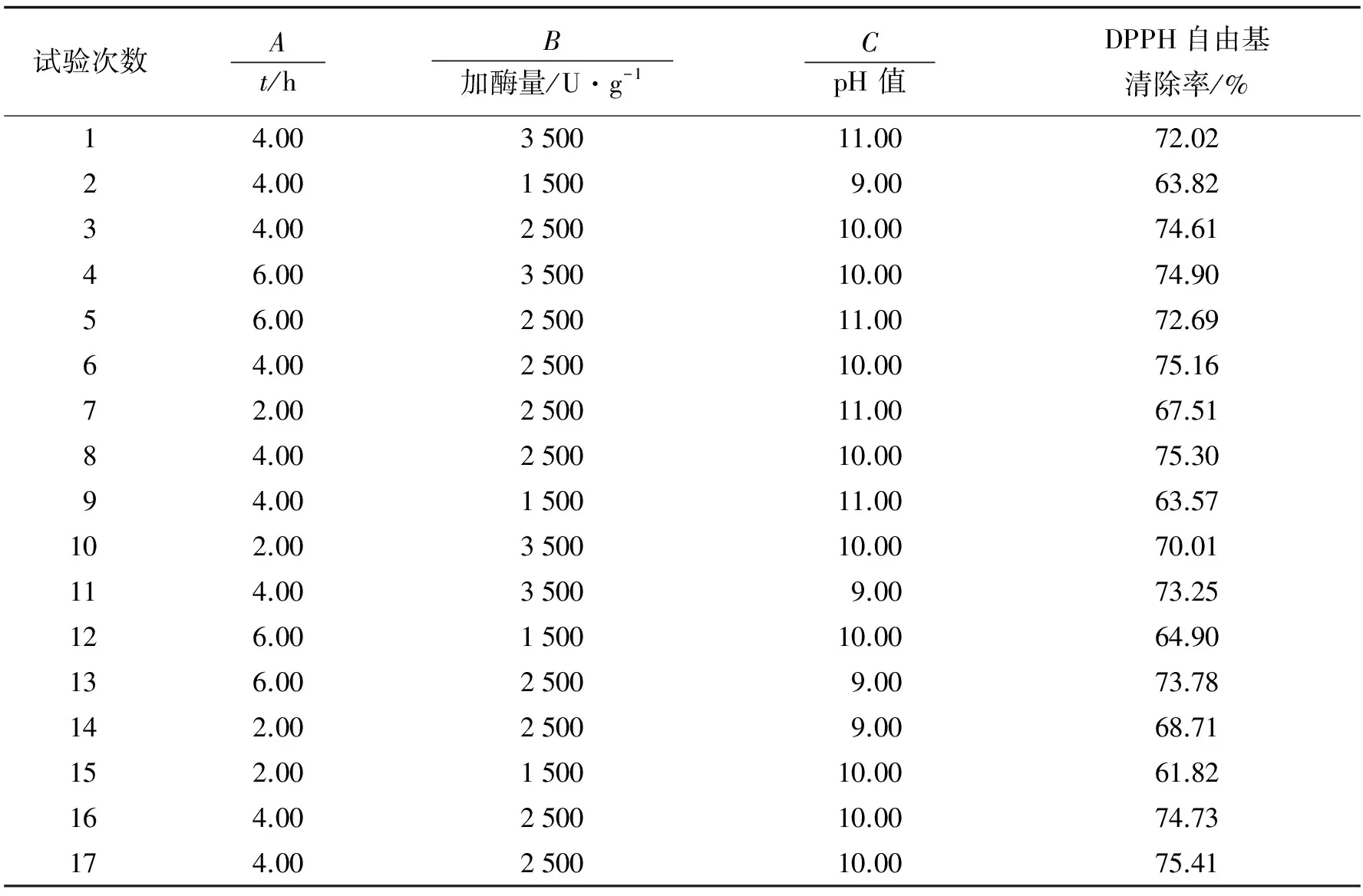
表2 试验设计与结果Tab. 2 Respond surface experimental design and results
利用Design-Expert V8.0.6 软件回归拟合, 模型方程如下:
Y=75.04+2.28A+4.51B-0.47C+0.45AB+0.026AC-0.24BC-2.31A2-4.82B2-2.06C2
表3为回归方程的方差分析结果. 所得模型极显著(P<0.000 1), 误差失拟项P=0.259 9(>0.05), 表明此模型失拟不显著, 此方程对试验拟合度好[15].R2= 0.996, 接近1, 可以看出影响紫苏籽蛋白酶解液DPPH自由基清除率的因素与所择取的3个变量有99.6%的相关度. 因此应用该回归模型能够有效预测紫苏籽多肽DPPH自由基清除能力.
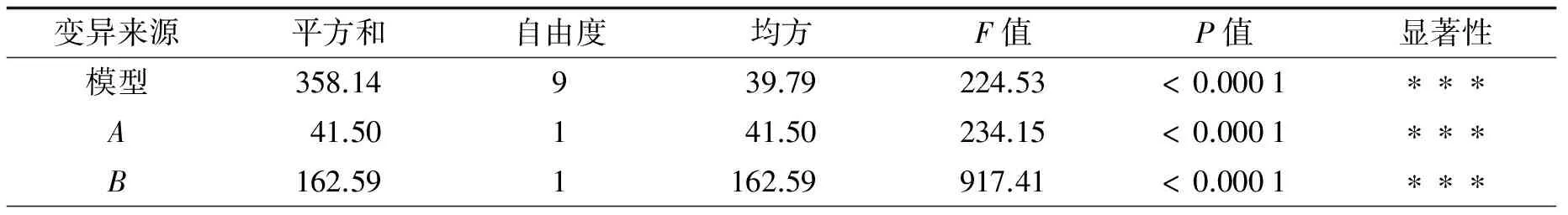
表3 模型回归方程方差分析Tab.3 ANOVA of regression equation
续表3

变异来源平方和自由度均方F值P值显著性C1.7811.7810.080.0156∗AB0.8310.834.670.0675AC0.002810.00280.0160.9030BC0.2410.241.350.2841A222.52122.52127.05<0.0001∗∗∗B297.90197.90552.42<0.0001∗∗∗C217.81117.81100.49<0.0001∗∗∗回归1.2470.18失拟0.7430.251.970.2599净误差0.5040.125总和359.3816R2=0.996R2Adj=0.99
注: ***表示P<0.001, 差异极显著; *表示P<0.05, 差异显著;P>0.05, 表示差异不显著
2.4.1 各因素对紫苏籽抗氧化肽DPPH自由基清除率的综合影响分析
由表3可知, 因素水平项A、B、A2、B2和C2是极显著水平,C是显著水平, 交互作用水平项AB、BC和AC影响不显著. 可通过各因素F值评价其对指标影响程度,F值越大, 影响越显著[16].F(A)=234.15,F(B)=917.41,F(C)=10.08, 因此, 影响DPPH自由基清除率的顺序为加酶量>酶解时间>pH值.
图3直观地给出了两两因素交互作用的响应面和等高线. 若响应面是凸状, 等高线是椭圆, 则说明两因素之间具有显著的交互作用[17-18]. 由图3(c)可知, 酶解时间A和加酶量B的交互作用显著, 在pH=10.00时, 等高线沿B轴变化趋势比沿A轴变化趋势更快, 说明加酶量对酶解液抗氧化性的影响较酶解时间更大. 另外两组曲线趋于平滑, 等高线接近圆形, 说明AC、BC具有不显著的交互作用.
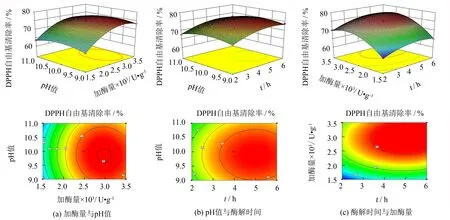
图3 各因素的交互作用对紫苏籽抗氧化肽DPPH自由基清除率影响的响应面和等高线Fig.3 Responsive surfaces and contour plot of the effect for every two factors on DPPH radical-scavenging activity
2.4.2 最佳酶解条件及验证
由Design-Expert V8.0.6 软件分析得最佳酶解条件为: 酶解时间5.08 h, 加酶量2 996 U·g-1, pH值9.86. 按照实验可操作性, 将最佳条件调整为酶解时间5.00 h, 加酶量3 000 U·g-1, pH值9.80, 温度50 ℃, 此条件下DPPH理论清除率为76.81%. 在此条件下进行3次验证试验, 测得实际DPPH自由基清除率为73.64%, 与理论值的相对误差为[(76.81%-73.64%)/76.81%]×100=4.13%, 表明由响应面法得到的模型回归方程及最佳条件可靠.
2.5 抗氧化活性测定
紫苏籽粗蛋白经上述最优酶解条件所得多肽液, 冷冻干燥后测定其抗氧化活性. 当紫苏籽多肽质量浓度为1.0 mg·mL-1时, DPPH自由基清除率达89.15%, 同等质量浓度下GSH的清除率为93.13%. 说明在最优酶解条件下获得的紫苏籽多肽具有媲美谷胱甘肽的抗氧化活性.
3 结语
通过比较不同的蛋白酶酶解紫苏籽蛋白, 可知紫苏籽蛋白经碱性蛋白酶酶解后具有更高的DH和抗氧化性. 通过单因素实验和响应面分析实验, 并建立数学模型及方差分析, 得出影响紫苏籽蛋白酶解液DPPH自由基清除率的各因素主次顺序是: 加酶量>酶解时间>pH值, 最佳工艺条件是: 酶解时间5.00 h, 加酶量3 000 U·g-1, pH值9.80, 温度50 ℃. 实验验证在最佳条件下, DPPH自由基清除率为73.64%, 与所建立的数学模型在最佳条件下的理论值无显著差异, 说明通过响应面分析法得到的回归方程可较好地预测实验结果. 质量浓度为1.0 mg·mL-1的紫苏籽抗氧化肽DPPH自由基清除率达89.15%, 可见在最优酶解条件下获得的紫苏籽多肽具有很好的抗氧化活性. 本研究结果为紫苏籽抗氧化肽的制备、 开发和利用提供了理论依据.
[1] LEE J H, PARK K H, LEE M H,etal. Identification, characterisation, and quantification of phenolic compounds in the antioxidant activity-containing fraction from the seeds of Korean perilla (Perillafrutescens) cultivars[J]. Food Chem, 2013, 136(2): 843-852.
[2] 胡晓丹. 紫苏中次生代谢物的现代提取分离技术及性质研究[D]. 北京: 北京林业大学, 2008.
[3] 朱国君. 紫苏饼粕蛋白质的分离提取及其功能特性研究[D]. 重庆: 西南大学, 2008.
[4] 张洪, 黄建韶, 赵东海. 紫苏营养成分的研究[J]. 食品与机械, 2006, 22(2): 41-43.
[5] 童波, 刘大川, 刘晔. 紫苏高F值低聚肽的制备研究[J]. 食品科学, 2009, 30(20): 178-181.
[6] 姜文鑫, 王晓飞, 崔玲玉, 等. 紫苏分离蛋白酶解制备抗菌肽的工艺优化[J]. 食品研究与开发, 2015, 36(3): 138-141; 142.
[7] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 谷物和豆类氮含量测定和粗蛋白质含量计算凯氏法: GB/T 5511-2008[S]. 北京: 中国标准出版社, 2008.
[8] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994,15(11): 65-67.
[9] HONG J, CHEN T T, HU P,etal. Purification and characterization of an antioxidant peptide (GSQ) from Chinese leek (AlliumtuberosumRottler) seeds[J]. Journal of Functional Foods, 2014,10: 144-153.
[10] KLOMPONG V, BENJAKUL S, KANTACHOTE D,etal. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally(Selaroidesleptolepis)as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1 317-1 327 .
[11] ZOU T B, HE T P, LI H B,etal. The structure-activity relationship of the antioxidant peptides from natural proteins[J]. Molecules, 2016, 21(1): 72.
[12] ADAMSON N J, REYNOLDS E C. Characterization of casein phosphopeptides prepared using alcalase: determination of enzyme specificity[J]. Enzyme Microb Technol, 1996, 19(3): 202-207.
[13] 盛彩虹. 紫苏蛋白产品的开发[D]. 武汉: 武汉工业学院, 2011.
[14] 厉望, 靳挺, 武玉学. 带鱼蛋白酶解条件优化及酶解物抗氧化性能[J]. 食品科学, 2013, 34(9): 234-239.
[15] LIU H, GENG P, ZHANG J,etal. Optimization on aqueous enzymatic extraction parameters of hemp seed oil by response[J]. Journal of the Chinese Cereals and Oils Association, 2014, 29(4): 62-67.
[16] 王岸娜, 孙玉丹, 李龙安, 等. 响应面法优化猕猴桃糖蛋白提取工艺研究[J]. 河南农业科学, 2012, 41(8): 121-127.
[17] SHAO P, JIANG S T, YING Y J. Optimization of molecular distillation for recovery of tocopherol from rapeseed oil deodorizer distillate using response surface and artificial neural network models[J]. Food and Bioproducts Processing, 2007, 85(2): 85-92.
[18] MURALIDHAR R V, CHIRUMAMILA R R, MARCHANT R,etal. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J]. Biochemical Engineering Journal, 2001, 9(1): 17-23.
StudyonpreparationofantioxidantpeptidesfromPerillaseed
HU Lei, CHEN Yibin, WANG Huimin, MENG Chun, HONG Jing, YE Nanhui
(College of Biological Science and Engineering, Fuzhou University, Fuzhou, Fujian 350116, China)
In the present study, the protein is extracted by alkali extraction and acid precipitation fromPerillaseed meal, and hydrolyzed by different proteases. The enzymatic hydrolysate by Alcalase have the highest degree of hydrolysis (DH) and DPPH radical-scavenging rates. Based on single factor test, design response surface method, establish mathematical model and determine the best technology. The results showed that all investigated parameters had also a notable effect on DPPH radical-scavenging activity of protein enzymolysis and could be ranked in decreasing order of importance in their effects as follows: protease dosage, time, pH value. The optimum conditions for protein enzymolysis as follow: time 5.00 h, protease dosage 3 000 U·g-1, pH value 9.80, temperature 50 ℃, DPPH radical-scavenging rate 73.64%. The results show that peptides have high antioxidant activity.
Perillaseed; antioxidant peptides; enzymolysis; response surface method
10.7631/issn.1000-2243.2017.05.0742
1000-2243(2017)05-0742-06
Q51
A
2016-03-16
洪晶(1981- ), 副教授, 主要从事食品生物技术的研究, jhong@fzu.edu.cn
福建省自然科学基金资助项目(2013J05050); 福建省教育厅科研资助项目(JA11019, JA12034); 福州大学科研启动基金资助项目( 022304)
(责任编辑: 洪江星)
